A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
انفصال الخلايا عن ظهارة اللسان وميسينشيم/ النسيج الضام للفئران الجنينية في اليوم 12.5 و8 أسابيع
In This Article
Summary
لقد قمنا بتطوير بروتوكول معمم لتفكيك كمية كبيرة من الخلايا المفردة عالية الجودة من الظهارة والأنسجة الميسنشيم / الضامة لألسنة الفئران الجنينية والبالغة.
Abstract
كان فصاغة الخلية إجراء أساسيا للدراسات على مستوى الخلية الفردية و/أو على مستوى مجموعة الخلايا (على سبيل المثال، تسلسل الحمض النووي الريبي أحادي الخلية وثقافة الخلية الأولية). إن إنتاج خلايا سليمة وقابلة للحياة بكميات كبيرة أمر بالغ الأهمية، والظروف المثلى للقيام بذلك تعتمد على الأنسجة. مجموعات الخلايا في ظهارة اللسان والأنسجة الكامنة وراء mesenchyme / الضام هي غير متجانسة وهياكل الأنسجة تختلف في مناطق مختلفة وفي مراحل النمو المختلفة. لقد اختبرنا بروتوكولات لعزل الخلايا من ظهارة لسان الماوس والأنسجة الميسنشيمية / الضامة في النمو المبكر [اليوم الجنيني 12.5 (E12.5)] ومراحل الشباب البالغين (8 أسابيع). كان من السهل تحقيق فصل نظيف بين الظهارة والأنسجة الكامنة في mesenchyme / الضام. ومع ذلك، لمزيد من معالجة وعزل الخلايا، مما أسفر عن خلايا صحية قابلة للحياة بكميات كبيرة، والاختيار الدقيق لحاجز الهضم الأنزيمي، ووقت الحضانة، وسرعة الطرد المركزي والوقت أمر بالغ الأهمية. أدى احتضان الظهارة المنفصلة أو النسيج الميسنشيمي/الضام الأساسي في 0.25٪ تريبسين-إي دي تا لمدة 30 دقيقة عند 37 درجة مئوية، يليه الطرد المركزي عند 200 × ز لمدة 8 دقائق إلى غلة عالية من الخلايا بمعدل صلاحية مرتفع (>90٪) بغض النظر عن مراحل الماوس ومناطق اللسان. وعلاوة على ذلك، وجدنا أن كلا من الخلايا الظهارية والظهارية الملساء / الضامة من الألسنة الجنينية والبالغة يمكن البقاء على قيد الحياة في الوسط القائم على ثقافة الخلية لمدة 3 ساعة على الأقل دون انخفاض كبير في صلاحية الخلية. وستكون البروتوكولات مفيدة للدراسات التي تتطلب إعداد خلايا معزولة من ألسنة الفئران في مراحل النمو المبكر (E12.5) والشباب البالغين (8 أسابيع) التي تتطلب انفصال الخلايا عن مقصورات الأنسجة المختلفة.
Introduction
لسان الثدييات هو جهاز معقد حاسم للذوق ، والتحدث ، وتجهيز الأغذية. وهي تتألف من أنواع متعددة من الأنسجة عالية التنظيم مجزأة من قبل mesenchyme / النسيج الضام وتغطيها ورقة الظهارية الطبقية التي تحتوي على الحليمة الذوق وبراعم الذوق. مجموعات الخلايا في كل من ظهارة اللسان والأنسجة mesenchyme / الضام غير متجانسة. لفهم وظائف وتوزيع نوع معين من الخلايا في اللسان بشكل أفضل، من الضروري إجراء دراسات باستخدام خلايا مفككة. على سبيل المثال، تسلسل الحمض النووي الريبي خلية واحدة هو وسيلة قوية وعالية الإنتاجية للتنميط النسخي في الخلايا الفردية، والتي تم تصميمها لفهم transcriptome من الأنسجة المعقدة فيقرار خليةواحدة 1،2،3،4. وقد ثبت أن ثقافة الخلايا الأولية أداة مفيدة لدراسة وظيفة وتمايز الخلايا الجذعية / السلف لبراعم الذوق5،6. تتطلب هذه الدراسات كمية كبيرة من مجموعات الخلايا المعزولة عالية الجودة (على سبيل المثال، العدد الإجمالي الكافي للخلايا مع التركيز المناسب والقدرة العالية على البقاء).
وبالتالي ، هناك حاجة لعزل الخلايا عن مناطق مختلفة من الأنسجة اللغوية وفي مراحل النمو المختلفة. حاليا، لا يوجد بروتوكول مفصل متاح للانشقاق الخلية من ظهارة اللسان والأنسجة الكامنة mesenchyme / الضام. هنا، نبلغ عن طريقة محسنة لتفكيك الخلايا لإعداد الخلايا للتجارب التي تتطلب جودة عالية من الخلايا الحية مثل تسلسل الحمض النووي الريبي أحادي الخلية وثقافات الخلايا الجذعية الأولية. وجدنا أن اختيار العازلة الهضم الأنزيمي، pipetting لطيف، واختيار متوسط إعادة الإنفاق، والوقت الأمثل الطرد المركزي والسرعة حاسمة لتوليد هذه الكميات الكبيرة من الخلايا عالية الجودة.
Protocol
وقد وافقت اللجنة المؤسسية لرعاية الحيوانات واستخدامها في جامعة جورجيا على استخدام الحيوانات (C57BL/6 mice طوال الدراسة) وكان وفقا للمبادئ التوجيهية الوطنية للمعاهد الصحية لرعاية الحيوانات واستخدامها في البحوث.
1. استخدام الحيوان
ملاحظة: تم تربية الفئران وصيانتها في منشأة الحيوان التابعة لقسم علوم الحيوان والألبان في جامعة جورجيا عند 22 درجة مئوية تحت دورات نهارية/ليلية 12 ساعة.
- عين ظهر يوم الكشف عن المكونات المهبلية في الفئران كيوم جنيني (E) 0.5. استخدمي الأجنة في E12.5 والفئران بعد الولادة في عمر 8 أسابيع للتجربة التالية.
2. التحضير قبل التجربة
ملاحظة: يتم سرد الصكوك المطلوبة لهذا البروتوكول في جدول المواد.
- أدوات الأوتوكلاف قبل التجربة. تعقيم الأدوات باستخدام معقم حبة أثناء التجربة.
- تنظيف المنطقة الجراحية، المجهر تشريح، ومجلس الوزراء السلامة البيولوجية باستخدام مناديل الإيثانول 70٪. قم بتشغيل ضوء الأشعة فوق البنفسجية في خزانة السلامة الحيوية وابقه على العمل لمدة 20 دقيقة قبل الإجراء التجريبي.
- إعداد خليط انزيم من 1:1 ديسباس (5.0 ملغ / مل) والكولاجيناز (2.0 ملغ / مل) إلى تركيز نهائي من 2.5 و 1.0 ملغ / مل على التوالي، وتصفية الحل باستخدام 0.22 ميكرومتر مرشح حقنة7.
- إعداد 1 مل من خليط الإنزيم للسان البالغ أو 0.5 مل لمنطقة معينة من اللسان (على سبيل المثال، اللسان الخلفي أو الأمامي).
- إعداد 2 مل من خليط الانزيم للألسنة الجنينية.
- جعل 10 مل من 2.5٪ BSA في 0.1 M PBS وتصفية الحل باستخدام حقنة 1 مل ومرشح حقنة 0.22 ميكرومتر.
- جعل 500 ميكرولتر من 5٪ FBS في DMEM/F12.
- جعل 3 مل من DMEM/F12 تحتوي على 10٪ FBS و 1٪ BSA وتصفية الحل باستخدام حقنة 1 مل ومرشح حقنة 0.22 ميكرومتر.
3. فصل ظهارة اللسان من mesenchyme / النسيج الضام الكامنة
- فصل الظهارة من mesenchyme لسان الماوس E12.5
- القتل الرحيم الفئران الإناث الحوامل في الوقت المناسب تحمل الأجنة E12.5 عن طريق وضعه في غرفة CO2 تليها خلع عنق الرحم.
ملاحظة: يتم جمع أجنة الفئران في E12.5 بعد الساعة 12 ظهرا (بعد الظهر) في اليوم الثاني عشر بعد اكتشاف المكونات المهبلية في الفئران الأنثوية الحامل. - نقل الفئران إلى المنطقة الجراحية. الرطب البطن الماوس باستخدام الإيثانول 70٪ لمنع الفراء من الدخول إلى موقع التشغيل.
- افتح البطن باستخدام مقص تشريحي لكشف قرون الرحم التي تحمل الأجنة. تشريح قرون الرحم باستخدام مقص تشريح ونقله إلى 15 مل من محلول تايرود الطازجة في طبق ثقافة 100 ملم.
- تشريح الأجنة (الشكل 1A1) من قرون الرحم تحت المجهر تشريح باستخدام مقص صغير والمملقط الدقيق.
- فتح تجويف الفم بعناية واسعة باستخدام ملقط ناعم وتشريح اللسان قبالة من الفك السفلي باستخدام مقص مصغرة(الشكل 1A2).
- غسل الألسنة باستخدام 15 مل من محلول تايرود العقيم الطازج في طبق ثقافة 100 ملم.
- نقل الأنسجة إلى 2 مل من خليط الانزيم من ديسباس (2.5 ملغم / مل) والكولاجيناز (1.0 ملغ / مل) في طبق ثقافة 35 ملم مع ملعقة والملقط الدقيق في خزانة السلامة البيولوجية. حضانة لمدة 20 دقيقة في 37 درجة مئوية.
- نقل الألسنة إلى 15 مل من محلول تايرود العقيم الطازج في طبق ثقافة 100 ملم وإزالة mesenchyme بلطف من الظهارة من الجانب البطني باستخدام ملقط ناعم.
ملاحظة: يمكن فصل الأوراق الظهارية دون قوة ميكانيكية أثناء الحضانة. - اغسل الظهارة المنفصلة والميسنشيم مرتين في 15 مل من محلول تايرود العقيم الطازج في طبق ثقافة 100 مم.
ملاحظة: سيتم تثبيط أنشطة ديسباس والكولاجيناز عن طريق EDTA في إجراء فص الخلايا (الخطوة 4.1).
- القتل الرحيم الفئران الإناث الحوامل في الوقت المناسب تحمل الأجنة E12.5 عن طريق وضعه في غرفة CO2 تليها خلع عنق الرحم.
- فصل ظهارة اللسان عن النسيج الضام الأساسي للفئران البالغة
- قتل الفأرة في 8 أسابيع من العمر عن طريق وضعه في غرفة CO2. تأكد من أن الماوس هو القتل الرحيم مع عدم وجود أنفاس واستجابة forepaw قرصة.
- نقل الفئران إلى المنطقة الجراحية. الرطب رأس الماوس باستخدام الإيثانول 70٪ لمنع الفراء من الدخول في تجويف الفم.
- قطع زوايا الفم على طول الخد باستخدام مقص تشريح لفتح تجويف الفم. تشريح اللسان مع الفك السفلي(الشكل 1B1)ووضعه في طبق من البلاستيك مع طبقة من البلاستيك التفاف.
- باستخدام ملقط جراحي لعقد اللسان تحت المجهر تشريح، وحقن خليط انزيم من ديسباس (2.5 ملغ / مل) والكولاجيناز (1.0 ملغ / مل) في الفضاء دون الظهارية من اللسان من خلال حافة القطع(الشكل 1B 1، السهام) من اللسان الخلفي.
- حقن 1 مل من خليط الانزيم بالتساوي إلى اللسان كله لجمع الأنسجة من كل من اللسان الأمامي والخلفي.
- حقن 0.5 مل من خليط الانزيم محليا إلى اللسان الأمامي لجمع الأنسجة من طرف اللسان أو إلى اللسان الخلفي لجمع أنسجة الحليمة المحيطة.
ملاحظة: اللسان سوف تنتفخ كما يتراكم الإنزيم (الشكل 1B2). يمكن للحقن اللطيف للانزيم منع الضغط من إتلاف الظهارة والحفاظ على أكبر قدر ممكن من الإنزيم في اللسان.
- لف اللسان بغلاف بلاستيكي واحتضن اللسان لمدة 30 دقيقة عند 37 درجة مئوية.
- استخدام مقص صغير لتشريح طرف اللسان و / أو الحليمة circumvallate، واستخدام ملعقة والملقط الدقيق لنقل الأنسجة إلى 15 مل من محلول تايرود العقيم الطازج في طبق ثقافة 100 ملم.
- افصل الظهارة عن النسيج الضام الأساسي في الفضاء دون الظهاري المهضوم بالإنزيمات باستخدام مقص صغير. تقليم الأنسجة إلى الحجم المناسب وفقا لمتطلبات التجارب المصب.
- اغسل الظهارة المنفصلة والأنسجة الضامة الأساسية مرتين في 15 مل من محلول تايرود العقيم الطازج في طبق ثقافة 100 مم.
ملاحظة: سيتم تثبيط أنشطة ديسباس والكولاجيناز عن طريق EDTA في إجراء فص الخلايا (الخطوة 4.1).
4. تفكك الخلايا
ملاحظة: يمكن تطبيق بروتوكول تفكك الخلايا الموصوف هنا على ظهارة اللسان والأنسجة الميسنشيمية/الضامة في كل من الفئران الجنينية E12.5 والفئران التي يبلغ عمرها 8 أسابيع. للحد من فقدان الخلية أثناء التحريض ونقل تعليق الخلية، استخدم نصائح الماصة التجارية منخفضة الاحتفاظ أو نصائح ماصة المغلفة مسبقا مع 2.5٪ BSA في 0.1 M PBS في pH 7.48.
- نقل الأنسجة باستخدام ملعقة والملقط الدقيق إلى 3 مل من 0.25٪ تريبسين-EDTA في طبق ثقافة 35 ملم جديدة لمدة 30 دقيقة في 37 درجة مئوية. يهيج الأنسجة بلطف كل 5 دقائق مع نصائح ماصة 1 مل.
ملاحظة: لا تقطع طرف ماصة، كما يمكن أن حافة القطع تلف جسديا الخلايا المفككة. - إضافة 500 ميكرولتر من 5٪ FBS في DMEM/F12 لوقف رد الفعل ونقل المتوسطة إلى أنبوب طرد مركزي منخفض الربط 5 مل.
- تعليق خلية الطرد المركزي في 200 × ز لمدة 8 دقائق في درجة حرارة الغرفة وإزالة supernatant.
- بلطف إعادة تعليق الخلايا في 3 مل من DMEM/F12 تحتوي على 10٪ FBS و 1٪ BSA باستخدام نصائح ماصة 1 مل وتصفية الخلايا باستخدام مصفاة خلية 70 ميكرومتر، تليها مصفاة خلية 35 ميكرومتر.
- تعليق خلية الطرد المركزي في 200 × ز لمدة 8 دقائق في درجة حرارة الغرفة. إزالة معظم المتوسط وترك 50-300 ميكرولتر كوحدة التخزين النهائية لإعادة تعليق الخلايا.
ملاحظة: ضبط تركيز الخلايا وفقا لمتطلبات التجارب المصب عن طريق تغيير الحجم النهائي للتعليق خلية واحدة.
5. اختبار عد الخلايا وقابليتها للحياة باستخدام مقياس الدم
ملاحظة: لتحسين دقة القياس، يوصى بإجراء 3 نسخ متماثلة تقنية لكل عينة.
- مزيج بلطف 5-10 ميكرولتر من تعليق خلية واحدة مع حجم متساو من الأزرق تريبان وإضافة إلى مقياس الدم.
ملاحظة: تنظيف مقياس الدم بدقة باستخدام الإيثانول 70٪ قبل الاستخدام. سيتم تلطيخ جزيئات الغبار على مقياس الدم باللون الأزرق الداكن وتؤثر على دقة اختبار الجدوى. تحقق من مقياس الدم تحت المجهر. - عد العدد الإجمالي للخلية وعدد الخلايا الحية (البيضاء) وعدد الخلايا الميتة (الأزرق الداكن) الملطخة بتريبان الأزرق(الشكل 2، الأسهم) على التوالي في 4 مربعات مع 16 شبكة(الشكل 2)باستخدام المجهر المقلوب مع نظام التصوير.
- حساب تركيز الخلية:
تركيز الخلية =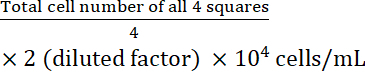
- حساب الجدوى:
القدرة على البقاء =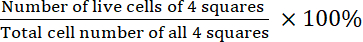
- حساب الجدوى:
النتائج
فصل ظهارة اللسان من الميسينشيم الكامنة / النسيج الضام
في لسان الفأر الجنيني ، تظهر فجوة في الفضاء دون الظهاري بعد الهضم السليم للإنزيمات. يتم فصل الصفائح الظهارية لبعض الألسنة دون قوة ميكانيكية أثناء الحضانة.
في لسان فأرة الكبار ، يشار إلى حقن إنزيم ناجح من خلال ت...
Discussion
حتى الآن، لم يكن هناك بروتوكول مفصل متاح لتفكك الخلية من ظهارة اللسان والأنسجة الكامنة mesenchyme / الضام. يوفر بروتوكول فص الخلية الحالي هذا إجراء قابلا للاستنساخ لإنشاء تعليق خلية واحدة مع قدرة عالية على البقاء (>90٪) من أنسجة لسان الفأر، بما في ذلك الصفائح الظهارية والأنسجة الظهارية / الضامة ف...
Disclosures
لم يتم الإعلان عن أي تضارب في المصالح.
Acknowledgements
وقد دعمت هذه الدراسة من قبل المعاهد الوطنية للصحة، رقم المنح R01DC012308 وR21DC018089 إلى HXL. ونشكر بريت مارشال (جامعة جورجيا، أثينا، الجمعية العامة) وإيغون رانجيني (10X علم الجينوم، بليزانتون، كاليفورنيا) للمساعدة التقنية والتشاور بشأن تفكك الخلية؛ إلى فرانسيسكا جيبسون بيرنلي (جامعة جورجيا، أثينا، الجمعية العامة) للتحرير باللغة الإنجليزية.
Materials
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
References
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved