É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dissociação celular do Epitélio da Língua e Mesenquime/Tecido Conjuntivo de Ratos Embrionários 12,5 e 8 Semanas
Neste Artigo
Resumo
Desenvolvemos um protocolo generalizado para dissociar uma grande quantidade de células únicas de alta qualidade a partir do epitélio e mesenquime/tecido conjuntivo de línguas de camundongos embrionários e adultos.
Resumo
A dissociação celular tem sido um procedimento essencial para estudos no nível de células individuais e/ou a nível de população celular (por exemplo, sequenciamento de RNA de células únicas e cultura celular primária). Produzir células viáveis e saudáveis em grandes quantidades é crítico, e as condições ideais para fazê-lo são dependentes de tecidos. As populações celulares no epitélio da língua e no tecido mesenquime/conjuntivo subjacente são heterogêneas e as estruturas teciduais variam em diferentes regiões e em diferentes estágios de desenvolvimento. Testamos protocolos para isolar células do epitélio da língua do rato e do tecido mesenquime/conjuntivo nas fases de desenvolvimento inicial [dia embrionário 12.5 (E12.5)] e jovens adultos (8 semanas). Uma separação limpa entre o epitélio e o tecido mesenquime/conjuntivo subjacente foi fácil de realizar. No entanto, para processar e isolar ainda mais as células, produzir células saudáveis viáveis em grandes quantidades, e seleção cuidadosa de tampão de digestão enzimática, tempo de incubação e velocidade e tempo de centrifugação são críticos. Incubação de epitélio separado ou tecido conjuntivo/mesenquime subjacente em 0,25% Trippsin-EDTA por 30 min a 37 °C, seguido por centrifugação a 200 x g por 8 min resultou em um alto rendimento de células a uma alta taxa de viabilidade (>90%) independentemente dos estágios do rato e regiões da língua. Além disso, descobrimos que tanto células epiteliais dissociadas quanto mesenquimais/conjuntivas de línguas embrionárias e adultas poderiam sobreviver no meio baseado na cultura celular por pelo menos 3 h sem uma diminuição significativa da viabilidade celular. Os protocolos serão úteis para estudos que requerem a preparação de células isoladas de línguas de camundongos em estágios de desenvolvimento precoce (E12,5) e jovens adultos (8 semanas) que requerem dissociação celular de diferentes compartimentos teciduais.
Introdução
A língua dos mamíferos é um órgão complexo crítico para o sabor, fala e processamento de alimentos. É composta por vários tipos de tecidos altamente organizados compartimentados por mesenchyme/tecido conjuntivo e cobertos por uma folha epitelial estratificada contendo papilas gustativas e papilas gustativas. Populações celulares em epitélio de língua e tecido mesenquime/conjuntivo são heterogêneas. Para entender melhor as funções e distribuição de um determinado tipo de células na língua, são necessários estudos com células dissociadas. Por exemplo, o sequenciamento de RNA de célula única é um método poderoso e de alto rendimento para o perfil transcriômico em células individuais, que é projetado para entender o transcriptome de tecido complexo em uma resolução unicelular1,2,3,4. A cultura celular primária tem sido comprovadamente uma ferramenta útil para estudar a função e diferenciação de células-tronco/progenitoras para as papilas gustativas5,6. Esses estudos requerem uma grande quantidade de populações de células isoladas de alta qualidade (por exemplo, número celular total suficiente com concentração adequada e alta viabilidade).
Assim, é necessário isolar células de diferentes regiões dos tecidos linguais e em diferentes estágios de desenvolvimento. Atualmente, não há um protocolo detalhado disponível para dissociação celular a partir do epitélio da língua e tecido mesenquime/conjuntivo subjacente. Aqui, relatamos um método otimizado de dissociação celular para preparar células para experimentos que requerem uma alta qualidade de células vivas, como para sequenciamento de RNA de células únicas e culturas primárias de células-tronco. Descobrimos que a seleção de tampão de digestão enzimática, pipetação suave, seleção de meio de resuspensão e tempo e velocidade de centrifugação ideais são cruciais para gerar essas grandes quantidades de células de alta qualidade.
Protocolo
O uso de animais (C57BL/6 camundongos ao longo do estudo) foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade da Geórgia e esteve de acordo com os Institutos Nacionais de Diretrizes de Saúde para cuidados e uso de animais para pesquisa.
1. Uso de animais
NOTA: Os camundongos foram criados e mantidos na instalação animal do departamento de Ciência Animal e Leite na Universidade da Geórgia a 22 °C sob ciclos de dia/noite de 12h.
- Designe meio-dia do dia da detecção de plugue vaginal em camundongos como embrionário (E) dia 0,5. Use embriões em E12,5 e camundongos pós-natais com 8 semanas de idade para os seguintes experimentos.
2. Preparação antes do experimento
NOTA: Os instrumentos necessários para este protocolo estão listados na Tabela de Materiais.
- Instrumentos autoclave antes do experimento. Esterilizar instrumentos usando um esterilizador de contas durante o experimento.
- Limpe a área cirúrgica, o microscópio de dissecação e o armário de biossegurança usando 70% de lenços de etanol. Ligue a luz UV do armário de biossegurança e mantenha-a acesa por 20 minutos antes do procedimento experimental.
- Prepare uma mistura enzimática de 1:1 dispase (5.0 mg/mL) e colagenase (2,0 mg/mL) para uma concentração final de 2,5 e 1,0 mg/mL, respectivamente, e filtre a solução usando filtro de seringa 0,22 μm7.
- Prepare 1 mL de mistura enzimápica para uma língua adulta ou 0,5 mL para uma região específica da língua (por exemplo, posterior ou língua anterior).
- Prepare 2 mL de mistura enzimápica para línguas embrionárias.
- Faça 10 mL de 2,5% BSA em 0,1 M PBS e filtre a solução usando seringa de 1 mL e filtro de seringa de 0,22 μm.
- Faça 500 μL de 5% de FBS em DMEM/F12.
- Faça 3 mL de DMEM/F12 contendo 10% de FBS e 1% BSA e filtre a solução usando seringa de 1 mL e filtro de seringa de 0,22 μm.
3. Separação do epitélio da língua do mesenquime/tecido conjuntivo subjacente
- Separação do epitélio do mesenquime de uma língua de rato E12.5
- Eutanize camundongos gestantes cronometrado carregando embriões E12,5 colocando-o em uma câmara de CO2 seguido de luxação cervical.
NOTA: Os embriões de camundongos no E12.5 são coletados após as 12:00 (tarde) no 12º dia após a detecção do plugue vaginal nos camundongos gestantes. - Transfira ratos para a área cirúrgica. Molhe o abdômen do rato usando 70% de etanol para evitar que a pele entre no local de operação.
- Abra o abdômen usando uma tesoura dissecando para expor os chifres uterinos que carregam embriões. Disseque os chifres uterinos usando tesouras dissecando e transfira para 15 mL de solução fresca de Tyrode em um prato de cultura de 100 mm.
- Dissecar os embriões (Figura 1A1) a partir de chifres uterinos sob um microscópio dissecando usando mini-tesouras e fórceps finos.
- Abra cuidadosamente a cavidade da boca, usando fórceps finos e dissecando a língua fora da mandíbula usando mini-tesoura(Figura 1A2).
- Lave as línguas usando 15 mL de solução estéril fresca de Tyrode em um prato de cultura de 100 mm.
- Transfira os tecidos para 2 mL de mistura enzimática de dispase (2,5 mg/mL) e colagenase (1,0 mg/mL) em um prato de cultura de 35 mm com espátula e fórceps finos em um armário de biossegurança. Incubar por 20 min a 37 °C.
- Transfira as línguas para 15 mL de solução de Tyrode estéril fresco em um prato de cultura de 100 mm e remova suavemente o mesenquime do epitélio do lado ventral usando fórceps finos.
NOTA: As folhas epiteliais podem ser separadas sem força mecânica durante a incubação. - Lave a epitélio separada e mesenquime duas vezes em 15 mL de solução estéril fresca de Tyrode em um prato de cultura de 100 mm.
NOTA: As atividades de dispase e colagem serão inibidas por EDTA no procedimento de dissociação celular (etapa 4.1).
- Eutanize camundongos gestantes cronometrado carregando embriões E12,5 colocando-o em uma câmara de CO2 seguido de luxação cervical.
- Separação do epitélio da língua do tecido conjuntivo subjacente de camundongos adultos
- Eutanize o rato com 8 semanas de idade colocando-o em uma câmara de CO2. Confirme se o mouse é eutanizado sem respiração e resposta de pressão dianteira.
- Transfira os ratos para a área cirúrgica. Molhe a cabeça do rato usando 70% de etanol para evitar que os peles entrem na cavidade oral.
- Corte os cantos da boca ao longo da bochecha usando uma tesoura dissecando para abrir a cavidade oral. Dissecar a língua com mandíbula(Figura 1B1) e coloque-a em um prato plástico com uma camada de plástico.
- Utilizando fórceps cirúrgicos para segurar a língua sob um microscópio dissecando, injete a mistura enzimática de dispase (2,5 mg/mL) e colagenase (1,0 mg/mL) no espaço sub-epitelial da língua através da borda de corte(Figura 1B1, setas) da língua posterior.
- Injete 1 mL de mistura enzimada uniformemente na língua inteira para coleta de tecido tanto da língua anterior quanto posterior.
- Injete 0,5 mL de mistura de enzima localmente à língua anterior para coleta de tecido da ponta da língua ou para a língua posterior para a coleta de tecido de papila circunvaltada.
NOTA: A língua vai inchar à medida que a enzima se acumula(Figura 1B2). A injeção suave da enzima pode evitar que a pressão danifique o epitélio e mantenha o máximo de enzimas possível na língua.
- Enrole a língua com plástico e incubar a língua por 30 min a 37 °C.
- Use mini-tesoura para dissecar a ponta da língua e/ou papila circunvaltada, e use espátula e fórceps finos para transferir tecido para 15 mL de solução de Tyrode estéril fresco em um prato de cultura de 100 mm.
- Separe o epitélio do tecido conjuntivo subjacente no espaço sub-epitelial digerido pela enzima usando mini-tesouras. Corte os tecidos em um tamanho adequado de acordo com a exigência de experimentos a jusante.
- Lave o epitélio separado e o tecido conjuntivo subjacente duas vezes em 15 mL de solução de Tyrode estéril fresco em um prato de cultura de 100 mm.
NOTA: As atividades de dispase e colagem serão inibidas por EDTA no procedimento de dissociação celular (etapa 4.1).
4. Dissociação celular
NOTA: O protocolo de dissociação celular descrito aqui pode ser aplicado ao epitélio da língua e ao tecido mesenquime/conjuntivo em camundongos embrionários E12,5 e 8 semanas de idade. Para reduzir a perda de celular durante a agitação e transferência de suspensão celular, use dicas comerciais de pipeta de baixa retenção ou pontas de pipeta pré-revestidas com 2,5% de BSA em 0,1 M PBS no pH 7.48.
- Transfira os tecidos usando espátula e fórceps finos para 3 mL de 0,25% trypsin-EDTA em um novo prato de cultura de 35 mm por 30 min a 37 °C. Agitar suavemente tecidos a cada 5 minutos com pontas de pipeta de 1 mL.
NOTA: Não corte a ponta da pipeta, pois a borda de corte pode danificar fisicamente as células dissociadas. - Adicione 500 μL de 5% de FBS no DMEM/F12 para parar a reação e transfira o meio para um tubo de centrífuga de baixa ligação de 5 mL.
- Suspensão celular centrífuga a 200 x g por 8 min a temperatura ambiente e remova o supernasce.
- Suspenda suavemente as células em 3 mL de DMEM/F12 contendo 10% de FBS e 1% BSA usando pontas de pipeta de 1 mL e filtre as células usando um coador de células de 70 μm, seguido por um coador de células de 35 μm.
- Suspensão celular centrífuga a 200 x g por 8 min a temperatura ambiente. Remova a maior parte do meio e deixe 50-300 μL como o volume final para re-suspender as células.
NOTA: Ajuste a concentração das células de acordo com os requisitos dos experimentos a jusante alterando o volume final de suspensão de célula única.
5. Teste de contagem de células e viabilidade usando hemótmetro
NOTA: Para melhorar a precisão da medição, são recomendadas 3 réplicas técnicas para cada amostra.
- Misture suavemente 5-10 μL da suspensão de célula única com um volume igual de azul Trypan e adicione ao hemócito.
NOTA: Limpe bem o hemótmetro usando 70% de etanol antes de usar. As partículas de poeira no hemócito ficarão manchadas em azul escuro e afetarão a precisão do teste de viabilidade. Verifique o hemótmetro sob um microscópio. - Conte o número total de células, o número de células vivas (brancas) e o número de células mortas (azul escuro) manchadas pelo azul Trypan(Figura 2, setas) respectivamente em 4 quadrados com 16 grades(Figura 2) usando microscópio invertido com sistema de imagem.
- Calcule a concentração celular:
Concentração celular =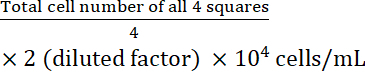
- Calcule a viabilidade:
Viabilidade =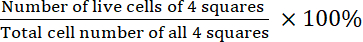
- Calcule a viabilidade:
Resultados
Separação do epitélio da língua do tecido mesenquime/conjuntivo subjacente
Na língua do rato embrionário, uma lacuna no espaço sub-epitelial é visível após a digestão adequada da enzima. Folhas epiteliais de algumas línguas são separadas sem força mecânica durante a incubação.
Na língua do rato adulto, uma injeção de enzima bem sucedida é indicada pelo inchaço nas áreas injetadas (Figura 1B2), ...
Discussão
Até o momento, não há um protocolo detalhado disponível para dissociação celular a partir do epitélio da língua e do tecido conjuntivo/mesenquime subjacente. Este protocolo de dissociação celular atual fornece um procedimento reprodutível para gerar uma única suspensão celular com uma alta viabilidade celular (>90%) de tecidos de língua de camundongos, incluindo folhas epiteliais e tecidos mesenquime/conjuntivos em estágios embrionários e pós-natais, embora células isoladas de E12,5 e camundongos adulto...
Divulgações
Nenhum conflito de interesses declarado.
Agradecimentos
Este estudo foi apoiado pelos Institutos Nacionais de Saúde, número de subvenção R01DC012308 e R21DC018089 para HXL. Agradecemos a Brett Marshall (Universidade da Geórgia, Atenas, GA) e Egon Ranghini (10X GENOMICS, Pleasanton, CA) por assistência técnica e consulta sobre a dissociação celular; para Francisca Gibson Burnley (Universidade da Geórgia, Atenas, GA) para edição em inglês.
Materiais
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
Referências
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados