このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
12.5日目および8週齢マウスの舌上皮・間分性/結合組織からの細胞解離
要約
我々は、胚および成体マウス舌の上皮および間線質/結合組織から大量の高品質単一細胞を解離するための一般化されたプロトコルを開発した。
要約
細胞解離は、個々の細胞レベルおよび/または細胞集団レベル(例えば、単一細胞RNAシーケンシングおよび一次細胞培養)での研究に不可欠な手順であった。大量に生存可能で健康な細胞を産出することは重要であり、そのために最適な条件は組織依存である。舌上皮および基礎となる間質/結合組織における細胞集団は異種であり、組織構造は異なる領域および異なる発達段階で異なる。我々は、初期発達[胚性12.5日目(E12.5)]および若年成人(8週間)段階でマウス舌上皮および間葉/結合組織から細胞を単離するためのプロトコルを試験した。上皮と下層の間質/結合組織との間のきれいな分離は容易に達成した。しかし、さらに細胞を処理して単離するには、生存可能な健康細胞を大量に生成し、酵素消化バッファー、インキュベーション時間、遠心分離の速度と時間を慎重に選択することが重要です。分離した上皮または基になる間葉系/結合組織を37°Cで30分間0.25%トリプシン-EDTAでインキュベーションし、続いて200xgで8分間遠心し、高い生存率(>90%)で細胞の高収率をもたらしたマウスのステージと舌の領域に関係なく。さらに、胚性および成体の舌からの解離された上皮および間葉/結合組織細胞の両方が、細胞生存率の有意な減少なしに少なくとも3時間細胞培養ベースの培地で生存できることを発見した。このプロトコルは、初期発達(E12.5)および若年成人(8週間)段階で異なる組織コンパートメントからの細胞解離を必要とするマウス舌からの単離細胞の調製を必要とする研究に有用である。
概要
哺乳類の舌は、味、話す、および食品処理に不可欠な複雑な器官である。それは間葉/結合組織によって区分され、味乳頭および味覚芽を含む階層化された上皮シートによって覆われる高度に組織化された組織の複数のタイプで構成される。舌上皮と間質/結合組織の両方の細胞集団は不均一である。舌の特定のタイプの細胞の機能と分布をよりよく理解するためには、解き分け細胞を用いた研究が必要である。例えば、単一細胞RNAシーケンシングは、個々の細胞における転写プロファイリングのための強力かつハイスループットな方法であり、単一細胞分解能1、2、3、4における複雑な組織の転写物を理解するように設計されている。一次細胞培養は、味覚芽5,6の幹細胞/前駆細胞の機能と分化を研究するのに有用なツールであることが証明されている。これらの研究は、大量の高品質の単離された細胞集団(例えば、適切な濃度および高い生存率を有する十分な総細胞数)を必要とする。
したがって、言語組織の異なる領域から、異なる発達段階で細胞を分離する必要があります。現在、舌上皮および基礎となる間質/結合組織からの細胞解離に利用できる詳細なプロトコルはない。ここでは、単一細胞RNAシーケンシングや一次幹細胞培養など、高い品質の生細胞を必要とする実験のために細胞を調製するための最適化された細胞解離方法を報告する。我々は、酵素消化バッファー、穏やかなピペット、再懸濁培地の選択、および最適な遠心分離時間と速度の選択は、これらの大量の高品質の細胞を生成するために重要であることを発見しました。
プロトコル
動物の使用(研究を通じてC57BL / 6マウス)は、ジョージア大学の制度的動物ケアと使用委員会によって承認され、研究のための動物のケアと使用のための国立健康ガイドライン研究所に従っていました。
1. 動物の使用
注:マウスは、ジョージア大学動物酪農科学科の動物施設で、12時間/夜間サイクルの下で22°Cで飼育および維持しました。
- マウスにおける膣プラグ検出の日の正午を胚(E)日0.5として指定する。E12.5で胚を使用し、生後マウスを生後8週で以下の実験に使用する。
2. 実験前の準備
注: このプロトコルに必要なインストゥルメントは、 資料一覧に記載されています。
- 実験前のオートクレーブ楽器。実験中にビーズ滅菌器を使用して器具を殺菌します。
- 70%エタノールワイプを使用して、外科領域、解剖顕微鏡、およびバイオセーフティキャビネットを洗浄します。バイオセーフティキャビネットのUVライトをオンにし、実験手順の前に20分間オンにします。
- 1:1ディスパーゼ(5.0 mg/mL)とコラゲナーゼ(2.0 mg/mL)の酵素混合物を最終濃度2.5と1.0mg/mLにそれぞれ調製し、0.22 μmシリンジフィルター7を使用して溶液をフィルター処理します。
- 成人の舌に対して1 mL、または特定の舌の領域(例えば、後部、または前舌)に対して0.5mLの酵素混合物を調製する。
- 胚性舌用酵素混合物2 mLを調製する。
- 0.1 M PBS で 2.5% BSA の 10 mL を作り、1 mL シリンジと 0.22 μm シリンジフィルターを使用して溶液をフィルターします。
- DMEM/F12で5%FBSの500 μLを作ります。
- 10%FBSと1%BSAを含むDMEM/F12の3mLを作り、1 mLシリンジと0.22 μmのシリンジフィルターを使用して溶液をフィルタリングします。
3. 間質/下層の結合組織からの舌上皮の分離
- E12.5マウス舌間質からの上皮の分離
- E12.5胚を運ぶ時安楽死させた妊婦マウスは、それをCO2 チャンバーに入れ、その後子宮頸部脱臼を行う。
注:E12.5のマウス胚は、妊娠中の雌マウスの膣プラグを検出した後、12日目の午後12時(午後)の後に収集されます。 - マウスを手術領域に移す。70%エタノールを使用してマウスの腹部を濡らし、毛皮が操作部位に入るのを防ぎます。
- 胚を運ぶ子宮の角を露出させるために解剖ハサミを使用して腹部を開きます。はさみを解剖して子宮の角を解剖し、100mmの培養皿で新鮮なタイロードの溶液を15mLに移します。
- ミニハサミと細かい鉗子を用いて、子宮角から胚(図1A1)を解剖する。
- 細かい鉗子を使用して口腔を慎重に大きく開き、ミニハサミを使って下顎から舌を解剖する(図1A2)。
- 100 mm の培養皿で 15 mL の新鮮な滅菌タイローデの溶液を使用して舌を洗浄します。
- 生安全キャビネットにヘラと細かい鉗子を備えた35mm培養皿で、ジスパーゼ(2.5mg/mL)とコラゲラーゼ(1.0mg/mL)の酵素混合物の2 mLに組織を移します。37°Cで20分間インキュベートします。
- 100mm培養皿で15mLの新鮮な滅菌タイローデの溶液に舌を移し、細かい鉗子を使用して腹側から上皮から間食物を静かに取り除きます。
注:上皮シートは、インキュベーション中に機械的な力なしで分離することができます。 - 分離した上皮と間質を15mLの新鮮な滅菌タイローデ溶液で100mm培養皿で2回洗浄します。
注意:ジスパーゼおよびコラゲナーゼの活動は、細胞解離手順(ステップ4.1)においてEDTAによって阻害される。
- E12.5胚を運ぶ時安楽死させた妊婦マウスは、それをCO2 チャンバーに入れ、その後子宮頸部脱臼を行う。
- 成体マウスの下層の結合組織からの舌上皮の分離
- マウスをCO2 チャンバーに入れることで、8週齢でマウスを安楽死させる。マウスが呼吸なしで安楽死させられ、前足ピンチ応答であることを確認します。
- マウスを手術領域に移す。毛皮が口腔に入るのを防ぐために70%エタノールを使用してマウスヘッドを濡らします。
- 口腔を開くために解剖ハサミを使用して頬に沿って口の角をカットします。下顎(図1B1)で舌を解剖し、ラップの層を持つプラスチック皿に入れます。
- 手術用鉗子を使用して舌を解剖顕微鏡で保持し、後舌の切り刃(図1B1、矢印)を通して舌の上皮下腔にディスパーゼ(2.5mg/mL)とコラゲターゼ(1.0mg/mL)の酵素混合物を注入する。
- 前舌と後舌の両方から組織を採取するために、1 mLの酵素混合物を舌全体に均等に注入します。
- 乳頭組織の周回採取のために、舌の先端または後舌からの組織採取のために前舌に0.5mLの酵素混合物を局所的に注入する。
注:酵素が蓄積するにつれて舌が膨らむ(図1B2)。酵素の穏やかな注入は、上皮を損傷する圧力を防ぎ、舌でできるだけ多くの酵素を保つことができます。
- ラップで舌を包み、37°Cで30分間舌をインキュベートします。
- ミニハサミを使用して舌の先端や乳頭を周回し、ヘラと細かい鉗子を使用して100mm培養皿で新鮮な滅菌チローデの溶液の15 mLに組織を移します。
- ミニハサミを使用して、酵素消化サブ上皮空間の下層の結合組織から上皮を分離します。下流の実験の要件に従って、組織を適切なサイズにトリミングします。
- 分離した上皮と根底にある結合組織を15mLの新鮮な滅菌タイローデの溶液を100mm培養皿で2回洗浄します。
注意:ジスパーゼおよびコラゲナーゼの活動は、細胞解離手順(ステップ4.1)においてEDTAによって阻害される。
4. 細胞解離
注:ここで説明する細胞解離プロトコルは、E12.5胚性マウスと8週齢マウスの両方で、舌上皮および間質/結合組織に適用することができます。細胞懸濁液の攪拌および移送中の細胞損失を低減するために、pH 7.4 8で0.1 M PBSで2.5%BSAで市販の低保持ピペットチップまたはプレコーティングされたピペットチップを使用してください。
- 37°Cで30分間新しい35 mm培養皿で、ヘラとファイン鉗子を使用して0.25%トリプシンEDTAの3 mLに組織を移します。 1 mLピペットチップで5分ごとに組織を穏やかに攪拌します。
注意:切削刃は解体細胞に物理的に損傷を与える可能性があるため、ピペットチップは切断しないでください。 - DMEM/F12に5%FBSの500 μLを加えて反応を停止し、培地を5 mLの低結合遠心分離管に移します。
- 遠心分離機細胞懸濁液を室温で8分間200xgで、上清を除去する。
- 1mLのピペットチップを使用して10%FBSと1%BSAを含むDMEM/F12の3mLのセルを穏やかに再中断し、70 μmの細胞ストレーナーを使用して細胞をフィルタリングし、続いて35 μmの細胞ストレーナーを使用します。
- 遠心分離機細胞懸濁液を室温で8分間200xgで懸濁した。ほとんどの培地を取り出し、50~300 μLを最終容積のままにして、細胞を再中断します。
注: 単一細胞懸濁液の最終容積を変更して、下流実験の要件に従って細胞の濃度を調整します。
5. ヘモサイトメーターを用いた細胞計数と生存率試験
注: 測定精度を向上させるために、各サンプルに対して 3 つの技術的な複製が推奨されます。
- 1細胞懸濁液の5~10μLを同量のトリパンブルーと軽く混ぜ、ヘモサイトメーターに加えます。
注:使用前に70%エタノールを使用して十分にヘモサイトメーターを清掃してください。血球体の塵粒子は濃い青色で染色され、生存率試験の精度に影響を与えます。顕微鏡で、ヘモサイトメーターを確認してください。 - 細胞総数、生細胞数(白)、トリパンブルーで染色された死細胞数(濃い青色)を、それぞれ16グリッド(図2)を有する4つの正方形(図2)で、画像化システムを用いた反転顕微鏡を用いた。
- 細胞濃度を計算します。
細胞濃度 =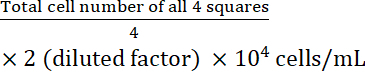
- 実行可能性を計算します。
生存率=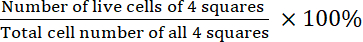
- 実行可能性を計算します。
結果
基礎間質/結合組織からの舌上皮の分離
胚性マウス舌では、適切な酵素消化後に上皮下腔の隙間が見える。一部の舌の上皮シートは、インキュベーション中に機械的な力なしで分離されます。
成人マウス舌では、注入された領域の腫脹(図1B2)によって酵素注射が成功したことを示しており、これは、酵素が舌によ?...
ディスカッション
現在までに、舌上皮および基礎となる間質/結合組織からの細胞解離に関する詳細なプロトコルは利用できていない。この現在の細胞解離プロトコルは、高い細胞生存率(>90%)を有する単一細胞懸濁液を生成する再現可能な手順を提供するE12.5と成体マウスからの単離された細胞が異なるにもかかわらず、胚および出生後の両方の段階で上皮シートおよび間葉/結合組織を含むマウスの舌組織から...
開示事項
利益相反は宣言されていません。
謝辞
この研究は、国立衛生研究所、助成番号R01DC012308、R21DC018089によってHXLに支援されました。ブレット・マーシャル(ジョージア大学、アテネ、GA)とエゴン・ランヒニ(10X GENOMICS、プレザントン、CA)に感謝し、細胞解離に関する技術支援と相談を行いました。フランシスカ・ギブソン・バーンリー(ジョージア大学、アテネ、ジョージア州)に英語編集。
資料
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
参考文献
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved