Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Диссоциация клеток из эпителия языка и мезенхимы/соединительной ткани эмбриональных мышей 12,5 и 8 недель
В этой статье
Резюме
Мы разработали обобщенный протокол для диссоциативного большого количества высококачественных одиночных клеток из эпителия и мезенхимы/соединительной ткани эмбриональных и взрослых мышей.
Аннотация
Диссоциация клеток была важной процедурой для исследований на уровне отдельных клеток и/или на уровне клеточной популяции (например, секвенирование одноклеточной РНК и первичная клеточная культура). Получение жизнеспособных, здоровых клеток в больших количествах имеет решающее значение, и оптимальные условия для этого зависят от тканей. Клеточные популяции в эпителии языка и лежащей в его основе мезенхиме/ соединительной ткани являются гетерогенными, и тканевые структуры различаются в разных областях и на разных стадиях развития. Мы протестировали протоколы выделения клеток из эпителия языка мыши и мезенхимы/соединительной ткани на ранних стадиях развития [эмбриональный день 12,5 (E12,5)] и молодых взрослых (8 недель). Чистое разделение между эпителием и подлежащей мезенхимой/соединительной тканью было легко осуществить. Однако для дальнейшей обработки и изоляции клеток, дающих жизнеспособные здоровые клетки в больших количествах, и тщательный выбор ферментативного буфера пищеварения, времени инкубации и скорости и времени центрифугирования имеют решающее значение. Инкубация отделенного эпителия или подлежащей мезенхимы/соединительной ткани в 0,25% трипсина-ЭДТА в течение 30 мин при 37 °C с последующим центрифугированием при 200 х г в течение 8 мин приводила к высокому выходу клеток при высокой скорости жизнеспособности (>90%) независимо от стадий мыши и областей языка. Более того, мы обнаружили, что как диссоциированные эпителиальные, так и мезенхимальные /соединительные клетки из эмбрионального и взрослого языков могут выживать в среде на основе клеточной культуры в течение не менее 3 ч без значительного снижения жизнеспособности клеток. Протоколы будут полезны для исследований, требующих подготовки изолированных клеток из языков мыши на ранних стадиях развития (E12.5) и молодых взрослых (8-недельных) стадиях, требующих диссоциации клеток из разных тканевых компартментов.
Введение
Язык млекопитающих является сложным органом, критически важным для вкуса, речи и обработки пищи. Он состоит из нескольких типов высокоорганизованных тканей, разделенных мезенхимой / соединительной тканью и покрытых стратифицированным эпителиальным листом, содержащим вкусовые сосочки и вкусовые рецепторы. Клеточные популяции как в эпителии языка, так и в мезенхиме/соединительной ткани неоднородны. Чтобы лучше понять функции и распределение определенного типа клеток на языке, необходимы исследования с использованием диссоциированных клеток. Например, секвенирование одноклеточной РНК является мощным и высокопроизводительный методом транскриптомного профилирования в отдельных клетках, который предназначен для понимания транскриптома сложной ткани при одноклеточном разрешении1,2,3,4. Было доказано, что первичная клеточная культура является полезным инструментом для изучения функции и дифференцировки стволовых/прогениторных клеток для вкусовых рецепторов5,6. Эти исследования требуют большого количества высококачественных изолированных клеточных популяций (например, достаточное общее количество клеток при правильной концентрации и высокой жизнеспособности).
Таким образом, возникает необходимость выделения клеток из разных областей лингвальных тканей и на разных стадиях развития. В настоящее время не существует подробного протокола диссоциации клеток от эпителия языка и лежащей в его основе мезенхимы / соединительной ткани. Здесь мы сообщаем об оптимизированном методе диссоциации клеток для подготовки клеток к экспериментам, требующим высокого качества живых клеток, таких как секвенирование одноклеточной РНК и первичные культуры стволовых клеток. Мы обнаружили, что выбор ферментативного буфера пищеварения, щадящее пипетирование, выбор среды ресуспензии, а также оптимальное время и скорость центрифугирования имеют решающее значение для создания этих больших количеств высококачественных клеток.
протокол
Использование животных (мыши C57BL/6 на протяжении всего исследования) было одобрено Комитетом по институциональному уходу и использованию животных Университета Джорджии и соответствовало Руководящим принципам Национального института здравоохранения по уходу и использованию животных для исследований.
1. Использование животными
ПРИМЕЧАНИЕ: Мыши были выведены и содержались в животноводческом учреждении факультета животноводства и молочных наук в Университете Джорджии при 22 ° C при 12-часовых циклах дня и ночи.
- Назначают полудень дня обнаружения влагалищной пробки у мышей как эмбриональный (Е) день 0,5. Используйте эмбрионы в E12.5 и постнатальных мышей в возрасте 8 недель для следующих экспериментов.
2. Подготовка перед экспериментом
ПРИМЕЧАНИЕ: Инструменты, необходимые для этого протокола, перечислены в Таблице материалов.
- Автоклавные приборы перед экспериментом. Стерилизуйте инструменты с помощью стерилизатора бисера во время эксперимента.
- Очистите хирургическую область, рассекающий микроскоп и шкаф биобезопасности, используя 70% этаноловые салфетки. Включите ультрафиолетовый свет шкафа биобезопасности и держите его в течение 20 минут до начала экспериментальной процедуры.
- Готовят ферментную смесь 1:1 диспазы (5,0 мг/мл) и коллагеназы (2,0 мг/мл) до конечной концентрации 2,5 и 1,0 мг/мл соответственно и фильтруют раствор с помощью шприцевого фильтра 0,22 мкм7.
- Приготовьте 1 мл ферментной смеси для взрослого языка или 0,5 мл для определенной области языка (например, заднего или переднего языка).
- Приготовить 2 мл ферментной смеси для эмбриональных языков.
- Сделайте 10 мл 2,5% BSA в 0,1 М PBS и отфильтруйте раствор с помощью шприца 1 мл и шприцевого фильтра 0,22 мкм.
- Сделайте 500 мкл 5% FBS в DMEM/F12.
- Сделайте 3 мл DMEM/F12, содержащих 10% FBS и 1% BSA, и процедить раствор с помощью шприца 1 мл и шприцевого фильтра 0,22 мкм.
3. Отделение эпителия языка от мезенхимы/подлежащей соединительной ткани
- Отделение эпителия от мезенхимы мышиного языка E12.5
- Усыпить беременных самок мышей, несущих эмбрионы E12.5, поместив их в камеру CO2 с последующим вывихом шейки матки.
ПРИМЕЧАНИЕ: Эмбрионы мышей при E12.5 собирают после 12 часов дня (днем) на 12-й день после обнаружения влагалищной пробки у беременных самок мышей. - Перенесите мышей в хирургическую зону. Смочите брюшко мыши, используя 70% этанола, чтобы предотвратить попадание шерсти в место работы.
- Откройте живот с помощью рассекающих ножниц, чтобы обнажить рога матки, несущие эмбрионы. Рассеките рога матки с помощью рассекающих ножниц и переложите его на 15 мл свежего раствора Тирода в 100 мм культуральной посуде.
- Рассекать эмбрионы(рисунок 1А1)из рогов матки под рассекающим микроскопом с помощью мини-ножниц и тонких щипцов.
- Осторожно широко откройте полость рта с помощью тонких щипцов и рассекайте язык от мандиблы с помощью мини-ножниц(рисунок 1А2).
- Вымойте языки, используя 15 мл свежего стерильного раствора Tyrode в 100 мм чашке для культуры.
- Переложить ткани на 2 мл ферментной смеси диспазы (2,5 мг/мл) и коллагеназы (1,0 мг/мл) в культурную посуду 35 мм с лопаткой и тонкими щипцами в шкафу биобезопасности. Инкубировать в течение 20 мин при 37 °C.
- Перенесите языки на 15 мл свежего стерильного раствора Тирода в 100 мм культуральной посуде и аккуратно удалите мезенхиму из эпителия с вентральной стороны с помощью тонких щипцов.
ПРИМЕЧАНИЕ: Эпителиальные листы могут быть отделены без механической силы во время инкубации. - Отделенная эпителия и мезенхима вымыть дважды в 15 мл свежего стерильного раствора Тирода в 100 мм культуральной посуде.
ПРИМЕЧАНИЕ: Активность диспазы и коллагеназы будет ингибироваться ЭДТА в процедуре диссоциации клеток (этап 4.1).
- Усыпить беременных самок мышей, несущих эмбрионы E12.5, поместив их в камеру CO2 с последующим вывихом шейки матки.
- Отделение эпителия языка от подлежащей соединительной ткани взрослых мышей
- Усыпить мышь в возрасте 8 недель, поместив ее в камеру CO2. Убедитесь, что мышь усыплена без дыхания и реакции защемления.
- Перенесите мышей в хирургическую область. Смочите голову мыши, используя 70% этанола, чтобы предотвратить попадание шерсти в ротовую полость.
- Срежьте уголки рта вдоль щеки с помощью рассекающих ножниц, чтобы открыть ротовую полость. Рассекните язык с помощью мандиблы(рисунок 1В1)и поместите его в пластиковую посуду со слоем полиэтиленовой пленки.
- Используя хирургические щипцы для удержания языка под рассекающим микроскопом, вводят ферментную смесь диспазы (2,5 мг/мл) и коллагеназы (1,0 мг/мл) в субэпителиальное пространство языка через режущую кромку(рисунок 1B1,стрелки) заднего языка.
- Равномерно ввести 1 мл ферментной смеси во весь язык для сбора тканей как с переднего, так и с заднего языка.
- Вводят 0,5 мл ферментной смеси локально в передний язык для сбора тканей с кончика языка или на задний язык для циркумвалляционного сбора ткани сосочков.
ПРИМЕЧАНИЕ: Язык будет набухать по мере накопления фермента(рисунок 1B2). Мягкая инъекция фермента может предотвратить давление от повреждения эпителия и сохранить как можно больше фермента в языке.
- Оберните язык полиэтиленовой пленкой и высиживание языка в течение 30 мин при 37 °C.
- Используйте мини-ножницы для рассечения кончика языка и/ или околоколлеобразного сосочка, а также используйте шпатель и тонкие щипцы для переноса ткани в 15 мл свежего стерильного раствора Тирода в 100 мм культуральной посуде.
- Отделите эпителий от подлежащей соединительной ткани в переваренный ферментами субэпителиальном пространстве с помощью мини-ножниц. Обрежьте ткани до надлежащего размера в соответствии с требованиями последующих экспериментов.
- Вымойте отделенный эпителий и подлежащую соединительную ткань дважды в 15 мл свежего стерильного раствора Тирода в 100 мм культуральной посуде.
ПРИМЕЧАНИЕ: Активность диспазы и коллагеназы будет ингибироваться ЭДТА в процедуре диссоциации клеток (этап 4.1).
4. Диссоциация клеток
ПРИМЕЧАНИЕ: Протокол диссоциации клеток, описанный здесь, может быть применен к эпителию языка и мезенхиме/соединительной ткани как у эмбриональных, так и у 8-недельных мышей E12.5. Чтобы уменьшить потерю клеток при перемешивании и переносе клеточной суспензии, используйте коммерческие наконечники пипеток с низким удержанием или предварительно покрытые наконечники пипеток с 2,5% BSA в 0,1 М PBS при рН7,4 8.
- Переложить ткани с помощью шпателя и мелкодисперсных щипцов до 3 мл 0,25% трипсина-ЭДТА в новой 35-мм культурной посуде в течение 30 мин при 37 °C. Осторожно перемешивать ткани каждые 5 минут кончиками пипеток 1 мл.
ПРИМЕЧАНИЕ: Не режут наконечник пипетки, так как режущая кромка может физически повредить диссоциированные клетки. - Добавьте 500 мкл 5% FBS в DMEM/F12, чтобы остановить реакцию и перенести среду в 5 мл низкосвязывающей центрифужной трубки.
- Центрифужная клеточная суспензия по 200 х г в течение 8 мин при комнатной температуре и удаление супернатанта.
- Осторожно повторно суспендируйте клетки в 3 мл DMEM/F12, содержащих 10% FBS и 1% BSA, используя наконечники пипетки 1 мл, и фильтруйте клетки с помощью клеточного ситечкового фильтра 70 мкм, а затем 35-мкм клеточного ситечко.
- Суспензия центрифужных ячеек по 200 х г в течение 8 мин при комнатной температуре. Удалите большую часть среды и оставьте 50-300 мкл в качестве конечного объема для повторной приостановки клеток.
ПРИМЕЧАНИЕ: Отрегулируйте концентрацию клеток в соответствии с требованиями последующих экспериментов путем изменения конечного объема одноклеточной суспензии.
5. Подсчет клеток и тест жизнеспособности с помощью гемоцитометра
ПРИМЕЧАНИЕ: Для повышения точности измерений для каждого образца рекомендуется использовать 3 технические реплики.
- Аккуратно смешать 5-10 мкл одноклеточной суспензии с равным объемом трипана синего и добавить на гемоцитометр.
ПРИМЕЧАНИЕ: Тщательно очистите гемоцитометр, используя 70% этанола перед использованием. Частицы пыли на гемоцитометре будут окрашены в темно-синий цвет и повлияют на точность теста на жизнеспособность. Проверьте гемоцитометр под микроскопом. - Подсчитайте общее число клеток, количество живых клеток (белые) и количество мертвых клеток (темно-синий), окрашенных трипановским синим цветом(рисунок 2,стрелки) соответственно в 4 квадрата с 16 сетками(рисунок 2)с помощью инвертированного микроскопа с системой визуализации.
- Рассчитайте концентрацию клеток:
Концентрация в клетках =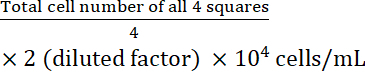
- Рассчитайте жизнеспособность:
Жизнеспособность =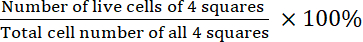
- Рассчитайте жизнеспособность:
Результаты
Отделение эпителия языка от подлежащей мезенхимы/соединительной ткани
В эмбриональном языке мыши виден разрыв в субэпителиальном пространстве после правильного переваривания ферментов. Эпителиальные листы некоторых языков отделяются без механической силы во время инкуб...
Обсуждение
На сегодняшний день не существует подробного протокола диссоциации клеток от эпителия языка и лежащей в его основе мезенхимы / соединительной ткани. Этот протокол диссоциации текущих клеток обеспечивает воспроизводимую процедуру для создания одноклеточной суспензии с высокой жизне?...
Раскрытие информации
Конфликт интересов не заявлен.
Благодарности
Это исследование было поддержано Национальными институтами здравоохранения, номер гранта R01DC012308 и R21DC018089 для HXL. Мы благодарим Бретта Маршалла (Университет Джорджии, Афины, Джорджия) и Эгона Рангини (10X GENOMICS, Плезантон, Калифорния) за техническую помощь и консультации по поводу диссоциации клеток; Франциске Гибсон Бернли (Университет Джорджии, Афины, Джорджия) для редактирования на английском языке.
Материалы
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
Ссылки
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены