Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zelldissoziation aus dem Zungenepithel und Mesenchym/Bindegewebe von embryonalen 12,5 und 8 Wochen alten Mäusen
In diesem Artikel
Zusammenfassung
Wir haben ein verallgemeinertes Protokoll entwickelt, um eine große Menge hochwertiger Einzelzellen aus dem Epithel und Mesenchym/Bindegewebe embryonaler und erwachsener Mauszungen zu dissoziieren.
Zusammenfassung
Die Zelldissoziation war ein wesentliches Verfahren für Studien auf Einzelzellebene und/oder auf Zellpopulationsebene (z. B. Einzelzell-RNA-Sequenzierung und primäre Zellkultur). Die Gewinnung lebensfähiger, gesunder Zellen in großen Mengen ist von entscheidender Bedeutung, und die optimalen Bedingungen dafür sind vom Gewebe abhängig. Zellpopulationen im Zungenepithel und im darunter liegenden Mesenchym/Bindegewebe sind heterogen und die Gewebestrukturen variieren in verschiedenen Regionen und in unterschiedlichen Entwicklungsstadien. Wir haben Protokolle zur Isolierung von Zellen aus dem Zungenepithel der Maus und Mesenchym/Bindegewebe in den frühen Entwicklungsstadien [Embryonaltag 12,5 (E12,5)] und jungen Erwachsenen (8 Wochen) getestet. Eine saubere Trennung zwischen dem Epithel und dem darunter liegenden Mesenchym/Bindegewebe war leicht zu bewerkstelligen. Um Zellen weiter zu verarbeiten und zu isolieren, sind jedoch lebensfähige gesunde Zellen in großen Mengen und die sorgfältige Auswahl des enzymatischen Verdauungspuffers, der Inkubationszeit und der Zentrifugationsgeschwindigkeit und -zeit von entscheidender Bedeutung. Die Inkubation von getrenntem Epithel oder darunterliegendem Mesenchym/Bindegewebe in 0,25% Trypsin-EDTA für 30 min bei 37 °C, gefolgt von zentrifugation bei 200 x g für 8 min führte zu einer hohen Zellausbeute bei einer hohen Lebensfähigkeitsrate (>90%) unabhängig von den Mausstadien und Zungenregionen. Darüber hinaus fanden wir heraus, dass sowohl dissoziierte epitheliale als auch mesenchymale/Bindegewebszellen aus embryonalen und adulten Zungen im zellkulturbasierten Medium mindestens 3 h überleben konnten, ohne dass die Zelllebensfähigkeit signifikant verringert wurde. Die Protokolle werden für Studien nützlich sein, die die Herstellung isolierter Zellen aus Mauszungen in frühen Entwicklungsstadien (E12.5) und jungen Erwachsenen (8 Wochen) erfordern, die eine Zelldissoziation aus verschiedenen Gewebekompartimenten erfordern.
Einleitung
Die Säugetierzunge ist ein komplexes Organ, das für Geschmack, Sprechen und Lebensmittelverarbeitung entscheidend ist. Es besteht aus mehreren Arten von hochorganisierten Geweben, die durch Mesenchym / Bindegewebe unterteilt und von einem geschichteten Epithelblatt bedeckt sind, das Geschmackspapillen und Geschmacksknospen enthält. Zellpopulationen sowohl im Zungenepithel als auch im Mesenchym/Bindegewebe sind heterogen. Um die Funktionen und die Verteilung eines bestimmten Zelltyps in der Zunge besser zu verstehen, sind Studien mit dissoziierten Zellen notwendig. Zum Beispiel ist die Einzelzell-RNA-Sequenzierung eine leistungsfähige und hochdurchsatzartige Methode zur transkriptomischen Profilierung in einzelnen Zellen, die entwickelt wurde, um das Transkriptom komplexer Gewebe mit einer Einzelzellauflösung1,2,3,4zu verstehen. Die primäre Zellkultur hat sich als nützliches Werkzeug erwiesen, um die Funktion und Differenzierung von Stamm-/Vorläuferzellen für Geschmacksknospen zu untersuchen5,6. Diese Studien erfordern eine große Menge an qualitativ hochwertigen isolierten Zellpopulationen (z. B. ausreichende Gesamtzellzahl bei richtiger Konzentration und hoher Lebensfähigkeit).
Daher besteht die Notwendigkeit, Zellen aus verschiedenen Regionen des Lingualgewebes und in verschiedenen Entwicklungsstadien zu isolieren. Derzeit gibt es kein detailliertes Protokoll für die Zelldissoziation vom Zungenepithel und dem darunter liegenden Mesenchym / Bindegewebe. Hier berichten wir über eine optimierte Zelldissoziationsmethode, um Zellen für Experimente vorzubereiten, die eine hohe Qualität lebender Zellen erfordern, z. B. für die Einzelzell-RNA-Sequenzierung und primäre Stammzellkulturen. Wir fanden heraus, dass die Auswahl des enzymatischen Aufschlusspuffers, das sanfte Pipettieren, die Auswahl des Resuspensionsmediums und die optimale Zentrifugationszeit und -geschwindigkeit entscheidend sind, um diese großen Mengen hochwertiger Zellen zu erzeugen.
Protokoll
Die Verwendung von Tieren (C57BL / 6-Mäuse während der gesamten Studie) wurde vom Institutional Animal Care and Use Committee der University of Georgia genehmigt und entsprach den Richtlinien der National Institutes of Health für die Pflege und Verwendung von Tieren für die Forschung.
1. Verwendung durch Tiere
HINWEIS: Mäuse wurden in der Tiereinrichtung der Abteilung für Tier- und Milchwissenschaften an der University of Georgia bei 22 ° C unter 12-Stunden-Tag/Nacht-Zyklen gezüchtet und gepflegt.
- Bezeichnen Sie den Mittag des Tages des Vaginalpfropfens bei Mäusen als embryonalen (E) Tag 0,5. Verwenden Sie Embryonen bei E12.5 und postnatale Mäuse im Alter von 8 Wochen für die folgenden Experimente.
2. Vorbereitung vor dem Experiment
HINWEIS: Die für dieses Protokoll erforderlichen Instrumente sind in der Materialtabelleaufgeführt.
- Autoklavinstrumente vor dem Experiment. Sterilisieren Sie Instrumente während des Experiments mit einem Perlensterilisator.
- Reinigen Sie den Operationsbereich, das Seziermikroskop und die Biosicherheitswerkbank mit 70% Ethanoltüchern. Schalten Sie das UV-Licht der Biosicherheitswerkbank ein und lassen Sie es vor dem Versuchsvorgang 20 Minuten lang eingeschaltet.
- Eine Enzymmischung aus 1:1-Dispase (5,0 mg/ml) und Kollagenase (2,0 mg/ml) wird auf eine Endkonzentration von 2,5 bzw. 1,0 mg/ml vorbereitet und die Lösung mit 0,22 μm Spritzenfilter7filtriert.
- Bereiten Sie 1 ml Enzymmischung für eine erwachsene Zunge oder 0,5 ml für eine bestimmte Zungenregion (z. B. hintere oder vordere Zunge) vor.
- Bereiten Sie 2 ml Enzymmischung für embryonale Zungen vor.
- Machen Sie 10 ml 2,5% BSA in 0,1 M PBS und filtern Sie die Lösung mit einer 1 ml Spritze und einem 0,22 μm Spritzenfilter.
- Machen Sie 500 μL von 5% FBS in DMEM/F12.
- Machen Sie 3 ml DMEM/F12 mit 10% FBS und 1% BSA und filtern Sie die Lösung mit 1 ml Spritze und 0,22 μm Spritzenfilter.
3. Trennung des Zungenepithels vom Mesenchym/darunterliegenden Bindegewebe
- Trennung des Epithels vom Mesenchym einer E12.5-Mauszunge
- Euthanasieren Sie trächtige weibliche Mäuse, die E12,5-Embryonen tragen, indem Sie sie in eine CO2-Kammer legen, gefolgt von zervikaler Dislokation.
HINWEIS: Mausembryonen bei E12.5 werden nach 12:00 Uhr (nachmittags) am 12. Tag nach dem Nachweis des Vaginalpfropfens bei den trächtigen weiblichen Mäusen entnommen. - Übertragen Sie Mäuse in den Operationsbereich. Befeuchten Sie den Bauch der Maus mit 70% Ethanol, um zu verhindern, dass Fell in die Operationsstelle gelangt.
- Öffnen Sie den Bauch mit einer Schere, um die Uterushörner freizulegen, die Embryonen tragen. Sezieren Sie die Uterushörner mit einer Schere und übertragen Sie sie in 15 ml frische Tyrode-Lösung in einer 100-mm-Kulturschale.
- Sezieren Sie die Embryonen (Abbildung 1A1) unter einem Seziermikroskop mit einer Minischere und einer feinen Zette aus den Uterushörnern heraus.
- Öffnen Sie die Mundhöhle vorsichtig mit einer feinen Zette weit und sezieren Sie die Zunge mit einer Minischere vom Unterkiefer ab (Abbildung 1A2).
- Waschen Sie die Zungen mit 15 ml frischer steriler Tyrode-Lösung in einer 100-mm-Kulturschale.
- Übertragen Sie das Gewebe auf 2 ml Enzymmischung aus Dispase (2,5 mg / ml) und Kollagenase (1,0 mg / ml) in einer 35 mm Kulturschale mit Spatel und feiner Zette in einer Biosicherheitswerkbank. 20 min bei 37 °C inkubieren.
- Die Zungen in eine 100-mm-Kulturschale auf 15 ml frische sterile Tyrode-Lösung geben und das Mesenchym vorsichtig mit einer feinen Handzette vom Epithel von der ventralen Seite entfernen.
HINWEIS: Epithelblätter können während der Inkubation ohne mechanische Kraft getrennt werden. - Waschen Sie das getrennte Epithel und Mesenchym zweimal in 15 ml frischer steriler Tyrode-Lösung in einer 100-mm-Kulturschale.
HINWEIS: Die Aktivitäten von Dispase und Kollagenase werden durch EDTA im Zelldissoziationsverfahren gehemmt (Schritt 4.1).
- Euthanasieren Sie trächtige weibliche Mäuse, die E12,5-Embryonen tragen, indem Sie sie in eine CO2-Kammer legen, gefolgt von zervikaler Dislokation.
- Trennung des Zungenepithels vom darunter liegenden Bindegewebe erwachsener Mäuse
- Euthanasieren Sie die Maus im Alter von 8 Wochen, indem Sie sie in eine CO2-Kammer legen. Bestätigen Sie, dass die Maus ohne Atemzüge und Vorpfoten-Pinch-Reaktion eingeschläfert wurde.
- Übertragen Sie die Mäuse in den Operationsbereich. Befeuchten Sie den Mauskopf mit 70% Ethanol, um zu verhindern, dass Fell in die Mundhöhle gelangt.
- Schneiden Sie die Mundwinkel entlang der Wange mit einer Schere, um die Mundhöhle zu öffnen. Sezieren Sie die Zunge mit dem Unterkiefer (Abbildung 1B1) und legen Sie sie in eine Plastikschale mit einer Schicht Plastikfolie.
- Mit einer chirurgischen Handzette, um die Zunge unter einem Seziermikroskop zu halten, injizieren Sie die Enzymmischung aus Dispase (2,5 mg / ml) und Kollagenase (1,0 mg / ml) in den subepithelialen Raum der Zunge durch dieSchneide (Abbildung 1B1, Pfeile) der hinteren Zunge.
- Injizieren Sie 1 ml Enzymmischung gleichmäßig auf die gesamte Zunge zur Gewebeentnahme von der vorderen und hinteren Zunge.
- Injizieren Sie 0,5 ml Enzymmischung lokal auf die Vorderzunge zur Gewebeentnahme von der Zungenspitze oder in die hintere Zunge zur Entnahme von Zirkumvallat-Papillengewebe.
HINWEIS: Die Zunge schwillt an, wenn sich das Enzym ansammelt (Abbildung 1B2). Eine sanfte Injektion des Enzyms kann verhindern, dass druckbelastend das Epithel schädigt und so viel Enzym wie möglich in der Zunge hält.
- Die Zunge mit Plastikfolie umwickeln und die Zunge 30 min bei 37 °C inkubieren.
- Verwenden Sie eine Mini-Schere, um die Zungenspitze und / oder die zirkumvallate Papille zu sezieren, und verwenden Sie Spatel und feine Zette, um Gewebe in 15 ml frische sterile Tyrode-Lösung in einer 100-mm-Kulturschale zu übertragen.
- Trennen Sie das Epithel vom darunter liegenden Bindegewebe im enzymverdauten Subepithelraum mit einer Minischere. Schneiden Sie das Gewebe entsprechend den Anforderungen nachgeschalteter Experimente auf eine geeignete Größe.
- Waschen Sie das abgetrennte Epithel und das darunter liegende Bindegewebe zweimal in 15 ml frischer steriler Tyrode-Lösung in einer 100-mm-Kulturschale.
HINWEIS: Die Aktivitäten von Dispase und Kollagenase werden durch EDTA im Zelldissoziationsverfahren gehemmt (Schritt 4.1).
4. Zelldissoziation
HINWEIS: Das hier beschriebene Zelldissoziationsprotokoll kann sowohl bei embryonalen als auch bei 8 Wochen alten E12.5-Mäusen auf das Zungenepithel und das Mesenchym-/Bindegewebe angewendet werden. Um den Zellverlust während des Rührens und übertragen der Zellsuspension zu reduzieren, verwenden Sie handelsübliche Pipettenspitzen mit geringer Retention oder vorbeschichtete Pipettenspitzen mit 2,5% BSA in 0,1 M PBS bei pH 7,48.
- Das Gewebe mit Spatel und feiner Zette auf 3 ml 0,25% Trypsin-EDTA in einer neuen 35 mm Kulturschale für 30 min bei 37 °C übertragen. Rühren Sie das Gewebe alle 5 Minuten vorsichtig mit 1 ml Pipettenspitzen.
HINWEIS: Schneiden Sie die Pipettenspitze nicht ab, da die Schneide die dissoziierten Zellen physisch beschädigen kann. - Fügen Sie 500 μL von 5% FBS in DMEM/F12 hinzu, um die Reaktion zu stoppen, und übertragen Sie das Medium in ein 5 mL niedrig bindendes Zentrifugenröhrchen.
- Zentrifugenzellensuspension bei 200 x g für 8 min bei Raumtemperatur und Entfernen des Überstands.
- Suspendieren Sie die Zellen vorsichtig in 3 ml DMEM/F12 mit 10% FBS und 1% BSA mit 1 mL Pipettenspitzen und filtern Sie die Zellen mit einem 70 μm Zellsieb, gefolgt von einem 35 μm Zellsieb.
- Zentrifugenzellsuspension bei 200 x g für 8 min bei Raumtemperatur. Entfernen Sie den größten Teil des Mediums und lassen Sie 50-300 μL als letztes Volumen, um die Zellen wieder aufzuhängen.
HINWEIS: Passen Sie die Konzentration der Zellen entsprechend den Anforderungen nachgeschalteter Experimente an, indem Sie das Endvolumen der Einzelzellsuspension ändern.
5. Zellzählung und Lebensfähigkeitstest mit Hämozytometer
HINWEIS: Um die Messgenauigkeit zu verbessern, werden 3 technische Replikate für jede Probe empfohlen.
- Mischen Sie vorsichtig 5-10 μL der Einzelzellsuspension mit einem gleichen Volumen Trypanblau und fügen Sie es auf das Hämozytometer hinzu.
HINWEIS: Reinigen Sie das Hämozytometer vor Gebrauch gründlich mit 70% Ethanol. Staubpartikel auf dem Hämozytometer werden dunkelblau gefärbt und beeinträchtigen die Genauigkeit der Lebensfähigkeitsprüfung. Überprüfen Sie das Hämozytometer unter einem Mikroskop. - Zählen Sie die Gesamtzahl der Zellen, die Anzahl der lebenden Zellen (weiß) und die Anzahl der toten Zellen (dunkelblau), die von Trypanblau gefärbt sind(Abbildung 2,Pfeile) bzw. in 4 Quadraten mit 16 Gittern(Abbildung 2)mit invertiertem Mikroskop mit Bildgebungssystem.
- Berechnen Sie die Zellkonzentration:
Zellkonzentration =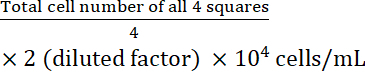
- Berechnen Sie die Lebensfähigkeit:
Lebensfähigkeit =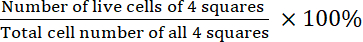
- Berechnen Sie die Lebensfähigkeit:
Ergebnisse
Trennung des Zungenepithels vom darunter liegenden Mesenchym/Bindegewebe
In der embryonalen Mauszunge ist nach der richtigen Enzymverdauung eine Lücke im subepithelialen Raum sichtbar. Epithelblätter einiger Zungen werden während der Inkubation ohne mechanische Kraft getrennt.
Bei der erwachsenen Mauszunge wird eine erfolgreiche Enzyminjektion durch die Schwellung in den injizierten Bereichen angezeigt (Abbildung 1B2
Diskussion
Bisher gibt es kein detailliertes Protokoll für die Zelldissoziation aus dem Zungenepithel und dem darunter liegenden Mesenchym/ Bindegewebe. Dieses aktuelle Zelldissoziationsprotokoll bietet ein reproduzierbares Verfahren, um eine Einzelzellsuspension mit einer hohen Zelllebensfähigkeit (>90%) aus Mauszungengewebe, einschließlich Epithelblättern und Mesenchym-/Bindegewebe sowohl im embryonalen als auch im postnatalen Stadium, obwohl isolierte Zellen von E12.5 und erwachsenen Mäusen unterschiedlich groß sind. Zum B...
Offenlegungen
Keine Interessenkonflikte deklariert.
Danksagungen
Diese Studie wurde von den National Institutes of Health mit den Fördernummern R01DC012308 und R21DC018089 an HXL unterstützt. Wir danken Brett Marshall (University of Georgia, Athens, GA) und Egon Ranghini (10X GENOMICS, Pleasanton, CA) für technische Unterstützung und Beratung bezüglich der Zelldissoziation; an Francisca Gibson Burnley (University of Georgia, Athens, GA) für englische Bearbeitung.
Materialien
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
Referenzen
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten