A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוק תאים מאפיתל הלשון ומיסנצ'ימה/רקמת החיבור של עכברים בני 12.5 ו-8 שבועות
In This Article
Summary
פיתחנו פרוטוקול כללי כדי לנתק כמות גדולה של תאים בודדים באיכות גבוהה מן האפיתל ו mesenchyme / רקמת חיבור של לשונות עכבר עובריות ובוגרות.
Abstract
דיסוציאציה של תאים הייתה הליך חיוני למחקרים ברמת התאים הבודדים ו/או ברמת אוכלוסיית התאים (למשל, רצף RNA של תא יחיד ותרבות תאים ראשונית). תשואת תאים בריאים ובת קיימא בכמויות גדולות היא קריטית, והתנאים האופטימליים לעשות זאת תלויים ברקמות. אוכלוסיות התאים באפיתל הלשון ורקמת החיבור הבסיסית הן הטרוגניות ומבני הרקמות משתנים באזורים שונים ובשלבים התפתחותיים שונים. בדקנו פרוטוקולים לבודד תאים מאפיתל לשון העכבר ורקמת mesenchyme / חיבור בשלבים ההתפתחותיים המוקדמים [יום עוברי 12.5 (E12.5)] ומבוגר צעיר (8 שבועות). הפרדה נקייה בין האפיתל לבין רקמת mesenchyme / חיבור הבסיסית היה קל להשיג. עם זאת, כדי להמשיך לעבד ולבודד תאים, מניב תאים בריאים קיימא בכמויות גדולות, ובחירה זהירה של מאגר עיכול אנזימטי, זמן הדגירה, ומהירות צנטריפוגה וזמן הם קריטיים. דגירה של אפיתל מופרד או רקמת mesenchyme / חיבור הבסיסית ב 0.25% טריפסין-EDTA במשך 30 דקות ב 37 °C (69 °F), ואחריו צנטריפוגה ב 200 x g במשך 8 דקות הביא תשואה גבוהה של תאים בשיעור כדאיות גבוהה (>90%) ללא קשר לשלבי העכבר ואזורי הלשון. יתר על כן, מצאנו כי הן אפיתל מנותק והן תאי רקמת mesenchymal / חיבור משפות עובריות ובוגרות יכול לשרוד במדיום מבוסס תרבות התא לפחות 3 שעות ללא ירידה משמעותית של הכדאיות התא. הפרוטוקולים יהיו שימושיים למחקרים הדורשים הכנת תאים מבודדים מלשונות עכבר בשלבים התפתחותיים מוקדמים (E12.5) ומבוגרים צעירים (8 שבועות) הדורשים ניתוק תאים מתאי רקמות שונים.
Introduction
לשון היונקים היא איבר מורכב הקריטי לטעם, דיבור ועיבוד מזון. הוא מורכב מסוגים רבים של רקמות מאורגנות מאוד ממודר על ידי mesenchyme / רקמת חיבור מכוסה על ידי גיליון אפיתל מרובד המכיל פפיליה טעם בלוטות טעם. אוכלוסיות התאים הן באפיתל הלשון והן ברקמת mesenchyme/connective הן הטרוגניות. כדי להבין טוב יותר את הפונקציות ואת ההפצה של סוג מסוים של תאים בלשון, מחקרים באמצעות תאים מנותקים נחוצים. לדוגמה, רצף RNA של תא יחיד הוא שיטה רבת עוצמה ובעלת תפוקה גבוהה לפרופיל שעתוק בתאים בודדים, אשר נועדה להבין את התמלול של רקמה מורכבת ברזולוציה של תא יחיד1,2,3,4. תרבות התאים העיקרית הוכחה ככלי שימושי לחקר הפונקציה והבידול של תאי גזע / אב לבלוטות טעם5,6. מחקרים אלה דורשים כמות גדולה של אוכלוסיות תאים מבודדים באיכות גבוהה (למשל, מספר תאים כולל מספיק עם ריכוז תקין וכדאיות גבוהה).
לכן, יש צורך לבודד תאים מאזורים שונים של הרקמות הלשונית בשלבים התפתחותיים שונים. נכון לעכשיו, אין פרוטוקול מפורט זמין עבור ניתוק התא מאפיתל הלשון ואת הרקמה mesenchyme / חיבור הבסיסית. כאן, אנו מדווחים על שיטת ניתוק תאים ממוטבת כדי להכין תאים לניסויים הדורשים איכות גבוהה של תאים חיים כגון עבור רצף RNA של תא יחיד ותרביות תאי גזע ראשוניות. מצאנו כי מבחר של מאגר עיכול אנזימטי, pipetting עדין, מבחר של מדיום resuspension, זמן צנטריפוגה אופטימלי ומהירות חיוניים כדי ליצור כמויות גדולות אלה של תאים באיכות גבוהה.
Protocol
שימוש בבעלי חיים (עכברי C57BL/6 לאורך כל המחקר) אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת ג'ורג'יה והיה בהתאם להנחיות המכונים הלאומיים לבריאות לטיפול ושימוש בבעלי חיים למחקר.
1. שימוש בבעלי חיים
הערה: עכברים גודלו ומתוחזקים במתקן בעלי החיים של המחלקה למדעי בעלי חיים ומוצרי חלב באוניברסיטת ג'ורג'יה ב 22 °C (70 °F) תחת 12 שעות יום / לילה מחזורים.
- לייעד את הצהריים של היום של זיהוי תקע הנרתיק בעכברים כמו עוברי (E) יום 0.5. השתמש בעוברים ב- E12.5 ובעכברים לאחר לידה בגיל 8 שבועות לניסויים הבאים.
2. הכנה לפני הניסוי
הערה: המכשירים הדרושים לפרוטוקול זה מפורטים בטבלת החומרים.
- מכשירי אוטוקלאב לפני הניסוי. לעקר מכשירים באמצעות מעקר חרוזים במהלך הניסוי.
- נקו את האזור הכירורגי, את המיקרוסקופ הנותח ואת ארון האבטחה הביולוגית באמצעות מגבוני אתנול 70%. הפעל את אור UV של ארון biosafety ולשמור אותו על במשך 20 דקות לפני ההליך הניסיוני.
- הכן תערובת אנזימים של 1:1 dispase (5.0 מ"ג / מ"ל) וקולאזנאז (2.0 מ"ג / מ"ל) לריכוז סופי של 2.5 ו 1.0 מ"ג / מ"ל בהתאמה, ולסנן את הפתרון באמצעות מסנן מזרק 0.22 מיקרומטר7.
- הכן 1 מ"ל של תערובת אנזימים ללשון בוגרת או 0.5 מ"ל לאזור מסוים של הלשון (למשל, לשון אחורית או לשון 100 מטר).
- מכינים 2 מ"ל של תערובת אנזימים לשונות עובריות.
- הפוך 10 מ"ל של 2.5% BSA ב 0.1 M PBS ולסנן את הפתרון באמצעות מזרק 1 מ"ל ו 0.22 מיקרומטר מזרק מסנן.
- הפוך 500 μL של 5% FBS ב DMEM / F12.
- הפוך 3 מ"ל של DMEM / F12 המכיל 10% FBS ו 1% BSA ולסנן את הפתרון באמצעות מזרק 1 מ"ל ו 0.22 מיקרומטר מזרק מסנן.
3. הפרדת אפיתל הלשון מרקמת החיבור mesenchyme/הבסיסית
- הפרדת האפיתל מהמזנצ'ימה של לשון עכבר E12.5
- המתת חסד מתוזמן עכברים נקבה בהריון נושאת E12.5 עוברים על ידי הצבת אותו בתא CO2 ואחריו נקע בצוואר הרחם.
הערה: עוברי עכבר ב E12.5 נאספים לאחר 12:00 (אחר הצהריים) ביום ה -12 לאחר גילוי של תקע הנרתיק בעכברים הנשיים בהריון. - העבר עכברים לאזור הכירורגי. הרטב את בטן העכבר באמצעות 70% אתנול כדי למנוע פרווה מלהיכנס לאתר ההפעלה.
- פתח את הבטן באמצעות מספריים מנתחים כדי לחשוף את קרני הרחם הנושאות עוברים. לנתח את קרני הרחם באמצעות מספריים מנתחים ולהעביר אותו 15 מ"ל של הפתרון של Tyrode טרי בצלחת תרבות 100 מ"מ.
- לנתח את העוברים (איור 1A1) מקרני הרחם תחת מיקרוסקופ מנתח באמצעות מספריים מיני מלקחיים עדינים.
- פתחו בזהירות את חלל הפה לרווחה באמצעות מלקחיים עדינים ונתחו את הלשון מהלסת התחתונה באמצעות מספריים קטנים(איור 1A2).
- לשטוף את הלשונות באמצעות 15 מ"ל של פתרון טרי סטרילי Tyrode בצלחת תרבות 100 מ"מ.
- מעבירים את הרקמות ל-2 מ"ל של תערובת אנזימים של פירוק (2.5 מ"ג/מ"ל) וקולאזנאז (1.0 מ"ג/מ"ל) בצלחת תרבות של 35 מ"מ עם מרית ומלקחיים עדינים בארון ביו-רוויה. דגירה במשך 20 דקות ב 37 מעלות צלזיוס.
- מעבירים את הלשונות ל-15 מ"ל של פתרון Tyrode סטרילי טרי בצלחת תרבות של 100 מ"מ ומסירים בעדינות את המזנצ'ימה מהאפיתל מהצד הגחוני באמצעות מלקחיים עדינים.
הערה: יריעות אפיתל ניתן להפריד ללא כוח מכני במהלך הדגירה. - שטפו את האפיתליה המופרדת ואת mesenchyme פעמיים ב 15 מ"ל של פתרון Tyrode סטרילי טרי בצלחת תרבות 100 מ"מ.
הערה: הפעילויות של dispase ו קולגנאז יהיה מעוכב על ידי EDTA בהליך ניתוק התא (שלב 4.1).
- המתת חסד מתוזמן עכברים נקבה בהריון נושאת E12.5 עוברים על ידי הצבת אותו בתא CO2 ואחריו נקע בצוואר הרחם.
- הפרדת אפיתל הלשון מרקמת החיבור הבסיסית של עכברים בוגרים
- המתת עכבר בגיל 8 שבועות על ידי הצבתו בתא CO2. ודא שהעכבר מורדם ללא נשימות ותגובת צביטה מראש.
- העבר את העכברים לאזור הכירורגי. הרטב את ראש העכבר באמצעות 70% אתנול כדי למנוע פרווה מלהיכנס לחלל הפה.
- חותכים את פינות הפה לאורך הלחי באמצעות מספריים מנתחים כדי לפתוח את חלל הפה. לנתח את הלשון עם הלסת התחתונה (איור 1B1) ומניחים אותה בצלחת פלסטיק עם שכבה של ניילון נצמד.
- באמצעות מלקחיים כירורגיים כדי להחזיק את הלשון תחת מיקרוסקופ מנתח, להזריק את תערובת האנזים של dispase (2.5 מ"ג / מ"ל) וקולאזנאז (1.0 מ"ג / מ"ל) בחלל תת אפיתל של הלשון דרך חוד החנית (איור 1B1, חצים) של הלשון האחורית.
- להזריק 1 מ"ל של תערובת אנזימים באופן שווה לכל הלשון לאיסוף רקמות הן מהלשון הצדדית והן מהלשון האחורית.
- להזריק 0.5 מ"ל של תערובת אנזימים מקומית ללשון הקדמונית לאיסוף רקמות מקצה הלשון או ללשון האחורית לאיסוף רקמת פפילה circumvallate.
הערה: הלשון תתנפח ככל שהאנזים יצטבר (איור 1B2). הזרקה עדינה של האנזים יכולה למנוע לחץ מפגיעה באפיתל ולשמור כמה שיותר אנזים בלשון.
- עוטפים את הלשון בניילון נצמד ומדגרים את הלשון במשך 30 דקות ב-37 מעלות צלזיוס.
- השתמש במספריים מיני כדי לנתח את קצה הלשון ו / או circumvallate papilla, ולהשתמש מרית מלקחיים עדינים להעביר רקמה ל 15 מ"ל של פתרון של Tyrode סטרילי טרי בצלחת תרבות 100 מ"מ.
- הפרד את האפיתל מרקמת החיבור הבסיסית בחלל התת-אפיתל המתעכל באמצעות מספריים קטנים. לקצץ את הרקמות לגודל הנכון על פי הדרישה של ניסויים במורד הזרם.
- שטפו את האפיתל המופרד ואת רקמת החיבור הבסיסית פעמיים ב-15 מ"ל של הפתרון של Tyrode סטרילי טרי בצלחת תרבות של 100 מ"מ.
הערה: הפעילויות של dispase ו קולגנאז יהיה מעוכב על ידי EDTA בהליך ניתוק התא (שלב 4.1).
4. ניתוק תאים
הערה: פרוטוקול ניתוק התא המתואר כאן יכול להיות מיושם על אפיתל הלשון ו mesenchyme / רקמת חיבור הן E12.5 עוברי ו 8 שבועות בן עכברים. כדי להפחית את אובדן התא במהלך עצבנות והעברת השעיית תאים, השתמש בטיפים מסחריים בעלי החזקה נמוכה של פיפטה או בטיפים מצופים מראש עם 2.5% BSA ב- 0.1 M PBS ב- pH 7.48.
- מעבירים את הרקמות באמצעות מרית ומלקחיים עדינים ל-3 מ"ל של 0.25% טריפסין-EDTA בצלחת תרבות חדשה של 35 מ"מ למשך 30 דקות ב-37 מעלות צלזיוס. בעדינות להתסיס רקמות כל 5 דקות עם טיפים פיפטה 1 מ"ל.
הערה: אין לחתוך את קצה הפיפטה, שכן חוד החנית עלול לגרום נזק פיזי לתאים המנותקים. - הוסף 500 μL של 5% FBS ב DMEM / F12 כדי לעצור את התגובה ולהעביר את המדיום לצינור צנטריפוגה מחייב נמוך 5 מ"ל.
- השעיית תא צנטריפוגה ב 200 x g במשך 8 דקות בטמפרטורת החדר ולהסיר את supernatant.
- בעדינות להשעות מחדש תאים 3 מ"ל של DMEM / F12 המכיל 10% FBS ו 1% BSA באמצעות טיפים פיפטה 1 מ"ל ולסנן את התאים באמצעות מסננת תאים 70 מיקרומטר, ואחריו מסננת תאים 35 מיקרומטר.
- השעיית תא צנטריפוגה ב 200 x g במשך 8 דקות בטמפרטורת החדר. הסר את רוב המדיום ולהשאיר 50-300 μL כאמצעי האחסון הסופי כדי להשעות מחדש את התאים.
הערה: התאם את ריכוז התאים בהתאם לדרישות הניסויים במורד הזרם על-ידי שינוי הנפח הסופי של השעיית תא יחיד.
5. בדיקת ספירת תאים וכדאיות באמצעות המוציטרומטר
הערה: כדי לשפר את דיוק המדידה, מומלץ לבצע 3 משכפלים טכניים עבור כל דגימה.
- מערבבים בעדינות 5-10 μL של המתלה תא יחיד עם נפח שווה של כחול Trypan ולהוסיף על המוציטרומטר.
הערה: יש לנקות את המוציטרומטר ביסודיות באמצעות 70% אתנול לפני השימוש. חלקיקי אבק על המוציטרומטר יהיו מוכתמים בכחול כהה וישפיעו על הדיוק של בדיקת הכדאיות. בדוק את המוציטרומטר תחת מיקרוסקופ. - ספור את מספר התא הכולל, את מספר התאים החיים (לבנים) ואת מספר התאים המתים (כחול כהה) המוכתמים בכחול Trypan(איור 2, חצים) בהתאמה ב- 4 ריבועים עם 16 רשתות (איור 2)באמצעות מיקרוסקופ הפוך עם מערכת דימות.
- חשב את ריכוז התא:
ריכוז תאים =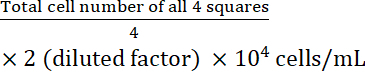
- חשב את הכדאיות:
כדאיות =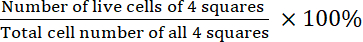
- חשב את הכדאיות:
תוצאות
הפרדת אפיתל הלשון מרקמת המזנצ'ים/חיבור הבסיסית
בלשון העכבר העוברי, ניתן לראות פער במרחב התת-אפיתל לאחר עיכול אנזים תקין. יריעות אפיתל של לשונות מסוימות מופרדות ללא כוח מכני במהלך הדגירה.
בלשון העכבר הבוגר, הזרקת אנזים מוצלחת מסומנת על ידי הנפיחות באזורים המוזרקי?...
Discussion
עד כה, לא היה פרוטוקול מפורט זמין עבור ניתוק התא מאפיתל הלשון ואת המזנצ'ימה הבסיסית / רקמת חיבור. פרוטוקול ניתוק תאים נוכחי זה מספק הליך לשחזור כדי ליצור השעיית תא בודד עם כדאיות גבוהה של תאים (>90%) מרקמות לשון העכבר, כולל יריעות אפיתל ורקמות mesenchyme / חיבור בשלבים העובריים ולאחר הלידה למרות תאי...
Disclosures
לא הוכרזו ניגודי אינטרסים.
Acknowledgements
מחקר זה נתמך על ידי המכונים הלאומיים לבריאות, מספר מענק R01DC012308 ו R21DC018089 ל- HXL. אנו מודים לברט מרשל (אוניברסיטת ג'ורג'יה, אתונה, GA) ואגון רנגיני (10X GENOMICS, Pleasanton, CA) על סיוע טכני וייעוץ לגבי ניתוק התא; כדי פרנסיסקו גיבסון ברנלי (אוניברסיטת ג'ורג'יה, אתונה, GA) לעריכה אנגלית.
Materials
| Name | Company | Catalog Number | Comments |
| bovine serum albumin (BSA) | Gold Biotechnology | A-420-100 | |
| C57BL/6 mouse (C57BL/6J) | The Jackson Laboratory | 000664 | |
| collagenase (Collagenase A) | Sigma-Aldrich | 10103586001 | |
| culture dish (35 mm in diameter) | Genesee Scientific | 32-103G | |
| culture dish (100 mm in diameter) | Genesee Scientific | 32-107G | |
| dispase (Dispase II) | Sigma-Aldrich | 04942078001 | |
| dissecting scissors (Student Fine Scissors) | Find Science Tool | 91460-11 | |
| DMEM/F12 | Gibco | 11320033 | |
| fetal bovine serum (FBS) | Hyclone | C838U82 | |
| fine forceps (Dumount #3 Forceps) | Find Science Tool | 11293-00 | |
| hemocytometer | Hausser Scientific | 3520 | |
| inverted microscope with imaging system (EVOS XL Core Cell Imaging System) | Life Technologies | AMEX1000 | |
| low retention pipette tips | METTLER TOLEDO | 17014342 | |
| mini-scissors (Evo Spring Scissors) | Fine Science Tool | 15800-01 | |
| plastic warp | VWR | 46610-056 | |
| spatula (Moria Spoon) | Fine Science Tool | 10321-08 | |
| surgical forceps (Dumount #2 Laminectomy Forceps) | Fine Science Tool | 11223-20 | |
| Trypan blue | Gibco | 15250061 | |
| Tyrode’s solution | Sigma-Aldrich | T2145-10L | made from Tyrode's salts |
| 0.25% typsin-EDTA | Gibco | 25200056 | |
| 0.1 M Phosphate-Buffered Saline (PBS) | Hoefer | 33946 | made from 1 M PBS |
| 0.22-μm syringe filter | Genesee Scientific | 25-243 | |
| 70% ethanol | Koptec | 233919 | made from 100% ethanol |
| 1-mL syringe | BD | 8194938 | |
| 5-mL low binding microcentrifuge tube | Eppendorf | 30122348 | |
| 30-G needle | BD | 9193532 | |
| 35-μm cell strainer | Falcon | 64750 | |
| 70-μm cell strainer | Falcon | 64752 |
References
- Grada, A., Weinbrecht, K. Next-generation sequencing: methodology and application. The Journal of investigative dermatology. 133 (8), 11 (2013).
- Whitley, S. K., Horne, W. T., Kolls, J. K. Research techniques made simple: methodology and clinical applications of RNA sequencing. Journal of Investigative Dermatology. 136 (8), 77-82 (2016).
- Schaum, N., et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris: The Tabula Muris Consortium. Nature. 562 (7727), 367 (2018).
- Sukumaran, S. K., et al. Whole transcriptome profiling of taste bud cells. Scientific reports. 7 (1), 1-15 (2017).
- Ren, W., et al. Transcriptome analyses of taste organoids reveal multiple pathways involved in taste cell generation. Scientific Reports. 7 (1), 1-13 (2017).
- Ren, W., et al. Single Lgr5-or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo. Proceedings of the National Academy of Sciences. 111 (46), 16401-16406 (2014).
- Venkatesan, N., Boggs, K., Liu, H. -. X. Taste bud labeling in whole tongue epithelial sheet in adult mice. Tissue Engineering Part C: Methods. 22 (4), 332-337 (2016).
- Nguyen-Ngoc, K. -. V., et al. . Tissue Morphogenesis. , 135-162 (2015).
- Okubo, T., Clark, C., Hogan, B. L. Cell lineage mapping of taste bud cells and keratinocytes in the mouse tongue and soft palate. Stem Cells. 27 (2), 442-450 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved