A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
جيل من نموذج مبسط ثلاثي الأبعاد للبشرة على رقاقة في منصة Micromachined Microfluidic
In This Article
Summary
هنا، نقدم بروتوكولا لتوليد نموذج بشرة مبسط وغير متمايز ثلاثي الأبعاد باستخدام منصة ميكروفلويدية ميكروماشينيد. يسمح نهج التدفق الموازي بترسب المقصورة الجلدية في الموقع لزرع الخلايا الظهارية في الأعلى ، والتي تسيطر عليها جميع مضخات الحقن.
Abstract
يقدم هذا العمل منصة ميكروفلويدية جديدة وفعالة من حيث التكلفة وموثوقة مع إمكانية توليد أنسجة معقدة متعددة الطبقات. كدليل على المفهوم ، تم تصميم جلد بشري مبسط وغير متمايز يحتوي على جلد (سترومال) ومقصورة البشرة (الظهارية). ولتحقيق ذلك، تم تطوير جهاز متعدد الاستخدامات وقوي قائم على الفينيل مقسم إلى غرفتين، للتغلب على بعض العيوب الموجودة في أجهزة microfluidic القائمة على البوليديميثيلسيلوكسيان (PDMS) للتطبيقات الطبية الحيوية، مثل استخدام معدات مكلفة ومتخصصة أو امتصاص جزيئات وبروتينات صغيرة مسعورة. وعلاوة على ذلك، تم تطوير طريقة جديدة تقوم على التدفق الموازي، مما يتيح ترسب في الموقع من كل من المقصورات الجلدية والجلدية. يتكون بناء الجلد من مصفوفة الفيبرين التي تحتوي على الخلايا الليفية الأولية البشرية و طبقة أحادية من خلايا القرنية الخالدة المصنفة في الأعلى ، والتي يتم الحفاظ عليها لاحقا في ظل ظروف الثقافة الديناميكية. هذه المنصة الجديدة microfluidic يفتح إمكانية لنموذج الأمراض الجلدية البشرية واستقراء طريقة لتوليد الأنسجة المعقدة الأخرى.
Introduction
مؤخرا، تم إحراز تقدم نحو تطوير وإنتاج نماذج الجلد البشري في المختبر لتحليل سمية مستحضرات التجميل والمنتجات الصيدلانية1. وقد تم استخدام الباحثين في الصناعات الصيدلانية والعناية بالبشرة الحيوانات، الفئران كونها الأكثر شيوعا، لاختبار منتجاتها2،3،4،5. ومع ذلك ، فإن اختبار المنتجات على الحيوانات ليس دائما تنبؤيا بالاستجابة لدى البشر ، مما يؤدي في كثير من الأحيان إلى فشل الدواء أو الآثار الضارة في البشر وبالتالي إلى الخسائر الاقتصادية5،6. وكانت المملكة المتحدة أول بلد يحظر استخدام الحيوانات في الاختبارات التجميلية في عام 1998. في وقت لاحق، في عام 2013، حظر الاتحاد الأوروبي اختبار واستحسان مستحضرات التجميل في الحيوانات (لائحة مستحضرات التجميل في الاتحاد الأوروبي رقم 1223/2009)7.
كما يتم النظر في هذا الحظر من قبل بلدان أخرى مثل "قانون مستحضرات التجميل الإنسانية" في الولايات المتحدةالأمريكية 8. بالإضافة إلى المخاوف الأخلاقية، فإن الاختلافات التشريحية بين جلد الحيوان والبشر تجعل اختبار الحيوانات يستغرق وقتا طويلا ومكلفا وغير فعال في كثير من الأحيان. وعلاوة على ذلك، من المتوقع أن يصل حجم السوق العالمي لاختبار السموم في المختبر إلى 26.98 مليار دولار أمريكي بحلول عام 20259. ولهذه الأسباب، هناك حاجة إلى تطوير أساليب وبدائل جديدة لأولئك الذين في المختبر الدراسات، مثل نماذج الجلد البشري المهندسة بيولوجيا، التي تمكن من اختبار السلامة والآثار السامة لمستحضرات التجميل والأدوية دون استخدام الحيوانات.
هناك نوعان مختلفان من نماذج الجلد البشري المتاحة تجاريا، في المختبر. يتكون النوع الأول من مكافئات البشرة الطبقية التي تحتوي على طبقات متعددة من الخلايا الكيراتينية المتمايزة التي تزرع على مواد مختلفة. وقد وافقت منظمة التعاون والتنمية في الميدان الاقتصادي على بعضها وجرى التحقق من صحتها من قبل (المركز الأوروبي للتحقق من صحة الطرق البديلة (ECVAM) لتآكل الجلد واختبار تهيج، مثل EpiDerm أو SkinEthic10،11،12. النوع الثاني هو مكافئات الجلد الكامل مع طبقة من الخلايا القرنية البشرية المتمايزة المصنفة على سقالة ثلاثية الأبعاد (ثلاثية الأبعاد) تحتوي على الخلايا الليفية ، مثل T-Skin و EpiDerm-FT. ومع ذلك ، يتم استزراع هذه النماذج في ظل ظروف ثابتة ، مما يجعلها غير قادرة على تمثيل الظروف الفسيولوجية البشرية بدقة.
وقد ركز الاهتمام مؤخرا على توليد نماذج الجلد 3D في المختبر في الخلية الثقافة إدراج (CCI) الأشكال مع التشوه الديناميكي13،14،15،16،17،18،19. ومع ذلك ، لا يمكن اعتبار هذه الأنظمة stricto sensu كجلد على رقائق ميكروفلويدي وفقا لتعريفها الكلاسيكي في هذا المجال. تعريف إنجبر للأعضاء على رقاقة تنص على أن الجهاز يجب أن توضع داخل القنوات microfluidic، وهو شرط أن عدد قليل فقط من الأجهزة تفي20،21. وقد وضعت الجلد على رقائق حتى الآن على غرار الظهارة بسيطة في الغالب كطبقات خلية واحدة و / أو طبقات الخلايا الجلدية مفصولة غشاء مسامية22،23. على الرغم من أن هناك بعض التقدم في نمذجة الجلد في النظم microfluidic16،24، لا يوجد حاليا أي أدب يظهر نظام الجهاز على رقاقة التي تناسب تعريف إنجر ، وقادرة على إنتاج الجلد متعدد الطبقات في الموقع ، بما في ذلك كل من المكونات الظهارية والسترومال.
في هذا العمل، يتم تقديم منصة ميكروفلويدية جديدة وفعالة من حيث التكلفة وقوية وقائمة على الفينيل لتطبيقات الجلد على رقاقة. تم إنتاج هذه المنصة عن طريق الآلات الدقيقة ، والتي توفر المزيد من البساطة في عملية التصنيع ، بالإضافة إلى زيادة المرونة والتنوع في تخطيط الجهاز ، والتغلب على بعض القيود المفروضة على PDMS25. كما تم تصميم طريقة لإدخال بناء الجلد المبسط من خلال تدفق مواز يتم التحكم فيه بمضخات الحقن. تدفق مواز يسمح اثنين من السوائل مع اللزوجة مختلفة جدا (عازلة وفيبرين ما قبل هلام في هذه الحالة) أن تكون متغلغلة من خلال قناة دون خلط مع بعضها البعض. كدليل على المفهوم ، تم إدخال بناء ديرمو البشرة يحتوي على الخلايا الليفية المضمنة في مصفوفة الفيبرين التي تحاكي الأدمة في الجهاز ، وعلى رأسها تم تحميل طبقة أحادية من الخلايا الكيراتينية لمحاكاة البشرة غير المتمايزة. يمكن تعديل ارتفاع المقصورة الجلدية عن طريق تعديل معدلات التدفق. الجدة الرئيسية لهذا العمل، مقارنة بالنماذج الموصوفة سابقا22و26و27و28و29،هي تطوير بناء ثلاثي الأبعاد داخل غرفة صغيرة عن طريق المايكروفلويديس. على الرغم من أن هذه المقالة تقدم بشرة مبسطة غير متمايزة ، فإن الهدف على المدى الطويل هو توليد وتوصيف بناء جلد متميز تماما لإثبات جدواه ووظائفه لأغراض الاختبار الدوائي والتجميلي.
Protocol
1. تصميم رقاقة والمعلمات micromachining
- تصميم طبقات رقاقة microfluidic مع برنامج تصميم فريكاد مفتوحة المصدر؛ راجع الجدول 1 لأبعاد القنوات. قم بتضمين أربعة ثقوب قطرها 2.54 مم في التصميم لاستخدام جهاز محاذاة مصنوع خصيصا لتراكب طبقة صحيحة.
| الطول (ميكرومتر) | العرض (ميكرومتر) | |
| الغرفة السفلى | 28,400 | 800 |
| الغرفة العليا | 31,000 | 800 |
الجدول 1: أبعاد القنوات العلوية والسفلية للجهاز.
- قطع 95 ميكرومتر سميكة، لاصقة، أوراق الفينيل شفافة في 30 سم × 30 سم المربعات لتناسب في الراسمة بشكل صحيح.
- استخدام برنامج Brother CanvasWorkspace لإنشاء مساحة عمل 30 سم × 30 سم ، وتعبئتها بالأنماط المصممة للطبقات المختلفة من الشريحة (الشكل 1A). تخزينه في ملف .svg.
- قطع 30 سم × 30 سم الفينيل ورقة مع حافة الراسمة(الشكل 1B-D).
- عصا ورقة الفينيل إلى حصيرة لاصقة تك منخفضة، والقضاء على جميع فقاعات الهواء إذا لزم الأمر.
- تحميل ملف .svg إلى الراسمة، وتعيين المعلمات القطع: قطع شفرة: مستوى 3؛ خفض الضغط: المستوى 0; قطع السرعة: المستوى 1. ضع حصيرة لاصقة مع الفينيل في الراسمة، والبدء في عملية القطع.
- قص نمط القناة العلوي على الفينيل الشريط مزدوجة 12 ميكرومتر سميكة باتباع الخطوات السابقة.

الشكل 1: تصميم رقاقة وعملية micromachining. (أ) تخطيط البرامج التي تبين مساحة العمل مليئة كل من أنماط أعلى وأسفل مصممة لرقاقة. (ب) حافة الراسمة أثناء عملية القطع؛ وتظهر شفرة القطع، ورقة الفينيل كله، وحصيرة لاصقة. (ج) الفينيل منقوشة يجري فصلها عن ورقة قطع. (د) عينة من طبقة الفينيل لاصقة منقوشة مع تصميم القناة العليا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تصنيع طبقة PDMS
- اخلط PDMS وعامل المعالجة بنسبة 10:1 (v/v)، وضع الخليط تحت الفراغ لمدة 15 دقيقة لإزالة فقاعات الهواء. صب 55 مل من الخليط في 55 سم2 طبق ثقافة مربعة للحصول على طبقة 2 مم سميكة. إزالة فقاعات مع إبرة.
- علاج الخليط (الخطوة 2.1) في الفرن لمدة 1 ساعة في 80 درجة مئوية. فك PDMS وقطع عليه إلى مستطيلات مع أبعاد رقاقة. جعل ثقوب للأنابيب مع إبرة حقنة 18 G.
3. رقاقة التجمع
ملاحظة: للحصول على فهم أفضل، راجع الشكل 2.
- تجميع الجهاز بأكمله باستخدام جهاز المحاذاة لضبط القنوات والمداخل والمنافذ بشكل صحيح. تتراكم أربع طبقات الفينيل (مع micropattern السفلي المقابلة) لتجميع القناة السفلى، والحفاظ على شريط تغطية الطبقة السفلية لتجنب التمسك المحاذاة.
- قطع ووضع البولي (PC) غشاء مسامية على رأس القناة السفلى لفصله عن الجزء العلوي. يجب الحرص على عدم تغطية مداخل القناة السفلية.
- إضافة عشر طبقات الفينيل مع تصميم الغرفة العليا. عصا طبقة الفينيل الشريط على الوجهين مع نمط القناة العليا على القمة. إزالة رقاقة من المحاذاة والتمسك بها على الشريحة الزجاجية.
- ضع ورقة PDMS بسماكة 2 مم فوق طبقة الفينيل الشريط على الوجهين لتوفير تثبيت مناسب للأنابيب وتجنب التسرب. اترك وزنا فوق الشريحة بين عشية وضحاها لضمان أن الشريحة محكمة الإغلاق تماما. تعقيم رقاقة عن طريق مسح 70٪ v/v الإيثانول لمدة 5 دقائق، ومن ثم يغسل مع المقطر H2O.
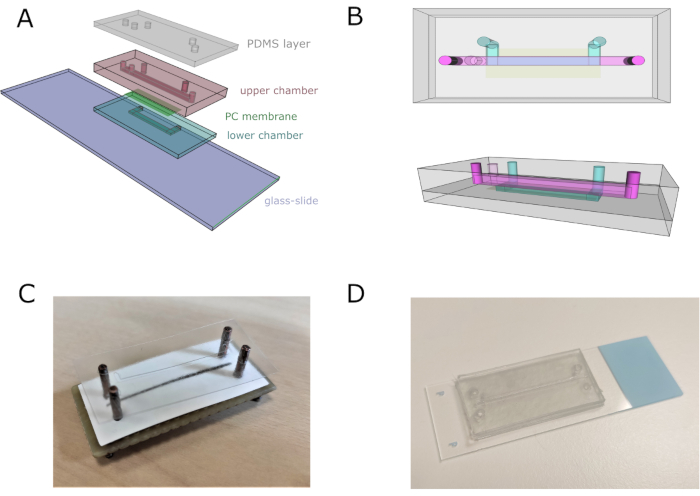
الشكل 2: تجميع رقاقة Microfluidic. (أ) مخطط عام لتجميع الجهاز. وتتكون الغرف السفلية والعليا من أربعة وإحدى عشرة ورقة الفينيل فرضه، على التوالي. (ب) وجهات النظر العلوية وال الجانبية للرقاقة microfluidic. يتم تمثيل القنوات العلوية والسفلية باللونين الوردي والأزرق على التوالي. (C) صورة تجميع الشرائح باستخدام محاذاة حسب الطلب. (D) صورة رقاقة بعد التجميع الكامل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. اتصالات مضخة
ملاحظة: يظهر التمثيل الرسومي لاتصالات المضخات في الشكل 3.
- توصيل المضخة 1 بمدخل الغرفة العليا 1 (UCi1).
- توصيل المضخة 2 بمدخل الغرفة العليا 2 (UCi2).
- توصيل المضخة 3 بمدخل الغرفة السفلى (LCi).
- توصيل منفذ الغرفة العليا (UCo) ومنفذ الغرفة السفلى (LCo) بأنبوب نفايات.
- ربط المحاقن إلى كل مدخل باستخدام أنابيب البوليتيترافلوروإيثيلين (PTFE) و 18 G موصلات الفولاذ المقاوم للصدأ.
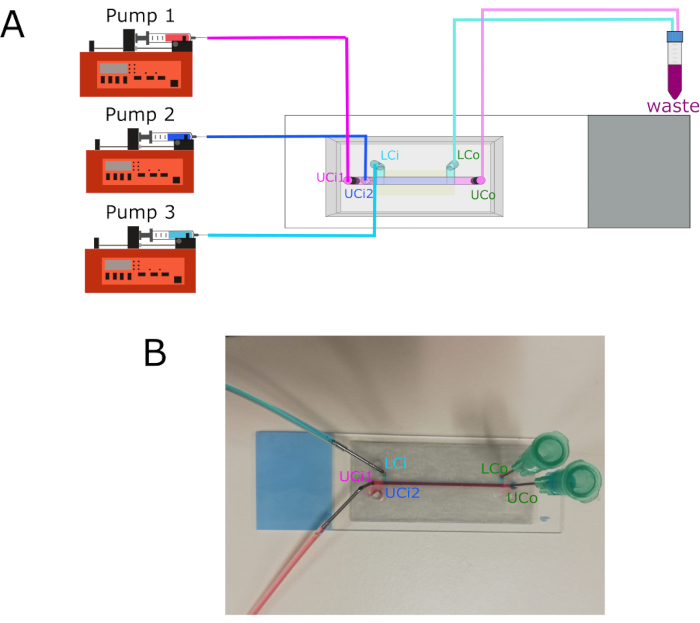
الشكل 3: مضخة اتصالات ومداخل / منافذ الموقع. (أ) الرسم البياني تبين اتصال المضخات الثلاث المختلفة إلى مداخل كل منها. منافذ الاتصال إلى حاوية النفايات. (ب) صورة رقاقة مع مداخل ومنافذ وصفت. المختصرات: LCi = مدخل الغرفة السفلية؛ LCo = منفذ الغرفة السفلى; UCi1 = مدخل الغرفة العليا 1; UCi2 = مدخل الغرفة العليا 2; UCo = منفذ الغرفة العليا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. ثقافة الخلية
ملاحظة: خط الخلية HaCaT له أصل تجاري. 10 - تأتي الخلايا الليفية الأولية البشرية من متبرعين أصحاء وتم الحصول عليها من جمع عينات بيولوجية من أصل بشري مسجلة في "السجل الوطني للبيوبانكوس الفقرة Investigación Biomédica del Instituto de Salud Carlos III".
- العمل في غطاء محرك السيارة ثقافة الخلية، تعقيمها سابقا تحت الأشعة فوق البنفسجية ومسحها مع الإيثانول.
- تذوب خلايا H2B-GFP-HaCaT (خلايا القرنية الجلدية الخالدة البشرية، hKCs) والخلايا الليفية الأولية GFP-human (hFBs) عند 37 درجة مئوية، وإضافة 2 مل من متوسط الثقافة، والطرد المركزي لمدة 7 دقائق عند 20 درجة مئوية عند 250 × ز.
ملاحظة: H2B-GFP-HaCaT خلايا القرنية الخالدة الإنسان تعديل للتعبير عن بروتين الفلورسنت الهجين الهستون H2B-الأخضر (GFP)، وتوفير نواتها مع مضان أخضر. GFP-hFBs هي الخلايا الليفية الأولية البشرية التي تحولت مع ناقلات pLZRS-IRES-EGFP للتعبير عن الفلورية الخضراء السيتوبلازمية. تم تعديل هذه الخلايا بعد البروتوكولات المنشورة سابقا30،31 - زراعة كل من hKCs وhFBs في 1x DMEM تكملها 10٪ مصل البقر الجنين و 1٪ من المضادات الحيوية / محلول مضاد للميكون. قم بتدفئة وسط الثقافة مسبقا عند 37 درجة مئوية قبل الاستخدام.
- فصل الخلايا عن طريق غسلها مع 1x الفوسفات العازلة المالحة (PBS)، مضيفا 2 مل من تريبسين / إيثيلينديامين حمض التترا الأسيتيك (EDTA) واحتضانها لمدة 10 دقيقة في 37 درجة مئوية.
- inactivate تريبسين إضافة 4 مل من الثقافة المتوسطة. إعادة إنفاق الخلايا ونقلها إلى أنبوب 15 مل. إزالة 10 ميكرولتر لحساب الخلايا على غرفة نيوباور وتحديد التركيز المناسب.
- الطرد المركزي أنبوب 15 مل لمدة 7 دقائق في 20 درجة مئوية في 250 × غرام. إزالة supernatant، وإعادة إنفاق الكريات في التركيز المطلوب: hFBs في 50،000 الخلايا / مل وhKCs في 5·× 106 خلايا / مل.
6. فيبرينوجين إعداد ما قبل هلام
- تنشيط thrombin بإضافة 1mL من CaCl2 (1٪ ث / الخامس في NaCl) إلى القارورة.
- إضافة المكونات التالية للحصول على 1 مل من هيدروجيل الفيبرين بتركيز نهائي من الفيبرين من 3.5 ملغ / مل: 59 ميكرولتر من الثرومبين المنشط (10 وحدات المعاهد القومية للصحة / م 59 ميكرولتر من حمض الترانيكساميد(جدول المواد،100 ملغم/مل)، 764 ميكرولتر من وسط الثقافة يحتوي على 50000 hFBs/mL، 118 ميكرولتر من الفيبرينوجين (20 ملغم/مل في NaCl (0.9٪ ث/v)).
ملاحظة: يجب إضافة فيبرينوجين في اللحظة الأخيرة.
7. بروتوكول التدفق المتوازي
- مضخة 1x برنامج تلفزيوني مع مضخة 3 من خلال LCi في 50 ميكرولتر / دقيقة خلال العملية برمتها.
- مضخة السائل الأضحية (1x PBS) مع مضخة 2 من خلال UCi2 في 100 ميكرولتر / دقيقة.
- تحميل المحاقن مع ما قبل هلام، ووضعها بسرعة في مضخة 1، وتشغيله في 200 ميكرولتر / دقيقة(الشكل 4A).
- توقف مضخات 1 و 2 مرة واحدة قبل هلام يخرج من UCo.
- اترك الشريحة دون إزالة الأنبوب عند 37 درجة مئوية لمدة 10 دقائق على الأقل للسماح بالجيليشن.
- مضخة الثقافة المتوسطة في 50 ميكرولتر / ساعة مع مضخة 3 من خلال UCi2 بين عشية وضحاها.
- كتلة UCi1 مع قبعة.
8. hKCs أحادية الطبقة البذر
- تحقق تحت المجهر من أن مركبات الهيدروكربون تنتشر بعد 24 ساعة من توليد المقصورة الجلدية.
- إدخال hKCs مع مضخة 2 من خلال UCi2 في 5 ×· 106 خلايا / مل في 40 ميكرولتر / دقيقة لمدة 1 دقيقة (الشكل 4B).
- اترك الشريحة بين عشية وضحاها عند 37 درجة مئوية في حاضنة مشبعة بالرطوبة لمرفق الخلية.
- ضخ الثقافة الطازجة المتوسطة مع مضخة 3 فقط من خلال LCi في 50 ميكرولتر / دقيقة (الشكل 4C).
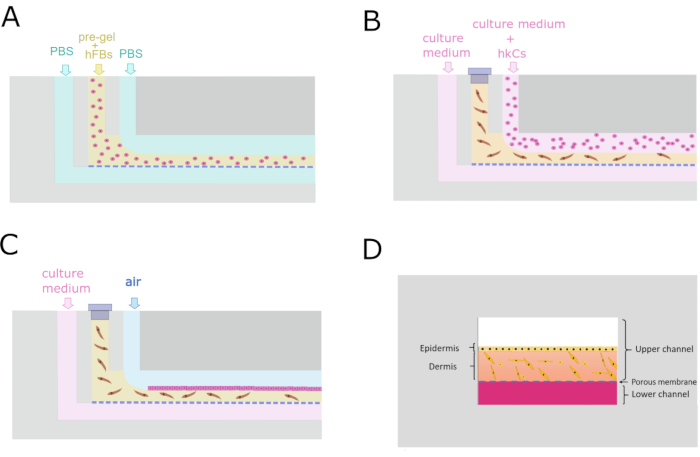
الشكل 4: بروتوكول Microfluidic لتوليد بناء ديرمو البشرة. (أ) عرضي عرضي يظهر عملية التدفق المتوازي لتوليد المقصورة الجلدية. (ب) الكيراتينية أحادية الطبقة البذر 24 ح بعد جيل المقصورة الجلدية. (ج) صيانة ثقافة الخلية داخل الجهاز microfluidic. (د) الاستجمام المقطعي من الجلد داخل الشريحة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
9. فحص قابلية البقاء الخلية
ملاحظة: مجموعة حية / ميتة البقع الخلايا مع مضان الأخضر أو الأحمر اعتمادا على حالتها الحية أو الميتة. ومن أجل التمايز السليم في الجدوى، يجب استخدام مركبات الهيدروفلوروكربون غير الفلورية ومركبات الكربون الهيدروفلورية في هذه الخطوة. يتم تنفيذ جميع الخطوات في الإجراء من خلال UCi2 مع مضخة 2.
- غسل القناة العلوية مع برنامج تلفزيوني 1x لمدة 5 دقائق في 50 ميكرولتر / دقيقة لإزالة الثقافة المتوسطة.
- ضخ الهواء لإزالة برنامج تلفزيوني 1x في 50 ميكرولتر / دقيقة.
- إعداد Calcein AM/Ethidium homodimer-1 كيت (لايف / الميت) الحل باتباع تعليمات الشركة المصنعة.
- مضخة لايف / الميت الحل في 50 ميكرولتر / دقيقة لمدة 2 دقيقة.
- احتضان 30 دقيقة في 37 درجة مئوية في الظلام.
- غسل القناة العليا عن طريق ضخ 1x PBS في 50 ميكرولتر / دقيقة لمدة 2 دقيقة لإزالة أي كاشف المتبقية.
- مراقبة العينة تحت المجهر confocal. استخدم طول موجي مثير 495/590 نانومتر وطول موجي للانبعاثات 519/617 نانومتر للخلايا الحية والميتة على التوالي.
النتائج
تتكون الشريحة المصممة من غرفتين سائلتين يفصل بينهما غشاء كمبيوتر بحجم 5 ميكرومتر يسمح بنمو الخلية من خلال السماح بمرور الجزيئات المعززة للنمو من الغرفة السفلية. الغرفة العليا يحمل بناء الأنسجة، في هذه الحالة، طبقة أحادية من hKCs على هيدروجيل الفيبرين التي تحتوي على hFBs.
يتم ت?...
Discussion
كان الدافع لتطوير هذه الطريقة هو الرغبة في نمذجة الأمراض الجلدية ودراسة آثار العلاجات الجديدة والمبتكرة في منصة عالية الإنتاجية. حتى الآن، ينتج هذا المختبر هذه مكافئات ديرمو البشرة عن طريق الصب إما يدويا أو بمساعدة تقنية الطباعة الحيوية ثلاثية الأبعاد- هلام الفيبرين مع الخلايا الليفية ف...
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
ونشكر بإخلاص الدكتور خافيير رودريغيز، والدكتورة ماريا لويزا لوبيز، وكارلوس ماتيلان، وخوان فرانسيسكو رودريغيز على اقتراحاتهم ومناقشاتهم و/أو بياناتهم الأولية المفيدة للغاية. كما نشكر مساهمات سيرجيو فيرنانديز وبيدرو هيريروس ولارا ستولزنبورغ في هذا المشروع. 11 - أتوجه بالشكر الخاص إلى الدكتورة مارتا غارسيا على المركبات الهيدروفلورية ومركبات الكربون الهيدروفلورية التي تحمل علامة GFP ومركبات الكربون الهيدروفلورية. وأخيرا، نعترف بالمساعدة التقنية الممتازة التي يقدمها غييرمو فيزكينو وأنجيليكا كورال. وقد دعم هذا العمل "برنامج العمل من قبل I+D entre Grupos de Investigación de la Comunidad de Madrid"، مشروع S2018/BAA-4480، Biopieltec-CM. كما تم دعم هذا العمل من قبل "برنامج دي إكسلينسيا"، مشروع EPUC3M03، CAM. المجلس النيجيرى دى ايدوكاسيون اي انفيستيجاسيون
Materials
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
References
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387 (2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016)
- . Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015 Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018)
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -. M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526 (2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43 (2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471 (2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898 (2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006 (2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved