È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Generazione di un modello skin-on-a-chip tridimensionale semplificato in una piattaforma microfluidica microlavorazione
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per generare un modello di pelle tridimensionale semplificato e indifferenziato utilizzando una piattaforma microfluidica microlavorazione. Un approccio a flusso parallelo consente la deposizione in situ di un compartimento dermico per la semina di cellule epiteliali sulla parte superiore, il tutto controllato da pompe a siringa.
Abstract
Questo lavoro presenta una piattaforma microfluidica nuova, economica e affidabile con il potenziale per generare tessuti multistrato complessi. Come prova di concetto, è stata modellata una pelle umana semplificata e indifferenziata contenente un compartimento dermico (stromale) e un compartimento epidermico (epiteliale). Per raggiungere questo obiettivo, è stato sviluppato un dispositivo versatile e robusto, a base di vinile diviso in due camere, superando alcuni degli inconvenienti presenti nei dispositivi microfluidici a base di polidimetilsilossano (PDMS) per applicazioni biomediche, come l'uso di apparecchiature costose e specializzate o l'assorbimento di piccole molecole e proteine idrofobiche. Inoltre, è stato sviluppato un nuovo metodo basato sul flusso parallelo, che consente la deposizione in situ di entrambi i compartimenti dermico ed epidermico. Il costrutto cutaneo è costituito da una matrice di fibrina contenente fibroblasti primari umani e un monostrato di cheratinociti immortalizzati seminati sulla parte superiore, che viene successivamente mantenuto in condizioni di coltura dinamiche. Questa nuova piattaforma microfluidica apre la possibilità di modellare le malattie della pelle umana ed estrapolare il metodo per generare altri tessuti complessi.
Introduzione
Recentemente, sono stati compiuti progressi verso lo sviluppo e la produzione di modelli in vitro di pelle umana per l'analisi della tossicità dei prodotti cosmetici e farmaceutici1. I ricercatori nelle industrie farmaceutiche e della cura della pelle hanno utilizzato animali, i topi sono i più comuni, per testare i loro prodotti2,3,4,5. Tuttavia, la sperimentazione di prodotti sugli animali non è sempre predittiva della risposta nell'uomo, che spesso porta a fallimento del farmaco o effetti avversi nell'uomo e di conseguenza a perdite economiche5,6. Il Regno Unito è stato il primo paese che ha vietato l'uso di animali per i test cosmetici nel 1998. Successivamente, nel 2013, l'UE ha vietato la sperimentazione e l'omologazione dei cosmetici negli animali (regolamento UE sui cosmetici n. 1223/2009)7.
Questo divieto è anche preso in considerazione da altri paesi come in "The Humane Cosmetics Act" negli Stati Uniti8. Oltre alle preoccupazioni etiche, le differenze anatomiche tra pelle animale e umana rendono la sperimentazione animale dispendiosa in termini di tempo, costosa e spesso inefficace. Inoltre, si prevede che le dimensioni del mercato globale dei test tossicologici in vitro raggiungeranno i 26,98 miliardi di dollari entro il 20259. Per questi motivi, è necessario sviluppare nuovi metodi e alternative per quegli studi in vitro, come i modelli bioingegnerizzati della pelle umana, che consentono di testare la sicurezza e gli effetti tossici di cosmetici e farmaci senza l'uso di animali.
Esistono due diversi tipi di modelli di pelle umana disponibili in commercio, in vitro. Il primo tipo è costituito da equivalenti epidermici stratificati contenenti più strati di cheratinociti differenzianti che vengono seminati su materiali diversi. Alcuni di essi sono stati approvati dall'Organizzazione per la cooperazione e lo sviluppo economico (OCSE) e convalidati dal Centro europeo per la convalida dei metodi alternativi (ECVAM) per i test di corrosione e irritazione cutanea, come EpiDerm o SkinEthic10,11,12. Il secondo tipo sono equivalenti a pelle intera con uno strato di cheratinociti umani differenzianti seminati su un'impalcatura tridimensionale (3D) che contiene fibroblasti, come T-Skin ed EpiDerm-FT. Tuttavia, questi modelli sono coltivati in condizioni statiche, il che li rende incapaci di rappresentare con precisione le condizioni fisiologiche umane.
L'interesse recente si è concentrato sulla generazione di modelli cutanei 3D in vitro in formati di inserto di coltura cellulare (CCI) con perfusione dinamica13,14, 15,16,17,18,19. Tuttavia, questi sistemi non possono essere considerati stricto sensu come skin-on-chip microfluidici secondo la loro definizione classica nel campo. La definizione di Ingber per organs-on-a-chip afferma che l'organo deve essere collocato all'interno dei canali microfluidici, che è una condizione che solo pochi dispositivi soddisfano20,21. Skin-on-chips hanno finora modellato per lo più epiteli semplici come strati unicellulari e / o strati cellulari dermici separati da una membrana porosa22,23. Sebbene ci siano stati alcuni progressi nella modellazione della pelle nei sistemi microfluidici16,24, attualmente non esiste letteratura che mostri un sistema organ-on-a-chip che si adatti alla definizione di Ingber, in grado di produrre una pelle multistrato in situ e comprendente sia componenti epiteliali che stromali.
In questo lavoro, viene presentata una nuova piattaforma microfluidica a base di vinile, economica, robusta e per applicazioni skin-on-a-chip. Questa piattaforma è stata prodotta mediante micro-lavorazione, che fornisce maggiore semplicità nel processo di fabbricazione, nonché una maggiore flessibilità e versatilità nel layout del dispositivo, superando alcuni dei limiti di PDMS25. È stato inoltre progettato un modo per introdurre un costrutto cutaneo semplificato attraverso un flusso parallelo controllato con pompe a siringa. Il flusso parallelo consente di perfusare due fluidi con viscosità molto diverse (un tampone e un pre-gel di fibrina in questo caso) attraverso un canale senza mescolarsi tra loro. Come prova di concetto, nel dispositivo è stato introdotto un costrutto dermo-epidermico contenente fibroblasti incorporati in una matrice di fibrina che imita il derma, in cima al quale è stato caricato un monostrato di cheratinociti per emulare l'epidermide indifferenziata. L'altezza del compartimento dermico può essere modulata modificando le portate. La principale novità di questo lavoro, rispetto ai modelli precedentemente descritti22,26,27,28,29,è lo sviluppo di un costrutto 3D all'interno di una microcamera per mezzo della microfluidica. Sebbene questo articolo presenti una pelle indifferenziata semplificata, l'obiettivo a lungo termine è quello di generare e caratterizzare un costrutto cutaneo completamente differenziato per dimostrare la sua vitalità e funzionalità a scopo di test farmacologici e cosmetici.
Protocollo
1. Progettazione del chip e parametri di microlavorazione
- Progettare gli strati di chip microfluidici con il software di progettazione open source FreeCAD; fare riferimento alla Tabella 1 per le dimensioni dei canali. Includere quattro fori di diametro di 2,54 mm nel progetto per utilizzare un allineatore personalizzato per una corretta sovrapposizione dello strato.
| Lunghezza (μm) | Larghezza (μm) | |
| Camera inferiore | 28,400 | 800 |
| Camera superiore | 31,000 | 800 |
Tabella 1: Dimensioni dei canali superiore e inferiore del dispositivo.
- Tagliare fogli di vinile trasparente adesivi di 95 μm di spessore in quadrati di 30 cm x 30 cm per adattarli correttamente al plotter.
- Utilizzare il software Brother CanvasWorkspace per creare uno spazio di lavoro di 30 cm x 30 cm e riempirlo con i modelli progettati per i diversi livelli del chip (Figura 1A). Archivialo in un file .svg.
- Tagliare i fogli di vinile da 30 cm x 30 cm con il plotter di bordo (Figura 1B-D).
- Attaccare il foglio di vinile a un tappetino adesivo a bassa aderenza ed eliminare tutte le bolle d'aria, se necessario.
- Caricare il file .svg sul plotter e impostare i parametri di taglio: lama di taglio: livello 3; pressione di taglio: livello 0; velocità di taglio: livello 1. Posizionare il tappetino adesivo con il vinile nel plotter e avviare il processo di taglio.
- Tagliare il modello del canale superiore su vinile a nastro biadesivo spesso 12 μm seguendo i passaggi precedenti.

Figura 1: Progettazione del chip e processo di microlavorazione. (A) Layout del software che mostra lo spazio di lavoro riempito con i modelli superiore e inferiore progettati per il chip. (B) Plotter di spigoli durante il processo di taglio; vengono mostrati lama da taglio, foglio intero in vinile e tappetino adesivo. (C) Vinile a motivi geometrici staccato dal foglio tagliato. (D) Campione di uno strato di vinile adesivo modellato con il design del canale superiore. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Fabbricazione dello strato PDMS
- Mescolare il PDMS e l'agente polimerizzante in un rapporto di 10:1 (v/v) e porre la miscela sotto vuoto per 15 minuti per rimuovere le bolle d'aria. Versare 55 ml del composto in una coltura quadrata di 55 cm2 per ottenere uno strato di 2 mm di spessore. Rimuovere le bolle con un ago.
- Polimerizzare la miscela (fase 2.1) in forno per 1 ora a 80 °C. Sformare il PDMS e tagliarlo in rettangoli con le dimensioni del chip. Fai dei fori per il tubo con un ago per siringa da 18 G.
3. Assemblaggio del chip
NOTA: per una migliore comprensione, vedere la Figura 2.
- Assemblare l'intero dispositivo utilizzando un allineatore per regolare correttamente canali, prese e prese. Accumulare quattro strati di vinile (con il corrispondente micropattern inferiore) per assemblare il canale inferiore, mantenendo il nastro di copertura dello strato inferiore per evitare di attaccarsi all'allineatore.
- Tagliare e posizionare la membrana porosa in policarbonato (PC) sopra il canale inferiore per separarla da quella superiore. Fare attenzione a non coprire le insenature del canale inferiore.
- Aggiungi dieci strati di vinile con il design della camera superiore. Attaccare uno strato di vinile a nastro biadesivo con il motivo del canale superiore sulla parte superiore. Rimuovere il chip dall'allineatore e incollarlo sulla diapositiva di vetro.
- Posizionare un foglio PDMS di 2 mm di spessore sopra lo strato di vinile a nastro biadesivo per fornire un ancoraggio appropriato per il tubo ed evitare perdite. Lasciare un peso sulla parte superiore del chip durante la notte per garantire che il chip sia completamente impermeabile. Sterilizzare il chip lavando il 70% v/v di etanolo per 5 minuti, quindi lavare con H2O distillato.
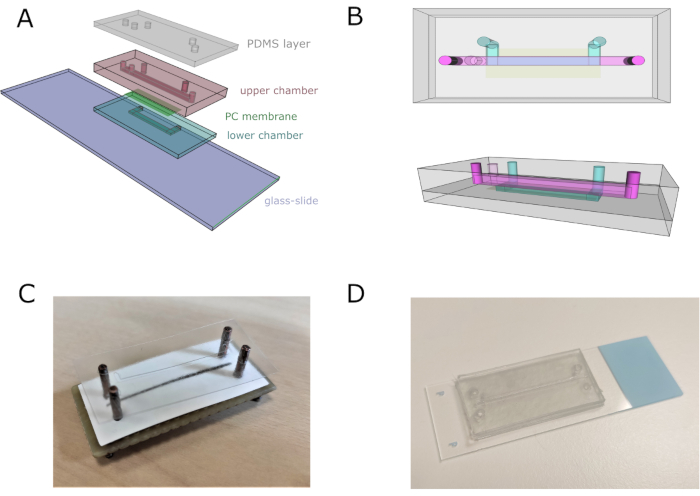
Figura 2: Assemblaggio di chip microfluidici. (A) Schema generale dell'insieme del dispositivo. Le camere inferiore e superiore sono composte rispettivamente da quattro e undici fogli di vinile sovrapposti. (B) Viste superiori e laterali del chip microfluidico. I canali superiore e inferiore sono rappresentati rispettivamente in rosa e blu. (C) Immagine dell'assemblaggio del chip utilizzando un allineatore su misura. (D) Immagine del chip dopo l'assemblaggio completo. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Connessioni della pompa
NOTA: la rappresentazione grafica delle connessioni delle pompe è illustrata nella Figura 3.
- Collegare la pompa 1 all'ingresso della camera superiore 1 (UCi1).
- Collegare la pompa 2 all'ingresso 2 della camera superiore (UCi2).
- Collegare la pompa 3 all'ingresso della camera inferiore (LCi).
- Collegare l'uscita della camera superiore (UCo) e l'uscita della camera inferiore (LCo) a un tubo di scarico.
- Collegare le siringhe a ciascun ingresso utilizzando tubi in politetrafluoroetilene (PTFE) e connettori in acciaio inossidabile da 18 G.
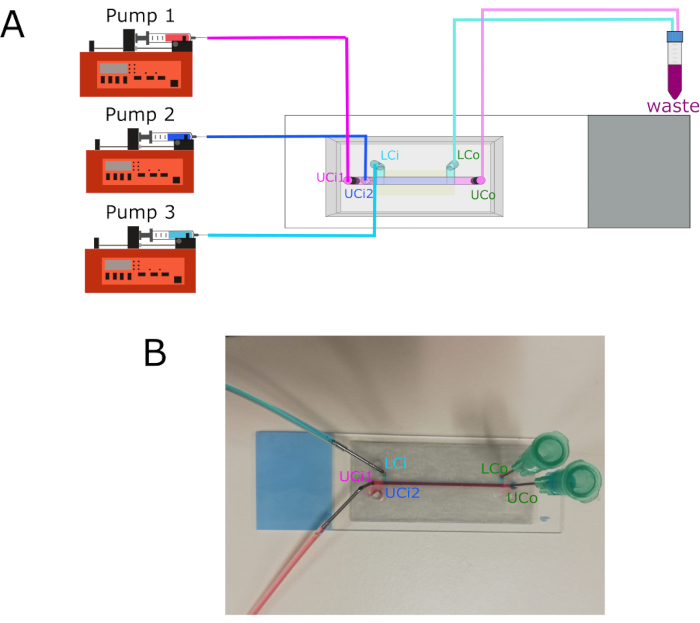
Figura 3: Connessioni delle pompe e posizione delle prese/uscite. (A) Diagramma che mostra il collegamento delle tre diverse pompe alle rispettive prese. Le prese si collegano a un contenitore per i rifiuti. (B) Immagine del chip con prese e uscite etichettate. Abbreviazioni: LCi = ingresso camera inferiore; LCo = uscita camera inferiore; UCi1 = ingresso camera superiore 1; UCi2 = ingresso camera superiore 2; UCo = uscita camera superiore. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Coltura cellulare
NOTA: La linea cellulare HaCaT ha un'origine commerciale. I fibroblasti primari umani provengono da donatori sani e sono stati ottenuti dalla raccolta di campioni biologici di origine umana registrati nel "Registro Nacional de Biobancos para Investigación Biomédica del Instituto de Salud Carlos III".
- Lavora in una cappa di coltura cellulare, precedentemente sterilizzata sotto luce ultravioletta e pulita con etanolo.
- Scongelare le cellule H2B-GFP-HaCaT (cheratinociti cutanei immortalizzati umani, hKCs) e i fibroblasti primari GFP-umani (hFB) a 37 °C, aggiungere 2 mL di terreno di coltura e centrifugare per 7 minuti a 20 °C a 250 × g.
NOTA: Le cellule H2B-GFP-HaCaT sono cheratinociti immortalizzati umani modificati per esprimere una proteina fluorescente ibrida di istone H2B-verde (GFP), fornendo ai loro nuclei una fluorescenza verde. I GFP-hFB sono fibroblasti primari umani trasformati con il vettore pLZRS-IRES-EGFP per esprimere la fluorescenza verde citoplasmatica. Queste cellule sono state modificate seguendo i protocolli30,31 precedentemente pubblicati - Coltura sia di hKCs che di hFB in 1x DMEM integrato con il 10% di siero bovino fetale e l'1% di soluzione antibiotica/antimicotica. Preriscaldarsi del terreno di coltura a 37 °C prima dell'uso.
- Staccare le cellule lavandole con 1x soluzione salina tamponata con fosfato (PBS), aggiungendo 2 ml di tripsina/acido tetraacetico etilendiammina (EDTA) e incubandole per 10 minuti a 37 °C.
- Inattivare la tripsina aggiungendo 4 ml di terreno di coltura. Risuspendare le cellule e trasferirle in un tubo da 15 ml. Rimuovere 10 μL per contare le cellule su una camera Neubauer e determinare la concentrazione appropriata.
- Centrifugare il tubo da 15 mL per 7 min a 20 °C a 250 × g. Rimuovere il surnatante e risuscivare i pellet alla concentrazione desiderata: hFB a 50.000 cellule/mL e hKCs a 5,× 106 celle/mL.
6. Preparazione pre-gel di fibrinogeno
- Attivare la trombina aggiungendo 1 mL di CaCl2 (1% p/v in NaCl) al flaconcino.
- Aggiungere i seguenti componenti per ottenere 1 mL di idrogel di fibrina ad una concentrazione finale di fibrina di 3,5 mg/mL: 59 μL di trombina attivata (10 unità NIH/mL), 59 μL di acido tranexamico (Tabella dei materiali,100 mg/mL), 764 μL di terreno di coltura contenente 50.000 hFB/mL, 118 μL di fibrinogeno (20 mg/mL in NaCl (0,9% p/v)).
NOTA: Il fibrinogeno deve essere aggiunto all'ultimo momento.
7. Protocollo a flusso parallelo
- Pompa 1x PBS con pompa 3 attraverso l'LCi a 50 μL/min durante l'intero processo.
- Pompa fluido sacrificale (1x PBS) con pompa 2 attraverso l'UCi2 a 100 μL/min.
- Caricare la siringa con il pre-gel, posizionarla rapidamente nella pompa 1 ed eseguirla a 200 μL/min (Figura 4A).
- Arrestare le pompe 1 e 2 una volta che il pre-gel esce dall'UCo.
- Lasciare il chip senza rimuovere il tubo a 37 °C per almeno 10 minuti per consentire la gelificazione.
- Mezzo di coltura della pompa a 50 μL/h con pompa da 3 a UCi2 durante la notte.
- Blocca UCi1 con un tappo.
8. Semina monostrato hKCs
- Controllare al microscopio che gli hFB siano distribuiti 24 ore dopo la generazione del compartimento dermico.
- Introdurre gli hKC con pompa da 2 a UCi2 a 5 ×·106 celle/mL a 40 μL/min per 1 min (Figura 4B).
- Lasciare il chip durante la notte a 37 °C in un incubatore saturo di umidità per il fissaggio della cella.
- Pompare il terreno di coltura fresco con pompa 3 solo attraverso LCi a 50 μL/min (Figura 4C).
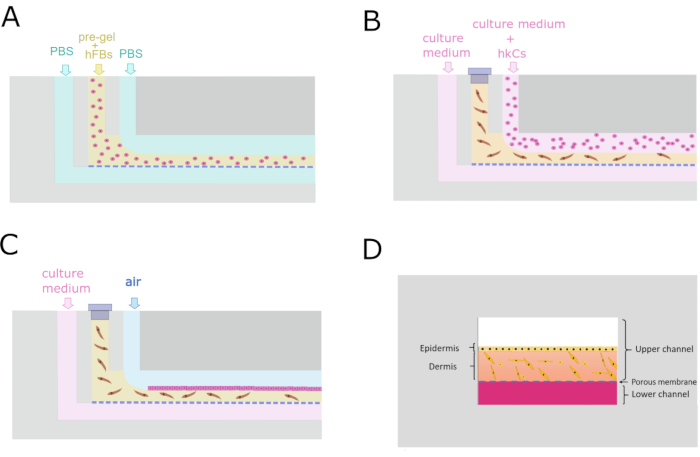
Figura 4: Protocollo microfluidico per la generazione del costrutto dermo-epidermico. (A) Sezione trasversale che mostra il processo di flusso parallelo per generare il compartimento dermico. (B) Semina monostrato di cheratinociti 24 ore dopo la generazione del compartimento dermico. (C) Manutenzione della coltura cellulare all'interno del dispositivo microfluidico. (D) Ricreazione in sezione trasversale della pelle all'interno del chip. Fare clic qui per visualizzare una versione più grande di questa figura.
9. Saggio di vitalità cellulare
NOTA: il kit Live/Dead colora le cellule con fluorescenza verde o rossa a seconda del loro stato vivo o morto. Per una corretta differenziazione della redditività, in questa fase devono essere utilizzati hKC e hFB non fluorescenti. Tutte le fasi della procedura vengono eseguite tramite UCi2 con pompa 2.
- Lavare il canale superiore con 1x PBS per 5 min a 50 μL/min per rimuovere il terreno di coltura.
- Pompare aria per rimuovere il PBS 1x a 50 μL/min.
- Preparare la soluzione calcein AM/Ethidium homodimer-1 Kit (Live/Dead) seguendo le istruzioni del produttore.
- Pompare la soluzione Live/Dead a 50 μL/min per 2 min.
- Incubare 30 min a 37 °C al buio.
- Lavare il canale superiore pompando 1x PBS a 50 μL/min per 2 min per rimuovere il reagente rimanente.
- Osservare il campione al microscopio confocale. Utilizzare una lunghezza d'onda di eccitazione di 495/590 nm e una lunghezza d'onda di emissione di 519/617 nm rispettivamente per le cellule vive e morte.
Risultati
Il chip progettato è composto da due camere fluidiche separate da una membrana PC di 5 μm di dimensioni dei pori che consente la crescita della cellula consentendo il passaggio di molecole che promuovono la crescita dalla camera inferiore. La camera superiore contiene il costrutto tissutale, in questo caso, un monostrato di hKCs su un idrogel di fibrina contenente hFB.
L'altezza dei canali è determinata dal numero di fogli adesivi aggiunti a ciascun canale. La camera inferiore è composta d...
Discussione
La motivazione per sviluppare questo metodo è stato il desiderio di modellare le malattie della pelle e studiare gli effetti di terapie nuove e innovative in una piattaforma ad alto rendimento. Ad oggi, questo laboratorio produce questi equivalenti dermo-epidermici colando - manualmente o con l'aiuto della tecnologia di bioprinting 3D - il gel di fibrina con fibroblasti in una piastra di inserto per colture cellulari e seminando i cheratinociti sopra di esso. Una volta che i cheratinociti raggiungono la confluenza, la c...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Ringraziamo sinceramente il Dr. Javier Rodríguez, la Dott.ssa María Luisa López, Carlos Matellán e Juan Francisco Rodríguez per suggerimenti, discussioni e/o dati preliminari molto utili. Ringraziamo anche i contributi di Sergio Férnandez, Pedro Herreros e Lara Stolzenburg a questo progetto. Un ringraziamento speciale va alla dottoressa Marta García per gli hFB e gli hCC con etichetta GFP. Infine, riconosciamo l'eccellente assistenza tecnica di Guillermo Vizcaíno e Angélica Corral. Questo lavoro è stato sostenuto dal "Programa de Actividades de I+D entre Grupos de Investigación de la Comunidad de Madrid", Progetto S2018/BAA-4480, Biopieltec-CM. Questo lavoro è stato sostenuto anche dal "Programa de excelencia", Progetto EPUC3M03, CAM. CONSEJERÍA DE EDUCACIÓN E INVESTIGACIÓN.
Materiali
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
Riferimenti
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387 (2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016)
- . Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015 Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018)
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -. M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526 (2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43 (2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471 (2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898 (2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006 (2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon