Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikromakine Mikroakışkan Platformda Basitleştirilmiş Üç Boyutlu Çip Üzerinde Cilt Modeli Üretimi
Bu Makalede
Özet
Burada, mikromakine mikroakışkan bir platform kullanarak üç boyutlu basitleştirilmiş ve farklılaşmamış bir cilt modeli oluşturmak için bir protokol sunuyoruz. Paralel akış yaklaşımı, hepsi şırınna pompaları tarafından kontrol edilen, üstteki epitel hücrelerinin tohumlaması için bir dermal bölmenin yerinde birikmesini sağlar.
Özet
Bu çalışma, karmaşık çok katmanlı dokular üretme potansiyeline sahip yeni, uygun maliyetli ve güvenilir bir mikroakışkan platform sunar. Bir kavram kanıtı olarak, dermal (stromal) ve epidermal (epitel) bölme içeren basitleştirilmiş ve farklılaşmamış bir insan derisi modellenmiştir. Bunu başarmak için, pahalı ve özel ekipmanların kullanımı veya küçük hidrofobik moleküllerin ve proteinlerin emilimi gibi biyomedikal uygulamalar için polidimetilsiloksan (PDMS) bazlı mikroakışkan cihazlarda bulunan bazı dezavantajların üstesinden gelen, iki lüse bölünmüş çok yönlü ve sağlam, vinil tabanlı bir cihaz geliştirilmiştir. Ayrıca, paralel akışa dayalı, hem dermal hem de epidermal bölmelerin yerinde birikmesini sağlayan yeni bir yöntem geliştirilmiştir. Cilt yapısı, insan birincil fibroblastlarını içeren bir fibrin matrisi ve daha sonra dinamik kültür koşullarında sürdürülen, üzerine tohumlanmış ölümsüzleştirilmiş keratinositlerden oluşan bir monolayerden oluşur. Bu yeni mikroakışkan platform, insan cilt hastalıklarını modelleme ve diğer karmaşık dokuları üretme yöntemini tahmin etme imkanını açar.
Giriş
Son zamanlarda, kozmetik ve farmasötik ürünlerin toksisitesinin analizi için in vitro insan derisi modellerinin geliştirilmesi ve üretimine yönelik ilerlemeler yapılmıştır1. İlaç ve cilt bakım endüstrilerindeki araştırmacılar, ürünlerini test etmek için en yaygın olan fareler olan hayvanları kullanıyorlar2,3,4,5. Bununla birlikte, ürünleri hayvanlar üzerinde test etmek, insanlarda sıklıkla ilaç yetmezliğine veya olumsuz etkilere ve dolayısıyla ekonomik kayıplara yol açan insanlardaki yanıtın her zaman tahmin edici değildir5,6. İngiltere, 1998 yılında kozmetik testler için hayvanların kullanılmasını yasaklayan ilk ülke oldu. Daha sonra, 2013 yılında AB, hayvanlarda kozmetiklerin testini ve tahsisini yasakladı (1223/2009 sayılı AB Kozmetik Yönetmeliği)7.
Bu yasak, ABD'deki 'İnsani Kozmetik Yasası' gibi diğer ülkeler tarafından da değerlendiriliyor8. Etik kaygılara ek olarak, hayvan ve insan derisi arasındaki anatomik farklılıklar, hayvan testini zaman alıcı, pahalı ve genellikle etkisiz hale getirir. Ayrıca, küresel in vitro toksikoloji test pazarı büyüklüğünün 2025 yılına kadar 26,98 milyar ABD dolarına ulaşması beklenmektedir9. Bu nedenlerden dolayı, biyomühendis insan derisi modelleri gibi kozmetik ve ilaçların güvenliği ve toksik etkileri için hayvan kullanmadan test edilmesini sağlayan in vitro çalışmalar için yeni yöntemler ve alternatifler geliştirmeye ihtiyaç vardır.
Ticari olarak mevcut iki farklı tür vardır, in vitro, insan cilt modelleri. İlk tip, farklı malzemelere tohumlanan birden fazla farklılaşan keratinosit katmanı içeren katmanlı epidermal eşdeğerlerden oluşur. Bazıları Ekonomik İşbirliği ve Kalkınma Örgütü (OECD) tarafından onaylanmış ve EpiDerm veya SkinEthic10 , 11,12gibi cilt korozyonu ve tahriş testi için (Avrupa Alternatif Yöntemleri Doğrulama Merkezi (EKVAM) tarafından onaylanmıştır. İkinci tip, T-Skin ve EpiDerm-FT gibi fibroblastlar içeren üç boyutlu (3D) bir iskelede tohumlanmış farklılaşan insan keratinositleri tabakasına sahip tam cilt eşdeğerleridir. Bununla birlikte, bu modeller statik koşullar altında kültürlenir, bu da onları insan fizyolojik koşullarını doğru bir şekilde temsil edemez hale getirir.
Son ilgi dinamik perfüzyon 13 ,14 , 15 , 16 , 17,18,19 ile hücre kültürü kesici uç(CCI)formatlarında in vitro 3Dcilt modelleri üretmeye odaklanmıştır. Ancak bu sistemler alandaki klasik tanımlarına göre mikroakışkan cilt-on-chips olarak stricto sensu olarak kabul edilemez. Ingber'in çip üzerindeki organlar için tanımı, organın mikroakışkan kanalların içine yerleştirilmesi gerektiğini belirtir, bu da sadece birkaç cihazın20,21' i yerine getirmesi gereken bir durumdur. Cilt-on-chips şimdiye kadar tek hücreli katmanlar ve / veya dermal hücre katmanları gözenekli bir membran ile ayrılmış olarak çoğunlukla basit epitel modellenmiştir22,23. Mikroakışkan sistemlerde deri modellemede bazı gelişmeler olmasına rağmen16,24, şu anda Ingber'in tanımına uyan, çok katmanlı bir cilt in situ üretebilen ve hem epitel hem de stromal bileşenleri içeren bir çip üzerinde organ sistemini gösteren bir literatür yoktur.
Bu çalışmada çip üzerinde cilt uygulamaları için yeni, uygun maliyetli, sağlam, vinil bazlı mikroakışkan bir platform sunulmaktadır. Bu platform, imalat sürecinde daha basitlik sağlayan mikro işlemenin yanı sıra cihazın düzeninde daha fazla esneklik ve çok yönlülük sağlayarak PDMS25'inbazı sınırlamalarını aşarak üretildi. Şırındi pompaları ile kontrol edilen paralel bir akış yoluyla basitleştirilmiş bir cilt yapısı sunmanın bir yolu da tasarlanmıştır. Paralel akış, çok farklı viskozitelere sahip iki sıvının (bu durumda bir tampon ve fibrin pre-jel) bir kanal aracılığıyla birbirine karışmadan perfüzyona maruz kalmasını sağlar. Bir kavram kanıtı olarak, dermisi taklit eden bir fibrin matrisine gömülü fibroblastlar içeren bir dermo-epidermal yapı, farklılaşmamış epidermisi taklit etmek için bir keratinosit monolayerinin yüklendiği cihaza tanıtıldı. Dermal bölme yüksekliği, akış hızları değiştirilerek modüle edilebilir. Bu çalışmanın ana yeniliği, daha önce açıklanan22 , 26,27,28,29modellerine kıyasla, mikrokışmacalar yoluyla bir mikro şarampol içinde 3D bir yapının geliştirilmesidir. Bu makale basitleştirilmiş farklılaşmamış bir cilt sunsa da, uzun vadeli amaç, ilaç ve kozmetik test amaçları için canlılığını ve işlevselliğini göstermek için tamamen farklılaşmış bir cilt yapısı oluşturmak ve karakterize etmektir.
Protokol
1. Çip tasarımı ve mikromakine parametreleri
- FreeCAD açık kaynaklı tasarım yazılımı ile mikroakışkan çip katmanlarını tasarlayın; kanalların boyutları için Tablo 1'e bakın. Doğru katman üstpozisyörü için özel yapım bir hizalayıcı kullanmak için tasarıma dört adet 2,54 mm çapında delik ekleyin.
| Uzunluk (μm) | Genişlik (μm) | |
| Alt bölme | 28,400 | 800 |
| Üst bölme | 31,000 | 800 |
Tablo 1: Cihazın üst ve alt kanallarının boyutları.
- Çiziciye düzgün bir şekilde sığacak şekilde 95 μm kalınlığında, yapışkan, şeffaf vinil levhaları 30 cm x 30 cm kareler halinde kesin.
- 30 cm x 30 cm çalışma alanı oluşturmak için Brother CanvasWorkspace yazılımını kullanın ve çipin farklı katmanları için tasarlanmış desenlerle doldurun (Şekil 1A). .svg bir dosyada saklayın.
- 30 cm x 30 cm vinil levhaları kenar çizici ile kesin (Şekil 1B-D).
- Vinil levhayı düşük yapışkanlı bir paspasa yapıştırın ve gerekirse tüm hava kabarcıklarını ortadan kaldırın.
- .svg dosyayı çiziciye yükleyin ve kesme parametrelerini ayarlayın: kesme bıçağı: seviye 3; kesme basıncı: seviye 0; kesme hızı: seviye 1. Yapışkan paspası vinil ile çiziciye yerleştirin ve kesme işlemine başlayın.
- Önceki adımları izleyerek 12 μm kalınlığında çift taraflı bant vinil üzerinde üst kanal desenini kesin.

Şekil 1: Çip tasarımı ve mikromakine işlemi. (A) Çip için tasarlanmış hem üst hem de alt desenlerle dolu çalışma alanını gösteren yazılım düzeni. (B) Kesme işlemi sırasında kenar çizici; kesme bıçağı, tüm vinil levha ve yapışkan paspas gösterilmiştir. (C) Desenli vinil kesim tabakasından ayrılır. (D) Üst kanal tasarımı ile desenli yapışkan vinil tabaka örneği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. PDMS katman imalatı
- PDMS ve kürleme maddesini 10:1 (v/v) oranında karıştırın ve hava kabarcıklarını çıkarmak için karışımı 15 dakika boyunca vakumun altına yerleştirin. 2 mm kalınlığında bir tabaka elde etmek için karışımın 55 mL'lik kısmını55 cm 2 kare kültür kabına dökün. Kabarcıkları bir iğne ile çıkarın.
- Karışımı (adım 2.1) 80 ° C'de 1 saat boyunca bir fırında tedavi edin. PDMS'yi çözün ve talaş boyutlarıyla dikdörtgenler halinde kesin. 18 G şırınga iğnesi ile boru için delikler açın.
3. Talaş montajı
NOT: Daha iyi anlamak için bkz.
- Kanalları, girişleri ve çıkışları düzgün bir şekilde ayarlamak için tüm cihazı bir hizalayıcı kullanarak monte edin. Alt kanalı monte etmek için dört vinil katmanı (ilgili alt mikropattern ile birlikte) bir araya toplayın, hizalayıcıya yapışmayı önlemek için alt katmanın kapak bandını tutun.
- Polikarbonat (PC) gözenekli zarı üst kanaldan ayırmak için alt kanalın üzerine kesin ve yerleştirin. Alt kanalın girişlerini örtmemeye dikkat edin.
- Üst hazne tasarımı ile on vinil katman ekleyin. Üst kanal deseni üstte olacak şekilde çift taraflı bant vinil tabakası yapıştırın. Çipi hizalayıcıdan çıkarın ve cam kaydırağa yapıştırın.
- Boru için uygun ankraj sağlamak ve sızıntıyı önlemek için çift taraflı bant vinil tabakasının üzerine 2 mm kalınlığında bir PDMS levha yerleştirin. Talaşın tamamen su geçirmez olduğundan emin olmak için bir gecede talaşın üzerine bir ağırlık bırakın. 5 dakika boyunca% 70 v / v etanol yıkayarak çipi sterilize edin ve ardından damıtılmış H2O ile yıkayın.
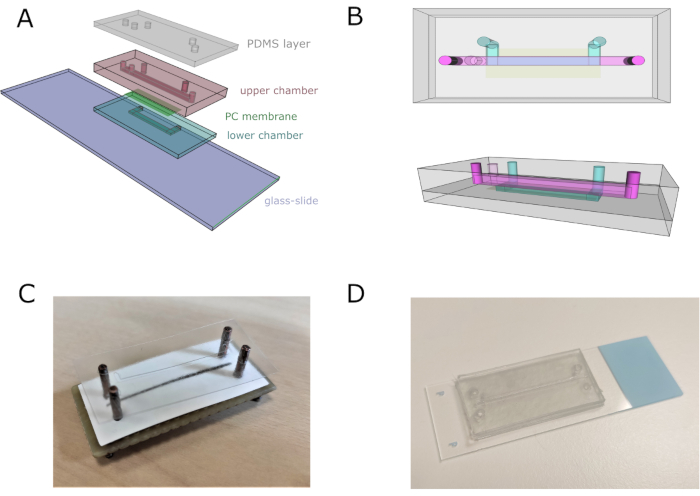
Şekil 2: Mikroakışkan talaş montajı. (A) Cihazın montajının genel şeması. Alt ve üst odalar sırasıyla dört ve on bir üst üste bindirilmiş vinil levhalardan oluşur. (B) Mikroakışkan çipin üst ve yanal görünümleri. Üst ve alt kanallar sırasıyla pembe ve mavi ile temsil edilir. (C) Özel yapım bir hizalayıcı kullanarak talaş tertibatının görüntüsü. (D) Komple montajdan sonra talaş görüntüsü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Pompa bağlantıları
NOT: Pompa bağlantılarının grafiksel gösterimi Şekil 3'tegösterilmiştir.
- Pompa 1'i Üst Hazne Girişi 1'e (UCi1) bağlayın.
- Pompa 2'yi Üst Hazne Girişi 2'ye (UCi2) bağlayın.
- Pompa 3'i Alt Hazne Girişine (LCi) bağlayın.
- Üst Oda Çıkışını (UCo) ve Alt Oda Çıkışını (LCo) bir atık tüpüne bağlayın.
- Şırıngları politetrafloroetilen (PTFE) tüpleri ve 18 G paslanmaz çelik konektörler kullanarak her girişe bağlayın.
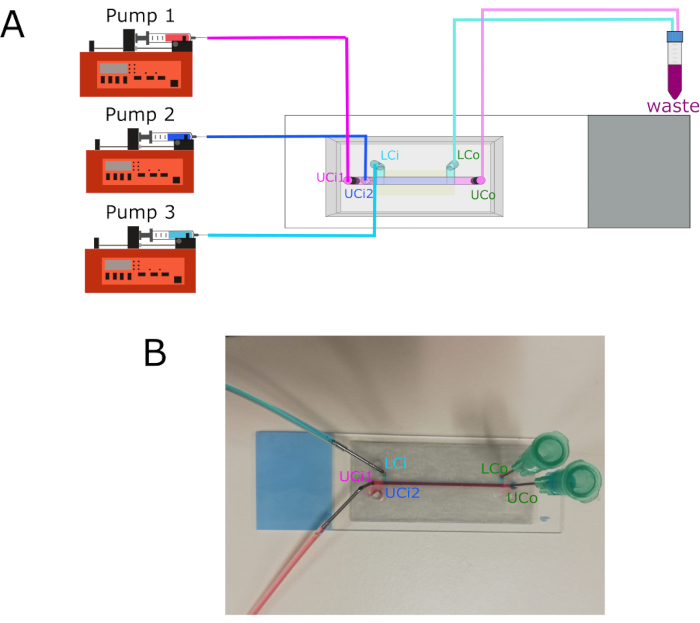
Şekil 3: Pompa bağlantıları ve giriş/çıkış yeri. (A) Üç farklı pompanın ilgili girişlerine bağlantısını gösteren diyagram. Çıkışlar bir atık konteynerine bağlanır. (B) Etiketli giriş ve çıkışlı talaş görüntüsü. Kısaltmalar: LCi = alt oda girişi; LCo = alt oda prizi; UCi1 = üst oda girişi 1; UCi2 = üst oda girişi 2; UCo = üst bölme çıkışı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Hücre kültürü
NOT: HaCaT hücre hattının ticari bir kökeni vardır. İnsan birincil fibroblastları sağlıklı donörlerden gelir ve "Registro Nacional de Biobancos para Investigación Biomédica del Instituto de Salud Carlos III" olarak kayıtlı insan kökenli biyolojik örneklerin toplanmasından elde edilmiştir.
- Daha önce ultraviyole ışık altında sterilize edilmiş ve etanol ile silinmiş bir hücre kültürü kaputunda çalışın.
- 37 °C'de H2B-GFP-HaCaT hücrelerini (insan ölümsüzleştirilmiş cilt keratinositleri, hKC'ler) ve GFP-insan birincil fibroblastlarını (hFB'ler) çözün, 2 mL kültür ortamı ekleyin ve 250 × g'da20 °C'de 7 dakika santrifüj ekleyin.
NOT: H2B-GFP-HaCaT hücreleri, çekirdeklerine yeşil floresan sağlayan hibrit bir histonE H2B-yeşil floresan proteinini (GFP) ifade etmek için modifiye edilmiş insan ölümsüzleştirilmiş keratinositlerdir. GFP-hFB'ler sitoplazmik yeşil floresan ifade etmek için pLZRS-IRES-EGFP vektörü ile dönüştürülmüş insan primer fibroblastlarıdır. Bu hücreler daha önce yayımlanmışprotokoller 30,31'den sonra değiştirilmiştir - 1x DMEM'de hem hKC'leri hem de hFB'leri %10 fetal sığır serumu ve %1 antibiyotik/antimycotic çözelti ile destekleyerek kültürlendirin. Kültür ortamını kullanmadan önce 37 °C'de önceden ısıtın.
- Hücreleri 1x fosfat tamponlu salin (PBS) ile yıkayarak ayırın, 2 mL tripsin/etilenediamin tetraasetik asit (EDTA) ekleyip 37 °C'de 10 dakika kuluçkaya yatırın.
- 4 mL kültür ortamı ekleyerek trypsin inaktive. Hücreleri yeniden biriktirin ve 15 mL'lik bir tüpe aktarın. Neubauer odasındaki hücreleri saymak ve uygun konsantrasyonu belirlemek için 10 μL'yi çıkarın.
- 15 mL'lik tüpü 250 × g'da 20 °C'de 7 dakika santrifüj edin. Üstnatant çıkarın ve peletleri istediğiniz konsantrasyonda yeniden biriktirin: 50.000 hücre/mL'de hFC'ler ve 5·× 106 hücre/mL'de hKC'ler.
6. Fibrinojen jel öncesi hazırlama
- Şişeye 1mL CaCl 2 (NaCl'de%1 w / v) ekleyerek trombini etkinleştirin.
- 3,5 mg/mL'lik son fibrin konsantrasyonunda 1 mL fibrin hidrojel elde etmek için aşağıdaki bileşenleri ekleyin: 59 μL aktif trombin (10 NIH ünitesi/) mL), 59 μL tranexamik asit(Malzeme Tablosu, 100 mg/mL), 50.000 hFB/mL içeren 764 μL kültür ortamı, 118 μL fibrinojen (NaCl'de 20 mg/mL (%0,9 w/v)).
NOT: Fibrinojen son anda eklenmelidir.
7. Paralel akış protokolü
- Tüm işlem sırasında 50 μL/dak'da LCi'den 3 pompa ile 1x PBS pompalayın.
- 100 μL/dak'ta UCi2'den 2 pompa ile kurban sıvısı (1x PBS) pompalanın.
- Şırınnayı ön jel ile yükleyin, pompa 1'e hızla yerleştirin ve 200 μL / dak'ta çalıştırın (Şekil 4A).
- Ön jel UCo'dan çıktıktan sonra 1 ve 2 numaralı pompaları durdurun.
- Jelleşmeyi sağlamak için boruyu 37 °C'de çıkarmadan en az 10 dakika boyunca talaşı bırakın.
- Pompa kültürü ortamı 50 μL/s'de, pompa 3 ile UCi2 arasında bir gecede.
- UCi1'i bir kapakla engelleyin.
8. hKCs monolayer tohumlama
- Mikroskop altında hFB'lerin dermal bölmenin üretilmesinden sonra 24 saat yayıldığını kontrol edin.
- HCC'leri 5 ×·106 hücre/mL'de 1 dakika boyunca 2'den UCi2'ye pompa ile tanıtın (Şekil 4B).
- Çipi hücre ataşmanı için neme doymuş bir inkübatörde 37 °C'de gece boyunca bırakın.
- Pompa ile taze kültür ortamı pompa 3 sadece LCi üzerinden 50 μL / dk(Şekil 4C).
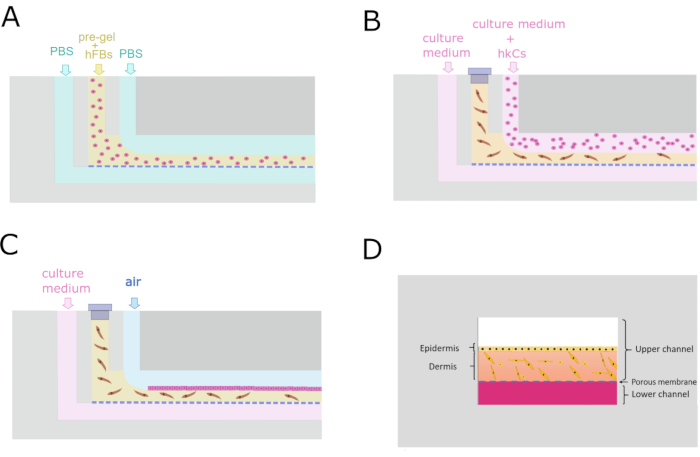
Şekil 4: Dermo-epidermal yapının üretimi için mikroakışkan protokol. (A) Dermal bölmeyi oluşturmak için paralel akış işlemini gösteren enine kesit. (B) Keratinosit monolayer tohumlama dermal bölme üretimi sonrası 24 saat. (C) Mikroakışkan cihazın içinde hücre kültürü bakımı. (D) Çipin içindeki cildin kesitsel rekreasyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
9. Hücre canlılığı tahlili
NOT: Live/Dead kiti, canlı veya ölü durumlarına bağlı olarak hücreleri yeşil veya kırmızı floresan ile lekeler. Uygun canlılık farklılaşması için, bu adımda floresan olmayan hCC'ler ve hFB'ler kullanılmalıdır. Prosedürdeki tüm adımlar pompa 2 ile UCi2 üzerinden gerçekleştirilir.
- Kültür ortamını kaldırmak için üst kanalı 1x PBS ile 50 μL/ dak'ta 5 dakika yıkayın.
- 1x PBS'yi 50 μL/dak'ta çıkarmak için pompa havası.
- Üreticinin talimatlarına uyarak Calcein AM/Ethidium homodimer-1 Kit (Live/Dead) solüsyonunu hazırlayın.
- 2 dakika boyunca 50 μL/dak'da Canlı/Ölü çözelti pompala.
- Karanlıkta 37 °C'de 30 dakika kuluçkaya yatır.
- Kalan reaktifleri çıkarmak için 2 dakika boyunca 50 μL/dk'da 1x PBS pompalayarak üst kanalı yıkayın.
- Konfokal mikroskop altında numuneyi gözlemleyin. Canlı ve ölü hücreler için sırasıyla 495/590 nm'lik bir ekscitasyon dalga boyu ve 519/617 nm emisyon dalga boyu kullanın.
Sonuçlar
Tasarlanan çip, büyümeyi teşvik eden moleküllerin alt odadan geçişine izin vererek hücrenin büyümesine izin veren 5 μm gözenek boyutunda bir PC membranı ile ayrılmış iki akışkan odadan oluşur. Üst oda doku yapısı tutar, bu durumda, hBC'ler içeren bir fibrin hidrojel üzerinde bir hKC monolayer.
Kanalların yüksekliği, her kanala eklenen yapışkan levha sayısına göre belirlenir. Alt bölme 4 katmandan (380 μm) ve 10 tek taraflı bant katmanından üstten ve çift t...
Tartışmalar
Bu yöntemi geliştirme motivasyon, cilt hastalıklarını modelleme ve yeni ve yenilikçi tedavilerin etkilerini yüksek verimli bir platformda inceleme arzusuydu. Bugüne kadar, bu laboratuvar bu dermo-epidermal eşdeğerleri manuel olarak veya 3D biyobaskı teknolojisi-fibroblastlı fibrin jeli yardımıyla bir hücre kültürü ekleme plakasına dökerek ve üzerine keratinositleri tohumlayarak üretmektedir. Keratinositler birleştiğinde, 3D kültürü, keratinosit farklılaşmasına neden olan, tabakalı bir epide...
Açıklamalar
Yazarlar rakip finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Dr. Javier Rodríguez, Dr. María Luisa López, Carlos Matellán ve Juan Francisco Rodríguez'e çok yararlı öneriler, tartışmalar ve/veya ön veriler için içtenlikle teşekkür ederiz. Sergio Férnandez, Pedro Herreros ve Lara Stolzenburg'un bu projeye katkılarına da teşekkür ederiz. GFP etiketli hBC'ler ve hKC'ler için Dr. Marta García'ya özel teşekkürler. Son olarak, Guillermo Vizcaíno ve Angélica Corral'ın mükemmel teknik yardımını biliyoruz. Bu çalışma "Programa de Actividades de I+D entre Grupos de Investigación de la Comunidad de Madrid", Project S2018/BAA-4480, Biopieltec-CM tarafından desteklenmiştir. Bu çalışma ayrıca "Programa de excelencia", Project EPUC3M03, CAM tarafından da desteklendi. CONSEJERÍA DE EDUCACIÓN E INVESTIGACIÓN.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
Referanslar
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387 (2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016)
- . Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015 Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018)
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -. M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526 (2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43 (2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471 (2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898 (2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006 (2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır