Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Génération d’un modèle tridimensionnel simplifié de peau sur puce dans une plate-forme microfluidique micro-usinée
Dans cet article
Résumé
Ici, nous présentons un protocole pour générer un modèle de peau tridimensionnel simplifié et indifférencié à l’aide d’une plate-forme microfluidique micro-usinée. Une approche à flux parallèle permet le dépôt in situ d’un compartiment dermique pour l’ensemencement de cellules épithéliales sur le dessus, le tout contrôlé par des pompes à seringues.
Résumé
Ce travail présente une nouvelle plate-forme microfluidique rentable et fiable avec le potentiel de générer des tissus multicouches complexes. Comme preuve de concept, une peau humaine simplifiée et indifférenciée contenant un compartiment dermique (stromale) et un compartiment épidermique (épithélial) a été modélisée. Pour ce faire, un dispositif polyvalent et robuste à base de vinyle divisé en deux chambres a été développé, surmontant certains des inconvénients présents dans les dispositifs microfluidiques à base de polydiméthylsiloxane (PDMS) pour des applications biomédicales, tels que l’utilisation d’équipements coûteux et spécialisés ou l’absorption de petites molécules et protéines hydrophobes. De plus, une nouvelle méthode basée sur l’écoulement parallèle a été développée, permettant le dépôt in situ des compartiments dermique et épidermique. La construction de la peau se compose d’une matrice de fibrine contenant des fibroblastes primaires humains et d’une monocouche de kératinocytes immortalisés ensemencés sur le dessus, qui est ensuite maintenue dans des conditions de culture dynamique. Cette nouvelle plateforme microfluidique ouvre la possibilité de modéliser les maladies de la peau humaine et d’extrapoler la méthode pour générer d’autres tissus complexes.
Introduction
Récemment, des progrès ont été réalisés dans le développement et la production de modèles de peau humaine in vitro pour l’analyse de la toxicité des produits cosmétiques et pharmaceutiques1. Les chercheurs des industries pharmaceutiques et des soins de la peau ont utilisé des animaux, les souris étant les plus courantes, pour tester leurs produits2,3,4,5. Cependant, tester des produits sur des animaux n’est pas toujours prédictif de la réponse chez l’homme, ce qui conduit fréquemment à une défaillance du médicament ou à des effets indésirables chez l’homme et, parconséquent,à des pertes économiques5,6. Le Royaume-Uni a été le premier pays à interdire l’utilisation d’animaux pour les tests cosmétiques en 1998. Plus tard, en 2013, l’UE a interdit les tests et l’approbation des cosmétiques chez les animaux (Règlement cosmétique de l’UE n° 1223/2009)7.
Cette interdiction est également envisagée par d’autres pays, comme dans le « Humane Cosmetics Act » aux États-Unis8. En plus des préoccupations éthiques, les différences anatomiques entre la peau animale et humaine rendent les tests sur les animaux longs, coûteux et souvent inefficaces. En outre, la taille du marché mondial des tests toxicologiques in vitro devrait atteindre 26,98 milliards USD d’ici 20259. Pour ces raisons, il est nécessaire de développer de nouvelles méthodes et alternatives pour ces études in vitro, telles que les modèles de peau humaine issus de la bioingénierie, qui permettent de tester la sécurité et les effets toxiques des cosmétiques et des médicaments sans l’utilisation d’animaux.
Il existe deux types différents de modèles de peau humaine disponibles dans le commerce, in vitro. Le premier type consiste en des équivalents épidermiques stratifiés contenant plusieurs couches de kératinocytes différenciants qui sont ensemencés sur différents matériaux. Certains d’entre eux ont été approuvés par l’Organisation de coopération et de développement économiques (OCDE) et validés par le Centre européen pour la validation des méthodes alternatives (ECVAM) pour les essais de corrosion et d’irritation de la peau, tels que EpiDerm ou SkinEthic10,11,12. Le deuxième type sont des équivalents à peau entière avec une couche de kératinocytes humains différenciants ensemencés sur un échafaudage tridimensionnel (3D) contenant des fibroblastes, tels que T-Skin et EpiDerm-FT. Cependant, ces modèles sont cultivés dans des conditions statiques, ce qui les rend incapables de représenter avec précision les conditions physiologiques humaines.
L’intérêt récent s’est concentré sur la génération de modèles de peau 3D in vitro dans des formats d’insertion de culture cellulaire (CCI) avec perfusion dynamique13,14,15,16,17,18,19. Cependant, ces systèmes ne peuvent pas être considérés comme stricto sensu comme des skin-on-chips microfluidiques selon leur définition classique dans le domaine. La définition d’Ingber pour les organes sur puce stipule que l’organe doit être placé à l’intérieur des canaux microfluidiques, ce qui est une condition que seuls quelques dispositifs remplissent20,21. Jusqu’à présent, les peaux sur puce ont modélisé principalement des épithéliums simples sous forme de couches unicellulaires et/ou de couches cellulaires dermiques séparées par une membrane poreuse22,23. Bien qu’il y ait eu quelques avancées dans la modélisation de la peau dans les systèmes microfluidiques16,24, il n’existe actuellement aucune littérature montrant un système d’organe sur puce qui correspond à la définition d’Ingber, capable de produire une peau multicouche in situ et comprenant à la fois des composants épithéliaux et stromaux.
Dans ce travail, une nouvelle plate-forme microfluidique à base de vinyle, rentable et robuste pour les applications de peau sur puce est présentée. Cette plate-forme a été produite par micro-usinage, ce qui offre plus de simplicité dans le processus de fabrication, ainsi qu’une flexibilité et une polyvalence accrues dans la disposition de l’appareil, surmontant certaines des limitations de PDMS25. Un moyen d’introduire une construction de peau simplifiée grâce à un débit parallèle contrôlé par des pompes à seringues a également été conçu. L’écoulement parallèle permet à deux fluides de viscosités très différentes (un tampon et un pré-gel de fibrine dans ce cas) d’être perfusés à travers un canal sans se mélanger l’un à l’autre. Comme preuve de concept, une construction dermo-épidermique contenant des fibroblastes incorporés dans une matrice de fibrine imitant le derme a été introduite dans le dispositif, au-dessus de laquelle une monocouche de kératinocytes a été chargée pour émuler l’épiderme indifférencié. La hauteur du compartiment dermique peut être modulée en modifiant les débits. La principale nouveauté de ce travail, par rapport aux modèles précédemment décrits22,26,27,28,29, est le développement d’une construction 3D à l’intérieur d’une microchambre au moyen de la microfluidique. Bien que cet article présente une peau simplifiée indifférenciée, l’objectif à long terme est de générer et de caractériser une construction cutanée entièrement différenciée pour démontrer sa viabilité et sa fonctionnalité à des fins de tests médicamenteux et cosmétiques.
Protocole
1. Paramètres de conception de la puce et de micro-usinage
- Concevoir les couches de puces microfluidiques avec le logiciel de conception open source FreeCAD; reportez-vous au tableau 1 pour connaître les dimensions des canaux. Inclure quatre trous de 2,54 mm de diamètre dans la conception pour utiliser un aligneur sur mesure pour une superposition de couche correcte.
| Longueur (μm) | Largeur (μm) | |
| Chambre basse | 28,400 | 800 |
| Chambre haute | 31,000 | 800 |
Tableau 1: Dimensions des canaux supérieur et inférieur de l’appareil.
- Découpez des feuilles de vinyle transparentes adhésives de 95 μm d’épaisseur en carrés de 30 cm x 30 cm pour les adapter correctement au traceur.
- Utilisez le logiciel Brother CanvasWorkspace pour créer un espace de travail de 30 cm x 30 cm et remplissez-le avec les motifs conçus pour les différentes couches de la puce (Figure 1A). Stockez-le dans un fichier .svg.
- Découpez les feuilles de vinyle de 30 cm x 30 cm avec le traceur de bord (Figure 1B-D).
- Collez la feuille de vinyle sur un tapis adhésif à faible adhérence et éliminez toutes les bulles d’air si nécessaire.
- Téléchargez le fichier .svg dans le traceur et définissez les paramètres de coupe : lame de coupe : niveau 3 ; pression de coupe: niveau 0; vitesse de coupe: niveau 1. Placez le tapis adhésif avec le vinyle dans le traceur et commencez le processus de coupe.
- Coupez le motif du canal supérieur sur du vinyle double face de 12 μm d’épaisseur en suivant les étapes précédentes.

Figure 1: Conception de la puce et processus de micro-usinage. (A) Disposition du logiciel montrant l’espace de travail rempli avec les motifs supérieur et inférieur conçus pour la puce. (B) Traceur de bord pendant le processus de coupe; la lame de coupe, la feuille de vinyle entière et le tapis adhésif sont montrés. (C) Vinyle à motifs détaché de la feuille découpée. (D) Échantillon d’une couche de vinyle adhésif à motifs de la conception du canal supérieur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Fabrication de couches PDMS
- Mélanger le PDMS et l’agent de durcissement dans un rapport de 10:1 (v / v) et placer le mélange sous vide pendant 15 minutes pour éliminer les bulles d’air. Verser 55 mL du mélange dans un plat de culture carré de 55 cm2 pour obtenir une couche de 2 mm d’épaisseur. Enlevez les bulles avec une aiguille.
- Durcir le mélange (étape 2.1) au four pendant 1 h à 80 °C. Démoulez le PDMS et coupez-le en rectangles avec les dimensions de la puce. Faites des trous pour le tube avec une aiguille de seringue de 18 G.
3. Assemblage de puces
REMARQUE : Pour une meilleure compréhension, reportez-vousà la figure 2 .
- Assemblez l’ensemble de l’appareil à l’aide d’un aligneur pour régler correctement les canaux, les entrées et les sorties. Empilez quatre couches de vinyle (avec le micromodèle inférieur correspondant) pour assembler le canal inférieur, en conservant le ruban de couverture de la couche inférieure pour éviter de coller à l’aligneur.
- Coupez et placez la membrane poreuse en polycarbonate (PC) sur le dessus du canal inférieur pour la séparer du canal supérieur. Veillez à ne pas couvrir les entrées du canal inférieur.
- Ajoutez dix couches de vinyle avec la conception de la chambre supérieure. Collez une couche de vinyle de ruban adhésif double face avec le motif de canal supérieur sur le dessus. Retirez la puce de l’aligneur et collez-la sur la glissière en verre.
- Placez une feuille PDMS de 2 mm d’épaisseur sur la couche de vinyle de ruban adhésif double face pour fournir un ancrage approprié pour le tube et éviter les fuites. Laissez un poids sur le dessus de la puce pendant la nuit pour vous assurer que la puce est complètement étanche. Stériliser la puce en rinçant à 70 % v/v d’éthanol pendant 5 min, puis laver avec du H2O distillé.
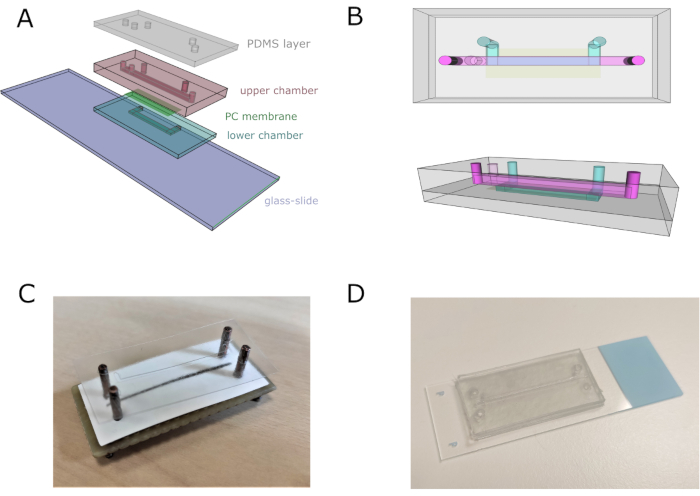
Figure 2: Assemblage de puces microfluidiques. (A) Schéma général de l’assemblage du dispositif. Les chambres inférieure et supérieure sont composées respectivement de quatre et onze feuilles de vinyle superposées. (B) Vues supérieures et latérales de la puce microfluidique. Les canaux supérieur et inférieur sont représentés en rose et en bleu, respectivement. (C) Image de l’assemblage de la puce à l’aide d’un aligneur sur mesure. (D) Image de la puce après assemblage complet. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Raccords de pompe
REMARQUE : La représentation graphique des raccords des pompes est illustrée à la figure 3.
- Connectez la pompe 1 à l’entrée de chambre supérieure 1 (UCi1).
- Connectez la pompe 2 à l’entrée 2 de la chambre supérieure (UCi2).
- Connectez la pompe 3 à l’entrée de la chambre inférieure (LCi).
- Connectez la sortie de la chambre supérieure (UCo) et la sortie de la chambre inférieure (LCo) à un tube de déchets.
- Connectez les seringues à chaque entrée à l’aide de tubes en polytétrafluoroéthylène (PTFE) et de connecteurs en acier inoxydable 18 G.
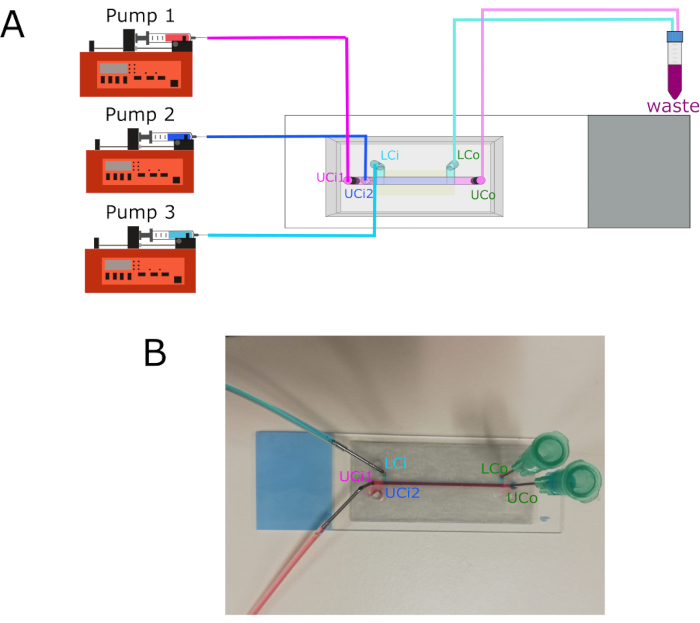
Figure 3: Raccordement des pompes et emplacement des entrées/sorties. (A) Schéma montrant le raccordement des trois pompes différentes à leurs entrées respectives. Les prises se connectent à un conteneur à déchets. (B) Image de puce avec entrées et sorties étiquetées. Abréviations : LCi = entrée de chambre inférieure ; LCo = sortie de la chambre inférieure; UCi1 = entrée de la chambre supérieure 1; UCi2 = entrée de la chambre supérieure 2; UCo = sortie de la chambre supérieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Culture cellulaire
REMARQUE: La lignée cellulaire HaCaT a une origine commerciale. Les fibroblastes primaires humains proviennent de donneurs sains et ont été obtenus à partir de la collecte d’échantillons biologiques d’origine humaine enregistrés dans le « Registro Nacional de Biobancos para Investigación Biomédica del Instituto de Salud Carlos III ».
- Travailler dans une hotte de culture cellulaire, préalablement stérilisée sous la lumière ultraviolette et essuyée à l’éthanol.
- Décongeler les cellules H2B-GFP-HaCaT (kératinocytes cutanés immortalisés par l’homme, hMC) et les fibroblastes primaires GFP-humains (hFB) à 37 °C, ajouter 2 mL de milieu de culture et centrifuger pendant 7 min à 20 °C à 250 × g.
REMARQUE: Les cellules H2B-GFP-HaCaT sont des kératinocytes immortalisés humains modifiés pour exprimer une protéine fluorescente hybride histone H2B-vert (GFP), fournissant à leurs noyaux une fluorescence verte. Les GFP-hFB sont des fibroblastes primaires humains transformés avec le vecteur pLZRS-IRES-EGFP pour exprimer la fluorescence verte cytoplasmique. Ces cellules ont été modifiées selon les protocoles précédemment publiés30,31 - Culturez les hBC et les hFB dans 1x DMEM complété par 10% de sérum bovin fœtal et 1% de solution antibiotique / antimycotique. Préchauffer le milieu de culture à 37 °C avant utilisation.
- Détachez les cellules en les lavant avec 1x solution saline tamponnée au phosphate (PBS), en ajoutant 2 mL de trypsine/éthylènediamine acide tétraacétique (EDTA) et en les incubant pendant 10 min à 37 °C.
- Inactiver la trypsine en ajoutant 4 mL de milieu de culture. Resuspendez les cellules et transférez-les dans un tube de 15 mL. Retirer 10 μL pour compter les cellules sur une chambre de Neubauer et déterminer la concentration appropriée.
- Centrifuger le tube de 15 mL pendant 7 min à 20 °C à 250 × g. Retirer le surnageant et ressuspener les pastilles à la concentration souhaitée : hFB à 50 000 cellules/mL et hKCs à 5·× 106 cellules/mL.
6. Préparation de pré-gel de fibrinogène
- Activer la thrombine en ajoutant 1 mL de CaCl2 (1 % p/v dans le NaCl) au flacon.
- Ajouter les composants suivants pour obtenir 1 mL d’hydrogel de fibrine à une concentration finale de fibrine de 3,5 mg/mL : 59 μL de thrombine activée (10 unités NIH/mL), 59 μL d’acide tranexamique(Table desmatières, 100 mg/mL), 764 μL de milieu de culture contenant 50 000 hFBs/mL, 118 μL de fibrinogène (20 mg/mL dans le NaCl (0,9 % p/v)).
REMARQUE: Le fibrinogène doit être ajouté au dernier moment.
7. Protocole de flux parallèle
- Pompe 1x PBS avec pompe 3 à travers le LCi à 50 μL / min pendant tout le processus.
- Pompe fluide sacrificiel (1x PBS) avec pompe 2 à travers l’UCi2 à 100 μL/min.
- Chargez la seringue avec le pré-gel, placez-la rapidement dans la pompe 1 et faites-la fonctionner à 200 μL/min(Figure 4A).
- Arrêtez les pompes 1 et 2 une fois que le pré-gel sort de l’UCo.
- Laissez la puce sans retirer le tube à 37 °C pendant au moins 10 min pour permettre la gélification.
- Milieu de culture de pompe à 50 μL / h avec pompe 3 à UCi2 pendant la nuit.
- Bloquez UCi1 avec un capuchon.
8. Ensemencement monocouche hKCs
- Vérifiez au microscope que les hFB sont répartis 24 h après la génération du compartiment dermique.
- Introduire les hKC avec pompe 2 à UCi2 à 5 ×·106 cellules/mL à 40 μL/min pendant 1 min(Figure 4B).
- Laissez la puce toute la nuit à 37 °C dans un incubateur saturé d’humidité pour la fixation des cellules.
- Pomper le milieu de culture frais avec la pompe 3 uniquement à travers LCi à 50 μL/min(Figure 4C).
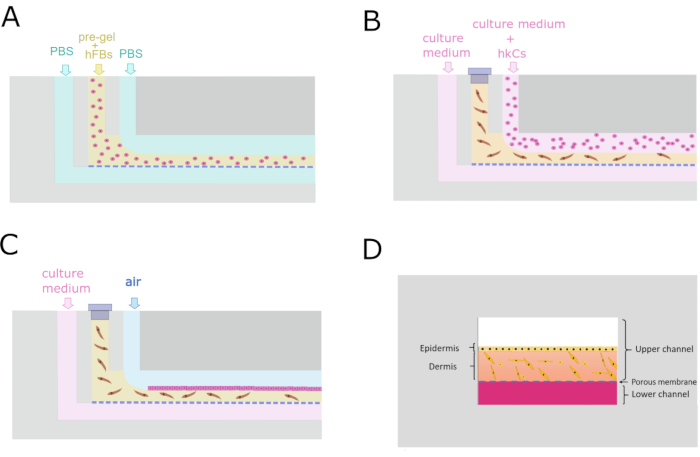
Figure 4: Protocole microfluidique pour la génération de la construction dermo-épidermique. (A) Section transversale montrant le processus d’écoulement parallèle pour générer le compartiment dermique. (B) Ensemencement monocouche de kératinocytes 24 h après la génération du compartiment dermique. ( C )Maintiende la culture cellulaire à l’intérieur du dispositif microfluidique. (D) Récréation transversale de la peau à l’intérieur de la puce. Veuillez cliquer ici pour voir une version agrandie de cette figure.
9. Test de viabilité cellulaire
REMARQUE: Le kit vivant / mort colore les cellules avec une fluorescence verte ou rouge en fonction de leur état vivant ou mort. Pour une différenciation de viabilité appropriée, des hKC et des hFB non fluorescents doivent être utilisés à cette étape. Toutes les étapes de la procédure sont effectuées via UCi2 avec pompe 2.
- Lavez le canal supérieur avec 1x PBS pendant 5 min à 50 μL/min pour éliminer le milieu de culture.
- Pompez de l’air pour retirer le PBS 1x à 50 μL/min.
- Préparez la solution Calcein AM/Ethidium homodimer-1 Kit (Live/Dead) en suivant les instructions du fabricant.
- Pomper la solution live/dead à 50 μL/min pendant 2 min.
- Incuber 30 min à 37 °C dans l’obscurité.
- Lavez le canal supérieur en pompant 1x PBS à 50 μL/min pendant 2 min pour éliminer tout réactif restant.
- Observez l’échantillon au microscope confocal. Utilisez une longueur d’onde d’excitation de 495/590 nm et une longueur d’onde d’émission de 519/617 nm pour les cellules vivantes et mortes, respectivement.
Résultats
La puce conçue est composée de deux chambres fluidiques séparées par une membrane PC de 5 μm de taille de pore qui permet la croissance de la cellule en permettant le passage de molécules favorisant la croissance de la chambre inférieure. La chambre supérieure contient la construction tissulaire, dans ce cas, une monocouche de hBC sur un hydrogel de fibrine contenant des hFB.
La hauteur des canaux est déterminée par le nombre de feuilles adhésives ajoutées à chaque canal. La chamb...
Discussion
La motivation pour développer cette méthode était le désir de modéliser les maladies de la peau et d’étudier les effets de thérapies nouvelles et innovantes dans une plate-forme à haut débit. À ce jour, ce laboratoire produit ces équivalents dermo-épidermiques en coulant - manuellement ou à l’aide de la technologie de bio-impression 3D - le gel de fibrine avec des fibroblastes dans une plaque d’insertion de culture cellulaire et en ensemençant les kératinocytes dessus. Une fois que les kératinocytes...
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents.
Remerciements
Nous remercions sincèrement le Dr Javier Rodríguez, le Dr María Luisa López, Carlos Matellán et Juan Francisco Rodríguez pour leurs suggestions, discussions et/ou données préliminaires très utiles. Nous remercions également les contributions de Sergio Férnandez, Pedro Herreros et Lara Stolzenburg à ce projet. Nous remercions tout particulièrement la Dre Marta García pour les hFB et les hKC étiquetés GFP. Enfin, nous reconnaissons l’excellente assistance technique de Guillermo Vizcaíno et Angélica Corral. Ce travail a été soutenu par le « Programa de Actividades de I+D entre Grupos de Investigación de la Comunidad de Madrid », Projet S2018/BAA-4480, Biopieltec-CM. Ce travail a également été soutenu par le « Programa de excelencia », Projet EPUC3M03, CAM. CONSEJERÍA DE EDUCACIÓN E INVESTIGACIÓN.
matériels
| Name | Company | Catalog Number | Comments |
| Amchafibrin | Rottafarm | Tranexamic acid | |
| Antibiotic/antimycotic | Thermo Scientific HyClone | ||
| Calcium chloride | Sigma Aldrich | ||
| Culture plates | Fisher | ||
| DMEM | Invitrogen Life Technologies | ||
| Double-sided tape vynil | ATP Adhesive Systems | GM 107CC, 12 µm thick | |
| Edge plotter | Brother | Scanncut CM900 | |
| FBS | Thermo Scientific HyClone | ||
| Fibrinogen | Sigma Aldrich | Extracted from human plasma | |
| Glass slide | Thermo Scientific | ||
| GFP-Human dermal fibroblasts | - | Primary. Gift from Dr. Marta García | |
| H2B-GFP-HaCaT cell line | ATCC | Immortalized keratinocytes. Gift from Dr. Marta García | |
| Live/dead kit | Invitrogen | ||
| PBS | Sigma Aldrich | ||
| Polycarbonate membrane | Merk TM | 5 µm pore size | |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 | |
| Sodium chloride | Sigma Aldrich | ||
| Syringes | Terumo | 5 mL | |
| Thrombin | Sigma Aldrich | 10 NIH/vial | |
| Transparent adhesive vinyl | Mactac | JT 8500 CG-RT, 95 µm thick | |
| Trypsin/EDTA | Sigma Aldrich | ||
| Tubing | IDEX | Teflon, 1/16” OD, 0.020” ID |
Références
- McNamee, P., et al. A tiered approach to the use of alternatives to animal testing for the safety assessment of cosmetics: Eye irritation. Regulatory Toxicology and Pharmacology. 54 (2), 197-209 (2009).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical Pharmacology: Advances and Applications. 8, 163-176 (2016).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Avci, P., et al. Animal models of skin disease for drug discovery. Expert Opinion on Drug Discovery. 8 (3), 331-355 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Pronko, P. P., VanRompay, P. A., Zhang, Z., Nees, J. A. Pronko et al. Reply. Physical Review Letters. 86 (7-12), 1387 (2001).
- H.R.2858 - Humane Cosmetics Act. 114th Congress Available from: https://congress.gov/bill/114th-congress/house-bill/2858 (2016)
- . Global in-vitro toxicology testing market report: size, share & trends analysis 2014-2015 Available from: https://www.prnewswire.com/news-releases/global-in-vitro-toxicology-testing-market-report-size-share--trends-analysis-2014-2025-300704958.html (2018)
- Zhang, Z., Michniak-Kohn, B. B. Tissue engineered human skin equivalents. Pharmaceutics. 4 (1), 26-41 (2012).
- OECD. In vitro skin corrosion: reconstructed human epidermis (RhE) test method. Test Guideline No.431. OECD Guideline for Testing of Chemicals. , (2019).
- Almeida, A., Sarmento, B., Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. International Journal of Pharmaceutics. 519 (1-2), 178-185 (2017).
- vanden Broek, L. J., Bergers, L. I. J. C., Reijnders, C. M. A., Gibbs, S. Progress and future Prospectives in Skin-on-Chip Development with Emphasis on the use of Different Cell Types and Technical Challenges. Stem Cell Reviews and Reports. 13 (3), 418-429 (2017).
- Ataç, B., et al. Skin and hair on-a-chip: In vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Abaci, H. E., Gledhill, K., Guo, Z., Christiano, A. M., Shuler, M. L. Pumpless microfluidic platform for drug testing on human skin equivalents. Lab on a Chip. 15 (3), 882-888 (2015).
- Wu, R., et al. Full-thickness human skin-on-chip with enhanced epidermal morphogenesis and barrier function. Materials Today. 21 (4), 326-340 (2017).
- Materne, E. -. M., et al. The multi-organ chip - a microfluidic platform for long-term multi-tissue coculture. Journal of Visualized Experiments: JoVE. (98), e52526 (2015).
- Schimek, K., et al. Bioengineering of a full-thickness skin equivalent in a 96-well insert format for substance permeation studies and organ-on-a-chip applications. Bioengineering. 5 (2), 43 (2018).
- Alberti, M., et al. Multi-chamber microfluidic platform for high-precision skin permeation testing. Lab on a Chip. 17, 1625-1634 (2017).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature BIotechnology. 32 (8), 760-772 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From 3D cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Wufuer, M., et al. Skin-on-a-chip model simulating inflammation, edema and drug-based treatment. Scientific Reports. 6, 37471 (2016).
- Ramadana, Q., Ting, F. C. W. In vitro micro-physiological immune-competent model of the human skin. Lab on a Chip. 16, 1899-1908 (2016).
- Kim, K., Jeon, H. M., Choi, K. C., Sung, G. Y. Testing the effectiveness of Curcuma longa leaf extract on a skin equivalent using a pumpless skin-on-a-chip model. International Journal of Molecular Sciences. 21 (11), 3898 (2020).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Huh, D. A human disease model of drug toxicity - induced pulmonary edema in a lung-on-a-chip microdevice. Scientific Translational Medicine. 4 (159), (2012).
- Beckwitt, C. H., et al. Liver ' organ on a chip '. Experimental Cell Research. 363 (1), 15-25 (2018).
- Poceviciute, R., Ismagilov, R. F. Human-gut-microbiome on a chip. Nature Biomedical Engineering. 3 (7), 500-501 (2019).
- Kanda, T., Sullivan, K. F., Wahl, G. M. Histone-GFP fusion protein enables sensitive analysis of chromosome dynamics in living mammalian cells. Current Biology. 8 (7), 377-385 (1998).
- Escámez, M. J., et al. Assessment of optimal virus-mediated growth factor gene delivery for human cutaneous wound healing enhancement. Journal of Investigative Dermatology. 128 (6), 1565-1575 (2008).
- Llames, S. G., et al. Human plasma as a dermal scaffold for the generation of a completely autologous bioengineered skin. Transplantation. 77 (3), 350-355 (2004).
- Llames, S., et al. Clinical results of an autologous engineered skin. Cell Tissue Bank. 7 (1), 47-53 (2006).
- Cubo, N., Garcia, M., del Cañizo, J. F., Velasco, D., Jorcano, J. L. 3D bioprinting of functional human skin: production and in vivo analysis. Biofabrication. 9 (1), 015006 (2016).
- Mori, N., Morimoto, Y., Takeuchi, S. Skin integrated with perfusable vascular channels on a chip. Biomaterials. 116, 48-56 (2017).
- Kim, H. J., Li, H., Collins, J. J., Ingber, D. E. Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip. Proceedings of the National Academy of Sciences of the United States of America. 113 (1), 7-15 (2016).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Marx, U., et al. Human-on-a-chip' developments: A translational cuttingedge alternative to systemic safety assessment and efficiency evaluation of substances in laboratory animals and man. Alternatives to Laboratory Animals. 40 (5), 235-257 (2012).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 659-668 (2018).
- Bennet, D., Estlack, Z., Reid, T., Kim, J. A microengineered human corneal epithelium-on-a-chip for eye drops mass transport evaluation. Lab on a Chip. 18, 1539-1551 (2018).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a chip. 12, 2165-2174 (2012).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integrative Biology. 5 (9), 1130-1140 (2013).
- O'Neill, A. T., Monteiro-Riviere, N. A., Walker, G. M. Characterization of microfluidic human epidermal keratinocyte culture. Cytotechnology. 56 (3), 197-207 (2008).
- Ren, K., Chen, Y., Wu, H. New materials for microfluidics in biology. Current Opinion in Biotechnology. 25, 78-85 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon