Method Article
تشريح الكيس اللمفاوي من الفئران
* These authors contributed equally
In This Article
Summary
تصف هذه الدراسة كيفية تشريح الكيس اللمفاوي الداخلي من الأذن الداخلية للفأر في أعمار مختلفة. تظهر نتيجة تشريح مماثل في نموذج فأر Slc26a4-null لتضخم الكيس اللمفاوي الباطن. يتم تقديم فأر معدل وراثيا مع مراسل فلوري يتم التعبير عنه في الكيس اللمفاوي الداخلي كنموذج لتصور الكيس اللمفاوي الداخلي بسهولة ، والأداة التعليمية.
Abstract
كشفت دراسة نماذج الفئران الطافرة لاضطرابات السمع والتوازن البشرية عن العديد من التغييرات الهيكلية والوظيفية التي قد تساهم في الأنماط الظاهرية البشرية. على الرغم من إحراز تقدم مهم في فهم تطور ووظيفة الظهارة الحسية العصبية للقوقعة والدهليز ، إلا أن المعرفة المحدودة متاحة فيما يتعلق بالتطور والتركيب الخلوي والمسارات الجزيئية والخصائص الوظيفية للكيس اللمفاوي الباطن. ويرجع ذلك ، في جزء كبير منه ، إلى صعوبة تصور هذا النسيج وتشريحه المجهري ، وهو ظهارة تتكون من طبقة خلية واحدة فقط. تصف الدراسة المقدمة هنا نهجا للوصول إلى الكيس اللمفاوي الداخلي وتشريحه المجهري من الأذن الداخلية للفأر من النوع البري في مختلف الأعمار. تظهر نتيجة تشريح مماثل في نموذج فأر يعاني من نقص البندرين لتضخم القناة الدهليزية. يتم تقديم فأر معدل وراثيا مع كيس لمفاوي فلوري. يمكن استخدام هذا الفأر المراسل لتصور الكيس اللمفاوي الباطن بسهولة مع تشريح محدود وتحديد حجمه. يمكن استخدامه أيضا كأداة تعليمية لتعليم كيفية تشريح الكيس اللمفاوي. يجب أن تسهل إجراءات التشريح هذه توصيفا إضافيا لهذا الجزء غير المدروس من الأذن الداخلية.
Introduction
تتكون الأذن الداخلية للثدييات من القوقعة ، والكيس ، والأوريكل ، وثلاث قنوات نصف دائرية ، والكيس اللمفاوي الباطن (الشكل 1 أ). تتكون هذه الأعضاء من ظهارة مستمرة مملوءة بالسوائل تسمى المتاهة الغشائية ، مع أعضاء مجاورة تتصل مباشرة أو من خلال هياكل القنوات الصغيرة مثل القناة العصائية أو القناة الكيسية أو القناة العصبية أو القناة اللمفاوية. بالمقارنة مع الأعضاء الأخرى في الأذن الداخلية ، فإن الكيس اللمفاوي البطاني له خصائص فريدة. أولا ، يفتقر إلى الخلايا الظهارية الحسية. بدلا من ذلك ، يحتوي الكيس اللمفاوي البطاني على خلايا متخصصة في نقل الأيونات. ثانيا ، على الرغم من أن المتاهة الغشائية محاطة بالمتاهة العظمية ، إلا أن الكيس اللمفاوي الداخلي هو استثناء ، حيث يبرز جزئيا من العظم الصخري إلى التجويف داخل الجمجمة. يبدو أن هذا التشكل محفوظ بشكل كبير أثناء تطور الأذن الداخلية. ثالثا ، الكيس اللمفاوي البطاني هو أول هيكل يتطور من الكيسة الأذنية في مرحلة جنينية مبكرة قبل تكوين أعضاء أخرى. بالإضافة إلى ذلك ، ارتبطت العديد من الأمراض بتضخم كيس لمفاوي باطن أو حجرة لمفاوية باطنية غير طبيعية. يؤدي وجود المتغيرات المسببة للأمراض في SLC26A4 (المعروف أيضا باسم جين البندرين) إلى شكل شائع نسبيا من فقدان السمع الحسي العصبي ، الناجم عن تضخم الكيس اللمفاوي البطاني المرتبط بوجود قناة دهليزية متضخمة (EVA)1. عندما يرتبط بتضخم الغدة الدرقية ، يشار إليه باسم متلازمة بندريد2،3. يعتقد البعض أيضا أن مرض مينيير مرتبط بتشوه في الحيز اللمفاوي الباطن (hydrops)4. تتوافق السمات الفريدة للكيس اللمفاوي الداخلي والأمراض المرتبطة بتغيير مورفولوجيته مع دور حاسم في تطوير الأذن الداخلية والحفاظ عليها.
على الرغم من أهميتها ، إلا أن المعرفة لا تزال محدودة فيما يتعلق بالتطور والتركيب الخلوي والمسارات الجزيئية والخصائص الوظيفية للكيس اللمفاوي الباطن. ويرجع ذلك جزئيا على الأقل إلى صعوبة تصور هذا النسيج وتشريحه المجهري. الكيس اللمفاوي الداخلي عبارة عن هيكل على شكل كيس ، يتكون من طبقة واحدة من الخلايا الظهارية ، والتي غالبا ما تكون شفافة ويصعب التعرف عليها من الأنسجة الملتحمة التي تحيط بها عن طريق المجهر المجهري الخفيف. على الرغم من أن عددا صغيرا من الباحثين قد طوروا تقنيات تشريح كاملة ونشروا نتائجهم التجريبية5،6،7،8،9،10 ، إلا أنه لا يوجد منشور يركز على التفاصيل الفنية لهذا الإجراء.
في هذه الدراسة ، تم وصف مناهج التشريح المجهري التي تم تطويرها للوصول إلى الكيس اللمفاوي الداخلي وعزله من الأذن الداخلية للفأر من النوع البري في أعمار مختلفة ، في التركيب الكامل. تظهر نتائج تشريح مماثل في نموذج الفأر ، الذي يفتقر إلى التعبير عن SLC26A4 ، والذي يحتوي على تضخم في القناة اللمفاوية الداخلية والكيس. تم الإبلاغ عن خط فأر يحتوي على جين معدل يشفر Cre recombinase المعبر عنه في الكيس اللمفاوي الباطن. في وجود مراسل فلوري لتعبير Cre ، هنا tdTomato، يمكن استخدام التألق لتصور الكيس اللمفاوي الداخلي بسهولة مع تشريح محدود والحصول على معلومات حول حجمه. يمكن أيضا استخدام خط الفأر المراسل هذا كأداة تعليمية لممارسة تشريح الكيس اللمفاوي الداخلي وإتقانه. يجب أن تسهل القدرة على تشريح أنسجة الكيس اللمفاوي الداخلي المزيد من التوصيف لهذا المكون غير المدروس ولكن الأساسي للأذن الداخلية.
Protocol
تم إجراء جميع التجارب والإجراءات على وفقا للبروتوكولات المعتمدة من قبل لجان رعاية واستخدامه التابع للمعهد الوطني للأمراض العصبية والسكتة الدماغية / المعهد الوطني للصمم واضطرابات التواصل الأخرى (# 1264) واللجنة المؤسسية لرعاية واستخدامه في جامعة طوكيو للطب وطب الأسنان (A2020-058A).
ملاحظة: الفئران C57BL / 6J (رقم المخزون رقم 000664) ، Pds-/- المعروف أيضا باسم الفئران Slc26a4 - / - (129S-Slc26a4 tm1Egr / AjgJ ، رقم 018424) 11 ، B6 ؛ CBA-Tg (ATP6V1B1-Cre) 1Rnel / Mm الفئران12 و Ai9 (LSL-RCL-tdT) (B6.Cg-GT (ROSA) 26Sortm9 (CAG-tdTomato) Hze ، رقم 007909) الفئران13 متوفرة من مختبر جاكسون وعند الطلب. تم وصف جميع إجراءات التنميط الجيني سابقا. ب 6 ؛ تم تربية الفئران CBA-Tg (ATP6V1B1-Cre) 1Rnel / Mm التي تم تهجينها سابقا لسلالة C57BL / 6J لمدة خمسة أجيال على الأقل ، للتجارب. يمكن دراسة من كلا الجنسين بهذا النهج دون اختلاف واضح. يتم احتساب اليوم الأول بعد التزاوج بين عشية وضحاها على أنه يوم جنيني 0.5 (E0.5).
1. حصاد وتثبيت الأذن الداخلية السليمة في الجمجمة
- القتل الرحيم للحيوان التجريبي أو سد الحمل أثناء الحمل باستخدام إجراء معتمد مؤسسيا ، على سبيل المثال ، باستخدام استنشاق ثاني أكسيد الكربون. اعمل تحت غطاء الدخان إن أمكن ، لتجنب أو تقليل انتشار مسببات الحساسية في الفئران. بعد التحقق من عدم الاستجابة للمنبهات المؤلمة مثل قرصات المخلب أو الذيل ، اقطع رأس. بالنسبة للسد الحامل ، يمكن استخدام خلع عنق الرحم كبديل لقطع الرأس إذا لم يتم استخدام أذنيه الداخليتين لمزيد من التجارب.
- حصاد الأجنة عن طريق شق البطن14 باستخدام مقص الشريان برأس كروي لحماية الأجنة أثناء العملية. التلاعب بالأجنة باستخدام ملقط الحلقة. ضع قرون الرحم في 4 درجات مئوية PBS على الجليد وعزل كل جنين كما هو موضح سابقا15 قبل قطع رأسها.
- قم بتقسيم الرأس من الخلف إلى الأمام: قم أولا بشق الجزء العلوي من الرأس عن طريق شق الجلد أولا ، ثم الجزء العلوي من الجمجمة ، مع شق حوالي ثلثه مع كل قطع حتى لا يكون هناك انحناء للجمجمة. ثم قطع الجزء السفلي من الجمجمة في الحال.
ملاحظة: بالنسبة للأجنة ، ينصح باستخدام شفرة حادة بدلا من المقص. من الأهمية بمكان ألا تتشوه الجمجمة في جميع الأعمار أثناء تقسيمها. - دون لمس الجمجمة أو ثنيها ، قم بإزالة نصف الدماغ بعناية للكشف عن المتاهة العظمية (الشكل 1 ب ، الشكل التكميلي 1 أ-ب).
- بالنسبة للفئران بعد الولادة في اليوم 5 أو أكثر ، قم بعبور القناة السمعية الخارجية واسحب الجلد للأمام نحو الأنف. تقليم الجمجمة حول الأذن الداخلية (الشكل التكميلي 1C).
- انقل جمجمتي نصفي كل مع الأذن الداخلية ، سليمة قدر الإمكان ، إلى قارورة زجاجية أو أنبوب يحتوي على 10 مل من 4 درجات مئوية 4٪ بارافورمالدهيد (PFA) مخفف في 1x PBS واحتفظ به على الجليد تحت غطاء الدخان.
ملاحظة: لا تحاول إزالة الأذن الداخلية من الجمجمة في هذه الخطوة لأن ذلك قد يؤدي إلى تلف القناة اللمفاوية الداخلية والكيس أثناء القيام بذلك. - احتضن لمدة ساعة واحدة عند 4 درجات مئوية على شاكر هزاز. إذا كنت تعمل مع أنسجة من مع مراسل الفلورسنت ، فاحتفظ بالأنبوب الذي يحتوي على العينة في رقائق الألومنيوم أو في صندوق لتقليل التعرض للضوء.
ملاحظة: إذا كنت مهتما بدراسة الأنابيب الدقيقة والجزيئات المرتبطة بها ، فيجب إجراء تثبيت الأنسجة في درجة حرارة الغرفة (RT) باستخدام مثبت RT. - تخلص من PFA في حاوية مناسبة في غطاء الدخان. اغسل ثلاث مرات باستخدام 10 مل من 1x PBS لمدة 15 دقيقة في كل مرة على شاكر هزاز في RT للتخلص من المثبت قبل التشريح.
2. التشريح المجهري للكيس اللمفاوي الداخلي
- انقل كل مستحضر للأذن الداخلية إلى طبق زراعة أنسجة مقاس 35 مم يحتوي على 1x PBS.
- ضع المستحضر في الطبق بحيث يتم توجيه جذر العصب القحفي الثامن لأعلى. امسك الأنسجة في هذا الوضع عن طريق الإمساك بالقوقعة باستخدام ملقط # 4 (الشكل 1 ج).
- حدد المعالم المهمة: القناة الدهليزية ، والقنوات نصف الدائرية الأمامية والخلفية ، والصليب المشترك ، والجيب السيني (الوريد) (الشكل 1 د).
ملاحظة: الكيس اللمفاوي الباطن في الفأر من النوع البري شفاف ويصعب تصوره. من أجل التشريح المجهري الناجح للكيس اللمفاوي الداخلي ، من المهم فهم تشريحه وتوطينه (الشكل 1E). - قم بشق الأم الجافية والقناة الدهليزية ، بالإضافة إلى الأنسجة الضامة الأساسية المحيطة بكيس اللمفاوی الداخلي ، باستخدام إبرة 27 جم على حقنة سعة 1 مل (الشكل 1D ، F).
ملاحظة: بالنسبة للفأر البالغ ، فإن إزالة الكلس من المستحضر باستخدام 10٪ EDTA (درجة الحموضة 7.4) قبل التشريح المجهري مفيد ، ولكنه ليس ضروريا ، لتسهيل شق القناة الدهليزية. لتشريح الكيس اللمفاوي المفتوح الأقدم من اليوم 5 بعد الولادة ، يوصى بوضع خط الشق على القناة الدهليزية الأمامية قليلا لعمل شق في تجويف الكيس اللمفاوي البطاني (الشكل 2 أ). - امسك النسيج الضام الموجود بشكل جانبي للكيس اللمفاوي الداخلي بالملقط واسحب الأنسجة لأعلى لتقشيرها من العظم الصدغي (الشكل 1G).
- قم بإزالة أي حطام متبقي بعناية. عادة ما يشمل المستحضر ظهارة الكيس اللمفاوي البطاني ، والأنسجة الضامة المحيطة ، وجزء من القناة الدهليزية ، والجيب السيني (الشكل 1H-I). إذا لزم الأمر ، افصل ظهارة الكيس اللمفاوي البطاني عن الأنسجة المحيطة (الشكل 1J).
- (اختياري) لتشريح الكيس اللمفاوي المفتوح ، أمسك الجزء الجذعي من المستحضر بحيث يمكن ملاحظة المقطع العرضي للتجويف. أدخل إبرة 27 جم في التجويف وحركها لتقطيع الكيس اللمفاوي إلى ورقتين (الشكل 2B-C). أمسك حافة كل نسيج يشبه الورقة بالملقط وافصلها عن بعضها البعض (الشكل 2D-F).
3. الكيمياء المناعية
- بعد التشريح المجهري ، استخدم ملقط # 5 لنقل الأكياس اللمفاوية إلى صفيحة زجاجية مكونة من 9 آبار.
- باستخدام المجهر للتأكد من بقاء الأكياس اللمفاوية الداخلية كما هي ، استخدم ماصة 200 ميكرولتر لإزالة كل 1x PBS باستثناء قطرة واحدة تحتوي على الأنسجة. أضف 200 ميكرولتر من محلول النفاذية والمانع (1x PBS مع 0.15٪ Triton X-100 (PBS-TX) و 5٪ ألبومين مصل البقر (BSA)) واحتضنه لمدة ساعة واحدة في RT على شاكر مداري.
- بعد إزالة كل محلول مانع باستثناء قطرة واحدة تحتوي على الأنسجة ، أضف 200 ميكرولتر من الأجسام المضادة الأولية واحتضن طوال الليل عند 4 درجات مئوية. يمكن استخدام الأجسام المضادة للبندرين6 المخففة 1: 1000 في محلول الحجب لتحديد الخلايا الغنية بالميتوكوندريا في الكيس اللمفاوي الداخلي ، على الرغم من ظهور تعبير خافت أيضا في مجموعة فرعية من الخلايا الغنية بالريبوسوم16 (الشكل 5).
- بعد ثلاث غسلات في 1x PBS لمدة 15 دقيقة في RT ، احتضن بالأجسام المضادة الثانوية. بالنسبة للوسم المعروض هنا ، احتضان 200 ميكرولتر من الأجسام المضادة الثانوية المترافقة بالصبغة الفلورية ، المخففة من المخزون التجاري عند 1: 500 في محلول مانع ، مع الأنسجة على منصة هزاز لمدة 1 ساعة في RT في الظلام. يمكن استخدام الفالودين المترافق بالصبغة الفلورية ، والذي يتعرف على β-actin (ACTB) ، لتسليط الضوء على وجود الكيس والقناة اللمفاوية وكذلك الأنسجة الملتحمة من حولهما (الشكل 5 أ ، ج ، FG).
- قم بتركيب الأكياس اللمفاوية الداخلية بين شريحة زجاجية وزلة غطاء باستخدام وسيط تركيب مضاد للبهتان مع DAPI. بعد ترك الشرائح تجف محمية من الضوء لمدة 1 ساعة في RT ، ضع طلاء أظافر شفاف عند التقاطع بين الغطاء والشريحة الزجاجية لإغلاقها والحد من تكوين فقاعة الهواء. إذا كنت تحاول تصور التوزيع التفاضلي للبروتينات في السطح القمي مقابل السطح القاعدي الجانبي للخلايا الظهارية ، فمن المستحسن فتح الكيس أثناء خطوة التركيب عن طريق شق حافة وفتحها.
- الصورة باستخدام المجهر متحد البؤر. تصور أولا مستحضرات الكيس اللمفاوي البطاني بهدف 10x لتوفير عرض عالمي لوضع العلامات على الكيس (الشكل 5A-D). ثم استخدم هدفا 63x للحصول على عرض تفصيلي لتوزيع البروتين ذي الأهمية في الخلايا الغنية بالميتوكوندريا والريبوسوم في الكيس اللمفاوي الداخلي (الشكل 5F-G).
النتائج
يتم تفصيل كل خطوة من خطوات هذا التشريح المجهري لكيس اللمفة الداخلية من النوع البري من فأر ما بعد الولادة 5 (P5) في الفيديو المرتبط ولقطات للخطوات الرئيسية لهذا التشريح وفتح الكيس اللمفاوي البطاني في الشكل 1 والشكل 2.
النتائج التمثيلية لتشريح الكيس اللمفاوي الداخلي مع tdمضان الطماطم في اليوم الجنيني 16.5 (E16.5) و P5 و P30 ، باتباع هذا البروتوكول ، يتم تقديمها في الشكل 3 وفي الشكل التكميلي 1 والشكل التكميلي 2. باستخدام مجهر التشريح مع التألق ، يمكن تصور الكيس اللمفاوي الداخلي بسهولة في الجمجمة بعد إزالة الدماغ في الفئران التي تحمل الجينات المعدلة Tg (ATP6V1B1-Cre) في حضور مراسل تعبير Cre: Ai9 (LSL-RCL-tdT) (انظر الشكل 3A-B ، والشكل التكميلي 1 للصور الملتقطة في الضوء الساقط و tdPainting Tomato من الكيس اللمفاوي الباطن في مراحل مختلفة من التشريح). في هذه الفئران ، يتم التعبير عن Cre كفسيفساء في الخلايا على طول الكيس اللمفاوي الداخلي والقناة (الشكل 3 ، انظر أيضا الشكل التكميلي 2 لتصور الكيس اللمفاوي الداخلي مع مراسل الفلورسنت مقابل بدون مراسل الفلورسنت). على الرغم من أن تعبير هذا المراسل ليس محددا للتعبير الذاتي ل Atp6v1b1 ، والذي يقتصر على الخلايا الغنية بالميتوكوندريا في الكيس اللمفاويالداخلي 16 ، وهو أحد نوعي الخلايا في هذه الظهارة (الشكل 5E) ، إلا أنه يساعد في تحديد وتشريح الكيس اللمفاوي الباطن.
يتم عرض الأذنين الداخلية التي تم تشريحها من نموذج الفأر لتوسيع القناة الدهليزية في الشكل 4. بالمقارنة مع زملاء القمامة ، يتم تكبير الأكياس والقنوات اللمفاوية الداخلية للفئران التي تعاني من نقص SLC26A4 (البندرين).
تظهر الصور التمثيلية للكيمياء المناعية للكيس اللمفاوي السليم مع وبدون نسيج ملتحم في الشكل 5. كما يتم تقديم نتائج الكيمياء المناعية للكيس اللمفاوي الداخلي المفتوح للفأر البري P5 (الشكل 5F-G). يتكون الكيس اللمفاوي الداخلي من طبقة واحدة من الظهارة مطوية في هيكل على شكل كيس ، تحتوي على اللمف الباطن في التجويف. تتكون هذه الظهارة من نوعين من الخلايا ، الخلايا الغنية بالميتوكوندريا والخلايا الغنية بالريبوسوم (الشكل 5 ه). سيتم تسطيح الكيس اللمفاوي الباطن بالكامل لأن اللمف الباطن لم يعد موجودا. سيظهر الكيس على شكل طبقتين متشابكتين من الظهارة ، مما يجعل من الصعب تحديد التوطين الخلوي للبروتينات المعبر عنها في هذه الظهارة. من خلال فتح الكيس اللمفاوي البطاني ، يمكن تصور ظهارة الطبقة المفردة بسهولة ويمكن تحديد التوزيع النسبي للبروتينات ذات الأهمية ، فيما يتعلق بتجويف الكيس اللمفاوي البطاني ، بشكل أكثر تحديدا. يمكن تحديد القمي المحتمل (اللمعي ، حيث سيكون اللمف الباطن) مقابل التخصيب القاعدي لهذه البروتينات بشكل أكثر دقة. على سبيل المثال ، يتم إثراء SLC26A4 على الجانب القمي للخلايا الغنية بالميتوكوندريا (الشكل 5F).
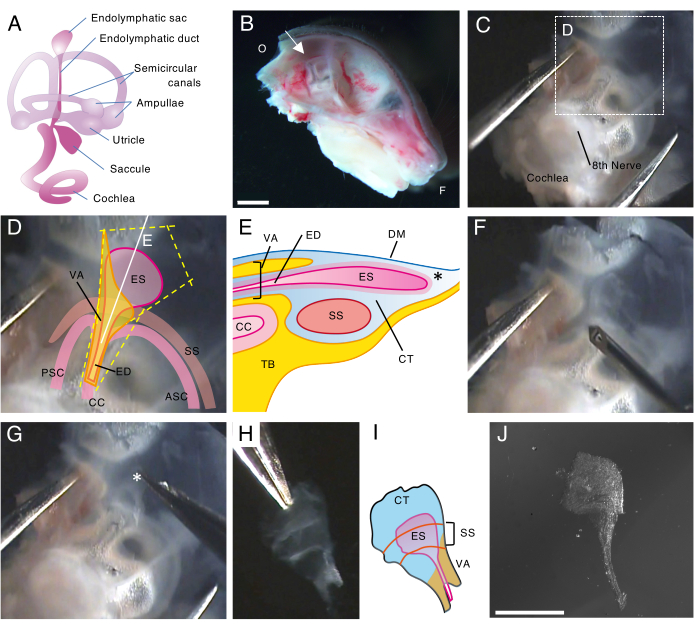
الشكل 1. تشريح كامل للكيس اللمفاوي البطاني لفأر من النوع البري في اليوم 5 بعد الولادة (P5).
(أ) تخطيطي للمتاهة الغشائية للأذن الداخلية للفأر المتطور (يمين). يشار إلى موقع الكيس اللمفاوي البطاني ، والهياكل القوقعة والدهليزية. تم تعديل هذا الرقم من Honda et al.16.
(ب) الجزء السهمي المتوسط الذي يظهر الجمجمة النصفية اليسرى. يشار إلى موقع الكيس اللمفاوي الباطن (السهم). (O ، قذالي. F ، أمامي)
(ج) كبسولة الأذن مع الجزء الحرشفية من العظم الصدغي.
(د) المعالم الهامة المتراكبة على الصندوق المنقط في اللوحة C. (ES ، الكيس اللمفاوي الباطن ؛ الضعف الجنسي ، القناة اللمفاوية الباطنة. VA ، قناة دهليزية. ASC ، قناة نصف دائرية أمامية. PSC ، قناة نصف دائرية خلفية. CC ، crus المشترك. SS ، الجيوب الأنفية السيني)
(ه) رسم تخطيطي للمقطع العرضي جنبا إلى جنب مع الخط الأبيض المستمر على اللوحة D من خلال الكيس اللمفاوي الباطن. الجانب القريب من الكيس اللمفاوي الباطن مغطى بقناة عظمية تسمى القناة الدهليزية ، جنبا إلى جنب مع القناة اللمفاوية البطانية. في الجانب البعيد ، يمتد الكيس اللمفاوي الداخلي ، المحاط بأنسجة متجانسة (CT) ، ويبرز إلى الخارج من المتاهة العظمية ومحصور بين الأم الجافية (DM) والجيب السيني مع الجزء الحرشفية من العظم الصدغي (TB).
(و) يتم استخدام إبرة رفيعة لقطع الكيس اللمفاوي البطاني (باتباع الخطوط الصفراء المنقطة على اللوحة D).
(ز) تتم إزالة المستحضر بعناية من العظم الصدغي عن طريق إمساك الأنسجة في الموضع الموضح بعلامة النجمة (* ، كما هو موضح في اللوحة E) وتقشيرها.
(ح) كيس لمفاوي كامل معزول مع الأنسجة المحيطة.
(ط) نسخة تخطيطية من هذا الكيس اللمفاوي الداخلي المعزول مع الأنسجة المحيطة.
(ي) كيس الليمفاوية الداخلية المعزولة بدون الأنسجة المحيطة.
قضبان المقياس: 2 مم (B) ، 1 مم (J). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
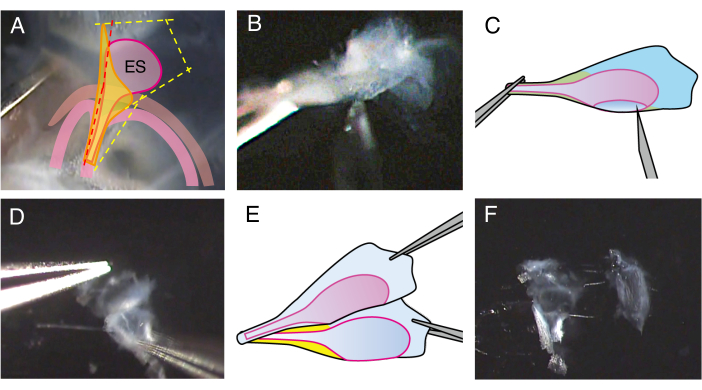
الشكل 2. تشريح الكيس اللمفاوي المفتوح لفأر من النوع البري P5.
(أ) في الخطوة 2.4 ، يتم وضع خط الشق على القناة الدهليزية في الأمام قليلا (الخط الأحمر المنقط) لعمل شق في تجويف الكيس اللمفاوي الباطن.
(ب) أمسك الجزء الجذعي من المستحضر ، وأدخل إبرة قياس 27 في التجويف ، وحركها لتقطيع الكيس اللمفاوي إلى ورقتين.
(ج) رسم تخطيطي لللوحة باء.
(د) أمسك حافة كل ورقة بالملقط وافصلها عن بعضها البعض.
(ه) رسم تخطيطي لللوحة دال.
(و) ينقسم الكيس اللمفاوي البطاني إلى ورقتين، بما في ذلك الظهارة والأنسجة المحيطة بها. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
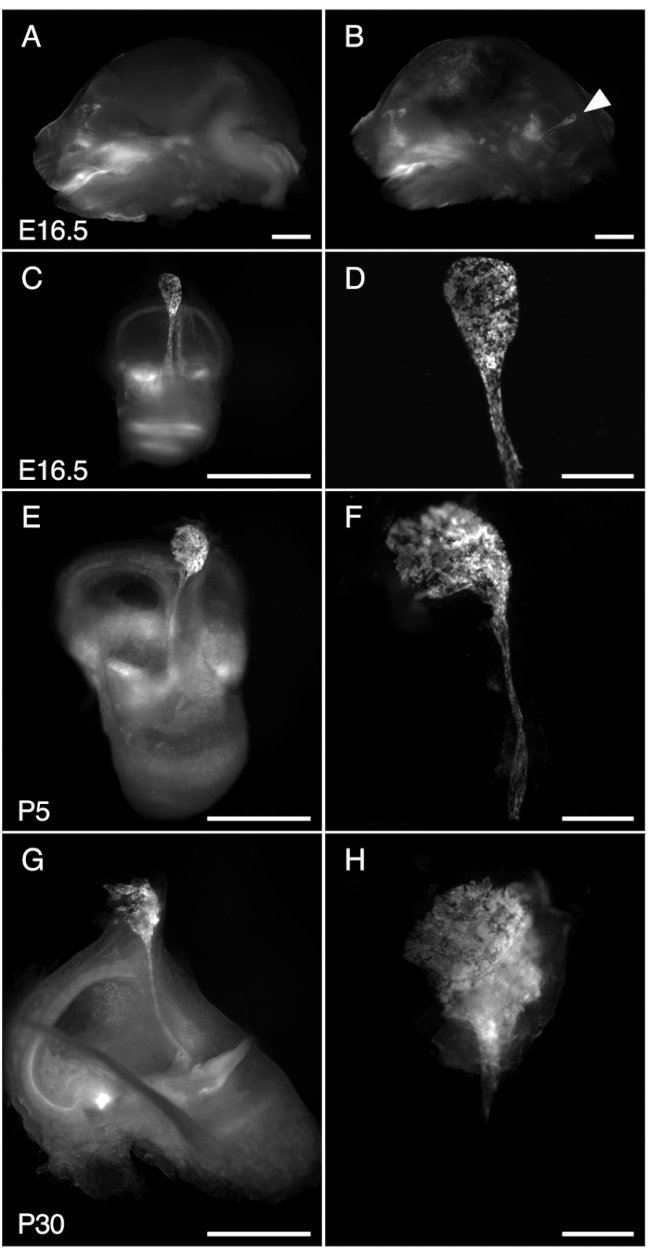
الشكل 3. تشريح R26LSL-RCL-tdT / + ؛ Tg (ATP6V1B1-Cre) 1Rnel / Mn كيس اللمفاوی البطاني للفأر في E16.5 و P5 و P30. تظهر جميع الصور المعروضة tdتألق الطماطم الذي تم الحصول عليه باستخدام مجهر مجسمة مع هدف 1 × مجهز للكشف عن tdمضان الطماطم.
(أ ، ب) الجزء السهمي المتوسط من جمجمة E16.5 R26LSL-RCL-tdT / + ؛ Tg (ATP6V1B1-Cre) 1Rnel / Mn الفأر قبل (A) وبعد (B) إزالة نصف الدماغ. tdيحدد مضان الطماطم موضع الأذن الداخلية. يمكن رؤية الكيس اللمفاوي الداخلي بسهولة حتى بدون تشريح (رأس السهم).
(ج ، ه ، ز) آذان داخلية معزولة من الفئران E16.5 و P5 و P30 ، على التوالي.
(د ، و و ه) صور تكبير أعلى للأكياس والقنوات اللمفاوية الداخلية المقابلة التشريح المجهري. في P30 ، يتم تغليف القناة اللمفاوية الداخلية في العظام مما يجعل عزلها صعبا بشكل خاص. قضبان المقياس: 2 مم (أ ، ب ، ج ، ه ، ز) ، 500 ميكرومتر (د ، و ، ح). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
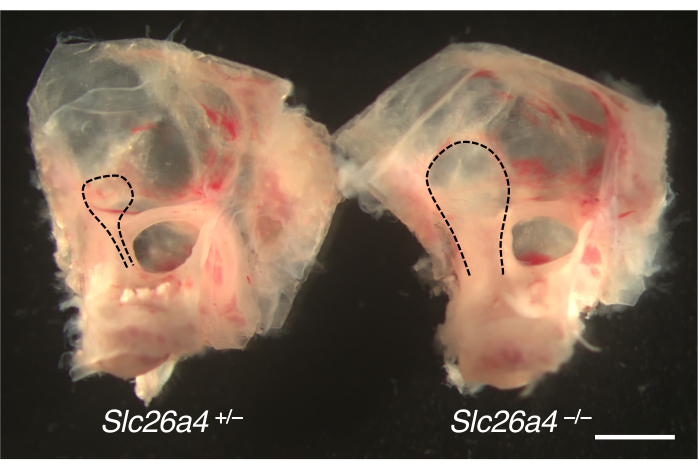
الشكل 4. التشريح الإجمالي لكبسولة الأذن مع كيس لمفاوي متضخم. آذان داخلية من Slc26a4 +/- (يسار) و Slc26a4 - / - (يمين) رفقاء الفأر في P105. يتم توسيع القناة الدهليزية والكيس والقناة اللمفاوية الداخلية (الخطوط المنقطة السوداء) في فأر Slc26a4 - / - مقارنة بتلك الموجودة في فأر Slc26a4 +/- . شريط المقياس: 2 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
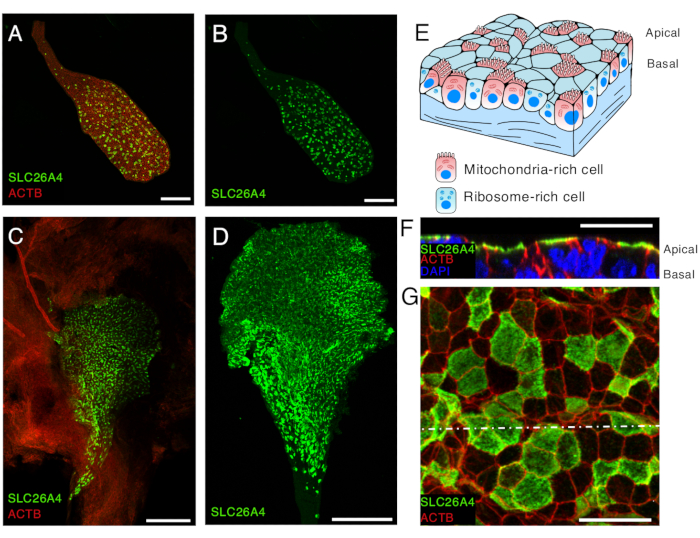
الشكل 5. SLC26A4 التعبير عن الخلايا الغنية بالميتوكوندريا في ظهارة الكيس اللمفاوي الداخلي عند E16.5 و P5.
(أ ، ب) كيس باطن لمفي معزول من فأر E16.5 المسمى بجسم مضاد مضاد SLC26A4 (أخضر) وفالودين الذي يضع ملصقات β-أكتين (ACTB ، أحمر).
(ج) صورة منخفضة التكبير لكيس الليمفاوية المفتوحة من فأر P5 تحمل علامة بجسم مضاد مضاد SLC26A4 (أخضر). يمكن استخدام الفالودين (ACTB ، أحمر) لتسليط الضوء على وجود الكيس اللمفاوي الباطن وكذلك الأنسجة الملتحمة المحيطة به.
(د) كيس لمفاوي باطن معزول مسمى بجسم مضاد مضاد SLC26A4 (أخضر).
(ه) رسم تخطيطي لظهارة الكيس اللمفاوي الداخلي يسلط الضوء على وجود نوعين من الخلايا: الخلايا الغنية بالميتوكوندريا ، التي يغطى سطحها القمي بالميكروفيلي ، والخلايا الغنية بالريبوسوم.
(إف جي) صور عالية التكبير لظهارة الكيس اللمفاوي الداخلي عند P5 ، بعد فتح الكيس اللمفاوي الداخلي وتصنيفه بجسم مضاد مضاد SLC26A4 (أخضر) والفالودين (ACTB ، أحمر). تظهر صورة تمثيلية على مستوى الغشاء القمي في G ، ويظهر مقطع عرضي معاد بناؤه من z-stack على مستوى الخط الأبيض المنقط في F. يتم تصنيف نواة الخلايا ب DAPI (أزرق).
قضبان المقياس: 100 ميكرومتر (أ ، ب) ؛ 200 ميكرومتر (ج ، د) ؛ 20 ميكرومتر (F ، G). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1. ضوء الحادث والصور المضاقة tdTomato المقابلة ل P5 R26LSL-RCL-tdT / + ؛ Tg (ATP6V1B1-Cre) 1Rnel / Mn الأذن الداخلية للفأر في ثلاث خطوات من التشريح. يمكن تصور الكيس والقناة اللمفاوية الداخلية بسهولة باستخدام tdTomato المضأل.
(أ-ب) منطقة الأذن الداخلية في الجزء الخلفي من نصف جمجمة سليمة من P5 R26LSL-RCL-tdT / + ؛ Tg (ATP6V1B1-Cre) 1Rnel / Mn الماوس.
(C-D) تسمح إزالة الجلد وجزء من الجمجمة برؤية أفضل لمنطقة الكيس اللمفاوي.
(ه، و) الأذن الداخلية المعزولة مع الكيس اللمفاوي البطاني الذي لا يزال مرتبطا بالأنسجة الملتحمة.
(أ ، ج ، ه) الصور الملتقطة في ضوء الساقط. (ب ، د ، و) tdتألق الطماطم للأنسجة المقابلة. قضبان المقياس: 2 مم (A-B) ، 1 مم (C-F). الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2. مقارنة بين تألق الأكياس اللمفاوية الداخلية المعزولة ل R26LSL-RCL-tdT / + ؛ Tg (ATP6V1B1-Cre) 1Rnel / Mnو R26LSL-RCL-tdT /+ الفئران littermate في E16.5 و P5. tdيسهل مضان الطماطم إلى حد كبير التعرف على الكيس والقناة اللمفاوية.
(أ-ج) الأكياس اللمفاوية الداخلية المجهرية من E16.5 R26LSL-RCL-tdT / + ؛ Tg (ATP6V1B1-Cre) 1Rnel / Mn (A) و R26LSL-RCL-tdT / + الفئران littermate (B ، C).
(D-F) الأكياس اللمفاوية الداخلية المجهرية من P5 R26LSL-RCL-tdT / + ؛ Tg (ATP6V1B1-Cre) 1Rnel / Mn (D) و R26LSL-RCL-tdT / + الفئران littermate (E ، F).
(أ ، ب ، د ، ه) tdمضان الطماطم. (ج، و) صور الضوء الساقط المقابلة ل B و E. أشرطة المقياس: 500 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
استخدم العديد من الباحثين أقساما مدمجة بالبارافين أو مجمدة للدراسات المورفولوجية للكيس اللمفاوي الباطن. عيب المستحضرات المجزأة هو أنه قد يكون من الصعب مراقبة التلامس المعقد من خلية إلى أخرى بشكل كامل لأن حجم وشكل كل خلية ظهارية في الكيس اللمفاوي الداخلي متغير للغاية ، مما يشكل طبقة خلية مجعدة وكاذبة. يسمح التلوين المناعي الكامل والتصوير z-stack ، الموصوف في هذا البروتوكول ، بتصور أفضل للبنية ثلاثية الأبعاد للكيس اللمفاوي الباطن.
من أجل التشريح المجهري الناجح ، فإن النقطة الحاسمة هي تصور الخطوط العريضة الكاملة لكيس الليمفاوية الداخلية عقليا ، حتى لو كان غير مرئي في الفأر من النوع البري. يمكن أن تكون ملاحظة مراسل الفلورسنت الموضح في الشكل 3 وفي الشكل التكميلي 1-2 مفيدة في التعرف على توطين وحجم الكيس اللمفاوي الداخلي في الفئران.
بينما تم استخدام طريقة التشريح الكاملة هذه للتلوين المناعي في البروتوكول أعلاه ، يمكن أيضا استخدام هذه التقنية لحصاد أنسجة الكيس اللمفاوي الداخلي لتحليل التعبير الجيني ، مثل RT-qPCR ، وتعبير المصفوفات الدقيقة ، وحتى تسلسل الحمض النووي الريبي أحادي الخلية. تم الإبلاغ سابقا عن نتائج تحليل الحمض النووي الريبي أحادي الخلية باستخدام الأنسجة المعدة بهذا البروتوكول16. لتحليل التعبير الجيني للخلايا الظهارية للكيس اللمفاوي الداخلي ، يفضل جمع الظهارة المعزولة حتى لا يكون هناك تلوث بالأنسجة المجاورة الأخرى. على الرغم من أنه يمكن فصل الكيس اللمفاوي الجنيني عن الأنسجة الضامة المجاورة ، إلا أنه يصعب القيام به في الأعمار اللاحقة. بالنسبة للعينات من الفئران الأكبر سنا ، يتم تشجيع الحضانة بالكولاجيناز / التباين لمدة 5 دقائق عند 37 درجة مئوية ويسهل عزل ظهارة الكيس اللمفاوي الباطن.
أحد عيوب التلوين المناعي الكامل الموصوف في هذا البروتوكول هو أن الهيكل ثلاثي الأبعاد الأصلي قد يتأثر بالصدمة أثناء تشريح أو تركيب المستحضر بين الشريحة الزجاجية والغطاء. هناك حاجة إلى توخي الحذر لتجنب القطع الأثرية بسبب التلاعب.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا البحث جزئيا من قبل برنامج البحوث الداخلية التابع للمعاهد الوطنية للصحة ، NIDCD (صناديق البحوث الداخلية للمعاهد الوطنية للصحة Z01-DC000060 و ZIC DC000081 إلى قلب التصوير المتقدم). نحن ممتنون للدكتورين راؤول دي نيلسون و آر لانس ميلر (جامعة يوتا ، سولت ليك سيتي ، يوتا) والدكتورة سوزان وول (كلية الطب بجامعة إيموري ، أتلانتا ، جورجيا) لمشاركة الفئران Tg (ATP6V1B1-Cre) وموظفي منشأة NIDCD لرعاية حيواناتنا. نعرب عن امتناننا للدكتورة فيلين وانجيمان على الرسم التوضيحي الجميل للأذن الداخلية. نشكر الدكتورين توماس ب. فريدمان وروبرت جيه موريل على مراجعة هذه المخطوطة بشكل نقدي.
Materials
| Name | Company | Catalog Number | Comments |
| EDTA 0.5 M | Crystalgen | 221-057 | |
| 1 mL TUBERCULIN syringe with 27G x 13mm | BD | 309623 | |
| 9-well spot glass plate | Pyrex | 13-748B | |
| Alexa Fluor 555-conjugated phalloidin | ThermoFisher Scientific | A34055 | |
| Artery Scissors - Ball Tip | Fine Science Tools | 14080-11 | |
| Bovine serum albumin | Sigma Aldrich | A3059 | |
| Camera to capture images in incident light | Leica | DFC 495 | |
| Camera to capture fluorescent images | Leica | DFC 7000 GT | |
| Centrifuge tubes 15 mL | Corning | 430053 | |
| Centrifuge tubes 50 mL | Corning | 430829 | |
| Collagenase/Dispase | Roche | 10269638001 | |
| Confocal microscope | Zeiss | LSM 880 | |
| Cover Glass | Corning | 2940-223 | |
| Dumont #4 Forceps | Fine Science Tools | 11241-30 | |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Alternative: Extra Fine Micro Dissecting Scissors; Straight; Sharp Points; 20mm Blade Length; 3 1/2" Overall Length | Roboz | RS-5880 | |
| Goat anti-rabbit Alexa Fluor 488-conjugated secondary antibody | ThermoFisher Scientific | A11034 | |
| MicroSlides Superfrost | VWR | 48311-702 | |
| Orbital shaker, for example Mini Shaker | Daigger | 980275 | |
| Paraformaldehyde (PFA) 16% Aqueous Solution | Electron Microscopy Sciences | 15710 | |
| Phosphate-Buffered Saline (10X) pH 7.4 | ThermoFisher Scientific | AM9624 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36931 | |
| Rabbit anti-Pendrin antibodies | In-house | RRID:AB_2713943, PB826 (Choi et al., 2011) | |
| Ring Forceps | Fine Science Tools | 11106-09 | |
| Rocking shaker, for example GyroMini | Labnet | S0500 | |
| Stereomicroscope equipped with a PlanApo 1.0x objective | Leica | ||
| Stainless Steel Single Edge Blades, .009" | GEM Personna | 62-0176 | |
| Tissue culture dish 60 mm | Falcon | 353002 | |
| Transparent nail polish | |||
| Triton X-100 | ACROS Organics | 32737-1000 |
References
- Dror, A. A., Brownstein, Z., Avraham, K. B. Integration of human and mouse genetics reveals pendrin function in hearing and deafness. Cellular Physiology and Biochemistry. 28 (3), 535-544 (2011).
- Reardon, W., CF, O. M., Trembath, R., Jan, H., Phelps, P. D. Enlarged vestibular aqueduct: a radiological marker of pendred syndrome, and mutation of the PDS gene. QJM. 93 (2), 99-104 (2000).
- Griffith, A. J., Wangemann, P. Hearing loss associated with enlargement of the vestibular aqueduct: mechanistic insights from clinical phenotypes, genotypes, and mouse models. Hearing Research. 281 (1-2), 11-17 (2011).
- Gurkov, R., Pyyko, I., Zou, J., Kentala, E. What is Meniere's disease? A contemporary re-evaluation of endolymphatic hydrops. Journal of Neurology. 263, 71-81 (2016).
- Eckhard, A., et al. Water channel proteins in the inner ear and their link to hearing impairment and deafness. Molecular Aspects of Medicine. 33 (5-6), 612-637 (2012).
- Choi, B. Y., et al. Mouse model of enlarged vestibular aqueducts defines temporal requirement of Slc26a4 expression for hearing acquisition. Journal of Clinical Investigation. 121 (11), 4516-4525 (2011).
- Miyashita, T., et al. Presence of FXYD6 in the endolymphatic sac epithelia. Neuroscience Letters. 513 (1), 47-50 (2012).
- Royaux, I. E., et al. Localization and functional studies of pendrin in the mouse inner ear provide insight about the etiology of deafness in pendred syndrome. Journal of the Association for Research in Otolaryngology. 4 (3), 394-404 (2003).
- Kim, H. M., Wangemann, P. Epithelial cell stretching and luminal acidification lead to a retarded development of stria vascularis and deafness in mice lacking pendrin. PLoS One. 6 (3), 17949 (2011).
- Dahlmann, A., von During, M. The endolymphatic duct and sac of the rat: a histological, ultrastructural, and immunocytochemical investigation. Cell and Tissue Research. 282 (2), 277-289 (1995).
- Everett, L. A., et al. Targeted disruption of mouse Pds provides insight about the inner-ear defects encountered in Pendred syndrome. Human Molecular Genetics. 10 (2), 153-161 (2001).
- Miller, R. L., et al. The V-ATPase B1-subunit promoter drives expression of Cre recombinase in intercalated cells of the kidney. Kidney International. 75 (4), 435-439 (2009).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Wang, L., Jiang, H., Brigande, J. V. Gene transfer to the developing mouse inner ear by in vivo electroporation. Journal of Visualized Experiments. (64), e3643 (2012).
- Currle, D. S., Hu, J. S., Kolski-Andreaco, A., Monuki, E. S. Culture of mouse neural stem cell precursors. Journal of Visualized Experiments. (2), 152 (2007).
- Honda, K., et al. Molecular architecture underlying fluid absorption by the developing inner ear. Elife. 6, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved