Method Article
생쥐의 내림프낭 해부
* 이 저자들은 동등하게 기여했습니다
요약
이 연구는 다양한 연령에서 쥐의 내이에서 내림프낭을 해부하는 방법을 설명합니다. 유사한 해부의 결과는 내림프낭의 확대에 대한 Slc26a4-null 마우스 모델에 나타나 있습니다. 내림프낭에 발현된 형광 리포터가 있는 형질전환 마우스를 내림프낭을 쉽게 시각화할 수 있는 모델과 교육 도구로 제시합니다.
초록
인간의 청각 및 균형 장애에 대한 돌연변이 마우스 모델에 대한 연구는 인간 표현형에 기여할 수 있는 많은 구조적 및 기능적 변화를 밝혀냈습니다. 달팽이관과 전정의 신경감각 상피의 발달과 기능에 대한 이해에 중요한 진전이 이루어졌지만, 내림프낭의 발달, 세포 구성, 분자 경로 및 기능적 특성에 대한 지식은 제한적입니다. 이는 대부분 하나의 세포층으로만 구성된 상피인 이 조직을 시각화하고 미세해부하는 것이 어렵기 때문입니다. 여기에 제시된 연구는 다양한 연령에서 야생형 쥐 내이에서 내림프낭에 접근하고 미세해부하는 접근 방식을 설명합니다. 유사한 해부의 결과는 전정 수로의 확대에 대한 펜드린 결핍 마우스 모델에서 나타납니다. 형광 내림프낭이 있는 형질전환 마우스가 제시됩니다. 이 리포터 마우스는 제한된 해부로 내림프낭을 쉽게 시각화하고 그 크기를 결정하는 데 사용할 수 있습니다. 또한 내림프낭을 해부하는 방법을 가르치는 교육 도구로도 사용할 수 있습니다. 이러한 절개 절차는 내이의 충분히 연구되지 않은 부분의 추가 특성화를 용이하게 할 것입니다.
서문
포유류의 내이(內耳)는 달팽이관(cochlea), 낭(saccule), 요실(utricle), 3개의 반고리관(semi-circular canals) 및 내림프낭(endolymphatic sac)으로 구성되어 있습니다(그림 1A). 이 기관은 막질 미로(membranous labyrinth)라고 하는 연속적이고 액체로 채워진 상피로 구성되어 있으며, 인접한 장기는 직접 연결되거나 reuniens관, saccular duct, utricular duct 또는 endolymphatic duct와 같은 작은 운하 구조를 통해 연결됩니다. 내이의 다른 기관과 비교했을 때, 내림프낭은 독특한 특성을 가지고 있습니다. 첫째, 감각 상피세포가 부족하다. 대신, 내림프 주머니에는 이온 수송에 특화된 세포가 있습니다. 둘째, 막미로(membranous labyrinth)는 뼈 미로(boney labyrinth)로 둘러싸여 있지만, 내림프낭(endolymphatic sac)은 예외적이며, 부분적으로 연골에서 두개강내(intracranial cavity)로 돌출되어 있다. 이 형태는 내이(內耳)의 진화 과정에서 매우 보존된 것으로 보인다. 셋째, 내림프낭(endolymphatic sac)은 다른 장기가 형성되기 전의 초기 배아 단계에서 이낭에서 발달하는 첫 번째 구조입니다. 또한, 여러 병리학이 비대해진 내림프낭 또는 비정상적인 내림프 구획과 관련이 있습니다. SLC26A4에서 병원성 변이체(펜드린 유전자라고도 함)의 존재는 전정수로(EVA)의 확대와 관련된 내림프낭의 비대로 인해 발생하는 비교적 흔한 형태의 감각신경성 난청을 유발합니다1. 갑상선종과 관련된 경우, Pendred 증후군 2,3이라고 불립니다. 메니에르병은 또한 일부 사람들은 내림프막(hydrops)의 이상과 관련이 있다고 생각합니다4. 내림프낭의 독특한 특징과 그 형태의 변화와 관련된 병리학은 내이의 발달 및 유지에 중요한 역할과 일치합니다.
그 중요성에도 불구하고 내림프낭의 발달, 세포 구성, 분자 경로 및 기능적 특성에 대한 지식은 여전히 제한적입니다. 이것은 적어도 부분적으로는 이 조직을 시각화하고 미세해부하는 것이 어렵기 때문입니다. 내림프낭은 상피세포의 단일 층으로 구성된 주머니 모양의 구조로, 종종 반투명하고 가벼운 입체현미경으로 둘러싸고 있는 결막 조직에서 식별하기가 매우 어렵습니다. 소수의 연구자들이 전체 산 해부 기술을 개발하고 실험 결과를 발표했지만 5,6,7,8,9,10 이 절차의 기술적 세부 사항에 초점을 맞춘 출판물은 없습니다.
이 연구에서는 다양한 연령의 야생형 쥐 내이에서 내림프낭에 접근하고 분리하기 위해 개발된 미세해부 접근법을 전체 마운트에서 설명합니다. 유사한 해부의 결과는 내림프관과 주머니가 확대된 SLC26A4의 발현이 결여된 마우스 모델에서 볼 수 있습니다. 내림프낭(endolymphatic sac)에서 발현된 Cre 재조합효소(Cre recombinase)를 암호화하는 전이유전자(transgene)를 가진 마우스(mouse) 계통이 보고되었다. Cre 발현의 형광 리포터(여기서는 tdTomato)가 있는 경우, 형광을 사용하여 제한된 해부로 내림프낭을 쉽게 시각화하고 그 크기에 대한 정보를 얻을 수 있습니다. 이 리포터 마우스 라인은 내림프낭 절개를 연습하고 완벽하게 하기 위한 교육 도구로도 사용할 수 있습니다. 내림프낭 조직을 해부할 수 있는 능력은 연구가 부족하지만 내이의 필수 구성 요소인 내이의 추가 특성 분석을 용이하게 할 것입니다.
프로토콜
모든 동물 실험 및 시술은 미국 국립신경질환 및 뇌졸중 연구소(National Institute of Neurological Diseases and Stroke)/국립청각 장애 및 기타 의사소통 장애 연구소(National Institute on Deafness and Other Communication Disorders, #1264)의 동물 관리 및 사용 위원회(Animal Care and Use Committees)와 도쿄 의과대학(Tokyo Medical and Dental University)의 기관 동물 관리 및 이용 위원회(Institutional Animal Care and Use Committee, A2020-058A)에서 승인한 프로토콜에 따라 수행되었습니다.
참고: C57BL/6J 마우스(재고 번호 000664), Pds-/-Slc26a4-/-라고도 함--마우스(129S-Slc26a4 tm1Egr/AjgJ, 번호 018424) 11, B6; CBA-Tg(ATP6V1B1-Cre)1Rnel/Mm 마우스12 및 Ai9(LSL-RCL-tdT) (B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze, no. 007909) 마우스13은 Jackson Laboratory에서 요청하여 구할 수 있습니다. 모든 유전형 분석 절차는 이전에 설명되었습니다. 나6; CBA-Tg(ATP6V1B1-Cre)1Rnel/Mm 마우스는 이전에 적어도 5세대 동안 C57BL/6J 균주로 역교배되어 실험을 위해 사육되었습니다. 남녀 모두의 동물은 명백한 차이 없이 이 접근 방식으로 연구할 수 있습니다. 하룻밤 짝짓기 후 첫 날은 배아 일 0.5(E0.5)로 계산됩니다.
1. 두개골에서 온전한 내이의 채취 및 고정
- 예를 들어 CO2 흡입을 사용하여 기관에서 승인된 절차를 사용하여 실험 동물 또는 임신 댐을 안락사시킵니다. 마우스 알레르겐의 확산을 피하거나 최소화하기 위해 가능하면 흄 후드 아래에서 작업하십시오. 발이나 꼬리를 꼬집는 것과 같은 고통스러운 자극에 대한 반응 부족을 확인한 후 동물의 목을 베십시오. 임신 중인 댐의 경우, 내이가 추가 실험에 사용되지 않는 경우 자궁 경부 탈구를 참수의 대안으로 사용할 수 있습니다.
- 개복술로 배아를 채취합니다14 과정에서 배아를 보호하기 위해 볼 팁이 있는 동맥 가위를 사용합니다. 고리 집게를 사용하여 배아를 조작합니다. 자궁 뿔을 얼음 위의 4 °C PBS에 놓고 앞에서 설명한 대로 각 배아를 분리합니다15 목을 베기 전에.
- 머리를 뒤에서 앞으로 이등분: 먼저 피부를 절개하여 정수리를 절개한 다음 두개골 상단을 절개하고 절단할 때마다 약 1/3을 절개하여 두개골이 구부러지지 않도록 합니다. 그런 다음 두개골의 바닥을 한 번에 자릅니다.
알림: 배아의 경우 가위보다는 날카로운 칼날을 사용하는 것이 좋습니다. 모든 연령대에서 두개골을 이등분하는 동안 두개골이 변형되지 않는 것이 중요합니다. - 두개골을 만지거나 구부리지 않고 반뇌를 조심스럽게 제거하여 뼈 미로가 드러납니다(그림 1B, 보충 그림 1A-B).
- 생후 5일 이상의 생쥐의 경우 외이도를 횡단하고 피부를 코 쪽으로 앞으로 당깁니다. 내이 주위의 두개골을 자릅니다(보충 그림 1C).
- 내이가 가능한 한 손상되지 않은 각 동물의 두 반두개골을 1x PBS에 희석한 4°C 4% 파라포름알데히드(PFA) 10mL가 들어 있는 유리 바이알 또는 튜브에 옮기고 흄 후드 아래 얼음 속에 보관합니다.
알림: 이 단계에서 두개골에서 내이를 제거하려고 하면 내림프관과 주머니가 손상될 수 있으므로 제거하지 마십시오. - 4 °C에서 1시간 동안 로킹 쉐이커에서 배양합니다. 형광 리포터가 있는 동물의 조직으로 작업하는 경우 표본이 들어 있는 튜브를 알루미늄 호일이나 상자에 넣어 빛에 대한 노출을 최소화하십시오.
참고: 미세소관 및 관련 분자 연구에 관심이 있는 경우 RT 고정제를 사용하여 실온(RT)에서 조직 고정을 수행해야 합니다. - PFA를 흄 후드의 적절한 용기에 넣어 폐기하십시오. 1x PBS 10mL로 매번 RT의 흔들리는 셰이커에서 15분 동안 3회 세척하여 해부 전에 정착제를 제거합니다.
2. 내림프낭 현미절개
- 각 내이 제제를 1x PBS가 들어 있는 35mm 조직 배양 접시에 옮깁니다.
- 8번째 뇌신경의 뿌리가 위로 향하도록 접시에 준비제를 놓습니다. #4 겸자로 달팽이관을 잡아 이 위치에 조직을 잡습니다(그림 1C).
- 중요한 랜드마크를 식별합니다: 전정관, 전방 및 후방 반고리관, 일반 crus, S상 동(정맥)(그림 1D).
참고: 야생형 쥐의 내림프낭은 반투명하여 시각화하기 어렵습니다. 내림프낭의 성공적인 미세해부를 위해서는 해부학적 구조와 국소화를 이해하는 것이 중요합니다(그림 1E). - 1mL 주사기에 27G 바늘을 사용하여 경막과 전정관, 내림프낭을 둘러싼 기본 결합 조직을 절개합니다(그림 1D,F).
참고: 성체 마우스의 경우 미세 절개 전에 10% EDTA(pH 7.4)를 사용하여 제제의 석회질을 제거하는 것이 유용하지만 필수는 아니지만 전정 수로의 절개를 용이하게 합니다. 출생 후 5일째 이전에 열린 내림프낭을 절개하는 경우, 내림프낭 내강을 절개하기 위해 전정수로의 절개선을 약간 앞쪽에 위치시키는 것이 좋습니다(그림 2A). - 내림프낭 측면에 위치한 결합 조직을 겸자로 잡고 조직을 위로 당겨 측두골에서 벗겨냅니다(그림 1G).
- 남아 있는 이물질을 조심스럽게 제거합니다. 제제에는 일반적으로 내림프낭 상피, 주변 결합 조직, 전정 수로의 일부 및 S상 동이 포함됩니다(그림 1H-I). 필요한 경우 내림프낭 상피를 주변 조직과 분리합니다(그림 1J).
- (선택 사항) 열린 내림프낭을 절개하려면 내강의 단면적이 관찰될 수 있도록 제제의 줄기 부분을 잡습니다. 27G 바늘을 내강에 삽입하고 움직여 내림프낭을 두 장으로 자릅니다(그림 2B-C). 각 시트와 같은 조직의 가장자리를 집게로 잡고 서로 분리합니다(그림 2D-F).
3. 면역조직화학(Immunohistochemistry)
- 미세해부 후 #5 겸자를 사용하여 내림프낭을 9웰 스폿 유리판으로 옮깁니다.
- 현미경을 사용하여 내림프낭이 그대로 유지되도록 하고 200μL 피펫을 사용하여 조직이 포함된 한 방울을 제외한 모든 1x PBS를 제거합니다. 200μL의 투과성 및 차단 용액(0.15% Triton X-100(PBS-TX) 및 5% 소 혈청 알부민(BSA)이 포함된 PBS 5개)를 추가하고 궤도 셰이커에서 RT에서 1시간 동안 배양합니다.
- 조직을 함유하고 있는 한 방울을 제외한 모든 차단 용액을 제거한 후 200μL의 1차 항체를 추가하고 4°C에서 하룻밤 동안 배양합니다. 차단 용액에 1:1000으로 희석된 항-펜드린 항체6 는 내림프낭의 미토콘드리아가 풍부한 세포를 식별하는 데 사용할 수 있지만, 리보솜이 풍부한 세포16 의 하위 집합에서도 희미한 발현이 관찰됩니다(그림 5).
- RT에서 1x PBS에서 15분 동안 3회 세척한 후 2차 항체로 배양합니다. 여기에 제시된 라벨링을 위해 상용 스톡에서 1:500으로 희석한 200μL의 형광 염료 접합 2차 항체를 차단 용액에 넣고 조직을 어두운 곳에서 RT에서 1시간 동안 흔들 수 있는 플랫폼에서 배양합니다. β-actin(ACTB)을 인식하는 형광 염료 접합 팔로이딘(phalloidin)은 내림프낭과 관의 존재 및 그 주변의 결막 조직을 강조하는 데 사용할 수 있습니다(그림 5A, C, F-G).
- DAPI가 있는 페이드 방지 장착 매체를 사용하여 유리 슬라이드와 커버슬립 사이에 내림프 주머니를 장착합니다. RT에서 1시간 동안 빛으로부터 보호된 슬라이드를 건조시킨 후 커버슬립과 유리 슬라이드 사이의 접합부에 투명 매니큐어를 바르면 밀봉하고 기포 형성을 제한합니다. 상피 세포의 정점 표면과 기저 표면에서 단백질의 차등 분포를 시각화하려는 경우, 장착 단계에서 가장자리를 절개하고 열어 주머니를 여는 것이 좋습니다.
- 컨포칼 현미경을 사용한 이미지. 먼저 10x 대물렌즈로 내림프낭 제제를 시각화하여 주머니 라벨링에 대한 전체적인 보기를 제공합니다(그림 5A-D). 그런 다음 63x 대물렌즈를 사용하여 내림프낭의 미토콘드리아 및 리보솜이 풍부한 세포에서 관심 단백질의 분포를 자세히 볼 수 있습니다(그림 5F-G).
결과
출생 후 5일차(P5) 마우스에서 야생형 내림프낭을 미세해부의 각 단계는 관련 비디오에 자세히 설명되어 있으며, 이 해부의 주요 단계와 내림프낭 개방의 스냅샷은 그림 1 및 그림 2 에 나와 있습니다.
이 프로토콜에 따라 배아 16.5일째(E16.5), P5 및 P30에 tdTomato 형광을 사용한 내림프낭 해부의 대표적인 결과는 그림 3과 보충 그림 1 및 보충 그림 2에 제시되어 있습니다. 형광 기능이 있는 해부 현미경을 사용하면 Cre 발현 보고자: Ai9(LSL-RCL-tdT)의 입사광 및 tdTomoto 형광에서 캡처된 이미지에 대한 그림 3A-B 및 보충 그림 1 참조)에서 전이유전자 Tg(ATP6V1B1-Cre)를 운반하는 마우스에서 뇌를 제거한 후 두개골에서 내림프낭을 쉽게 시각화할 수 있습니다(해부의 여러 단계에서 내림프낭의 입사광 및 tdTomato 형광에서 캡처된 이미지는 그림 3A-B 및 보충 그림 1 참조). 이 마우스에서 Cre는 내림프낭 및 관을 따라 세포에서 모자이크로 발현됩니다(그림 3, 형광 리포터가 있는 경우와 없는 내림프낭의 시각화에 대한 보충 그림 2 참조). 본 보고자의 발현은 이 상피의 두 가지 세포 유형 중 하나인 내림프낭(16)의 미토콘드리아가 풍부한 세포에 국한된 Atp6v1b1의 내인성 발현에 특이적이지는 않지만(그림 5E), 내림프낭을 식별하고 해부하는 데 도움이 됩니다.
전정 수로의 확대를 위해 마우스 모델에서 절개한 내이가 그림 4에 나와 있습니다. 대조군 새끼와 비교했을 때, SLC26A4(pendrin)이 결핍된 쥐의 내림프낭과 관이 확대되어 있다.
결막 조직이 있는 경우와 없는 경우의 온전한 내림프낭의 면역조직화학의 대표적인 이미지가 그림 5에 나와 있습니다. P5 야생형 마우스의 열린 내림프낭의 면역조직화학(immunohistochemistry) 결과도 제시되어 있습니다(그림 5F-G). 내림프낭은 내강에 내림프를 포함하는 주머니 모양의 구조로 접힌 단일 층의 상피로 구성됩니다. 이 상피는 미토콘드리아가 풍부한 세포와 리보솜이 풍부한 세포의 두 가지 세포 유형으로 구성됩니다(그림 5E). 전체 마운트 내림프낭은 내림프가 더 이상 존재하지 않기 때문에 평평해집니다. 주머니는 두 개의 얽힌 상피층으로 나타나 이 상피에서 발현되는 단백질의 세포 내 국소화를 결정하기 어렵게 만듭니다. 내림프낭을 열면 단일층 상피를 쉽게 시각화할 수 있으며 내림프낭 내강에 대한 관심 단백질의 상대적 분포를 보다 명확하게 결정할 수 있습니다. 이러한 단백질의 잠재적인 정점(내림프가 있을 경우 루미널) 대 기저 농축을 보다 정확하게 결정할 수 있습니다. 예를 들어, SLC26A4은 미토콘드리아가 풍부한 세포의 정점 쪽에서 농축됩니다(그림 5F).
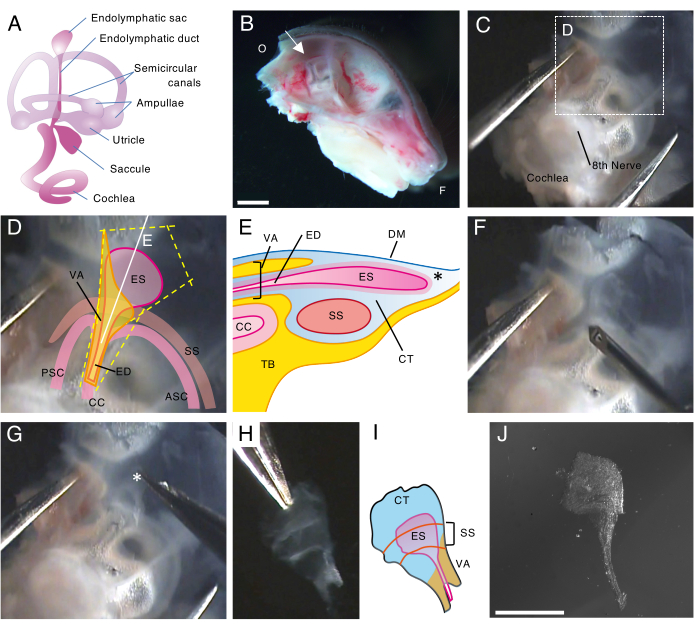
그림 1. 출생 후 5일째(P5)에 야생형 쥐의 내림프낭의 전체 마운트 절개.
(A) 발달된 쥐 내이의 막질 미로의 개략도(오른쪽). 내림프낭의 위치, 달팽이관 및 전정 구조가 표시됩니다. 이 수치는 Honda et al.16에서 수정되었습니다.
(B) 왼쪽 반두개골을 보여주는 중간 시상 부분. 내림프낭의 위치가 표시됩니다(화살표). (O, 후두부; F, 정면)
(C) 측두골의 편평 부분과 함께 귀 캡슐.
(D) 패널 C의 점선 상자에 겹쳐진 중요한 랜드마크(ES, 내림프낭; ED, 내림프관; VA, 전정 수로; ASC, 전방 반고리관; PSC, 후방 반고리관; CC, 일반 crus; SS, S상 부비동)
(E) 내림프낭을 통과하는 패널 D의 연속적인 흰색 선과 함께 단면의 개략도. 내림프낭의 근위부는 내림프관과 함께 전정수로(vestibular aqueduct)라고 하는 뼈 운하로 덮여 있습니다. 원위부에서는 협막 조직(CT)으로 둘러싸인 내림프낭이 뼈 미로 외부로 확장되고 돌출되어 있으며 측두골(TB)의 편평 부분이 있는 경막(DM)과 S상 부비동 사이에 끼어 있습니다.
(F) 가는 바늘을 사용하여 내림프낭 주위를 자릅니다(패널 D의 노란색 점선을 따라).
(G) 제제는 별표로 표시된 위치(*, 패널 E에도 표시됨)에 조직을 잡고 벗겨냄으로써 측두골에서 조심스럽게 제거됩니다.
(H) 주변 조직이 있는 고립된 전체 내림프낭.
(I) 주변 조직이 있는 이 고립된 내림프낭의 개략도.
(J) 주변 조직이 없는 고립된 내림프낭.
눈금자: 2 mm (B), 1 mm (J). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
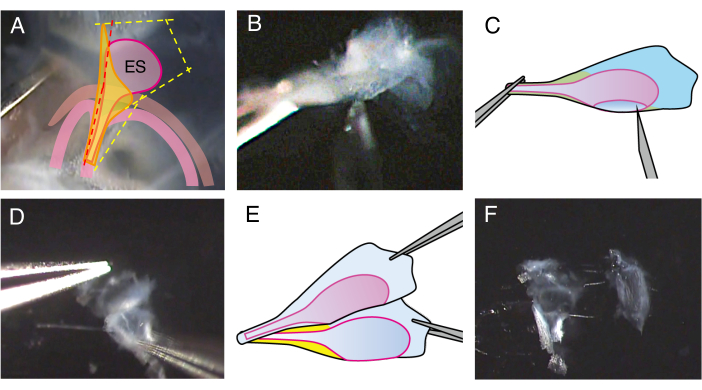
그림 2. P5 야생형 쥐의 열린 내림프낭 해부.
(A) 2.4단계에서 전정관의 절개선은 약간 앞쪽(빨간색 점선)에 위치하여 내림프낭 내강으로 절개합니다.
(B) 제제의 줄기 부분을 잡고 27 게이지 바늘을 내강에 삽입하고 그것을 움직여 내림프 주머니를 두 장으로 자릅니다.
(C) 패널 B의 개략도.
(D) 집게로 각 시트의 가장자리를 잡고 서로 분리합니다.
(E) 패널 D의 개략도.
(F) 내림프낭은 상피와 주변 조직을 포함하여 두 장으로 분리되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
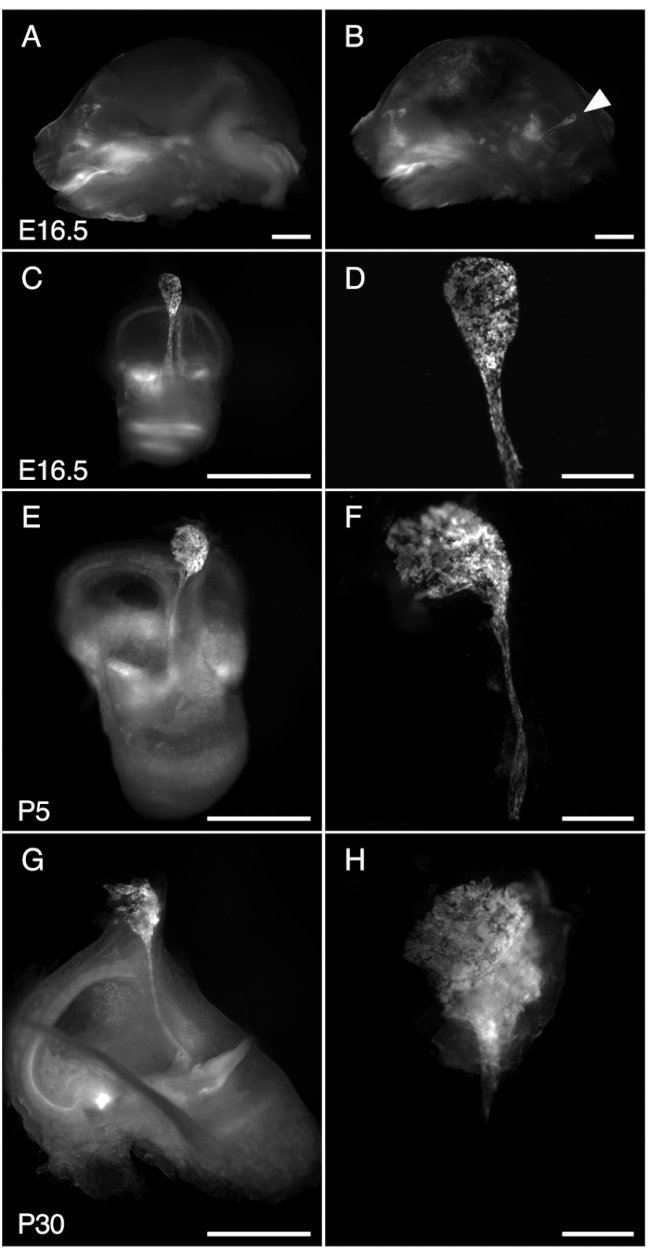
그림 3. R26LSL-RCL-tdT/+의 해부; Tg(ATP6V1B1-Cre)1Rnel/Mn E16.5, P5 및 P30의 마우스 내림프낭. 제시된 모든 이미지는 tdTomato 형광 검출을 위한 1 x 대물렌즈가 장착된 실체현미경을 사용하여 얻은 tdTomato 형광을 보여줍니다.
(ᅡ, 나) E16.5 R26LSL-RCL-tdT/+ 두개골의 중간 시상 부분; Tg(ATP6V1B1-Cre)1Rnel/Mn 쥐 (A) 전(A) 및 (B) 반뇌 제거 후. tdTomato 형광은 내이의 위치를 나타냅니다. 내림프낭은 절개(화살촉) 없이도 쉽게 볼 수 있습니다.
(C, E, G) 각각 E16.5, P5 및 P30 마우스에서 분리된 내이.
(D, F, H) 해당 미세절개된 내림프낭 및 관의 고배율 이미지. P30에서는 내림프관이 뼈에 캡슐화되어 있어 분리하기가 특히 어렵습니다. 스케일 바: 2mm(A, B, C, E, G), 500μm(D, F, H). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
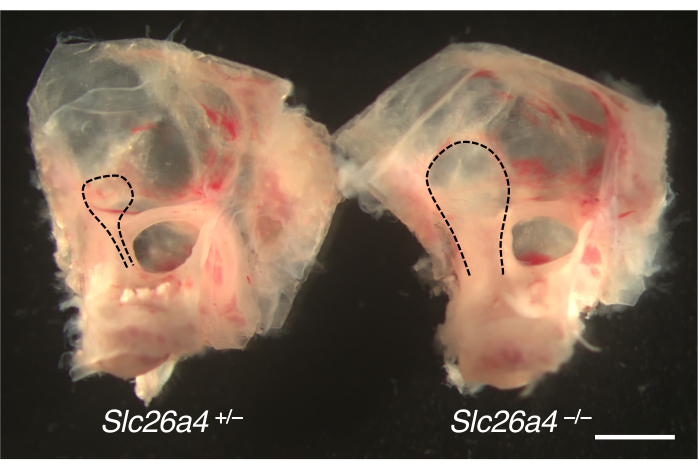
그림 4. 확대된 내림프낭이 있는 귀 캡슐의 총 해부학. Slc26a4+/-(왼쪽) 및 Slc26a4-/-(오른쪽) 쥐의 내이가 P105에서 짝을 이룹니다. 전정 수로와 내림프 주머니 및 관(검은색 점선)은 Slc26a4+/- 마우스에 비해 Slc26a4-/- 마우스에서 확대됩니다. 축척 막대: 2mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
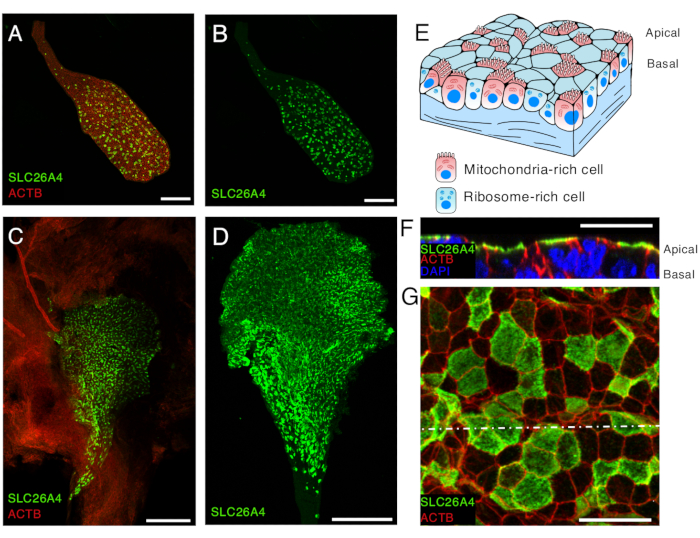
그림 5. E16.5 및 P5의 내림프낭 상피에서 미토콘드리아가 풍부한 세포의 SLC26A4 발현.
(ᅡ, 나) 항SLC26A4 항체(녹색) 및 β-actin(ACTB, 빨간색)을 표시하는 남근으로 라벨링된 E16.5 마우스에서 분리된 내림프낭.
(C) 항SLC26A4 항체(녹색)로 라벨링된 P5 마우스의 열린 내림프낭의 저배율 이미지. Phalloidin(ACTB, 빨간색)은 내림프낭과 그 주변의 결막 조직의 존재를 강조하는 데 사용할 수 있습니다.
(D) 항SLC26A4 항체(녹색)로 라벨링된 분리된 내림프낭.
(E) 내림프낭 상피의 개략도는 두 가지 세포 유형, 즉 정점 표면이 미세융모로 덮여 있는 미토콘드리아가 풍부한 세포와 리보솜이 풍부한 세포의 존재를 강조합니다.
(F-G) 내림프낭을 열고 항SLC26A4 항체(녹색)와 남근(ACTB, 빨간색)으로 라벨링한 후 P5에서 내림프낭 상피의 고배율 이미지. 정점 멤브레인 수준의 대표 이미지는 G로 표시되어 있으며, 반점 흰색 선 수준에서 z-stack의 재구성된 단면은 F로 표시되어 있습니다. 세포의 핵은 DAPI(파란색)로 표시되어 있습니다.
스케일 바: 100 μm (A, B); 200 μm (C, D) ; 20μm(F, G)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1. P5 R26LSL-RCL-tdT/+의 입사광 및 해당 tdTomato 형광 이미지; Tg(ATP6V1B1-Cre)1Rnel/Mn 마우스 내이를 3단계로 절개합니다. 내림프낭과 관은 tdTomato 형광을 사용하여 쉽게 시각화할 수 있습니다.
(AB까지) P5 R26LSL-RCL-tdT/+의 온전한 반두개골의 후방 부분에 있는 내이 영역; Tg(ATP6V1B1-Cre)1Rnel/Mn 마우스.
(C-D) 피부와 두개골의 일부를 제거하면 내림프낭 영역을 더 잘 시각화할 수 있습니다.
(E, F) 내림프낭이 여전히 결막 조직과 연결되어 있는 고립된 내이.
(A, C, E) 입사광에 포착된 이미지. (B, D, F) 해당 조직의 tdTomato 형광. 눈금자: 2 mm (AB), 1 mm (C-F). 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2. R26LSL-RCL-tdT/+의 분리된 내림프낭의 형광 비교; Tg(ATP6V1B1-Cre)1Rnel/Mn및 R26LSL-RCL-tdT/+ E16.5 및 P5에서 리터메이트 마우스. tdTomato 형광은 내림프낭과 관의 인식을 크게 촉진합니다.
(A-C) E16.5 R26LSL-RCL-tdT/+의 미세절개된 내림프낭; Tg(ATP6V1B1-Cre)1Rnel/Mn(A) 및 R26LSL-RCL-tdT/+ littermate 마우스(B, C).
(D-F) P5 R26LSL-RCL-tdT/+의 미세절개된 내림프낭; Tg(ATP6V1B1-Cre)1Rnel/Mn(D) 및 R26LSL-RCL-tdT/+ littermate 마우스(E, F).
(A, B, D, E) td토마토 형광. (씨, 에프) B 및 E에 해당하는 입사광 이미지. 스케일 바: 500 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
많은 연구자들이 내림프낭의 형태학적 연구를 위해 파라핀이 포매되거나 동결된 절편을 사용해 왔습니다. 단면화된 제제의 단점은 내림프낭에 있는 각 상피 세포의 크기와 모양이 매우 다양하여 주름지고 가성층화된 세포층을 형성하기 때문에 복잡한 세포 간 접촉을 완전히 관찰하기 어려울 수 있다는 것입니다. 이 프로토콜에 설명된 Whole-mount immunostaining 및 z-stack imaging을 사용하면 내림프낭의 3차원 구조를 더 잘 시각화할 수 있습니다.
성공적인 현미해부를 위한 중요한 점은 야생형 마우스에서 보이지 않더라도 내림프낭의 전체 윤곽을 정신적으로 시각화하는 것입니다. 그림 3 및 보충 그림 1-2에 표시된 형광 리포터의 관찰은 마우스에서 내림프낭의 국소화 및 크기를 인식하는 데 도움이 될 수 있습니다.
이 전체 마운트 절개 방법은 위의 프로토콜에서 면역염색에 사용되었지만, 이 기술은 RT-qPCR, 마이크로어레이 발현 및 단일 세포 RNA-seq와 같은 유전자 발현 분석을 위한 내림프 주머니 조직을 수확하는 데에도 사용할 수 있습니다. 이 프로토콜로 제조된 조직을 사용한 단일세포 RNA-seq 분석 결과는 이전에보고된 바 있다 16. 내림프낭 상피세포의 유전자 발현 분석을 위해서는 다른 인접 조직과의 오염이 없도록 분리된 상피를 채취하는 것이 바람직하다. 배아 내림프낭(embryonic endolymphatic sac)은 인접한 결합 조직과 분리될 수 있지만, 노년기에는 분리하기가 훨씬 더 어렵습니다. 나이가 많은 마우스의 표본의 경우 37°C에서 5분 동안 콜라겐분해효소/디스파제로 배양하는 것이 권장되며 내림프낭 상피의 분리를 용이하게 합니다.
이 프로토콜에 설명된 전체 마운트 면역염색의 단점 중 하나는 원래의 3차원 구조가 유리 슬라이드와 커버슬립 사이의 제제를 절개 또는 장착하는 동안 외상에 의해 영향을 받을 수 있다는 것입니다. 조작으로 인한 인공물을 피하기 위해주의가 필요합니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 연구는 NIH의 교내 연구 프로그램, NIDCD(NIH 교내 연구 기금 Z01-DC000060 및 ZIC DC000081 Advanced Imaging Core)의 지원을 받았습니다. Tg(ATP6V1B1-Cre) 생쥐를 나눠 주신 Raoul D. Nelson 박사와 R. Lance Miller 박사(유타 대학교, 유타 솔트레이크시티, 유타) 그리고 Susan Wall 박사(조지아주 애틀랜타, 에모리 대학교 의과대학)와 우리 동물을 돌봐 주신 NIDCD 동물 시설 직원들에게 감사드립니다. 우리는 내이의 아름다운 삽화에 대해 Philine Wangeman 박사에게 감사를 표합니다. 이 원고를 비판적으로 검토해 주신 토마스 B. 프리드먼(Thomas B. Friedman) 박사와 로버트 J. 모렐(Robert J. Morell) 박사에게 감사를 표한다.
자료
| Name | Company | Catalog Number | Comments |
| EDTA 0.5 M | Crystalgen | 221-057 | |
| 1 mL TUBERCULIN syringe with 27G x 13mm | BD | 309623 | |
| 9-well spot glass plate | Pyrex | 13-748B | |
| Alexa Fluor 555-conjugated phalloidin | ThermoFisher Scientific | A34055 | |
| Artery Scissors - Ball Tip | Fine Science Tools | 14080-11 | |
| Bovine serum albumin | Sigma Aldrich | A3059 | |
| Camera to capture images in incident light | Leica | DFC 495 | |
| Camera to capture fluorescent images | Leica | DFC 7000 GT | |
| Centrifuge tubes 15 mL | Corning | 430053 | |
| Centrifuge tubes 50 mL | Corning | 430829 | |
| Collagenase/Dispase | Roche | 10269638001 | |
| Confocal microscope | Zeiss | LSM 880 | |
| Cover Glass | Corning | 2940-223 | |
| Dumont #4 Forceps | Fine Science Tools | 11241-30 | |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Alternative: Extra Fine Micro Dissecting Scissors; Straight; Sharp Points; 20mm Blade Length; 3 1/2" Overall Length | Roboz | RS-5880 | |
| Goat anti-rabbit Alexa Fluor 488-conjugated secondary antibody | ThermoFisher Scientific | A11034 | |
| MicroSlides Superfrost | VWR | 48311-702 | |
| Orbital shaker, for example Mini Shaker | Daigger | 980275 | |
| Paraformaldehyde (PFA) 16% Aqueous Solution | Electron Microscopy Sciences | 15710 | |
| Phosphate-Buffered Saline (10X) pH 7.4 | ThermoFisher Scientific | AM9624 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36931 | |
| Rabbit anti-Pendrin antibodies | In-house | RRID:AB_2713943, PB826 (Choi et al., 2011) | |
| Ring Forceps | Fine Science Tools | 11106-09 | |
| Rocking shaker, for example GyroMini | Labnet | S0500 | |
| Stereomicroscope equipped with a PlanApo 1.0x objective | Leica | ||
| Stainless Steel Single Edge Blades, .009" | GEM Personna | 62-0176 | |
| Tissue culture dish 60 mm | Falcon | 353002 | |
| Transparent nail polish | |||
| Triton X-100 | ACROS Organics | 32737-1000 |
참고문헌
- Dror, A. A., Brownstein, Z., Avraham, K. B. Integration of human and mouse genetics reveals pendrin function in hearing and deafness. Cellular Physiology and Biochemistry. 28 (3), 535-544 (2011).
- Reardon, W., CF, O. M., Trembath, R., Jan, H., Phelps, P. D. Enlarged vestibular aqueduct: a radiological marker of pendred syndrome, and mutation of the PDS gene. QJM. 93 (2), 99-104 (2000).
- Griffith, A. J., Wangemann, P. Hearing loss associated with enlargement of the vestibular aqueduct: mechanistic insights from clinical phenotypes, genotypes, and mouse models. Hearing Research. 281 (1-2), 11-17 (2011).
- Gurkov, R., Pyyko, I., Zou, J., Kentala, E. What is Meniere's disease? A contemporary re-evaluation of endolymphatic hydrops. Journal of Neurology. 263, 71-81 (2016).
- Eckhard, A., et al. Water channel proteins in the inner ear and their link to hearing impairment and deafness. Molecular Aspects of Medicine. 33 (5-6), 612-637 (2012).
- Choi, B. Y., et al. Mouse model of enlarged vestibular aqueducts defines temporal requirement of Slc26a4 expression for hearing acquisition. Journal of Clinical Investigation. 121 (11), 4516-4525 (2011).
- Miyashita, T., et al. Presence of FXYD6 in the endolymphatic sac epithelia. Neuroscience Letters. 513 (1), 47-50 (2012).
- Royaux, I. E., et al. Localization and functional studies of pendrin in the mouse inner ear provide insight about the etiology of deafness in pendred syndrome. Journal of the Association for Research in Otolaryngology. 4 (3), 394-404 (2003).
- Kim, H. M., Wangemann, P. Epithelial cell stretching and luminal acidification lead to a retarded development of stria vascularis and deafness in mice lacking pendrin. PLoS One. 6 (3), 17949 (2011).
- Dahlmann, A., von During, M. The endolymphatic duct and sac of the rat: a histological, ultrastructural, and immunocytochemical investigation. Cell and Tissue Research. 282 (2), 277-289 (1995).
- Everett, L. A., et al. Targeted disruption of mouse Pds provides insight about the inner-ear defects encountered in Pendred syndrome. Human Molecular Genetics. 10 (2), 153-161 (2001).
- Miller, R. L., et al. The V-ATPase B1-subunit promoter drives expression of Cre recombinase in intercalated cells of the kidney. Kidney International. 75 (4), 435-439 (2009).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Wang, L., Jiang, H., Brigande, J. V. Gene transfer to the developing mouse inner ear by in vivo electroporation. Journal of Visualized Experiments. (64), e3643 (2012).
- Currle, D. S., Hu, J. S., Kolski-Andreaco, A., Monuki, E. S. Culture of mouse neural stem cell precursors. Journal of Visualized Experiments. (2), 152 (2007).
- Honda, K., et al. Molecular architecture underlying fluid absorption by the developing inner ear. Elife. 6, (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유