Method Article
Вскрытие эндолимфатического мешка у мышей
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом исследовании описывается, как рассекать эндолимфатический мешок от внутреннего уха мыши в разном возрасте. Результат аналогичного рассечения показан на мышиной модели расширения эндолимфатического мешка на основе Slc26a4-null. Трансгенная мышь с флуоресцентным репортером, экспрессируемым в эндолимфатическом мешке, представлена в качестве модели для легкой визуализации эндолимфатического мешка и образовательного инструмента.
Аннотация
Изучение мутантных мышиных моделей нарушений слуха и равновесия человека выявило множество структурных и функциональных изменений, которые могут способствовать формированию фенотипов человека. Несмотря на значительный прогресс, достигнутый в понимании развития и функции нейросенсорного эпителия улитки и вестибулы, имеются ограниченные знания о развитии, клеточном составе, молекулярных путях и функциональных характеристиках эндолимфатического мешка. В значительной степени это связано с сложностью визуализации и микрорассечения этой ткани, которая представляет собой эпителий, состоящий только из одного клеточного слоя. Представленное здесь исследование описывает подход к доступу и микропрепарированию эндолимфатического мешка из внутреннего уха мыши дикого типа в разном возрасте. Результат аналогичного рассечения показан на мышиной модели расширения вестибулярного водопровода с дефицитом пендрина. Представлена трансгенная мышь с флуоресцентным эндолимфатическим мешком. С помощью этой мыши-репортера можно легко визуализировать эндолимфатический мешок с ограниченным рассечением и определить его размер. Его также можно использовать в качестве учебного пособия для обучения тому, как препарировать эндолимфатический мешок. Эти процедуры диссекции должны способствовать дальнейшей характеристике этой малоизученной части внутреннего уха.
Введение
Внутреннее ухо млекопитающих состоит из улитки, мешочка, утрикула, трех полукружных каналов и эндолимфатического мешка (рис. 1А). Эти органы состоят из непрерывного, заполненного жидкостью эпителия, называемого мембранным лабиринтом, с соседними органами, соединяющимися напрямую или через небольшие структуры каналов, такие как ductus reuniens, мешотчатый проток, утрикулярный проток или эндолимфатический проток. По сравнению с другими органами внутреннего уха, эндолимфатический мешок обладает уникальными характеристиками. Во-первых, у него отсутствуют сенсорные эпителиальные клетки. Вместо этого эндолимфатический мешок имеет клетки, специализированные для транспортировки ионов. Во-вторых, хотя пленчатый лабиринт заключен в костный лабиринт, эндолимфатический мешок является исключением, частично выступающим из каменистой кости во внутричерепную полость. Эта морфология, по-видимому, высоко консервативна в ходе эволюции внутреннего уха. В-третьих, эндолимфатический мешок является первой структурой, которая развивается из отоцисты на ранней эмбриональной стадии до формирования других органов. Кроме того, несколько патологий были связаны с увеличенным эндолимфатическим мешком или аномальным эндолимфатическим компартментом. Наличие патогенных вариантов в SLC26A4 (также известных как ген пендрина) приводит к сравнительно распространенной форме сенсоневральной тугоухости, вызванной увеличением эндолимфатического мешка, связанным с наличием увеличенного вестибулярного водопровода (ЭВА)1. Когда он связан с зобом, его называют синдромомПендреда 2,3. Некоторые также считают, что болезнь Меньера связана с аномалией эндолимфатического компартмента (гидропса)4. Уникальные особенности эндолимфатического мешка и патологии, связанные с изменением его морфологии, согласуются с его критической ролью в развитии и поддержании внутреннего уха.
Несмотря на его важность, знания о развитии, клеточном составе, молекулярных путях и функциональных характеристиках эндолимфатического мешка все еще ограничены. По крайней мере отчасти это связано с сложностью визуализации и микрорассечения этой ткани. Эндолимфатический мешок представляет собой мешочекообразную структуру, состоящую из одного слоя эпителиальных клеток, который часто является полупрозрачным и его очень трудно идентифицировать из окружающей его соединительной ткани с помощью световой стереомикроскопии. Несмотря на то, что небольшое число исследователей разработали методы рассечения всего монта и опубликовали свои экспериментальные результаты 5,6,7,8,9,10, нет публикации, посвященной техническим деталям этой процедуры.
В этом исследовании описаны подходы к микродиссекции, разработанные для доступа и изоляции эндолимфатического мешка от внутреннего уха мыши дикого типа в разном возрасте, в целом. Результаты аналогичного рассечения показаны на мышиной модели, лишенной экспрессии SLC26A4, которая имеет расширение эндолимфатического протока и мешка. Сообщается о мышиной линии с трансгеном, кодирующим Cre-рекомбиназу, экспрессируемую в эндолимфатическом мешке. В присутствии флуоресцентного репортера экспрессии Cre, в данном случае tdTomato, флуоресценция может быть использована для легкой визуализации эндолимфатического мешка с ограниченным рассечением и получения информации о его размерах. Эта линейка мышей также может быть использована в качестве учебного пособия для практики и совершенствования рассечения эндолимфатических мешков. Возможность рассечения ткани эндолимфатического мешка должна способствовать дальнейшей характеристике этого малоизученного, но важного компонента внутреннего уха.
протокол
Все эксперименты и процедуры на животных проводились в соответствии с протоколами, утвержденными Комитетами по уходу за животными и их использованию Национального института неврологических заболеваний и инсульта/Национального института глухоты и других коммуникативных расстройств (#1264) и Комитетом по институциональному уходу за животными и их использованию в Токийском медицинском и стоматологическом университете (A2020-058A).
ПРИМЕЧАНИЕ: мыши C57BL/6J (биржевой номер 000664), Pds-/-также известные как мыши Slc26a4-/- (129S-Slc26a4 tm1Egr/AjgJ, No 018424) 11, B6; Мыши12 CBA-Tg(ATP6V1B1-Cre)1Rnel/mm и мыши Ai9(LSL-RCL-tdT) (B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze, No 007909) доступны в лаборатории Джексона и по запросу. Все процедуры генотипирования были описаны ранее. В6; Для экспериментов были выведены мыши CBA-Tg(ATP6V1B1-Cre)1Rnel/mm, ранее скрещивавшиеся со штаммом C57BL/6J в течение как минимум пяти поколений. Животные обоих полов могут быть изучены при таком подходе без видимой разницы. Первый день после ночного спаривания засчитывается как эмбриональный день 0,5 (Е0,5).
1. Забор и фиксация неповрежденного внутреннего уха в черепе
- Усыпляйте подопытное животное или беременную мать с помощью утвержденной в учреждении процедуры, например, с помощью ингаляции CO2 . По возможности работайте под вытяжным шкафом, чтобы избежать или свести к минимуму распространение мышиных аллергенов. Убедившись в отсутствии реакции на болевые раздражители, такие как щипки лапы или хвоста, обезглавьте животное. Для беременной на сроке матери вывих шейки матки может быть использован в качестве альтернативы обезглавливанию, если ее внутренние уши не используются для дальнейших экспериментов.
- Забор эмбрионов с помощью лапаротомии14 с помощью артериальных ножниц с шариковым наконечником для защиты эмбрионов во время процесса. Манипулируйте эмбрионами с помощью кольцевых щипцов. Поместите рога матки при температуре 4 °C PBS на лед и изолируйте каждый эмбрион, как описано ранее15 , прежде чем обезглавить их.
- Рассеките голову пополам сзади наперед: сначала надрежьте верхнюю часть головы, сначала надрез кожи, затем верхнюю часть черепа, надрезая примерно одну треть ее с каждым разрезом, чтобы череп не изгибался. Затем сразу разрежьте нижнюю часть черепа.
ПРИМЕЧАНИЕ: Для эмбрионов рекомендуется использовать острое лезвие, а не ножницы. Очень важно, чтобы в любом возрасте череп не деформировался во время его рассечения пополам. - Не касаясь черепа и не сгибая его, осторожно удалите полумозг, чтобы обнажить костный лабиринт (рис. 1В, дополнительный рис. 1А-В).
- Для мышей после родов на 5-й день или старше пересеките наружный слуховой проход и потяните кожу вперед к носу. Обрежьте череп вокруг внутреннего уха (дополнительный рисунок 1C).
- Перенесите два получерепа каждого животного с внутренним ухом, как можно более неповрежденными, в стеклянный флакон или пробирку, содержащую 10 мл 4 °C 4% параформальдегида (PFA), разведенного в 1x PBS, и храните на льду под вытяжным шкафом.
ПРИМЕЧАНИЕ: Не пытайтесь удалить внутреннее ухо из черепа на этом этапе, так как это может повредить эндолимфатический проток и мешок при этом. - Выдерживать в течение 1 ч при температуре 4 °C на качающемся шейкере. При работе с тканью животного с помощью флуоресцентного репортера храните трубку с образцом в алюминиевой фольге или в коробке, чтобы свести к минимуму воздействие света.
ПРИМЕЧАНИЕ: Если вас интересует изучение микротрубочек и связанных с ними молекул, фиксация тканей должна быть выполнена при комнатной температуре (ОТ) с помощью фиксатора ОТ. - Выбросьте PFA в соответствующую емкость в вытяжном шкафу. Промойте три раза 10 мл 1x PBS в течение 15 минут каждый раз на качающемся шейкере в режиме RT, чтобы устранить фиксатор перед рассечением.
2. Микродиссекция эндолимфатического мешка
- Перенесите каждый препарат внутреннего уха в чашку для культуры тканей диаметром 35 мм, содержащую 1x PBS.
- Поместите заготовку в посуду так, чтобы корень 8-го черепного нерва был ориентирован вверх. Удерживайте ткань в этом положении, захватывая улитку щипцами #4 (Рисунок 1C).
- Определите важные ориентиры: вестибулярный водопровод, передний и задний полукружные каналы, голень обыкновенный и синус сигмовидной кишки (вена) (рисунок 1D).
ПРИМЕЧАНИЕ: Эндолимфатический мешок у мышей дикого типа полупрозрачный и его трудно визуализировать. Для успешной микродиссекции эндолимфатического мешка важно понимать его анатомию и локализацию (рисунок 1Е). - Разрежьте твердую мозговую оболочку и вестибулярный водопровод, а также подлежащие соединительные ткани, окружающие эндолимфатический мешок, с помощью иглы 27 G на шприце объемом 1 мл (рис. 1D, F).
ПРИМЕЧАНИЕ: Для взрослой мыши декальцинация препарата с использованием 10% ЭДТА (pH 7,4) перед микродиссекцией полезна, но не обязательна, для облегчения разреза вестибулярного водопровода. Для рассечения вскрытого эндолимфатического мешка старше 5-го дня после рождения рекомендуется расположить линию разреза на вестибулярном водопроводе немного вперед, чтобы сделать разрез в просвете эндолимфатического мешка (рис. 2А). - Удерживайте соединительную ткань, расположенную латерально от эндолимфатического мешка, щипцами и подтяните ткань, чтобы отделить ее от височной кости (рисунок 1G).
- Осторожно удалите оставшийся мусор. Препарат обычно включает эпителий эндолимфатического мешка, окружающие соединительные ткани, часть вестибулярного водопровода и сигмовидный синус (рис. 1H-I). При необходимости отделите эпителий эндолимфатического мешка от окружающих тканей (рисунок 1J).
- (Дополнительный) Для рассечения вскрытого эндолимфатического мешка следует провести ножевую часть препарата так, чтобы было видно поперечное сечение просвета. Вставьте иглу 27 G в просвет и переместите ее, чтобы разрезать эндолимфатический мешок на два листа (рисунок 2B-C). Возьмитесь за край каждой листовой ткани щипцами и отделите их друг от друга (рисунок 2D-F).
3. Иммуногистохимия
- После микродиссекции используйте щипцы #5 для переноса эндолимфатических мешочков в 9-луночную точечную стеклянную пластину.
- Используя микроскоп, чтобы убедиться, что эндолимфатические мешочки остаются нетронутыми, с помощью пипетки объемом 200 мкл удалите все 1x PBS, за исключением одной капли, содержащей ткань. Добавьте 200 μл проникающего и блокирующего раствора (1x PBS с 0,15% Triton X-100 (PBS-TX) и 5% бычьим сывороточным альбумином (BSA)) и инкубируйте в течение 1 ч в RT на орбитальном шейкере.
- После удаления всего блокирующего раствора, за исключением одной капли, содержащей ткань, добавьте 200 мкл первичных антител и инкубируйте в течение ночи при 4 °C. Антипендриновые антитела6 , разведенные в соотношении 1:1000 в блокирующем растворе, могут быть использованы для идентификации богатых митохондриями клеток эндолимфатического мешка, хотя слабая экспрессия также наблюдается в подмножестве богатых рибосомами клеток16 (рис. 5).
- После трех промываний в 1x PBS в течение 15 мин на RT инкубировать с вторичными антителами. Для мечения, представленного здесь, инкубируют 200 мкл флуоресцентных вторичных антител, конъюгированных с красителем, разведенных из коммерческого запаса в 1:500 в блокирующем растворе, с тканью на качающейся платформе в течение 1 ч при ЛТ в темноте. Флуоресцентный фаллоидин, конъюгированный с красителем, который распознает β-актин (ACTB), может быть использован для выделения наличия эндолимфатического мешка и протока, а также соединительной ткани вокруг них (рис. 5A, C, F-G).
- Установите эндолимфатические мешочки между предметным стеклом и покровным стеклом с помощью монтажной среды с защитой от выцветания и DAPI. После того, как слайды высохнут в защищенном от света месте в течение 1 часа, нанесите прозрачный лак для ногтей на стыке покровного стекла и предметного стекла, чтобы запечатать их и ограничить образование пузырьков воздуха. При попытке визуализировать дифференциальное распределение белков на апикальной и базолатеральной поверхности эпителиальных клеток рекомендуется вскрыть мешок на этапе монтажа, надрезав край и открыв его.
- Изображение с помощью конфокального микроскопа. Сначала визуализируйте препараты эндолимфатического мешка с помощью 10-кратного объектива, чтобы получить глобальное представление о мечении мешка (рисунок 5A-D). Затем используйте 63-кратный объектив, чтобы получить подробное представление о распределении интересующего белка в богатых митохондриями и рибосомами клетках эндолимфатического мешка (рисунок 5F-G).
Результаты
Каждый этап этой микродиссекции эндолимфатического мешка дикого типа у мыши после рождения на 5-й день (P5) подробно описан в соответствующем видео, а снимки ключевых этапов этого рассечения и открытия эндолимфатического мешка представлены на рисунках 1 и 2.
Репрезентативные результаты вскрытия эндолимфатического мешка флуоресценцией tdTomato на 16,5-й день (E16,5), P5 и P30 в соответствии с этим протоколом представлены на рисунке 3, а также на дополнительном рисунке 1 и дополнительном рисунке 2. С помощью диссекционного микроскопа с флуоресценцией эндолимфатический мешок может быть легко визуализирован в черепе после удаления мозга у мышей, несущих трансген Tg(ATP6V1B1-Cre) в присутствии репортера экспрессии Cre: Ai9 (LSL-RCL-tdT) (см. Рисунок 3A-B и Дополнительный рисунок 1 для изображений, полученных в условиях падающего света и флуоресценции tdTomato эндолимфатического мешка на разных стадиях диссекции). У этих мышей Cre экспрессируется в виде мозаики в клетках по всему эндолимфатическому мешку и протоку (Рисунок 3, см. также Дополнительный рисунок 2 для визуализации эндолимфатического мешка с флуоресцентным репортером и без него). Несмотря на то, что экспрессия этого репортера не специфична для эндогенной экспрессии Atp6v1b1, которая ограничена богатыми митохондриями клетками эндолимфатического мешка16, одного из двух типов клеток этого эпителия (рис. 5E), он является полезным подспорьем для идентификации и препарирования эндолимфатического мешка.
Внутренние уши, рассеченные у мышиной модели для увеличения вестибулярного водопровода, представлены на рисунке 4. По сравнению с контрольными однопометниками, эндолимфатические мешочки и протоки мышей с дефицитом SLC26A4 (пендрина) увеличены.
Репрезентативные изображения иммуногистохимии интактного эндолимфатического мешка с соединительной тканью и без нее представлены на рисунке 5. Представлены также результаты иммуногистохимии открытого эндолимфатического мешка мыши дикого типа P5 (рис. 5F-G). Эндолимфатический мешок состоит из одного слоя эпителия, сложенного в мешочек-форму, содержащего в своем просвете эндолимфу. Этот эпителий состоит из двух типов клеток: богатых митохондриями и богатых рибосомами клеток (рисунок 5E). Эндолимфатический мешок целиком будет сплющен, потому что эндолимфа больше не присутствует. Мешочек будет выглядеть как два переплетенных слоя эпителия, что затруднит определение субклеточной локализации белков, экспрессируемых в этом эпителии. Открывая эндолимфатический мешок, можно легко визуализировать однослойный эпителий и более точно определить относительное распределение интересующих белков по отношению к просвету эндолимфатического мешка. Потенциальное апикальное (люминальное, где должна быть эндолимфа) и базальное обогащение этих белков может быть определено более точно. Например, SLC26A4 обогащен на апикальной стороне клеток, богатых митохондриями (рисунок 5F).
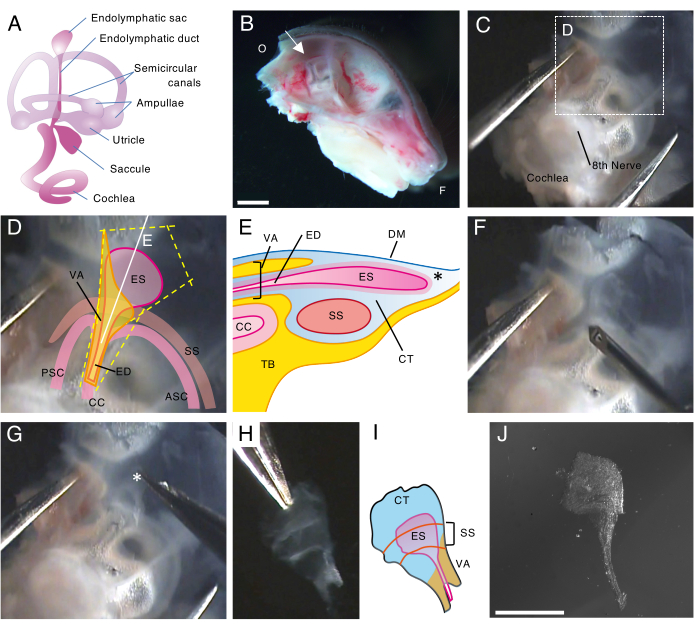
Рисунок 1. Полное рассечение эндолимфатического мешка мыши дикого типа на 5-й день после рождения (P5).
(А) Схема перепончатого лабиринта развитого внутреннего уха мыши (справа). Указывается расположение эндолимфатического мешка, а также улитки и вестибулярных структур. Эта цифра была изменена по сравнению с Honda et al.16.
(B) Средний сагиттальный разрез, показывающий левый получереп. Указывается расположение эндолимфатического мешка (стрелкой). (О, затылочный; F, фронтальный)
(C) Глазная капсула вместе с плоской частью височной кости.
(D) Важные ориентиры, наложенные на пунктирную рамку на панели C. (ES, эндолимфатический мешок; ЭД, эндолимфатический проток; ВА – вестибулярный водопровод; ASC, передний полукружный канал; ПСК, задний полукружный канал; CC, обыкновенный crus; SS, сигмовидный синус)
(E) Схематическое изображение поперечного сечения вместе с непрерывной белой линией на панели D через эндолимфатический мешок. Проксимальная сторона эндолимфатического мешка покрыта костным каналом, называемым вестибулярным акведуком, вместе с эндолимфатическим протоком. В дистальной части эндолимфатический мешок, окруженный конъективной тканью (КТ), расширяется и выступает наружу костного лабиринта и зажат между твердой мозговой оболочкой (ТМ) и сигмовидным синусом с плоской частью височной кости (ТБ).
(F) Тонкая игла используется для разрезания вокруг эндолимфатического мешка (следуя пунктирным желтым линиям на панели D).
(G) Препарат осторожно удаляют из височной кости, удерживая ткань в положении, указанном звездочкой (*, также показанной на панели Е), и отслаивая ее.
(H) Изолированный целый эндолимфатический мешок с окружающими тканями.
(I) Схематическая версия этого изолированного эндолимфатического мешка с окружающими тканями.
(J) Изолированный эндолимфатический мешок без окружающих тканей.
Масштабные линейки: 2 мм (B), 1 мм (J). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
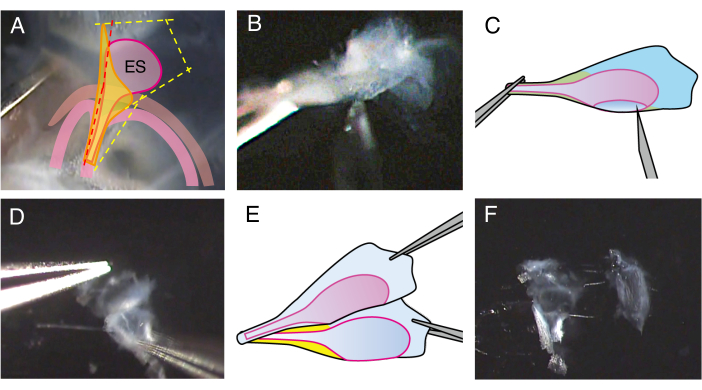
Рисунок 2. Вскрытие эндолимфатического мешка мыши дикого типа P5.
(A) На шаге 2.4 линия разреза на вестибулярном водопроводе располагается немного вперед (красная пунктирная линия) для выполнения разреза в просвете эндолимфатического мешка.
(В) Возьмитесь за стержневую часть препарата, вставьте иглу 27-го калибра в просвет и переместите ее, чтобы разрезать эндолимфатический мешок на два листа.
(В) Схематическое изображение панели В.
(D) Удерживайте край каждого листа щипцами и отделите их друг от друга.
(E) Схематическое изображение панели D.
(F) Эндолимфатический мешок разделен на два листа, включая эпителий и окружающие ткани. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
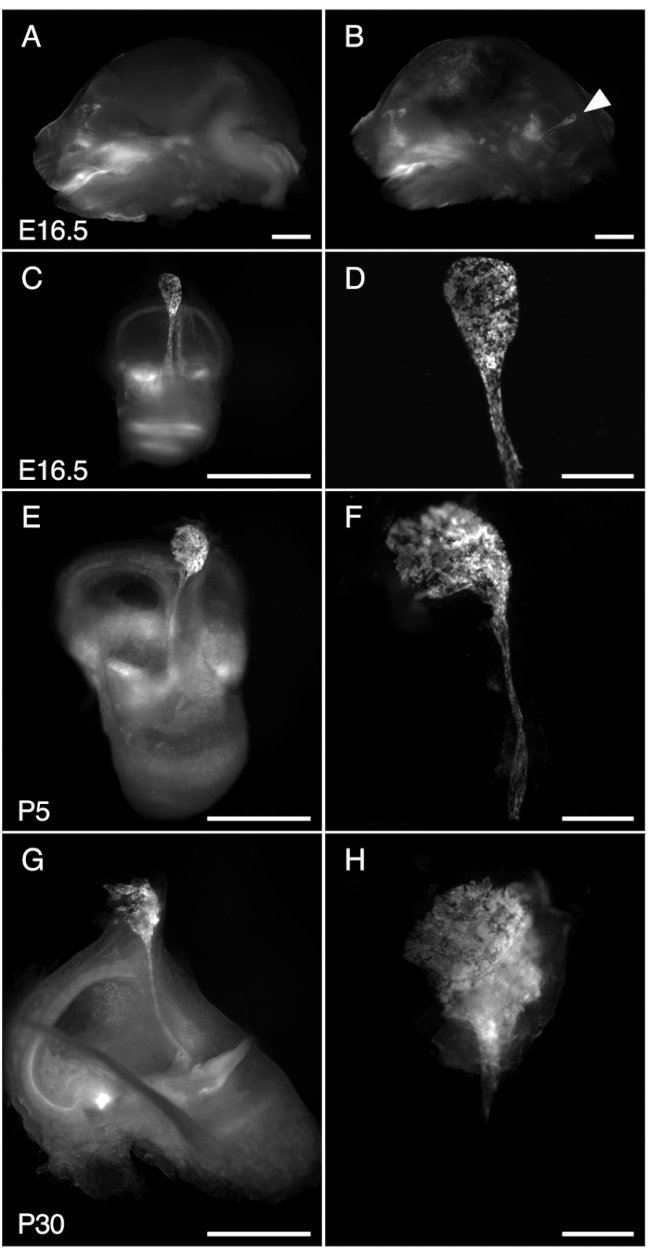
Рисунок 3. Диссекция R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn эндолимфатический мешок мыши в E16.5, P5 и P30. На всех представленных изображениях показана флуоресценция tdTomato, полученная с помощью стереомикроскопа с объективом 1 х, оснащенным для детектирования флуоресценции tdTomato.
(А, Б) Среднесагиттальный срез черепа E16.5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn мышь до (A) и после (B) удаления половины мозга. Флуоресценция tdTomato обрисовывает положение внутреннего уха. Эндолимфатический мешок хорошо заметен даже без рассечения (стреловидного наконечника).
(С, Е, Г) Изолированные внутренние уши у мышей E16.5, P5 и P30 соответственно.
(D, F и H) Изображения с большим увеличением соответствующих микрорассеченных эндолимфатических мешочков и протоков. В P30 эндолимфатический проток инкапсулирован в кость, что делает его особенно трудным для изоляции. Масштабные линейки: 2 мм (A, B, C, E, G), 500 μм (D, F, H). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
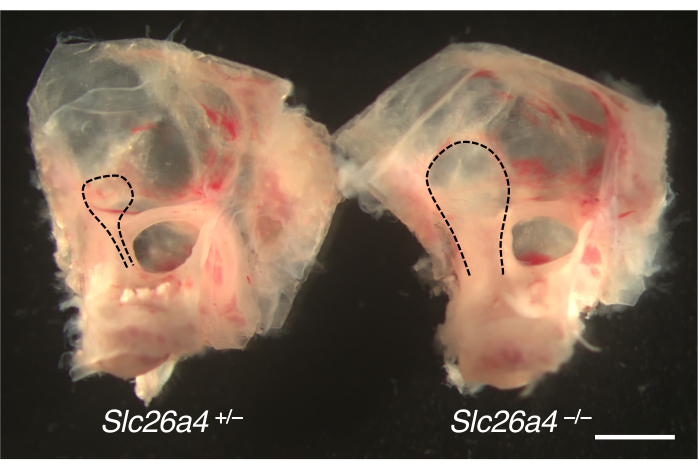
Рисунок 4. Общая анатомия глазной капсулы с увеличенным эндолимфатическим мешком. Внутренние уши мышиных однопометников Slc26a4+/- (слева) и Slc26a4-/- (справа) на P105. Вестибулярный водопровод и эндолимфатический мешок и проток (черные пунктирные линии) увеличены у мыши Slc26a4-/- по сравнению с мышью Slc26a4+/- . Масштабная линейка: 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
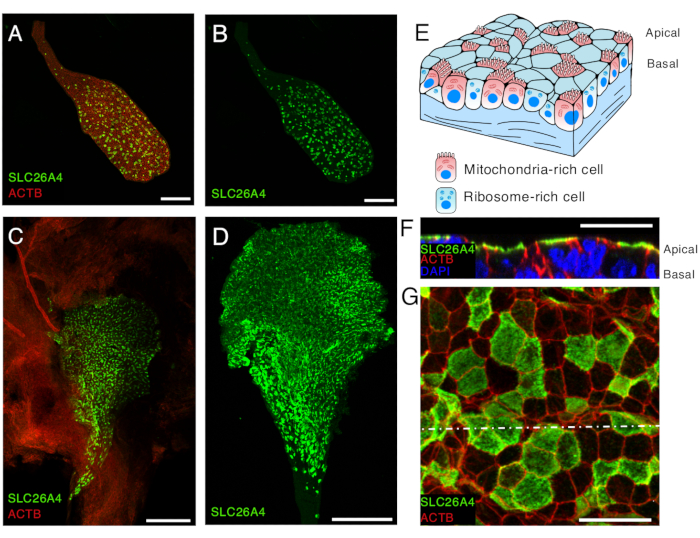
Рисунок 5. SLC26A4 экспрессия богатых митохондриями клеток в эпителии эндолимфатического мешка в E16,5 и P5.
(А, Б) Изолированный эндолимфатический мешок мыши E16.5, меченный антителом против SLC26A4 (зеленый) и фаллоидином, который метит β-актин (ACTB, красный).
(C) Изображение с малым увеличением открытого эндолимфатического мешка мыши P5, помеченного антителом против SLC26A4 (зеленым). Фаллоидин (ACTB, красный) может быть использован для выделения наличия эндолимфатического мешка, а также соединительной ткани вокруг него.
(D) Изолированный эндолимфатический мешок, меченный антителом против SLC26A4 (зеленого цвета).
(E) Схематическое изображение эпителия эндолимфатического мешка, подчеркивающее наличие двух типов клеток: богатых митохондриями клеток, апикальная поверхность которых покрыта микроворсинками, и богатых рибосомами клеток.
(Ф-Г) Изображения эпителия эндолимфатического мешка с большим увеличением в точке P5, после того как эндолимфатический мешок был открыт и помечен антителом против SLC26A4 (зеленый) и фаллоидином (ACTB, красный). Репрезентативное изображение на уровне апикальной мембраны показано в G, а восстановленное поперечное сечение из z-стека на уровне точечной белой линии показано в F. Ядро клеток помечено DAPI (синим цветом).
Масштабные линейки: 100 μм (А, В); 200 μм (C, D) ; 20 мкм (F, G). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок 1. Падающий свет и соответствующие флуоресцентные изображения tdTomato P5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn внутреннее ухо мыши в три этапа вскрытия. Эндолимфатический мешок и проток можно легко визуализировать с помощью флуоресценции tdTomato.
(А-Б) Область внутреннего уха в задней части интактного получерепа P5 R26LSL-RCL-tdT/+; Мышь Tg(ATP6V1B1-Cre)1Rnel/Mn.
(К-Д) Удаление кожи и части черепа позволяет лучше визуализировать область эндолимфатического мешка.
(Е, Ж) Изолированное внутреннее ухо с эндолимфатическим мешком, все еще связанным с соединительной тканью.
(А, С, Е) Снимки сделаны при падающем свете. (B, D, F) tdTomato флуоресценция соответствующей ткани. Масштабные линейки: 2 мм (A-B), 1 мм (C-F). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2. Сравнение флуоресценции изолированных эндолимфатических мешочков R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn и R26LSL-RCL-tdT/+ однопометные мыши в E16.5 и P5. Флуоресценция tdTomato значительно облегчает распознавание эндолимфатического мешка и протока.
(А-С) Микродиссекция эндолимфатических мешочков E16,5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn (A) и R26LSL-RCL-tdT/+ однопометные мыши (B, C).
(Д-Ж) Микродиссекция эндолимфатических мешочков P5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn (D) и R26LSL-RCL-tdT/+ однопометные мыши (E, F).
(A, B, D, E) tdФлуоресценция томатов. (С, Ж) Изображения в падающем свете, соответствующие B и E. Масштабные линейки: 500 мкм. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Многие исследователи использовали залитые парафином или замороженные срезы для морфологических исследований эндолимфатического мешка. Недостатком секционных препаратов является то, что может быть трудно полностью наблюдать сложные межклеточные контакты, поскольку размер и форма каждой эпителиальной клетки в эндолимфатическом мешке чрезвычайно изменчивы, образуя морщинистый и псевдостратифицированный клеточный слой. Иммуноокрашивание всего монтирования и визуализация z-стека, описанные в этом протоколе, позволяют лучше визуализировать трехмерную структуру эндолимфатического мешка.
Для успешной микродиссекции критическим моментом является мысленная визуализация всего контура эндолимфатического мешка, даже если он незаметен у мышей дикого типа. Наблюдение за флуоресцентным репортером, показанное на рисунке 3 и на дополнительном рисунке 1-2, может быть полезным для распознавания локализации и размера эндолимфатического мешка у мышей.
В то время как этот метод диссекции всего монта использовался для иммуноокрашивания в вышеупомянутом протоколе, этот метод также может быть использован для сбора ткани эндолимфатического мешка для анализа экспрессии генов, таких как ОТ-кПЦР, экспрессия микрочипов и даже секвенирование РНК одиночных клеток. Ранее сообщалось о результатах анализа РНК-секвенирования одиночных клеток с использованием ткани, полученной по этому протоколу16. Для анализа экспрессии генов эпителиальных клеток эндолимфатического мешка предпочтительно собирать изолированный эпителий таким образом, чтобы не было контаминации с другими соседними тканями. Хотя эмбриональный эндолимфатический мешок может быть отделен от прилегающих соединительных тканей, в более позднем возрасте это сделать гораздо сложнее. Для образцов от более старых мышей рекомендуется инкубация с коллагеназой/диспазой в течение 5 минут при 37 °C, что способствует выделению эпителия эндолимфатического мешка.
Одним из недостатков иммуноокрашивания всего крепления, описанного в данном протоколе, является то, что исходная трехмерная структура может быть повреждена травмой во время рассечения или монтажа препарата между предметным стеклом и покровным стеклом. Необходимо соблюдать осторожность, чтобы избежать артефактов из-за манипуляций.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было частично поддержано Программой внутренних исследований NIH, NICD (NIH Intramural Research Funds Z01-DC000060 и ZIC DC000081 в Advanced Imaging Core). Мы благодарны докторам Раулю Д. Нельсону и Р. Лэнсу Миллеру (Университет штата Юта, Солт-Лейк-Сити, штат Юта) и доктору Сьюзан Уолл (Медицинская школа Университета Эмори, Атланта, штат Джорджия) за совместное использование мышей Tg(ATP6V1B1-Cre), а также персоналу ветеринарного комплекса NIDCD за заботу о наших животных. Выражаем благодарность доктору Филин Вангеман за прекрасную иллюстрацию внутреннего уха. Мы благодарим докторов Томаса Б. Фридмана и Роберта Дж.
Материалы
| Name | Company | Catalog Number | Comments |
| EDTA 0.5 M | Crystalgen | 221-057 | |
| 1 mL TUBERCULIN syringe with 27G x 13mm | BD | 309623 | |
| 9-well spot glass plate | Pyrex | 13-748B | |
| Alexa Fluor 555-conjugated phalloidin | ThermoFisher Scientific | A34055 | |
| Artery Scissors - Ball Tip | Fine Science Tools | 14080-11 | |
| Bovine serum albumin | Sigma Aldrich | A3059 | |
| Camera to capture images in incident light | Leica | DFC 495 | |
| Camera to capture fluorescent images | Leica | DFC 7000 GT | |
| Centrifuge tubes 15 mL | Corning | 430053 | |
| Centrifuge tubes 50 mL | Corning | 430829 | |
| Collagenase/Dispase | Roche | 10269638001 | |
| Confocal microscope | Zeiss | LSM 880 | |
| Cover Glass | Corning | 2940-223 | |
| Dumont #4 Forceps | Fine Science Tools | 11241-30 | |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Alternative: Extra Fine Micro Dissecting Scissors; Straight; Sharp Points; 20mm Blade Length; 3 1/2" Overall Length | Roboz | RS-5880 | |
| Goat anti-rabbit Alexa Fluor 488-conjugated secondary antibody | ThermoFisher Scientific | A11034 | |
| MicroSlides Superfrost | VWR | 48311-702 | |
| Orbital shaker, for example Mini Shaker | Daigger | 980275 | |
| Paraformaldehyde (PFA) 16% Aqueous Solution | Electron Microscopy Sciences | 15710 | |
| Phosphate-Buffered Saline (10X) pH 7.4 | ThermoFisher Scientific | AM9624 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36931 | |
| Rabbit anti-Pendrin antibodies | In-house | RRID:AB_2713943, PB826 (Choi et al., 2011) | |
| Ring Forceps | Fine Science Tools | 11106-09 | |
| Rocking shaker, for example GyroMini | Labnet | S0500 | |
| Stereomicroscope equipped with a PlanApo 1.0x objective | Leica | ||
| Stainless Steel Single Edge Blades, .009" | GEM Personna | 62-0176 | |
| Tissue culture dish 60 mm | Falcon | 353002 | |
| Transparent nail polish | |||
| Triton X-100 | ACROS Organics | 32737-1000 |
Ссылки
- Dror, A. A., Brownstein, Z., Avraham, K. B. Integration of human and mouse genetics reveals pendrin function in hearing and deafness. Cellular Physiology and Biochemistry. 28 (3), 535-544 (2011).
- Reardon, W., CF, O. M., Trembath, R., Jan, H., Phelps, P. D. Enlarged vestibular aqueduct: a radiological marker of pendred syndrome, and mutation of the PDS gene. QJM. 93 (2), 99-104 (2000).
- Griffith, A. J., Wangemann, P. Hearing loss associated with enlargement of the vestibular aqueduct: mechanistic insights from clinical phenotypes, genotypes, and mouse models. Hearing Research. 281 (1-2), 11-17 (2011).
- Gurkov, R., Pyyko, I., Zou, J., Kentala, E. What is Meniere's disease? A contemporary re-evaluation of endolymphatic hydrops. Journal of Neurology. 263, 71-81 (2016).
- Eckhard, A., et al. Water channel proteins in the inner ear and their link to hearing impairment and deafness. Molecular Aspects of Medicine. 33 (5-6), 612-637 (2012).
- Choi, B. Y., et al. Mouse model of enlarged vestibular aqueducts defines temporal requirement of Slc26a4 expression for hearing acquisition. Journal of Clinical Investigation. 121 (11), 4516-4525 (2011).
- Miyashita, T., et al. Presence of FXYD6 in the endolymphatic sac epithelia. Neuroscience Letters. 513 (1), 47-50 (2012).
- Royaux, I. E., et al. Localization and functional studies of pendrin in the mouse inner ear provide insight about the etiology of deafness in pendred syndrome. Journal of the Association for Research in Otolaryngology. 4 (3), 394-404 (2003).
- Kim, H. M., Wangemann, P. Epithelial cell stretching and luminal acidification lead to a retarded development of stria vascularis and deafness in mice lacking pendrin. PLoS One. 6 (3), 17949 (2011).
- Dahlmann, A., von During, M. The endolymphatic duct and sac of the rat: a histological, ultrastructural, and immunocytochemical investigation. Cell and Tissue Research. 282 (2), 277-289 (1995).
- Everett, L. A., et al. Targeted disruption of mouse Pds provides insight about the inner-ear defects encountered in Pendred syndrome. Human Molecular Genetics. 10 (2), 153-161 (2001).
- Miller, R. L., et al. The V-ATPase B1-subunit promoter drives expression of Cre recombinase in intercalated cells of the kidney. Kidney International. 75 (4), 435-439 (2009).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Wang, L., Jiang, H., Brigande, J. V. Gene transfer to the developing mouse inner ear by in vivo electroporation. Journal of Visualized Experiments. (64), e3643 (2012).
- Currle, D. S., Hu, J. S., Kolski-Andreaco, A., Monuki, E. S. Culture of mouse neural stem cell precursors. Journal of Visualized Experiments. (2), 152 (2007).
- Honda, K., et al. Molecular architecture underlying fluid absorption by the developing inner ear. Elife. 6, (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены