Method Article
マウスの内リンパ嚢の解剖
* これらの著者は同等に貢献しました
要約
この研究では、さまざまな年齢でマウスの内耳から内リンパ嚢を解剖する方法について説明しています。同様の解剖の結果は、内リンパ嚢の肥大の Slc26a4-nullマウスモデルで示されています。内リンパ嚢に蛍光レポーターを発現させたトランスジェニックマウスを、内リンパ嚢を容易に可視化するためのモデルとして、また教育ツールとして提示します。
要約
ヒトの聴覚障害とバランス障害の変異マウスモデルの研究は、ヒトの表現型に寄与する可能性のある多くの構造的および機能的変化を解明しました。蝸牛と前庭の神経感覚上皮の発達と機能の理解において重要な進歩が見られましたが、内リンパ嚢の発達、細胞組成、分子経路、および機能的特性に関する知識は限られています。これは主に、1つの細胞層のみで構成される上皮であるこの組織を視覚化して顕微鏡で解剖することが難しいためです。ここで紹介する研究では、さまざまな年齢で野生型マウスの内耳から内リンパ嚢にアクセスし、マイクロダイセクションするアプローチについて説明しています。同様の解剖の結果は、前庭水道の拡大のペンドリン欠損マウスモデルで示されています。蛍光性内リンパ嚢を有するトランスジェニックマウスを提示。このレポーターマウスは、限られた解剖で内リンパ嚢を容易に視覚化し、そのサイズを決定するために使用できます。また、内リンパ嚢の解剖方法を教える教育ツールとしても使用できます。これらの解剖手順は、内耳のこの研究されていない部分のさらなる特徴付けを容易にするはずです。
概要
哺乳類の内耳は、蝸牛、球形嚢、卵形嚢、3つの半規管、および内リンパ嚢で構成されています(図1A)。これらの臓器は、膜性迷路と呼ばれる連続した液体で満たされた上皮を構成し、隣接する臓器は、直接または尿管、嚢管、卵形管、内リンパ管などの小さな管構造を介して接続しています。内耳の他の器官と比較して、内リンパ嚢は独特の特徴を持っています。まず、感覚上皮細胞が不足しています。代わりに、内リンパ嚢にはイオン輸送に特化した細胞があります。第二に、膜性迷路は骨迷路に囲まれていますが、内リンパ嚢は例外であり、部分的に錐体骨から頭蓋内腔に突き出ています。この形態は、内耳の進化中に高度に保存されているようです。第三に、内リンパ嚢は、他の臓器が形成される前の初期胚段階で耳嚢から発生する最初の構造です。さらに、いくつかの病状は、肥大した内リンパ嚢または異常な内リンパコンパートメントに関連しています。SLC26A4に病原性多様体(ペンドリン遺伝子とも呼ばれる)が存在すると、前庭水道(EVA)の肥大に伴う内リンパ嚢の肥大によって引き起こされる、比較的一般的な感音難聴を引き起こします。甲状腺腫と関連づけられるとき、それはペンドレッド症候群2,3として参照されます。メニエール病は、内リンパ管の異常(水腫)4と関連していると考える人もいます。内リンパ嚢のユニークな特徴とその形態の変化に関連する病状は、内耳の発達と維持のための重要な役割と一致しています。
その重要性にもかかわらず、内リンパ嚢の発生、細胞組成、分子経路、および機能的特性に関する知識はまだ限られています。これは、少なくとも部分的には、この組織を視覚化して顕微鏡で解剖することの難しさによるものです。内リンパ嚢は袋状の構造で、上皮細胞の単層で構成されており、上皮細胞は半透明であることが多く、光立体顕微鏡でそれを取り囲む結合組織から同定することは非常に困難です。少数の研究者がホールマウント解剖技術を開発し、実験結果を発表しました5,6,7,8,9,10、この手順の技術的な詳細に焦点を当てた出版物はありません。
この研究では、野生型マウスの内耳から内リンパ嚢にアクセスして分離するために開発されたマイクロダイセクションアプローチについて説明します。同様の解剖の結果は、SLC26A4の発現を欠くマウスモデルで示されており、内リンパ管と嚢が肥大しています。内リンパ嚢で発現するCreリコンビナーゼをコードする導入遺伝子を持つマウス系統が報告されています。Cre発現の蛍光レポーターの存在下では、ここではtdTomato、蛍光を使用して、限られた解剖で内リンパ嚢を容易に視覚化し、そのサイズに関する情報を得ることができます。このレポーターマウスラインは、内リンパ嚢解剖を実践し、完成させるための教育ツールとしても使用できます。内リンパ嚢組織を解剖する能力は、この研究が進んでいないが内耳の不可欠な構成要素のさらなる特性評価を容易にするはずです。
プロトコル
すべての動物実験および手順は、国立神経疾患・脳卒中研究所/国立難聴・コミュニケーション障害研究所の動物管理委員会(#1264)および東京医科歯科大学動物実験委員会(A2020-058A)の承認を受けたプロトコルに従って行われました。
注:C57BL/6Jマウス(品番000664)、Pds-/-別名Slc26a4-/-マウス(129S-Slc26a4 tm1Egr/AjgJ、No.018424)11、B6;CBA-Tg(ATP6V1B1-Cre)1Rnel/Mmマウス12およびAi9(LSL-RCL-tdT)(B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze, no. 007909)マウス13は、ジャクソン研究所から入手可能であり、ご要望に応じて入手可能です。すべてのジェノタイピング手順は、以前に説明されています。B6;CBA-Tg(ATP6V1B1-Cre)1Rnel/MmマウスをC57BL/6J株に少なくとも5世代戻し交配したマウスを実験用に飼育しました。このアプローチでは、男女の動物を明らかな違いなく研究することができます。一晩の交配後の最初の日は、胚の日0.5(E0.5)としてカウントされます。
1.頭蓋骨の無傷の内耳の採取と固定
- 実験動物または妊娠時間の母を、施設で承認された手順、たとえばCO2 吸入を使用して安楽死させます。可能であれば、マウスアレルゲンの拡散を回避または最小限に抑えるために、ドラフトの下で作業してください。足や尻尾のつまみなどの痛みを伴う刺激に対する反応の欠如を確認した後、動物を斬首します。妊娠期間のあるダムの場合、内耳をさらなる実験に使用しない場合、頸椎脱臼を斬首の代わりに使用できます。
- 開腹術14 により、ボールチップ付きの動脈ハサミを使用して胚を採取し、プロセス中に胚を保護します。リング鉗子を使用して胚を操作します。子宮角を氷上の4°CPBSに置き、前に説明したように各胚を分離します15 それらを斬首する前に。
- 頭を後ろから前に二等分します:最初に皮膚を切開して頭のてっぺんを切開し、次に頭蓋骨の上部を切開し、頭蓋骨が曲がらないように各カットで頭蓋骨の約3分の1を切開します。次に、頭蓋骨の底を一度に切ります。
注:胚の場合は、はさみではなく鋭利な刃を使用することをお勧めします。すべての年齢で、頭蓋骨が二等分している間に頭蓋骨が変形しないことが重要です。 - 頭蓋骨に触れたり曲げたりせずに、半脳を慎重に取り外して骨の迷路を露出させます(図1B、補足図1A-B)。
- 生後5日目以上のマウスの場合は、外耳道を横断し、皮膚を鼻に向かって前方に引っ張ります。内耳の周りの頭蓋骨を切り取ります(補足図1C)。
- 各動物の2つの半頭蓋骨を、内耳をできるだけ無傷で、10mLの4°C 4%パラホルムアルデヒド(PFA)を1x PBSで希釈したガラスバイアルまたはチューブに移し、ドラフトの下で氷上に保ちます。
注:このステップで頭蓋骨から内耳を取り外しようとしないでください。これにより、内リンパ管と嚢が損傷する可能性があります。 - ロッキングシェーカーで4°Cで1時間インキュベートします。蛍光レポーターを使用して動物の組織を取り扱う場合は、試料の入ったチューブをアルミホイルまたは箱に入れて、光への曝露を最小限に抑えてください。
注:微小管および関連分子の研究に興味がある場合は、室温(RT)でRT固定剤を使用して組織固定を行う必要があります。 - PFAはドラフトの適切な容器に廃棄してください。1x PBS10 mLで1x PBSを1回3回、RTのロッキングシェーカーで15分間毎回3回洗浄し、解剖前に固定剤を除去します。
2. 内リンパ嚢マイクロダイセクション
- 各内耳調製物を、1x PBSを含む35 mm組織培養皿に移します。
- 第8脳神経の根元が上を向くように、準備を皿に入れます。#4鉗子で蝸牛をつかむことにより、組織をこの位置に保持します(図1C)。
- 重要なランドマークを特定します:前庭水道、前部および後部の半規管、総腿骨、およびS状結腸洞(静脈)(図1D)。
注:野生型マウスの内リンパ嚢は半透明で、視覚化しにくいです。内リンパ嚢の顕微解剖を成功させるには、その解剖学的構造と局在を理解することが重要です(図1E)。 - 1 mLシリンジに27 Gの針を使用して、硬膜と前庭水道、および内リンパ嚢を囲む下にある結合組織を切開します(図1D、F)。
注:成体マウスの場合、マイクロダイセクションの前に10%EDTA(pH 7.4)を使用して製剤を脱灰することは、前庭水道の切開を容易にするために有用ですが、必須ではありません。出生後5日目より古い開いた内リンパ嚢の解剖には、前庭水道の切開線を少し前方に配置して、内リンパ嚢内腔を切開することをお勧めします(図2A)。 - 内リンパ嚢の外側に位置する結合組織を鉗子で保持し、組織を引き上げて側頭骨から剥がします(図1G)。
- 残っている破片を慎重に取り除きます。調製物には通常、内リンパ嚢上皮、周囲の結合組織、前庭水道の一部、およびS状結腸洞が含まれます(図1H-I)。必要に応じて、内リンパ嚢上皮を周囲の組織から分離します(図1J)。
- (オプション)開いた内リンパ嚢の解剖のために、内腔の断面が観察できるように調製物のステム部分を保持します。27 Gの針を内腔に挿入し、それを動かして内リンパ嚢を2枚のシートに切断します(図2B-C)。各シート状組織の端を鉗子で保持し、それらを互いに分離します(図2D-F)。
3. 免疫組織化学
- マイクロダイセクション後、#5鉗子を使用して、内リンパ嚢を9ウェルスポットガラスプレートに移します。
- 顕微鏡を使用して内リンパ嚢が触れられていないことを確認し、200 μLピペットを使用して、組織を含む1滴を除くすべての1x PBSを除去します。200 μLの透過処理およびブロッキング溶液(1x PBSと0.15% Triton X-100(PBS-TX)および5%ウシ血清アルブミン(BSA))を加え、オービタルシェーカー上でRTで1時間インキュベートします。
- 組織を含む1滴を除くすべてのブロッキング溶液を除去した後、一次抗体200 μLを加え、4°Cで一晩インキュベートします。 ブロッキング溶液で1:1000に希釈した抗ペンドリン抗体6 は、内リンパ嚢のミトコンドリアに富む細胞を同定するために用いることができるが、リボソームに富む細胞16 の一部にもかすかな発現が見られる(図5)。
- 1x PBSでRTで15分間3回洗浄した後、二次抗体とインキュベートします。ここで提示する標識では、市販のストックからブロッキング溶液で1:500に希釈した蛍光色素標識二次抗体200 μLを、組織をロッキングプラットホーム上で暗所RTで1時間インキュベートします。β-アクチン(ACTB)を認識する蛍光色素結合ファロイジンは、内リンパ嚢と内リンパ管の存在、およびそれらの周囲の結合組織を強調するために使用できます(図5A、C、F-G)。
- スライドガラスとカバースリップの間に内リンパ嚢を取り付けます。DAPIを使用した色あせ防止封入剤を使用します。スライドを光から保護してRTで1時間乾燥させた後、カバースリップとスライドガラスの接合部に透明なマニキュアを塗布してシールし、気泡の形成を制限します。上皮細胞の頂端表面 と 基底外側表面におけるタンパク質の分布の違いを視覚化しようとする場合、マウントステップ中にエッジを切開して開口することにより、嚢を開くことをお勧めします。
- 共焦点顕微鏡を使用した画像。まず、10倍の対物レンズを使用して内リンパ嚢調製物を視覚化し、嚢標識の全体像を提供します(図5A-D)。次に、63倍対物レンズを使用して、内リンパ嚢のミトコンドリアおよびリボソームに富む細胞における目的のタンパク質の分布の詳細なビューを取得します(図5F-G)。
結果
出生後5日目(P5)マウスの野生型内リンパ嚢のこのマイクロダイセクションの各ステップは、関連するビデオで詳細に説明されており、この解剖の主要なステップと内リンパ嚢の開口部のスナップショットが図1と図2に示されています。
このプロトコルに続いて、胚の 16.5 日目 (E16.5)、P5 および P30 で tdTomato 蛍光を発した内リンパ嚢の解剖の代表的な結果を図 3 および補足図 1 および補足図 2 に示します。蛍光付き解剖顕微鏡を使用すると、Cre発現:Ai9(LSL-RCL-tdT)のレポーターの存在下で、導入遺伝子Tg(ATP6V1B1-Cre)を保有するマウスの脳を切除した後、頭蓋骨内で内リンパ嚢を容易に視覚化できます(図3A-B、および解剖のさまざまな段階で内リンパ嚢の入射光とtdTomato蛍光で撮影された画像については補足図1を参照)。これらのマウスでは、Creは内リンパ嚢および内リンパ管全体に沿って細胞内でモザイクとして発現します(図3、蛍光レポーターありとなしの内リンパ嚢の視覚化については補足図2も参照してください)。このレポーターの発現は、この上皮の2つの細胞タイプの1つである内リンパ嚢16のミトコンドリアに富む細胞に限定されるAtp6v1b1の内因性発現に特異的ではありませんが(図5E)、内リンパ嚢を同定し解剖するのに役立つ補助材料です。
前庭水道の拡張のためにマウスモデルから解剖された内耳を 図4に示します。対照同腹仔と比較して、SLC26A4(ペンドリン)が不足しているマウスの内リンパ嚢と管が肥大しています。
図5に、結合組織の有無にかかわらず、無傷の内リンパ嚢の免疫組織化学の代表的な画像を示します。P5野生型マウスの開放内リンパ嚢の免疫組織化学の結果も示されています(図5F-G)。内リンパ嚢は、袋状の構造に折り畳まれた上皮の単層で構成され、その内腔に内リンパが含まれています。この上皮は、ミトコンドリアに富む細胞とリボソームに富む細胞の2つの細胞タイプで構成されています(図5E)。ホールマウントの内リンパ嚢は、内リンパが存在しなくなったため、平らになります。嚢は上皮の2つの絡み合った層として現れるため、この上皮で発現するタンパク質の細胞内局在を特定することは困難です。内リンパ嚢を開くことにより、単層上皮を容易に視覚化でき、内リンパ嚢内腔に対する目的のタンパク質の相対的な分布をより明確に決定できます。これらのタンパク質の潜在的な頂端(内リンパがある場所は管腔)と基礎の濃縮はより正確に決定できます。一例として、SLC26A4はミトコンドリアが豊富な細胞の頂端側で濃縮されています(図5F)。
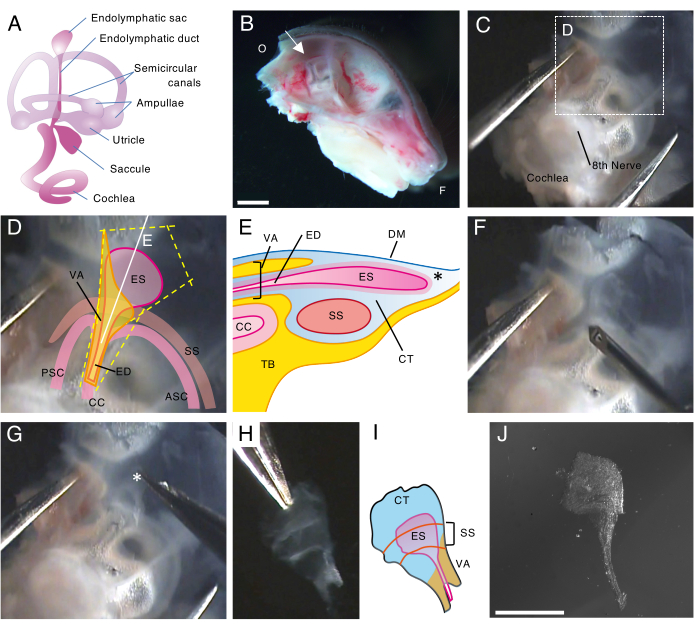
図 1.出生後5日目(P5)の野生型マウスの内リンパ嚢の全マウント解剖。
(A)発達したマウスの内耳の膜迷路の模式図(右)。内リンパ嚢の位置、および蝸牛と前庭の構造が示されています。この図はHonda et al.16から修正されています。
(B)左半頭蓋骨を示す矢状中央部。内リンパ嚢の位置が示されています(矢印)。(O、後頭部;F、前頭)
(C)側頭骨の扁平上皮部分と一緒に耳嚢。
(D)パネルCの点線ボックスに重ねられた重要なランドマーク(ES、内リンパ嚢;ED、内リンパ管;VA、前庭水道;ASC、前半規管;PSC、後部半規管;CC、一般的なクリュ;SS、S状結腸洞)
(E)内リンパ嚢を通るパネルDの連続した白い線に沿った断面の概略図。内リンパ嚢の近位側は、内リンパ管とともに前庭水道と呼ばれる骨管で覆われています。遠位側では、結合組織(CT)に囲まれた内リンパ嚢が骨迷路の外側に伸びて突き出ており、側頭骨の扁平上皮部分(TB)で硬膜(DM)とS状結腸洞の間に挟まれています。
(F)細い針を使用して内リンパ嚢の周りを切断します(パネルDの黄色の点線に従います)。
(G)アスタリスク(*※、パネルEにも示されている)で示された位置に組織を保持し、それを剥がすことにより、調製物を側頭骨から慎重に取り除きます。
(H)周囲の組織を持つ孤立した全内リンパ嚢。
(I)この孤立した内リンパ嚢と周囲の組織の概略図。
(J)周囲の組織のない孤立した内リンパ嚢。
スケールバー:2 mm(B)、1 mm(J)。 この図の拡大版を表示するには、ここをクリックしてください。
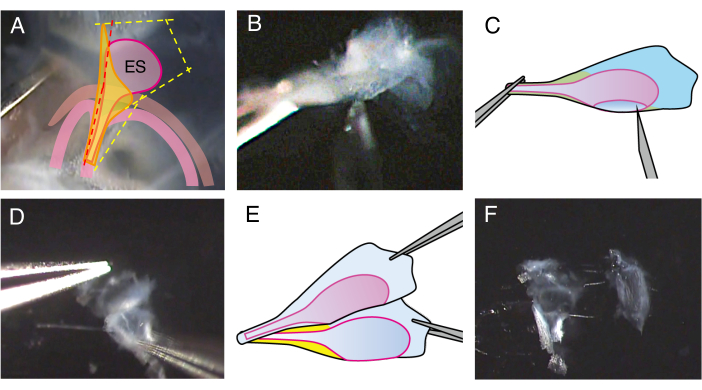
図 2.P5野生型マウスの開いた内リンパ嚢の解剖。
(A)ステップ2.4では、前庭水道の切開線をわずかに前方(赤い点線)に配置して、内リンパ嚢内腔に切開します。
(B)製剤のステム部分を持ち、内腔に27ゲージの針を挿入し、それを動かして内リンパ嚢を2枚にカットします。
(C)パネルBの概略図。
(D)各シートの端を鉗子で保持し、互いに分離します。
(E)パネルDの概略図。
(F)内リンパ嚢は、上皮と周囲の組織を含む2枚のシートに分離されています。 この図の拡大版を表示するには、ここをクリックしてください。
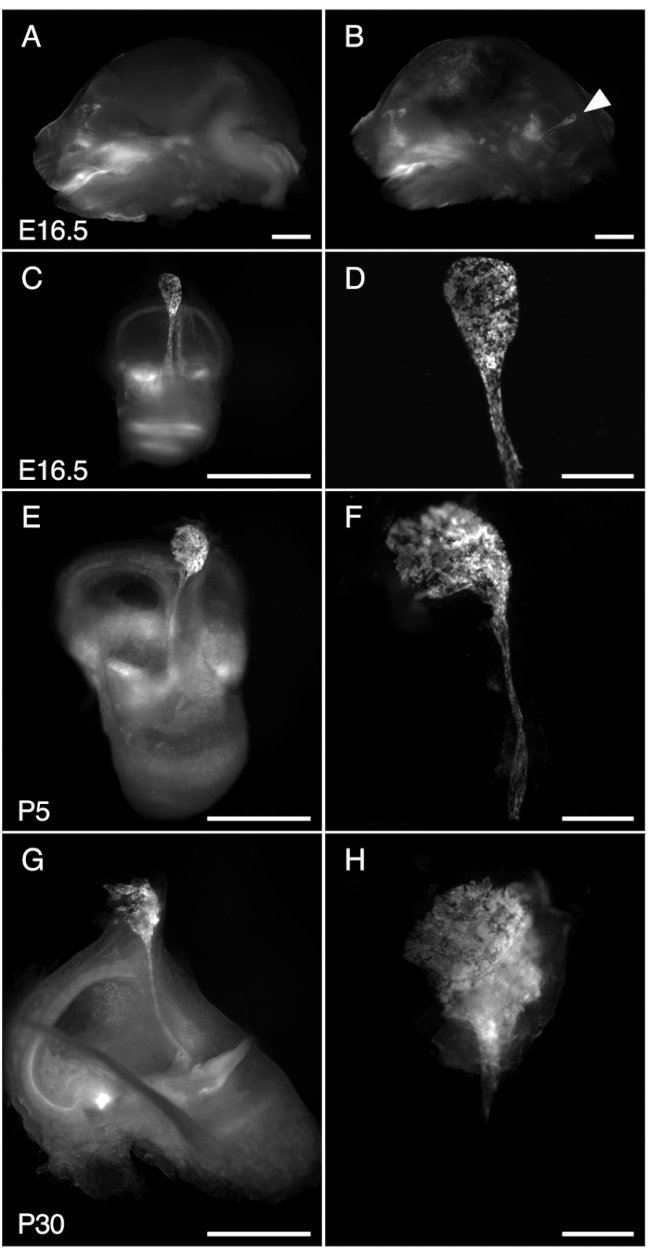
図 3. R26LSL-RCL-tdT/+の解剖;Tg(ATP6V1B1-Cre)1Rnel/Mn マウス内リンパ嚢E16.5、P5、P30。提示されたすべての画像は、tdTomato蛍光の検出用に装備された1 x対物レンズを備えた実体顕微鏡を使用して得られたtdTomato蛍光を示しています。
(A、B)E16.5 R26LSL-RCL-tdT/+の頭蓋骨の中央矢状部分。Tg(ATP6V1B1-Cre)1Rnel/Mn マウスの(A)および(B)半脳除去前および(B)後。tdTomato蛍光は、内耳の位置を概説します。内リンパ嚢は、解剖しなくても容易に見えます(矢印)。
(C、E、G)E16.5、P5、P30マウスからそれぞれ内耳を分離した。
(D、F、H)対応する微小解剖された内リンパ嚢と管の高倍率画像。P30では、内リンパ管が骨にカプセル化されているため、分離が特に困難です。スケールバー:2 mm(A、B、C、E、G)、500 μm(D、F、H)。 この図の拡大版を表示するには、ここをクリックしてください。
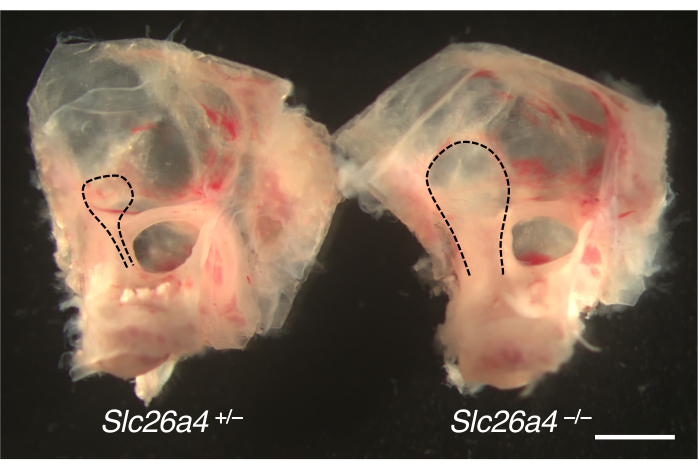
図 4.肥大した内リンパ嚢を有する耳嚢の肉眼的解剖学的構造。Slc26a4+/-(左)およびSlc26a4-/-(右)マウスの内耳はP105で同腹仔を飼っています。前庭水道と内リンパ嚢および管(黒い点線)は、Slc26a4-/-マウスのものと比較してSlc26a4-/-マウスで拡大されます。スケールバー:2 mm。 この図の拡大版を表示するには、ここをクリックしてください。
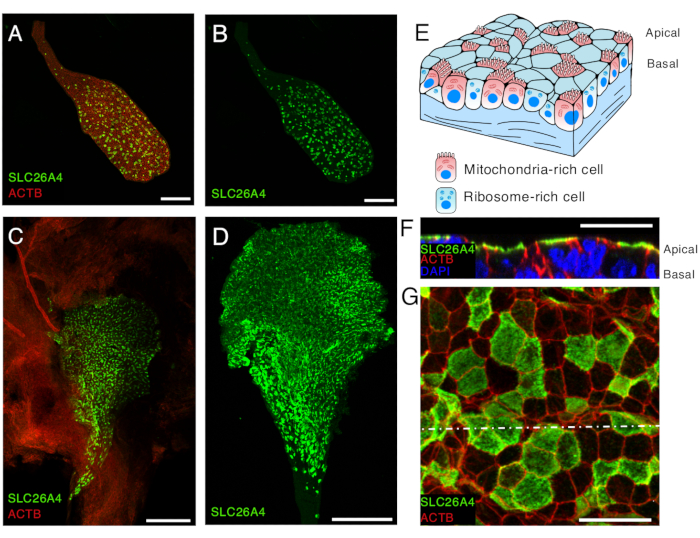
図 5.SLC26A4 E16.5およびP5の内リンパ嚢上皮におけるミトコンドリアに富む細胞の発現。
(A、B)抗SLC26A4抗体(緑)とβ-アクチンを標識するファロイジン(ACTB、赤)で標識したE16.5マウスから単離された内リンパ嚢。
(C)抗SLC26A4抗体(緑)で標識したP5マウスの開いた内リンパ嚢の低倍率画像。ファロイジン(ACTB、赤)は、内リンパ嚢の存在とその周囲の結膜組織を強調するために使用できます。
(D)抗SLC26A4抗体で標識された単離された内リンパ嚢(緑)。
(E)頂端表面が微絨毛で覆われているミトコンドリアリッチ細胞とリボソームリッチ細胞の2種類の細胞の存在を強調した内リンパ嚢上皮の模式図。
(F-G)内リンパ嚢を開き、抗SLC26A4抗体(緑)とファロイジン(ACTB、赤)で標識した後のP5の内リンパ嚢上皮の高倍率画像。頂端膜レベルでの代表像をGに、点状の白線レベルでのzスタックから再構成した断面をFに示します。細胞の核はDAPI(青)で標識されています。
スケールバー:100μm(A、B);200 μm (C, D) ;20 μm (F, G)。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1.P5 R26LSL-RCL-tdT/+の入射光とそれに対応するtdTomato蛍光画像;Tg(ATP6V1B1-Cre)1Rnel/Mnマウスの内耳を3段階の解剖で観察します。 内リンパ嚢と内リンパ管は、tdTomato蛍光を使用して容易に視覚化できます。
(A-B)P5 R26LSL-RCL-tdT/+の無傷の半頭蓋骨の後部にある内耳の領域。Tg(ATP6V1B1-Cre)1Rnel/Mnマウス。
(C-D)皮膚と頭蓋骨の一部を切除することで、内リンパ嚢の領域をよりよく視覚化することができます。
(E、F)内リンパ嚢がまだ結膜組織に関連付けられている孤立した内耳。
(A、C、E)入射光で撮影された画像。(B、D、F)対応する組織のtdTomato蛍光。スケールバー:2 mm(AB)、1 mm(CF)。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2.R26LSL-RCL-tdT/+の単離された内リンパ嚢の蛍光の比較; E16.5およびP5の Tg(ATP6V1B1-Cre)1Rnel/MnおよびR26LSL-RCL-tdT/+同腹仔マウス。tdTomato蛍光は、内リンパ嚢と内リンパ管の認識を大幅に促進します。
(A-C)E16.5 R26LSL-RCL-tdT/+の微小解剖された内リンパ嚢;Tg(ATP6V1B1-Cre)1Rnel/Mn (A) および R26LSL-RCL-tdT/+ 同腹仔マウス (B, C).
(D-F)P5 R26LSL-RCL-tdT/+の微小解剖された内リンパ嚢;Tg(ATP6V1B1-Cre)1Rnel/Mn (D) および R26LSL-RCL-tdT/+ 同腹仔マウス (E, F).
(A、B、D、E)tdTomato蛍光。(C、F)B、Eに対応する入射光像 スケールバー:500μm。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
多くの研究者は、パラフィン包埋切片または凍結切片を使用して、内リンパ嚢の形態学的研究を行っています。切片調製物の欠点は、内リンパ嚢内の各上皮細胞のサイズと形状が非常に変動し、しわのある偽層状の細胞層を形成するため、複雑な細胞間接触を完全に観察することが困難になることです。このプロトコルに記載されているホールマウント免疫染色およびzスタックイメージングにより、内リンパ嚢の三次元構造のより良好な可視化が可能になります。
マイクロダイセクションを成功させるための重要なポイントは、野生型マウスでは見えない場合でも、内リンパ嚢の全体像を精神的に視覚化することです。図3および補足図1-2に示す蛍光レポーターの観察は、マウスの内リンパ嚢の局在とサイズを認識するのに役立ちます。
このホールマウント解剖法は、上記のプロトコルの免疫染色に使用されましたが、この技術は、RT-qPCR、マイクロアレイ発現、さらにはシングルセルRNA-seqなどの遺伝子発現解析のための内リンパ嚢組織の採取にも使用できます。このプロトコルで調製した組織を用いたシングルセルRNA-seq解析の結果は、これまでに報告されている16。内リンパ嚢上皮細胞の遺伝子発現解析では、他の隣接組織とのコンタミネーションがないように単離された上皮を採取することが好ましい。胚性内リンパ嚢は隣接する結合組織から分離することができますが、後の年齢でそれを行うのははるかに困難です。高齢マウスの標本については、コラゲナーゼ/ディスパーゼと37°Cで5分間インキュベートすることが推奨され、内リンパ嚢上皮の単離が容易になります。
このプロトコルに記載されるホールマウント免疫染色の欠点の1つは、元の三次元構造が、スライドガラスとカバースリップとの間の調製物の解剖または取り付け中の外傷によって影響を受ける可能性があることである。操作によるアーティファクトを避けるための注意が必要です。
開示事項
著者は何も開示していません。
謝辞
この研究は、NIHの学内研究プログラムであるNIDCD(NIH Intramural Research Funds Z01-DC000060 and ZIC DC000081 to the Advanced Imaging Core)によって部分的に支援されました。ラウル・D・ネルソン博士とR・ランス・ミラー博士(ユタ大学、ユタ州ソルトレイクシティ)、スーザン・ウォール博士(エモリー大学医学部、ジョージア州アトランタ)には、Tg(ATP6V1B1-Cre)マウスを共有していただき、NIDCD動物施設のスタッフには動物の世話をしていただき、感謝いたします。フィリン・ワンゲマン博士には、内耳の美しいイラストを提供していただき、感謝の意を表します。この原稿を批判的にレビューしてくださったThomas B. Friedman博士とRobert J. Morell博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| EDTA 0.5 M | Crystalgen | 221-057 | |
| 1 mL TUBERCULIN syringe with 27G x 13mm | BD | 309623 | |
| 9-well spot glass plate | Pyrex | 13-748B | |
| Alexa Fluor 555-conjugated phalloidin | ThermoFisher Scientific | A34055 | |
| Artery Scissors - Ball Tip | Fine Science Tools | 14080-11 | |
| Bovine serum albumin | Sigma Aldrich | A3059 | |
| Camera to capture images in incident light | Leica | DFC 495 | |
| Camera to capture fluorescent images | Leica | DFC 7000 GT | |
| Centrifuge tubes 15 mL | Corning | 430053 | |
| Centrifuge tubes 50 mL | Corning | 430829 | |
| Collagenase/Dispase | Roche | 10269638001 | |
| Confocal microscope | Zeiss | LSM 880 | |
| Cover Glass | Corning | 2940-223 | |
| Dumont #4 Forceps | Fine Science Tools | 11241-30 | |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Alternative: Extra Fine Micro Dissecting Scissors; Straight; Sharp Points; 20mm Blade Length; 3 1/2" Overall Length | Roboz | RS-5880 | |
| Goat anti-rabbit Alexa Fluor 488-conjugated secondary antibody | ThermoFisher Scientific | A11034 | |
| MicroSlides Superfrost | VWR | 48311-702 | |
| Orbital shaker, for example Mini Shaker | Daigger | 980275 | |
| Paraformaldehyde (PFA) 16% Aqueous Solution | Electron Microscopy Sciences | 15710 | |
| Phosphate-Buffered Saline (10X) pH 7.4 | ThermoFisher Scientific | AM9624 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36931 | |
| Rabbit anti-Pendrin antibodies | In-house | RRID:AB_2713943, PB826 (Choi et al., 2011) | |
| Ring Forceps | Fine Science Tools | 11106-09 | |
| Rocking shaker, for example GyroMini | Labnet | S0500 | |
| Stereomicroscope equipped with a PlanApo 1.0x objective | Leica | ||
| Stainless Steel Single Edge Blades, .009" | GEM Personna | 62-0176 | |
| Tissue culture dish 60 mm | Falcon | 353002 | |
| Transparent nail polish | |||
| Triton X-100 | ACROS Organics | 32737-1000 |
参考文献
- Dror, A. A., Brownstein, Z., Avraham, K. B. Integration of human and mouse genetics reveals pendrin function in hearing and deafness. Cellular Physiology and Biochemistry. 28 (3), 535-544 (2011).
- Reardon, W., CF, O. M., Trembath, R., Jan, H., Phelps, P. D. Enlarged vestibular aqueduct: a radiological marker of pendred syndrome, and mutation of the PDS gene. QJM. 93 (2), 99-104 (2000).
- Griffith, A. J., Wangemann, P. Hearing loss associated with enlargement of the vestibular aqueduct: mechanistic insights from clinical phenotypes, genotypes, and mouse models. Hearing Research. 281 (1-2), 11-17 (2011).
- Gurkov, R., Pyyko, I., Zou, J., Kentala, E. What is Meniere's disease? A contemporary re-evaluation of endolymphatic hydrops. Journal of Neurology. 263, 71-81 (2016).
- Eckhard, A., et al. Water channel proteins in the inner ear and their link to hearing impairment and deafness. Molecular Aspects of Medicine. 33 (5-6), 612-637 (2012).
- Choi, B. Y., et al. Mouse model of enlarged vestibular aqueducts defines temporal requirement of Slc26a4 expression for hearing acquisition. Journal of Clinical Investigation. 121 (11), 4516-4525 (2011).
- Miyashita, T., et al. Presence of FXYD6 in the endolymphatic sac epithelia. Neuroscience Letters. 513 (1), 47-50 (2012).
- Royaux, I. E., et al. Localization and functional studies of pendrin in the mouse inner ear provide insight about the etiology of deafness in pendred syndrome. Journal of the Association for Research in Otolaryngology. 4 (3), 394-404 (2003).
- Kim, H. M., Wangemann, P. Epithelial cell stretching and luminal acidification lead to a retarded development of stria vascularis and deafness in mice lacking pendrin. PLoS One. 6 (3), 17949 (2011).
- Dahlmann, A., von During, M. The endolymphatic duct and sac of the rat: a histological, ultrastructural, and immunocytochemical investigation. Cell and Tissue Research. 282 (2), 277-289 (1995).
- Everett, L. A., et al. Targeted disruption of mouse Pds provides insight about the inner-ear defects encountered in Pendred syndrome. Human Molecular Genetics. 10 (2), 153-161 (2001).
- Miller, R. L., et al. The V-ATPase B1-subunit promoter drives expression of Cre recombinase in intercalated cells of the kidney. Kidney International. 75 (4), 435-439 (2009).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Wang, L., Jiang, H., Brigande, J. V. Gene transfer to the developing mouse inner ear by in vivo electroporation. Journal of Visualized Experiments. (64), e3643 (2012).
- Currle, D. S., Hu, J. S., Kolski-Andreaco, A., Monuki, E. S. Culture of mouse neural stem cell precursors. Journal of Visualized Experiments. (2), 152 (2007).
- Honda, K., et al. Molecular architecture underlying fluid absorption by the developing inner ear. Elife. 6, (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved