Method Article
נתיחת השק האנדולימפטי מעכברים
* These authors contributed equally
In This Article
Summary
מחקר זה מתאר כיצד לנתח את השק האנדולימפטי מהאוזן הפנימית של העכבר בגילאים שונים. התוצאה של דיסקציה דומה מוצגת במודל עכבר Slc26a4-null של הגדלת השק האנדולימפטי. עכבר מהונדס עם כתב ניאון המתבטא בשק האנדולימפטי מוצג כמודל לדמיין בקלות את השק האנדולימפטי, ואת הכלי החינוכי.
Abstract
המחקר של מודלים עכבריים מוטנטיים של הפרעות שמיעה ושיווי משקל אנושיים חשף שינויים מבניים ותפקודיים רבים שעשויים לתרום לפנוטיפים האנושיים. למרות התקדמות חשובה שנעשתה בהבנת ההתפתחות והתפקוד של האפיתל הנוירוסנסורי של השבלול והווסטיבולה, קיים ידע מוגבל לגבי ההתפתחות, הרכב התאים, מסלולים מולקולריים ומאפיינים תפקודיים של השק האנדולימפטי. זאת, במידה רבה, בשל הקושי לדמיין ולנתח מיקרו-ניתוח של רקמה זו, שהיא אפיתל המורכב משכבת תא אחת בלבד. המחקר המוצג כאן מתאר גישה לגישה ולניתוח מיקרו של השק האנדולימפטי מהאוזן הפנימית של עכבר מסוג פרא בגילאים שונים. התוצאה של דיסקציה דומה מוצגת במודל עכבר חסר פנדרין של הגדלת אמת שיווי המשקל. עכבר מהונדס עם שק אנדולימפטי פלואורסצנטי מוצג. עכבר כתב זה יכול לשמש כדי לדמיין בקלות את השק האנדולימפטי עם דיסקציה מוגבלת ולקבוע את גודלו. זה יכול לשמש גם ככלי חינוכי ללמד כיצד לנתח את השק האנדולימפטי. הליכי דיסקציה אלה אמורים להקל על אפיון נוסף של חלק זה של האוזן הפנימית.
Introduction
האוזן הפנימית של יונקים מורכבת משברלול, עצם העצה, האוטריקל, שלוש תעלות חצי עגולות ושק אנדולימפטי (איור 1A). איברים אלה מהווים אפיתל רציף ומלא נוזלים הנקרא מבוך הממברנות, עם איברים סמוכים המתחברים ישירות או דרך מבני תעלה קטנים כגון ductus reuniens, צינור העצה, צינור utricular או צינור endolympatic. בהשוואה לאיברים אחרים באוזן הפנימית, לשק האנדולימפטי יש מאפיינים ייחודיים. ראשית, חסרים בו תאי אפיתל חושיים. במקום זאת, בשק האנדולימפטי יש תאים המתמחים בהובלת יונים. שנית, למרות שהמבוך הקרומי סגור במבוך הגרמי, השק האנדולימפטי הוא יוצא מן הכלל, ובולט בחלקו מתוך עצם הפטרוס אל תוך החלל התוך גולגולתי. נראה כי מורפולוגיה זו נשמרה מאוד במהלך האבולוציה של האוזן הפנימית. שלישית, השק האנדולימפטי הוא המבנה הראשון שהתפתח מהאוטוציסט בשלב עוברי מוקדם לפני היווצרות איברים אחרים. בנוסף, מספר פתולוגיות נקשרו עם שק אנדולימפטי מוגדל או תא אנדולימפטי חריג. נוכחותם של וריאנטים פתוגניים ב-SLC26A4 (הידוע גם בשם גן הפנדרין) מובילה לצורה נפוצה יחסית של ליקוי שמיעה תחושתי-עצבי, הנגרמת על ידי הגדלת השק האנדולימפטי הקשור לנוכחות אמת שיווי משקל מוגדלת (EVA)1. כאשר הוא קשור לזפק, הוא מכונה תסמונת פנדרד 2,3. מחלת מנייר נחשבת גם על ידי כמה להיות קשורה עם חריגה של התא האנדולימפטי (hydrops)4. התכונות הייחודיות של השק האנדולימפטי והפתולוגיות הקשורות לשינוי המורפולוגיה שלו עולות בקנה אחד עם תפקיד קריטי להתפתחות ותחזוקה של האוזן הפנימית.
למרות חשיבותו, הידע עדיין מוגבל לגבי ההתפתחות, הרכב התאים, מסלולים מולקולריים ומאפיינים תפקודיים של השק האנדולימפטי. זה לפחות בחלקו בשל הקושי של הדמיה microdissecting רקמה זו. השק האנדולימפטי הוא מבנה דמוי כיס, המורכב משכבה אחת של תאי אפיתל, שהיא לרוב שקופה וקשה מאוד לזיהוי מתוך רקמת הלחמית המקיפה אותה בסטריאומיקרוסקופיה קלה. למרות שמספר קטן של חוקרים פיתחו טכניקות דיסקציה שלמות ופרסמו את ממצאי הניסוי שלהם 5,6,7,8,9,10, אין פרסום המתמקד בפרטים הטכניים של הליך זה.
במחקר זה מתוארות גישות המיקרודיסקציה שפותחו כדי לגשת ולבודד את השק האנדולימפטי מהאוזן הפנימית של עכבר מסוג פרא בגילאים שונים, בהרכבה שלמה. התוצאות של דיסקציה דומה מוצגות במודל עכבר, חסר ביטוי של SLC26A4, אשר יש הגדלה של צינור אנדולימפטי ושק. מדווח על קו עכבר עם טרנסגן המקודד Cre recombinase המתבטא בשק האנדולימפטי. בנוכחות כתב פלורסנט של ביטוי Cre, כאן tdTomato, ניתן להשתמש בפלואורסצנטיות כדי לדמיין בקלות את השק האנדולימפטי עם דיסקציה מוגבלת ולקבל מידע על גודלו. קו עכבר כתב זה יכול לשמש גם ככלי חינוכי לתרגול ושכלול נתיחות שק אנדולימפטיות. היכולת לנתח רקמת שק אנדולימפטי אמורה להקל על אפיון נוסף של מרכיב לא נחקר אך חיוני זה של האוזן הפנימית.
Protocol
כל הניסויים וההליכים בבעלי חיים בוצעו על פי פרוטוקולים שאושרו על ידי ועדות הטיפול והשימוש בבעלי חיים של המכון הלאומי למחלות נוירולוגיות ושבץ / המכון הלאומי לחירשות והפרעות תקשורת אחרות (#1264) והוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטה הרפואית ורפואת השיניים של טוקיו (A2020-058A).
הערה: עכברי C57BL/6J (מספר מלאי מס' 000664), Pds-/-ידועים גם בשם Slc26a4-/- עכברים (129S-Slc26a4 tm1Egr/AjgJ, מס' 018424) 11, B6; עכברי CBA-Tg(ATP6V1B1-Cre)1Rnel/Mm עכברים12 ו-Ai9(LSL-RCL-tdT) (B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze, no. 007909) עכברים13 זמינים ממעבדת ג'קסון ועל פי בקשה. כל הליכי הגנוטיפ תוארו בעבר. ב6; עכברי CBA-Tg(ATP6V1B1-Cre)1Rnel/Mm שבעבר עברו הכלאה לאחור לזן C57BL/6J במשך חמישה דורות לפחות, גודלו לצורך ניסויים. בעלי חיים משני המינים ניתן לחקור עם גישה זו ללא הבדל ברור. היום הראשון לאחר הזדווגות הלילה נספר כיום עוברי 0.5 (E0.5).
1. קציר וקיבוע האוזן הפנימית השלמה בגולגולת
- המתת חסד של בעלי חיים ניסיוניים או סכר בהריון בזמן באמצעות הליך מאושר מוסדית, למשל, באמצעות שאיפת CO2 . יש לעבוד תחת מכסה אדים במידת האפשר, כדי למנוע או למזער את התפשטות האלרגנים של עכברים. לאחר אימות חוסר התגובה לגירויים כואבים כגון צביטות כפה או זנב, ערפו את ראשו של החיה. עבור סכר בהריון בזמן, נקע צוואר הרחם יכול לשמש כחלופה לעריפת ראשים אם אוזניו הפנימיות אינן משמשות לניסויים נוספים.
- קצרו את העוברים על ידי לפרטומיה14 באמצעות מספריים עורקיים עם קצה כדור כדי להגן על העוברים במהלך התהליך. לתפעל את העוברים באמצעות מלקחיים טבעתיים. הניחו את קרני הרחם בטמפרטורה של 4 מעלות צלזיוס על קרח ובודדו כל עובר כפי שתואר קודם לכן15 לפני עריפת ראשו.
- חתכו את הראש מאחור לחזית: תחילה חתכו את החלק העליון של הראש על ידי חיתוך העור, לאחר מכן את החלק העליון של הגולגולת, וחתכו כשליש ממנו עם כל חתך כדי שלא יהיה כיפוף של הגולגולת. ואז לחתוך את החלק התחתון של הגולגולת בבת אחת.
הערה: עבור עוברים, מומלץ להשתמש בלהב חד, ולא מספריים. זה קריטי, כי בכל הגילאים, הגולגולת לא מעוות בעת חיתוך אותו. - בלי לגעת בגולגולת או לכופף אותה, הסירו בזהירות את חצי המוח כדי לחשוף את המבוך הגרמי (איור 1B, איור משלים 1A-B).
- עבור עכברים לאחר יום 5 ומעלה, לחצות את תעלת השמע החיצונית ולמשוך את העור קדימה לכיוון האף. חתכו את הגולגולת סביב האוזן הפנימית (איור משלים 1C).
- העבירו את שתי גולגולות ההמי של כל בעל חיים עם האוזן הפנימית, שלמות ככל האפשר, לבקבוקון זכוכית או צינור המכיל 10 מ"ל של 4°C 4% paraformaldehyde (PFA) מדולל ב-1x PBS ושמרו על קרח מתחת למכסה אדים.
הערה: אל תנסה להסיר את האוזן הפנימית מהגולגולת בשלב זה, מכיוון שהדבר עלול לגרום נזק לצינור האנדולימפטי ולשק תוך כדי כך. - יש לדגור במשך שעה אחת ב-4°C על שייקר נדנדה. אם אתם עובדים עם רקמה מבעל חיים עם כתב פלואורסצנטי, שמרו את הצינור המכיל את הדגימה ברדיד אלומיניום או בקופסה כדי למזער את החשיפה לאור.
הערה: אם מעוניינים לחקור מיקרוטובולים ומולקולות קשורות, יש לבצע קיבוע רקמות בטמפרטורת החדר (RT) עם קיבוע RT. - יש להשליך את ה-PFA במיכל מתאים במכסה אדים. שטפו שלוש פעמים עם 10 מ"ל של 1x PBS במשך 15 דקות בכל פעם על שייקר נדנדה ב-RT כדי לבטל את הקיבוע לפני הנתיחה.
2. מיקרודיסקציה של שק אנדולימפטי
- מעבירים כל תכשיר אוזן פנימית לצלחת תרבית רקמה בקוטר 35 מ"מ המכילה PBS אחד.
- מניחים את ההכנה בצלחת כך ששורש עצב הגולגולת ה -8 מכוון כלפי מעלה. החזיקו את הרקמה במצב הזה על-ידי אחיזת השבלול עם מלקחיים #4 (איור 1C).
- זהו ציוני דרך חשובים: אמת שיווי המשקל, התעלות החצי עגולות הקדמיות והאחוריות, קרוס משותף וסינוס סיגמואיד (וריד) (איור 1D).
הערה: השק האנדולימפטי בעכבר מסוג פרא הוא שקוף וקשה לדמיין. למיקרודיסקציה מוצלחת של השק האנדולימפטי, חשוב להבין את האנטומיה ואת הלוקליזציה שלו (איור 1E). - חותכים את הדורה מאטר ואת אמת שיווי המשקל, כמו גם את רקמות החיבור הבסיסיות המקיפות את השק האנדולימפטי, באמצעות מחט 27 G על מזרק 1 מ"ל (איור 1D,F).
הערה: עבור עכבר בוגר, הסתיידות של התכשיר באמצעות 10% EDTA (pH 7.4) לפני microdissection הוא שימושי, אבל לא חיוני, כדי להקל על חתך של אמת שיווי המשקל. לדיסקציה של שק אנדולימפטי פתוח שגילו עולה על היום ה-5 שלאחר הלידה, מומלץ למקם את קו החתך על אמת שיווי המשקל מעט קדמית כדי לבצע חתך לתוך לומן השק האנדולימפטי (איור 2A). - החזיקו את רקמת החיבור הממוקמת לרוחב השק האנדולימפטי בעזרת מלקחיים ומשכו את הרקמה למעלה כדי לקלף אותה מהעצם הרקתית (איור 1G).
- יש לסלק בזהירות את שאריות הפסולת. ההכנה כוללת בדרך כלל את אפיתל השק האנדולימפטי, רקמות החיבור שמסביב, חלק מאמת שיווי המשקל והסינוס הסיגמואיד (איור 1H-I). במידת הצורך, הפרידו את אפיתל השק האנדולימפטי מהרקמות הסובבות אותו (איור 1J).
- (אופציונלי) לדיסקציה של השק האנדולימפטי הפתוח, החזיקו את חלק הגבעול של ההכנה, כך שניתן יהיה לראות את חתך הרוחב של הלומן. הכניסו מחט 27G לתוך הלומן והזיזו אותה כדי לחתוך את השק האנדולימפטי לשני יריעות (איור 2B-C). החזיקו את הקצה של כל רקמה דמוית יריעה בעזרת מלקחיים והפרידו ביניהן (איור 2D-F).
3. אימונוהיסטוכימיה
- לאחר מיקרודיסקציה, השתמש במלקחיים #5 כדי להעביר שקיות אנדולימפטיות לתוך צלחת זכוכית ספוט 9 בארות.
- באמצעות המיקרוסקופ כדי לוודא שהשקים האנדולימפטיים נשארים ללא פגע, השתמש בפיפט של 200 μL כדי להסיר את כל PBS 1x למעט טיפה אחת המכילה את הרקמה. הוסף 200 μL של תמיסת חדירה וחסימה (1x PBS עם 0.15% Triton X-100 (PBS-TX) ו-5% אלבומין בסרום בקר (BSA)) ודגור במשך שעה אחת ב-RT על שייקר מסלולי.
- לאחר הסרת כל התמיסה החוסמת למעט טיפה אחת המכילה את הרקמה, יש להוסיף 200 μL של נוגדנים ראשוניים ולדגור למשך הלילה בטמפרטורה של 4°C. נוגדנים נגד פנדרין6 מדוללים בקנ"מ 1:1000 בתמיסת חסימה יכולים לשמש לזיהוי התאים העשירים במיטוכונדריה של השק האנדולימפטי, אם כי ביטוי חלש נראה גם בתת-קבוצה של תאים עשירים בריבוזום16 (איור 5).
- לאחר שלוש שטיפות ב 1x PBS במשך 15 דקות ב RT, לדגור עם נוגדנים משניים. עבור התיוג המוצג כאן, לדגור 200 μL של נוגדנים משניים מצומדים בצבע פלואורסצנטי, מדולל מן המלאי המסחרי ב 1:500 בתמיסת חסימה, עם הרקמה על פלטפורמת נדנדה במשך 1 שעה ב RT בחושך. ניתן להשתמש בפלואידין מצומד בצבע פלואורסצנטי, אשר מזהה β-אקטין (ACTB), כדי להדגיש את נוכחותם של השק והצינור האנדולימפטי, כמו גם את רקמת הלחמית סביבם (איור 5A, C, F-G).
- הרכבה של שקיות אנדולימפטיות בין מגלשת זכוכית לכיסוי באמצעות אמצעי הרכבה נגד דהייה עם DAPI. לאחר שנותנים למגלשות להתייבש ומוגנות מאור למשך שעה אחת ב-RT, יש למרוח לק שקוף בצומת שבין הכיסוי למגלשת הזכוכית כדי לאטום אותן ולהגביל את היווצרות בועות האוויר. אם מנסים לדמיין את ההתפלגות הדיפרנציאלית של החלבונים במשטח האפיקאלי לעומת המשטח הבזולטרלי של תאי האפיתל, מומלץ לפתוח את השק במהלך שלב ההרכבה על ידי חיתוך קצה ופתיחתו.
- תמונה באמצעות מיקרוסקופ קונפוקלי. ראשית, דמיינו תכשירי שק אנדולימפטיים במטרה של פי 10 לספק תצוגה גלובלית של תיוג השק (איור 5A-D). לאחר מכן השתמשו במטרה של פי 63 כדי לקבל תצוגה מפורטת של התפלגות החלבון המעניין בתאים עשירים במיטוכונדריה וריבוזום בשק האנדולימפטי (איור 5F-G).
תוצאות
כל שלב של מיקרודיסקציה זו של שק אנדולימפטי מסוג פרא מעכבר יום 5 (P5) לאחר הלידה מפורט בווידיאו המשויך, ותמונות של שלבי המפתח של הדיסקציה והפתיחה של השק האנדולימפטי מוצגות באיור 1 ובאיור 2.
תוצאות מייצגות של הנתיחות של השק האנדולימפטי עם פלואורסצנטיות tdTomato ביום העוברי 16.5 (E16.5), P5 ו-P30, בעקבות פרוטוקול זה, מוצגות באיור 3 ובאיור משלים 1 ובאיור משלים 2. באמצעות מיקרוסקופ דיסקציה עם פלואורסצנטיות, ניתן לדמיין בקלות את השק האנדולימפטי בגולגולת לאחר הסרת המוח בעכברים הנושאים את הטרנסגן Tg(ATP6V1B1-Cre) בנוכחות המדווח של ביטוי Cre: Ai9 (LSL-RCL-tdT) (ראו איור 3A-B, ואיור משלים 1 לתמונות שצולמו באור אירוע ופלואורסצנטיות tdTomato של השק האנדולימפטי בשלבים שונים של הדיסקציה). בעכברים האלה, Cre מבוטא כפסיפס בתאים לכל אורך השק והצינור האנדולימפטי (איור 3, ראו גם איור משלים 2 להדמיה של השק האנדולימפטי עם לעומת ללא כתב פלואורסצנטי). אף על פי שהביטוי של כתב זה אינו ספציפי עבור הביטוי האנדוגני של Atp6v1b1, אשר מוגבל לתאים עשירים במיטוכונדריה של שק אנדולימפטי16, אחד משני סוגי התאים של אפיתל זה (איור 5E), זהו כלי עזר מועיל לזהות ולנתח את השק האנדולימפטי.
אוזניים פנימיות שנותחו ממודל עכברי להגדלת אמת שיווי המשקל מוצגות באיור 4. בהשוואה להמלטות הביקורת, השקים האנדולימפטיים והתעלות של עכברים החסרים SLC26A4 (פנדרין) מוגדלים.
תמונות מייצגות של אימונוהיסטוכימיה של שק אנדולימפטי שלם עם ובלי רקמת לחמית מוצגות באיור 5. תוצאות של אימונוהיסטוכימיה של שק אנדולימפטי פתוח של עכבר מסוג P5 מוצגות גם הן (איור 5F-G). השק האנדולימפטי מורכב משכבה אחת של אפיתל מקופל במבנה בצורת פאוץ', המכיל את הלומן אנדולימפה שלו. אפיתל זה מורכב משני סוגי תאים, תאים עשירים במיטוכונדריה ותאים עשירים בריבוזום (איור 5E). שק אנדולימפטי שלם ישוטח מכיוון שהאנדולימפה כבר לא קיים. השק יופיע כשתי שכבות משולבות של אפיתל, מה שיקשה על קביעת לוקליזציה תת-תאית של חלבונים המבוטאים באפיתל זה. על ידי פתיחת השק האנדולימפטי, ניתן לדמיין בקלות את אפיתל השכבה הבודדת ולקבוע את ההתפלגות היחסית של החלבונים המעניינים, ביחס ללומן השק האנדולימפטי, באופן סופי יותר. אפיקל פוטנציאלי (לומינלי, היכן שהאנדולימפה יהיה) לעומת העשרה בסיסית של חלבונים אלה ניתן לקביעה מדויקת יותר. לדוגמה, SLC26A4 מועשר בצד האפי של תאים עשירים במיטוכונדריה (איור 5F).
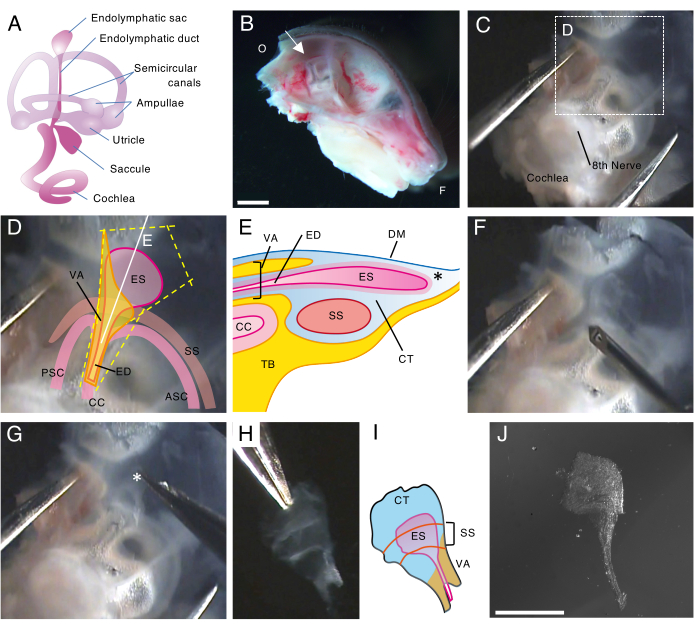
איור 1. דיסקציה שלמה של השק האנדולימפטי של עכבר מסוג פרא ביום 5 שלאחר הלידה (P5).
(A) סכמטיות של המבוך הקרומי של אוזן פנימית מפותחת של עכבר מפותח (מימין). המיקום של השק האנדולימפטי, ואת השבלול ואת מבנים שיווי המשקל מסומנים. נתון זה שונה מ- Honda et al.16.
(B) חתך אמצע הקשת המציג את הגולגולת השמאלית של ההמי. המיקום של השק האנדולימפטי מצוין (חץ). (O, עורפית; F, חזיתית)
(C) קפסולה אוטית יחד עם החלק הקשקשי של העצם הרקתית.
(D) ציוני דרך חשובים על גבי התיבה המנוקדת בלוח C. (ES, שק אנדולימפטי; ED, צינור אנדולימפטי; VA, אמת שיווי משקל; ASC, תעלה חצי עגולה קדמית; PSC, תעלה חצי עגולה אחורית; CC, crus נפוץ; SS, סינוס סיגמואיד)
(E) המחשה סכמטית של חתך הרוחב יחד עם הקו הלבן הרציף בלוח D דרך השק האנדולימפטי. הצד הפרוקסימלי של השק האנדולימפטי מכוסה בתעלה גרמית הנקראת אמת שיווי המשקל, יחד עם הצינור האנדולימפטי. בצד הדיסטלי, השק האנדולימפטי, מוקף ברקמת הלחמית (CT), משתרע ובולט לחלק החיצוני של המבוך הגרמי והוא דחוק בין הסינוס הדורה מאטר (DM) והסינוס הסיגמואיד עם החלק הקשקשי של העצם הטמפורלית (שחפת).
(F) מחט דקה משמשת לחיתוך סביב השק האנדולימפטי (בעקבות הקווים הצהובים המנוקדים בלוח D).
(G) התכשיר מוסר בזהירות מהעצם הרקתית על ידי החזקת הרקמה במיקום המוצג בכוכבית (*, מוצג גם בלוח E) וקילוף שלה.
(H) שק אנדולימפטי שלם מבודד עם רקמות מסביב.
(I) גרסה סכמטית של השק האנדולימפטי המבודד הזה עם הרקמות שמסביב.
(J) שק אנדולימפטי מבודד ללא רקמות מסביב.
פסי קנה מידה: 2 מ"מ (B), 1 מ"מ (J). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
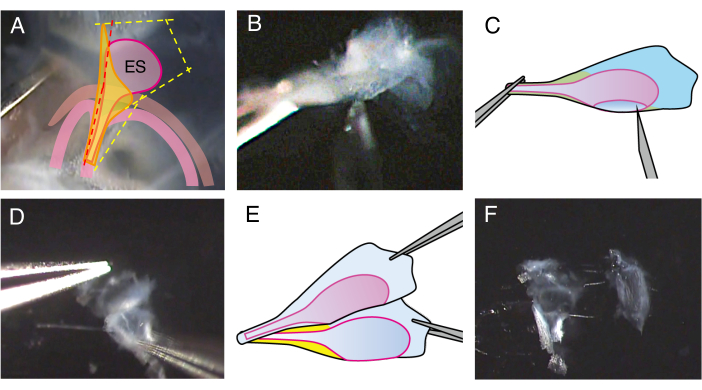
איור 2. דיסקציה של השק האנדולימפטי הפתוח של עכבר מסוג P5 פראי.
(A) בשלב 2.4, קו החתך על אמת שיווי המשקל ממוקם מעט קדמי (קו אדום מקווקו) כדי לבצע חתך לתוך לומן השק האנדולימפטי.
(B) החזיקו את חלק הגבעול של התכשיר, הכניסו מחט באורך 27 מד לתוך הלומן, והזיזו אותה כדי לחתוך את השק האנדולימפטי לשתי יריעות.
(C) איור סכמטי של לוח B.
(D) החזיקו את קצה כל יריעה במלקחיים והפרידו ביניהן.
(E) איור סכמטי של לוח D.
(F) השק האנדולימפטי מופרד לשני יריעות, כולל האפיתל והרקמות הסובבות אותו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
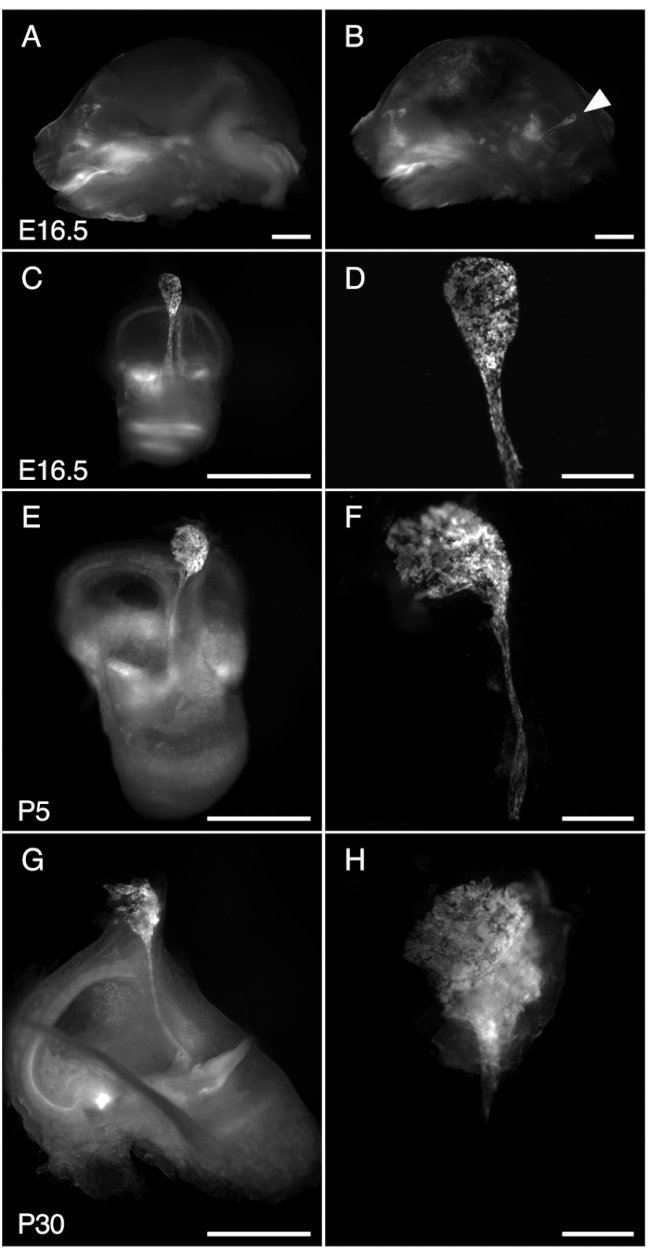
איור 3. דיסקציה של R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn עכבר שק אנדולימפטי ב-E16.5, P5 ו-P30. כל התמונות המוצגות מראות פלואורסצנטיות tdTomato המתקבלת באמצעות סטריאומיקרוסקופ עם מטרה 1 x מצויד לזיהוי של פלואורסצנטיות tdTomato.
(א, ב) חתך אמצע הקשת של הגולגולת של E16.5 R26LSL-RCL-tdT/+; עכבר Tg(ATP6V1B1-Cre)1Rnel/Mn לפני (A) ואחרי (B) הסרת חצי מוח. פלואורסצנטיות של tdTomato מתארת את מיקום האוזן הפנימית. השק האנדולימפטי נראה בקלות גם ללא דיסקציה (ראש חץ).
(ג, ה, ז) אוזניים פנימיות מבודדות מעכברי E16.5, P5 ו-P30, בהתאמה.
(ד, ו' ו-ח') תמונות הגדלה גבוהות יותר של השקים והתעלות האנדולימפטיים המיקרו-חתוכים המתאימים. ב-P30, הצינור האנדולימפטי עטוף בעצם ולכן קשה במיוחד לבודד אותו. פסי קנה מידה: 2 מ"מ (A, B, C, E, G), 500 מיקרומטר (D, F, H). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
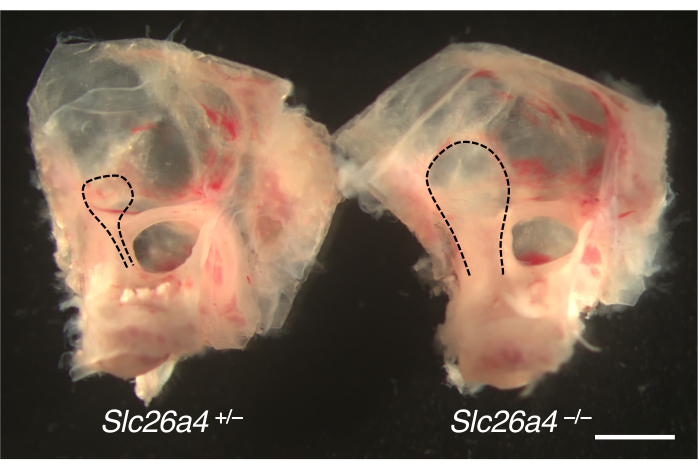
איור 4. אנטומיה גסה של הקפסולה האופטית עם שק אנדולימפטי מוגדל. אוזניים פנימיות של עכברי Slc26a4+/- (משמאל) ו-Slc26a4-/- (מימין) ב-P105. אמת שיווי המשקל והשק והתעלה האנדולימפטיים (קווים מנוקדים שחורים) מוגדלים בעכבר Slc26a4-/- בהשוואה לאלה שבעכבר Slc26a4+/- . סרגל קנה מידה: 2 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
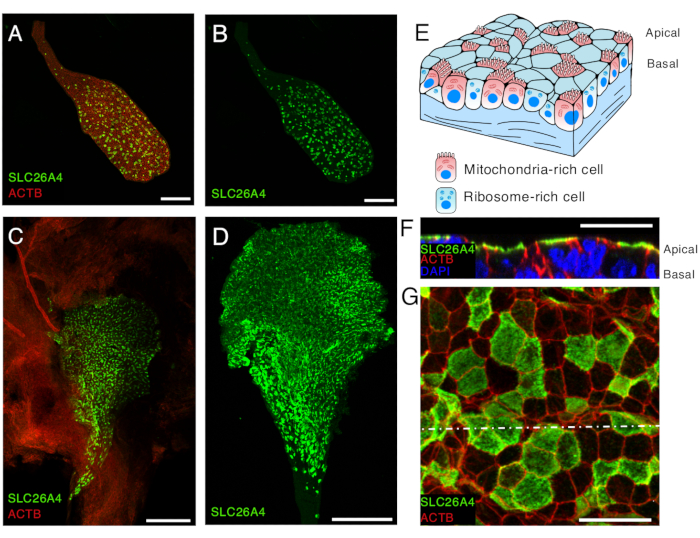
איור 5. ביטוי SLC26A4 של תאים עשירים במיטוכונדריה באפיתל השק האנדולימפטי ב-E16.5 וב-P5.
(א, ב) שק אנדולימפטי מבודד מעכבר E16.5 המסומן בנוגדן אנטי-SLC26A4 (ירוק) ופאלואדין המסומן β-אקטין (ACTB, אדום).
(C) תמונה בהגדלה נמוכה של שק אנדולימפטי פתוח מעכבר P5 המסומן בנוגדן אנטי-SLC26A4 (ירוק). Phalloidin (ACTB, אדום) ניתן להשתמש כדי להדגיש את נוכחותו של השק האנדולימפטי, כמו גם את רקמת הלחמית סביבו.
(D) שק אנדולימפטי מבודד המסומן בנוגדן אנטי-SLC26A4 (ירוק).
(E) המחשה סכמטית של אפיתל השק האנדולימפטי המדגישה את נוכחותם של שני סוגי תאים: התאים העשירים במיטוכונדריה, שפני השטח האפיים מכוסים במיקרוווילי, והתאים העשירים בריבוזום.
(פ-ג) תמונות בהגדלה גבוהה של אפיתל שק אנדולימפטי ב-P5, לאחר שהשק האנדולימפטי נפתח ותויג בנוגדן אנטי-SLC26A4 (ירוק) ופאלואדין (ACTB, אדום). תמונה מייצגת ברמת הממברנה האפיקלית מוצגת ב-G, וחתך רוחב משוחזר מערימת z ברמת הקו הלבן המנוקב מוצג ב-F. גרעין התאים מסומן ב-DAPI (כחול).
מוטות קנה מידה: 100 מיקרומטר (A, B); 200 מיקרומטר (C, D) ; 20 מיקרומטר (F, G). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תרשים משלים 1. תאורת אירוע ותמונות פלואורסצנטיות tdTomato תואמות של P5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn אוזן פנימית של עכבר בשלושה שלבים של הדיסקציה. ניתן לדמיין בקלות את השק והצינור האנדולימפטי באמצעות פלואורסצנטיות tdTomato.
(א-ב) אזור האוזן הפנימית בחלק האחורי של חצי גולגולת שלמה של P5 R26LSL-RCL-tdT/+; עכבר Tg(ATP6V1B1-Cre)1Rnel/Mn.
(ג-ד) הסרת העור וחלק מהגולגולת מאפשרת הדמיה טובה יותר של אזור השק האנדולימפטי.
(ה, ו) אוזן פנימית מבודדת עם השק האנדולימפטי שעדיין קשור לרקמת הלחמית.
(א, ג, ה) תמונות שצולמו באור אירוע. (B, D, F) TDTOMATO FLUORESCENCE של הרקמה המתאימה. פסי קנה מידה: 2 מ"מ (A-B), 1 מ"מ (C-F). אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 2. השוואה של פלואורסצנטיות של שקים אנדולימפטיים מבודדים של R26LSL-RCL-tdT/+; עכברי Tg(ATP6V1B1-Cre)1Rnel/Mn ו-R26LSL-RCL-tdT/+ littermate ב-E16.5 וב-P5. tdTomato fluorescence מאוד מקל על זיהוי של שק endolymphatic צינור.
(א-ג) שקיות אנדולימפטיות מיקרו-חתוכות של E16.5 R26LSL-RCL-tdT/+; עכברי Tg(ATP6V1B1-Cre)1Rnel/Mn (A) ו-R26LSL-RCL-tdT/+ ליטרמט עכברים (B, C).
(ד-ו) שקיות אנדולימפטיות מיקרו-חתוכות של P5 R26LSL-RCL-tdT/+; עכברי Tg(ATP6V1B1-Cre)1Rnel/Mn (D) ו-R26LSL-RCL-tdT/+ ליטרמט עכברים (E, F).
(A, B, D, E) פלואורסצנטיות עגבניות. (ג, ו) תמונות אור אירוע המתאימות ל- B ו- E. פסי קנה מידה: 500 מיקרומטר. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
חוקרים רבים השתמשו במקטעים משובצים פרפין או קפואים למחקרים מורפולוגיים של השק האנדולימפטי. החיסרון של תכשירים חתוכים הוא שזה יכול להיות קשה להתבונן באופן מלא במגעים המסובכים בין תאים מכיוון שהגודל והצורה של כל תא אפיתל בשק האנדולימפטי משתנים ביותר, ויוצרים שכבת תא מקומטת ופסאודוסטרטית. הדמיית אימונוסטיין בהר שלם והדמיית מחסנית z, המתוארת בפרוטוקול זה, מאפשרת הדמיה טובה יותר של המבנה התלת-ממדי של השק האנדולימפטי.
עבור microdissection מוצלח, הנקודה הקריטית היא לדמיין מנטלית את כל קווי המתאר של השק האנדולימפטי, גם אם הוא בלתי נראה בעכבר מסוג פראי. תצפית על כתב הפלואורסצנטי שמוצג באיור 3 ובאיור משלים 1-2 יכולה לסייע בזיהוי לוקליזציה וגודל של השק האנדולימפטי בעכברים.
בעוד ששיטת דיסקציה שלמה זו שימשה לצביעת מערכת החיסון בפרוטוקול הנ"ל, טכניקה זו יכולה לשמש גם לקצירת רקמת שק אנדולימפטי לניתוח ביטוי גנים, כגון RT-qPCR, ביטוי מיקרו-מערך ואפילו RNA-seq של תא יחיד. התוצאות של ניתוח RNA-seq חד-תאי באמצעות רקמות שהוכנו עם פרוטוקול זה דווחו בעבר16. לניתוח ביטוי גנים של תאי אפיתל שק אנדולימפטי, עדיף לאסוף אפיתל מבודד כך שלא יהיה זיהום עם רקמות סמוכות אחרות. למרות שניתן להפריד את השק האנדולימפטי העוברי מרקמות החיבור הסמוכות, הרבה יותר קשה לעשות זאת בגילאים מאוחרים יותר. עבור דגימות מעכברים מבוגרים יותר, מומלץ לדגור עם collagenase/dispase במשך 5 דקות ב 37 ° C ומקל על בידוד של אפיתל השק האנדולימפטי.
אחד החסרונות של ההרכבה החיסונית כולה המתוארת בפרוטוקול זה הוא שהמבנה התלת-ממדי המקורי עלול להיות מושפע מטראומה במהלך דיסקציה או הרכבה של ההכנה בין מגלשת זכוכית לכיסוי. יש צורך בזהירות כדי למנוע חפצים עקב מניפולציה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך בחלקו על ידי תוכנית המחקר התוך-ציורי של ה-NIH, NIDCD (NIH Intramural Research Funds Z01-DC000060 ו-ZIC DC000081 ל-Advanced Imaging Core). אנו אסירי תודה לד"ר ראול ד. נלסון ור. לאנס מילר (אוניברסיטת יוטה, סולט לייק סיטי, יוטה) ולד"ר סוזן וול (בית הספר לרפואה של אוניברסיטת אמורי, אטלנטה, ג'ורג'יה) על שיתוף עכברי Tg (ATP6V1B1-Cre) ולצוות מתקן החיות NIDCD על הטיפול בבעלי החיים שלנו. אנו מביעים את תודתנו לד"ר פילין וונגמן על האיור היפה של האוזן הפנימית. אנו מודים לד"ר תומס ב. פרידמן וד"ר רוברט ג' מורל על סקירת כתב היד באופן ביקורתי.
Materials
| Name | Company | Catalog Number | Comments |
| EDTA 0.5 M | Crystalgen | 221-057 | |
| 1 mL TUBERCULIN syringe with 27G x 13mm | BD | 309623 | |
| 9-well spot glass plate | Pyrex | 13-748B | |
| Alexa Fluor 555-conjugated phalloidin | ThermoFisher Scientific | A34055 | |
| Artery Scissors - Ball Tip | Fine Science Tools | 14080-11 | |
| Bovine serum albumin | Sigma Aldrich | A3059 | |
| Camera to capture images in incident light | Leica | DFC 495 | |
| Camera to capture fluorescent images | Leica | DFC 7000 GT | |
| Centrifuge tubes 15 mL | Corning | 430053 | |
| Centrifuge tubes 50 mL | Corning | 430829 | |
| Collagenase/Dispase | Roche | 10269638001 | |
| Confocal microscope | Zeiss | LSM 880 | |
| Cover Glass | Corning | 2940-223 | |
| Dumont #4 Forceps | Fine Science Tools | 11241-30 | |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Alternative: Extra Fine Micro Dissecting Scissors; Straight; Sharp Points; 20mm Blade Length; 3 1/2" Overall Length | Roboz | RS-5880 | |
| Goat anti-rabbit Alexa Fluor 488-conjugated secondary antibody | ThermoFisher Scientific | A11034 | |
| MicroSlides Superfrost | VWR | 48311-702 | |
| Orbital shaker, for example Mini Shaker | Daigger | 980275 | |
| Paraformaldehyde (PFA) 16% Aqueous Solution | Electron Microscopy Sciences | 15710 | |
| Phosphate-Buffered Saline (10X) pH 7.4 | ThermoFisher Scientific | AM9624 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36931 | |
| Rabbit anti-Pendrin antibodies | In-house | RRID:AB_2713943, PB826 (Choi et al., 2011) | |
| Ring Forceps | Fine Science Tools | 11106-09 | |
| Rocking shaker, for example GyroMini | Labnet | S0500 | |
| Stereomicroscope equipped with a PlanApo 1.0x objective | Leica | ||
| Stainless Steel Single Edge Blades, .009" | GEM Personna | 62-0176 | |
| Tissue culture dish 60 mm | Falcon | 353002 | |
| Transparent nail polish | |||
| Triton X-100 | ACROS Organics | 32737-1000 |
References
- Dror, A. A., Brownstein, Z., Avraham, K. B. Integration of human and mouse genetics reveals pendrin function in hearing and deafness. Cellular Physiology and Biochemistry. 28 (3), 535-544 (2011).
- Reardon, W., CF, O. M., Trembath, R., Jan, H., Phelps, P. D. Enlarged vestibular aqueduct: a radiological marker of pendred syndrome, and mutation of the PDS gene. QJM. 93 (2), 99-104 (2000).
- Griffith, A. J., Wangemann, P. Hearing loss associated with enlargement of the vestibular aqueduct: mechanistic insights from clinical phenotypes, genotypes, and mouse models. Hearing Research. 281 (1-2), 11-17 (2011).
- Gurkov, R., Pyyko, I., Zou, J., Kentala, E. What is Meniere's disease? A contemporary re-evaluation of endolymphatic hydrops. Journal of Neurology. 263, 71-81 (2016).
- Eckhard, A., et al. Water channel proteins in the inner ear and their link to hearing impairment and deafness. Molecular Aspects of Medicine. 33 (5-6), 612-637 (2012).
- Choi, B. Y., et al. Mouse model of enlarged vestibular aqueducts defines temporal requirement of Slc26a4 expression for hearing acquisition. Journal of Clinical Investigation. 121 (11), 4516-4525 (2011).
- Miyashita, T., et al. Presence of FXYD6 in the endolymphatic sac epithelia. Neuroscience Letters. 513 (1), 47-50 (2012).
- Royaux, I. E., et al. Localization and functional studies of pendrin in the mouse inner ear provide insight about the etiology of deafness in pendred syndrome. Journal of the Association for Research in Otolaryngology. 4 (3), 394-404 (2003).
- Kim, H. M., Wangemann, P. Epithelial cell stretching and luminal acidification lead to a retarded development of stria vascularis and deafness in mice lacking pendrin. PLoS One. 6 (3), 17949 (2011).
- Dahlmann, A., von During, M. The endolymphatic duct and sac of the rat: a histological, ultrastructural, and immunocytochemical investigation. Cell and Tissue Research. 282 (2), 277-289 (1995).
- Everett, L. A., et al. Targeted disruption of mouse Pds provides insight about the inner-ear defects encountered in Pendred syndrome. Human Molecular Genetics. 10 (2), 153-161 (2001).
- Miller, R. L., et al. The V-ATPase B1-subunit promoter drives expression of Cre recombinase in intercalated cells of the kidney. Kidney International. 75 (4), 435-439 (2009).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Wang, L., Jiang, H., Brigande, J. V. Gene transfer to the developing mouse inner ear by in vivo electroporation. Journal of Visualized Experiments. (64), e3643 (2012).
- Currle, D. S., Hu, J. S., Kolski-Andreaco, A., Monuki, E. S. Culture of mouse neural stem cell precursors. Journal of Visualized Experiments. (2), 152 (2007).
- Honda, K., et al. Molecular architecture underlying fluid absorption by the developing inner ear. Elife. 6, (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved