Method Article
Dissezione del sacco endolinfatico da topi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio descrive come sezionare il sacco endolinfatico dall'orecchio interno del topo a diverse età. Il risultato di una dissezione simile è mostrato in un modello murino nullo di Slc26a4-null di allargamento del sacco endolinfatico. Un topo transgenico con un reporter fluorescente espresso nel sacco endolinfatico viene presentato come modello per visualizzare prontamente il sacco endolinfatico e strumento educativo.
Abstract
Lo studio di modelli murini mutanti di disturbi dell'udito e dell'equilibrio umano ha rivelato molti cambiamenti strutturali e funzionali che possono contribuire ai fenotipi umani. Sebbene siano stati compiuti importanti progressi nella comprensione dello sviluppo e della funzione degli epiteli neurosensoriali della coclea e del vestibolo, le conoscenze disponibili sono limitate per quanto riguarda lo sviluppo, la composizione cellulare, le vie molecolari e le caratteristiche funzionali del sacco endolinfatico. Ciò è, in gran parte, dovuto alla difficoltà di visualizzare e microdissezionare questo tessuto, che è un epitelio composto da un solo strato cellulare. Lo studio qui presentato descrive un approccio per accedere e microdissezionare il sacco endolinfatico dall'orecchio interno del topo wild-type a diverse età. Il risultato di una dissezione simile è mostrato in un modello murino con deficit di pendorina dell'allargamento dell'acquedotto vestibolare. Viene presentato un topo transgenico con un sacco endolinfatico fluorescente. Questo topo reporter può essere utilizzato per visualizzare facilmente il sacco endolinfatico con dissezione limitata e determinarne le dimensioni. Può anche essere utilizzato come strumento educativo per insegnare come sezionare il sacco endolinfatico. Queste procedure di dissezione dovrebbero facilitare un'ulteriore caratterizzazione di questa parte poco studiata dell'orecchio interno.
Introduzione
L'orecchio interno dei mammiferi è costituito dalla coclea, dal sacculo, dall'utricolo, da tre canali semicircolari e dal sacco endolinfatico (Figura 1A). Questi organi comprendono un epitelio continuo, pieno di liquido, chiamato labirinto membranoso, con organi adiacenti che si collegano direttamente o attraverso piccole strutture canalizzate come il dotto reuniens, il dotto sacculare, il dotto utricolare o il dotto endolinfatico. Rispetto ad altri organi dell'orecchio interno, il sacco endolinfatico ha caratteristiche uniche. In primo luogo, manca di cellule epiteliali sensoriali. Invece, il sacco endolinfatico ha cellule specializzate per il trasporto di ioni. In secondo luogo, sebbene il labirinto membranoso sia racchiuso nel labirinto osseo, il sacco endolinfatico è un'eccezione, sporgendo parzialmente dall'osso petroso e nella cavità intracranica. Questa morfologia sembra essere altamente conservata durante l'evoluzione dell'orecchio interno. In terzo luogo, il sacco endolinfatico è la prima struttura a svilupparsi dall'otocisti in uno stadio embrionale precoce prima della formazione di altri organi. Inoltre, diverse patologie sono state associate a un sacco endolinfatico ingrossato o a un compartimento endolinfatico anomalo. La presenza di varianti patogene nell'SLC26A4 (noto anche come gene della pendrina) porta a una forma relativamente comune di sordità neurosensoriale, causata dall'ingrossamento del sacco endolinfatico associato alla presenza di un acquedotto vestibolare allargato (EVA)1. Quando è associata al gozzo, viene definita sindrome di Pendred 2,3. Alcuni ritengono inoltre che la malattia di Ménière sia associata ad anomalie del compartimento endolinfatico (idrope)4. Le caratteristiche uniche del sacco endolinfatico e le patologie associate a un cambiamento della sua morfologia sono coerenti con un ruolo critico per lo sviluppo e il mantenimento dell'orecchio interno.
Nonostante la sua importanza, le conoscenze sono ancora limitate per quanto riguarda lo sviluppo, la composizione cellulare, le vie molecolari e le caratteristiche funzionali del sacco endolinfatico. Ciò è almeno in parte dovuto alla difficoltà di visualizzare e microdissezionare questo tessuto. Il sacco endolinfatico è una struttura a forma di sacca, composta da un singolo strato di cellule epiteliali, spesso traslucida e molto difficile da identificare al di fuori del tessuto congiuntivo che la circonda mediante stereomicroscopia ottica. Sebbene un piccolo numero di ricercatori abbia sviluppato tecniche di dissezione a montatura intera e pubblicato i risultati sperimentali 5,6,7,8,9,10, non esiste una pubblicazione incentrata sui dettagli tecnici di questa procedura.
In questo studio, vengono descritti gli approcci di microdissezione sviluppati per accedere e isolare il sacco endolinfatico dall'orecchio interno del topo wild-type a diverse età, in montatura intera. I risultati di una dissezione simile sono mostrati in un modello murino, privo di espressione di SLC26A4, che presenta un ingrossamento del dotto endolinfatico e del sacco. È stata riportata una linea murina con un transgene che codifica per una Cre ricombinasi espressa nel sacco endolinfatico. In presenza di un reporter fluorescente di espressione Cre, qui tdTomato, la fluorescenza può essere utilizzata per visualizzare prontamente il sacco endolinfatico con dissezione limitata e per ottenere informazioni sulle sue dimensioni. Questa linea di topi reporter può essere utilizzata anche come strumento educativo per esercitarsi e perfezionare le dissezioni del sacco endolinfatico. La capacità di sezionare il tessuto del sacco endolinfatico dovrebbe facilitare un'ulteriore caratterizzazione di questo componente poco studiato ma essenziale dell'orecchio interno.
Protocollo
Tutti gli esperimenti e le procedure sugli animali sono stati eseguiti secondo i protocolli approvati dai comitati per la cura e l'uso degli animali dell'Istituto nazionale per le malattie neurologiche e l'ictus/Istituto nazionale per la sordità e altri disturbi della comunicazione (#1264) e dal Comitato istituzionale per la cura e l'uso degli animali presso l'Università medica e odontoiatrica di Tokyo (A2020-058A).
NOTA: topi C57BL/6J (codice n. 000664), Pds-/-noto anche come Slc26a4-/- topi (129S-Slc26a4 tm1Egr/AjgJ, n. 018424) 11, B6; I topi CBA-Tg(ATP6V1B1-Cre)1Rnel/Mm 12 e i topi Ai9(LSL-RCL-tdT) (B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze, n. 007909)13 sono disponibili presso il Jackson Laboratory e su richiesta. Tutte le procedure di genotipizzazione sono state precedentemente descritte. B6; Topi CBA-Tg(ATP6V1B1-Cre)1Rnel/Mm precedentemente reincrociati con il ceppo C57BL/6J per almeno cinque generazioni, sono stati allevati per esperimenti. Gli animali di entrambi i sessi possono essere studiati con questo approccio senza una differenza evidente. Il primo giorno dopo l'accoppiamento notturno viene conteggiato come giorno embrionale 0,5 (E0,5).
1. Raccolta e fissazione dell'orecchio interno intatto nel cranio
- Eutanasia di animali da esperimento o madri in gravidanza utilizzando una procedura approvata istituzionalmente, ad esempio utilizzando l'inalazione di CO2 . Lavorare sotto una cappa aspirante, se possibile, per evitare o ridurre al minimo la diffusione degli allergeni del topo. Dopo aver verificato la mancata risposta a stimoli dolorosi come pizzicamenti della zampa o della coda, decapitare l'animale. Per una madre incinta nel tempo, la lussazione cervicale può essere utilizzata come alternativa alla decapitazione se le sue orecchie interne non vengono utilizzate per ulteriori esperimenti.
- Raccogli gli embrioni mediante laparotomia14 usando le forbici per arterie con una punta a sfera per proteggere gli embrioni durante il processo. Manipolare gli embrioni utilizzando una pinza ad anello. Posizionare le corna uterine a 4 °C PBS su ghiaccio e isolare ogni embrione come precedentemente descritto15 prima di decapitarli.
- Dividere in due la testa da dietro in avanti: incidere prima la parte superiore della testa incidendo prima la pelle, poi la parte superiore del cranio, incidendone circa un terzo ad ogni taglio in modo che non ci sia flessione del cranio. Quindi taglia subito la parte inferiore del cranio.
NOTA: Per gli embrioni, si consiglia l'uso di una lama affilata, piuttosto che di forbici. È fondamentale che, a tutte le età, il cranio non si deformi durante la divisione in due. - Senza toccare o piegare il cranio, rimuovere con cautela l'emi-encefalo per rivelare il labirinto osseo (Figura 1B, Figura supplementare 1A-B).
- Per i topi dopo la nascita dal 5° giorno o più, sezionare il canale uditivo esterno e tirare la pelle in avanti verso il naso. Taglia il teschio intorno all'orecchio interno (Figura supplementare 1C).
- Trasferire i due emicrani di ciascun animale con l'orecchio interno, il più intatto possibile, in una fiala o provetta di vetro contenente 10 ml di paraformaldeide (PFA) al 4 °C al 4% diluita in 1x PBS e conservare in ghiaccio sotto una cappa aspirante.
NOTA: Non tentare di rimuovere l'orecchio interno dal cranio in questa fase in quanto ciò potrebbe danneggiare il dotto endolinfatico e il sacco mentre lo si fa. - Incubare per 1 ora a 4 °C su uno shaker a dondolo. Se si lavora con il tessuto di un animale con un reporter fluorescente, mantenere la provetta contenente il campione in un foglio di alluminio o in una scatola per ridurre al minimo l'esposizione alla luce.
NOTA: Se interessati allo studio dei microtubuli e delle molecole associate, la fissazione tissutale deve essere eseguita a temperatura ambiente (RT) con fissativo RT. - Gettare il PFA in un contenitore appropriato in una cappa aspirante. Lavare tre volte con 10 mL di 1x PBS per 15 minuti ogni volta su uno shaker a dondolo a RT per eliminare il fissativo prima della dissezione.
2. Microdissezione del sacco endolinfatico
- Trasferire ogni preparato per l'orecchio interno in una piastra per coltura tissutale da 35 mm contenente 1x PBS.
- Mettere il preparato nel piatto in modo che la radice dell'8° nervo cranico sia orientata verso l'alto. Tenere il tessuto in questa posizione afferrando la coclea con una pinza #4 (Figura 1C).
- Identificare i punti di riferimento importanti: l'acquedotto vestibolare, i canali semicircolari anteriori e posteriori, la crus comune e il seno sigmoideo (vena) (Figura 1D).
NOTA: Il sacco endolinfatico nel topo wild type è traslucido e difficile da visualizzare. Per una microdissezione di successo del sacco endolinfatico, è importante comprenderne l'anatomia e la localizzazione (Figura 1E). - Incidere la dura madre e l'acquedotto vestibolare, nonché i tessuti connettivi sottostanti che circondano il sacco endolinfatico, utilizzando un ago da 27 G su una siringa da 1 ml (Figura 1D, F).
NOTA: Per un topo adulto, la decalcificazione del preparato utilizzando EDTA al 10% (pH 7,4) prima della microdissezione è utile, ma non essenziale, per facilitare l'incisione dell'acquedotto vestibolare. Per la dissezione del sacco endolinfatico aperto più vecchio del 5° giorno postnatale, si consiglia di posizionare la linea di incisione sull'acquedotto vestibolare leggermente anteriormente per praticare un'incisione nel lume del sacco endolinfatico (Figura 2A). - Tenere il tessuto connettivo situato lateralmente al sacco endolinfatico con una pinza e sollevare il tessuto per staccarlo dall'osso temporale (Figura 1G).
- Rimuovere con cura eventuali detriti rimanenti. La preparazione di solito include l'epitelio del sacco endolinfatico, i tessuti connettivi circostanti, una porzione dell'acquedotto vestibolare e il seno sigmoideo (Figura 1H-I). Se necessario, separare l'epitelio del sacco endolinfatico dai tessuti circostanti (Figura 1J).
- (Facoltativo) Per la dissezione del sacco endolinfatico aperto, tenere la parte dello stelo del preparato in modo che la sezione trasversale del lume possa essere osservata. Inserire un ago da 27 G nel lume e spostarlo per tagliare il sacco endolinfatico in due fogli (Figura 2B-C). Tenere il bordo di ciascun tessuto simile a un foglio con una pinza e separarli l'uno dall'altro (Figura 2D-F).
3. Immunoistochimica
- Dopo la microdissezione, utilizzare una pinza #5 per trasferire le sacche endolinfatiche in una piastra di vetro spot a 9 pozzetti.
- Utilizzando il microscopio per assicurarsi che le sacche endolinfatiche rimangano intatte, utilizzare una pipetta da 200 μl per rimuovere tutto il PBS 1x tranne una goccia contenente il tessuto. Aggiungere 200 μL di soluzione permeabilizzante e bloccante (1x PBS con 0,15% di Triton X-100 (PBS-TX) e 5% di albumina sierica bovina (BSA)) e incubare per 1 ora a RT su un agitatore orbitale.
- Dopo aver rimosso tutta la soluzione bloccante tranne una goccia contenente il tessuto, aggiungere 200 μl di anticorpi primari e incubare per una notte a 4 °C. Gli anticorpi anti-pendrin6 diluiti 1:1000 in soluzione bloccante possono essere utilizzati per identificare le cellule ricche di mitocondri del sacco endolinfatico, sebbene si osservi anche una debole espressione in un sottogruppo di cellule ricche di ribosomi16 (Figura 5).
- Dopo tre lavaggi in 1x PBS per 15 minuti a RT, incubare con anticorpi secondari. Per la marcatura qui presentata, incubare 200 μL di anticorpi secondari coniugati con colorante fluorescente, diluiti dallo stock commerciale a 1:500 in soluzione bloccante, con il tessuto su una piattaforma oscillante per 1 ora a RT al buio. La falloidina coniugata con colorante fluorescente, che riconosce la β-actina (ACTB), può essere utilizzata per evidenziare la presenza del sacco endolinfatico e del dotto, nonché del tessuto congiuntivo che li circonda (Figura 5A, C, F-G).
- Montare le sacche endolinfatiche tra un vetrino e un vetrino coprioggetti utilizzando un mezzo di montaggio antisbiadimento con DAPI. Dopo aver lasciato asciugare i vetrini al riparo dalla luce per 1 ora a RT, applicare lo smalto trasparente all'incrocio tra vetrino e vetrino per sigillarli e limitare la formazione di bolle d'aria. Se si cerca di visualizzare la distribuzione differenziale delle proteine sulla superficie apicale rispetto a quella basolaterale delle cellule epiteliali, si consiglia di aprire la sacca durante la fase di montaggio incidendo un bordo e aprendolo.
- Immagine con un microscopio confocale. Per prima cosa, visualizza le preparazioni del sacco endolinfatico con un obiettivo 10x per fornire una visione globale dell'etichettatura del sacco (Figura 5A-D). Quindi utilizzare un obiettivo 63x per ottenere una visione dettagliata della distribuzione della proteina di interesse nelle cellule ricche di mitocondri e ribosomi del sacco endolinfatico (Figura 5F-G).
Risultati
Ogni fase di questa microdissezione di un sacco endolinfatico wild type da un topo postnatale del giorno 5 (P5) è dettagliata nel video associato e le istantanee delle fasi chiave di questa dissezione e dell'apertura del sacco endolinfatico sono presentate nella Figura 1 e nella Figura 2.
I risultati rappresentativi delle dissezioni del sacco endolinfatico con fluorescenza di tdTomato al giorno embrionale 16.5 (E16.5), P5 e P30, seguendo questo protocollo, sono presentati nella Figura 3 e nella Figura 1 e nella Figura 2 supplementare. Utilizzando un microscopio da dissezione con fluorescenza, il sacco endolinfatico può essere facilmente visualizzato nel cranio dopo la rimozione del cervello nei topi portatori del transgene Tg(ATP6V1B1-Cre) in presenza del reporter dell'espressione di Cre: Ai9 (LSL-RCL-tdT) (vedi Figura 3A-B e Figura supplementare 1 per le immagini catturate in luce incidente e fluorescenza tdTomato del sacco endolinfatico in diverse fasi della dissezione). In questi topi, Cre è espresso come un mosaico nelle cellule lungo tutto il sacco endolinfatico e il dotto (Figura 3, vedere anche la Figura 2 supplementare per la visualizzazione del sacco endolinfatico con rispetto a senza reporter fluorescente). Sebbene l'espressione di questo reporter non sia specifica per l'espressione endogena di Atp6v1b1, che è limitata alle cellule ricche di mitocondri del sacco endolinfatico16, uno dei due tipi cellulari di questo epitelio (Figura 5E), è un aiuto utile per identificare e sezionare il sacco endolinfatico.
Le orecchie interne sezionate da un modello murino per l'allargamento dell'acquedotto vestibolare sono presentate nella Figura 4. Rispetto ai compagni di cucciolata di controllo, le sacche endolinfatiche e i dotti dei topi carenti di SLC26A4 (pendrin) sono ingranditi.
Le immagini rappresentative dell'immunoistochimica del sacco endolinfatico intatto con e senza tessuto congiuntivo sono mostrate nella Figura 5. Vengono presentati anche i risultati dell'immunoistochimica del sacco endolinfatico aperto di un topo wild type P5 (Figura 5F-G). Il sacco endolinfatico è composto da un singolo strato di epitelio piegato in una struttura a forma di sacca, contenente nel suo lume endolinfa. Questo epitelio è costituito da due tipi di cellule, cellule ricche di mitocondri e cellule ricche di ribosomi (Figura 5E). Un sacco endolinfatico a montaggio intero sarà appiattito perché l'endolinfa non è più presente. Il sacco apparirà come due strati intrecciati di epitelio, rendendo difficile determinare la localizzazione subcellulare delle proteine espresse in questo epitelio. Aprendo il sacco endolinfatico, l'epitelio a singolo strato può essere facilmente visualizzato e la distribuzione relativa delle proteine di interesse, rispetto al lume del sacco endolinfatico, può essere determinata in modo più definitivo. Un potenziale arricchimento apicale (luminale, dove si troverebbe l'endolinfa) rispetto a quello basale di queste proteine può essere determinato in modo più accurato. Ad esempio, SLC26A4 è arricchito sul lato apicale delle cellule ricche di mitocondri (Figura 5F).
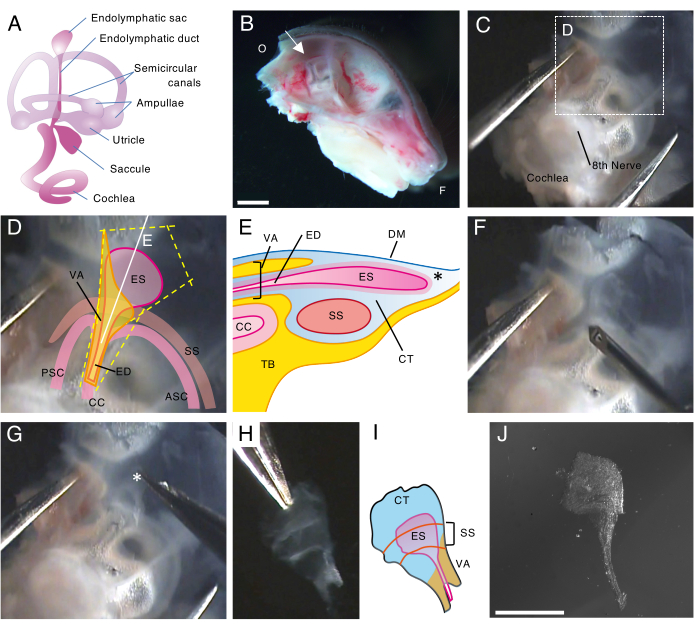
Figura 1. Dissezione a montaggio intero del sacco endolinfatico di un topo wild type al 5° giorno postnatale (P5).
(A) Schema del labirinto membranoso di un orecchio interno di topo sviluppato (a destra). Sono indicate la posizione del sacco endolinfatico e la coclea e le strutture vestibolari. Questa cifra è stata modificata da Honda et al.16.
(B) Sezione medio-sagittale che mostra l'emicranio sinistro. La posizione del sacco endolinfatico è indicata (freccia). (O, occipitale; F, frontale)
(C) Capsula otica insieme alla parte squamosa dell'osso temporale.
(D) Punti di riferimento importanti sovrapposti al riquadro tratteggiato nel pannello C. (ES, sacco endolinfatico; ED, dotto endolinfatico; VA, acquedotto vestibolare; ASC, canale semicircolare anteriore; PSC, canale semicircolare posteriore; CC, cru comuni; SS, seno sigmoideo)
(E) Illustrazione schematica della sezione trasversale insieme alla linea bianca continua sul pannello D attraverso il sacco endolinfatico. Il lato prossimale del sacco endolinfatico è coperto da un canale osseo chiamato acquedotto vestibolare, insieme al dotto endolinfatico. Nella parte distale, il sacco endolinfatico, circondato da tessuto congiuntivo (CT), si estende e sporge verso l'esterno del labirinto osseo ed è inserito tra la dura madre (DM) e il seno sigmoideo con la parte squamosa dell'osso temporale (TB).
(F) Un ago sottile viene utilizzato per tagliare intorno al sacco endolinfatico (seguendo le linee gialle tratteggiate sul pannello D).
(G) Il preparato viene accuratamente rimosso dall'osso temporale tenendo il tessuto nella posizione indicata dall'asterisco (*, mostrato anche nel pannello E) e staccandolo.
(H) Un sacco endolinfatico intero isolato con tessuti circostanti.
(I) Versione schematica di questo sacco endolinfatico isolato con i tessuti circostanti.
(J) Sacco endolinfatico isolato senza tessuti circostanti.
Barre della scala: 2 mm (B), 1 mm (J). Clicca qui per visualizzare una versione più grande di questa figura.
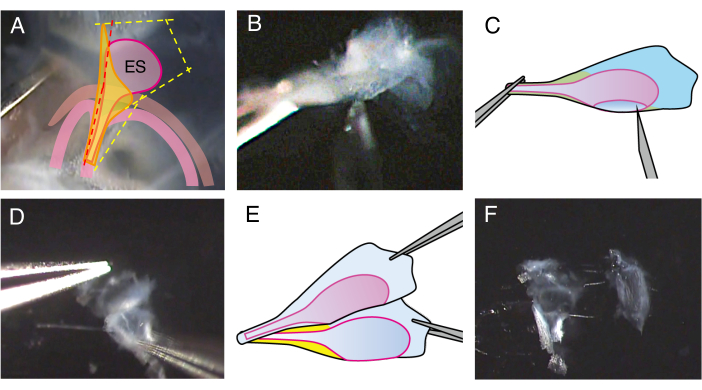
Figura 2. Dissezione del sacco endolinfatico aperto di un topo wild type P5.
(A) Al punto 2.4, la linea di incisione sull'acquedotto vestibolare è posizionata leggermente anteriormente (linea tratteggiata rossa) per praticare un'incisione nel lume del sacco endolinfatico.
(B) Tenere la parte del gambo del preparato, inserire un ago calibro 27 nel lume e spostarlo per tagliare il sacco endolinfatico in due fogli.
(C) Illustrazione schematica del pannello B.
(D) Tenere il bordo di ogni foglio con una pinza e separarli l'uno dall'altro.
(E) Illustrazione schematica del pannello D.
(F) Il sacco endolinfatico è separato in due fogli, compreso l'epitelio e i tessuti circostanti. Clicca qui per visualizzare una versione più grande di questa figura.
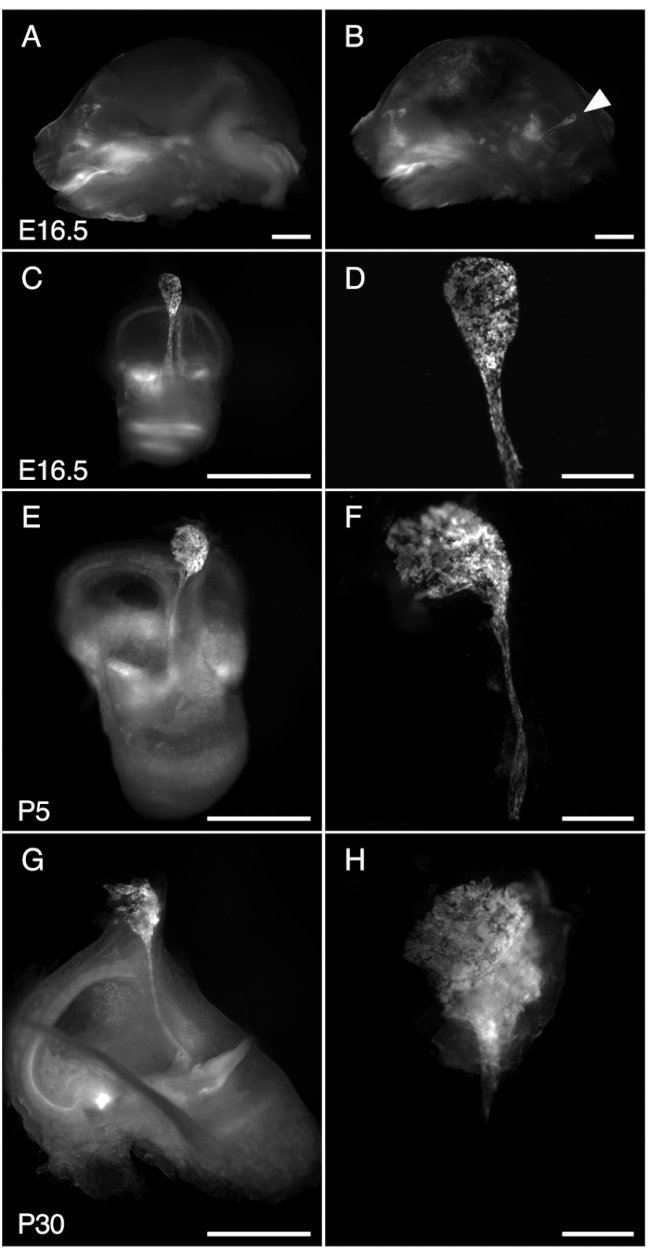
Figura 3. Dissezione di R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/sacco endolinfatico di topo Mn a E16.5, P5 e P30. Tutte le immagini presentate mostrano la fluorescenza di tdTomato ottenuta utilizzando uno stereomicroscopio con un obiettivo 1 x equipaggiato per la rilevazione della fluorescenza di tdTomato.
(A, B) Sezione sagittale media del cranio di un E16.5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn prima (A) e dopo (B) rimozione del semicervello. tdLa fluorescenza del pomodoro delinea la posizione dell'orecchio interno. Il sacco endolinfatico è facilmente visibile anche senza dissezione (punta di freccia).
(C, E, G) Orecchie interne isolate da topi E16.5, P5 e P30, rispettivamente.
(D, F e H) Immagini con ingrandimento più elevato delle sacche e dei dotti endolinfatici microdissezionati corrispondenti. A P30, il dotto endolinfatico è incapsulato nell'osso, rendendolo particolarmente difficile da isolare. Barre della scala: 2 mm (A, B, C, E, G), 500 μm (D, F, H). Clicca qui per visualizzare una versione più grande di questa figura.
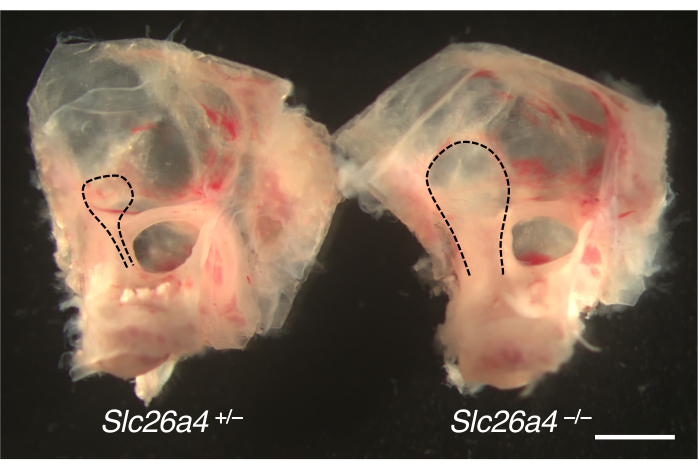
Figura 4. Anatomia macroscopica della capsula otica con un sacco endolinfatico allargato. Orecchie interne di Slc26a4+/- (a sinistra) e Slc26a4-/- (a destra) di cucciolate di topo a P105. L'acquedotto vestibolare e il sacco e il dotto endolinfatico (linee tratteggiate nere) sono ingranditi nel topo Slc26a4-/- rispetto a quelli di un topo Slc26a4+/- . Barra della scala: 2 mm. Clicca qui per visualizzare una versione più grande di questa figura.
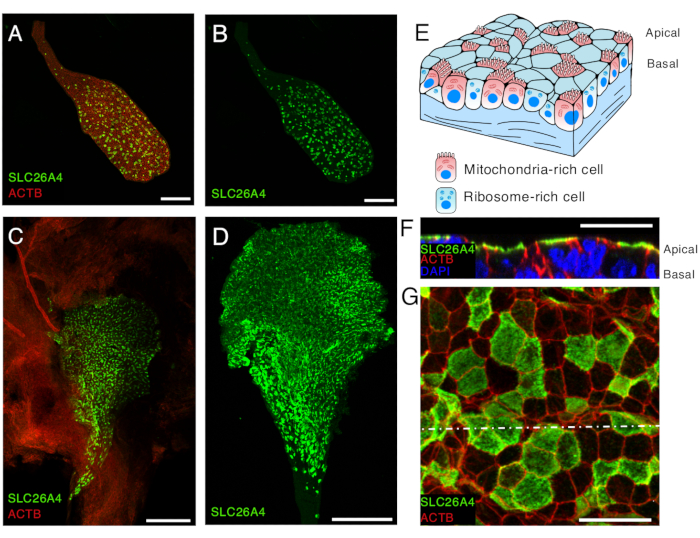
Figura 5. SLC26A4 espressione di cellule ricche di mitocondri nell'epitelio del sacco endolinfatico a E16.5 e P5.
(A, B) Sacco endolinfatico isolato da topo E16.5 marcato con anticorpo anti-SLC26A4 (verde) e falloidina che marcano β-actina (ACTB, rosso).
(C) Un'immagine a basso ingrandimento del sacco endolinfatico aperto da un topo P5 marcato con un anticorpo anti-SLC26A4 (verde). La falloidina (ACTB, rosso) può essere utilizzata per evidenziare la presenza del sacco endolinfatico e del tessuto congiuntivo che lo circonda.
(D) Sacco endolinfatico isolato marcato con un anticorpo anti-SLC26A4 (verde).
(E) Illustrazione schematica dell'epitelio del sacco endolinfatico evidenziando la presenza di due tipi di cellule: le cellule ricche di mitocondri, la cui superficie apicale è ricoperta di microvilli, e le cellule ricche di ribosomi.
(F-G) Immagini ad alto ingrandimento dell'epitelio del sacco endolinfatico a P5, dopo che il sacco endolinfatico è stato aperto e marcato con un anticorpo anti-SLC26A4 (verde) e falloidina (ACTB, rosso). Un'immagine rappresentativa a livello della membrana apicale è mostrata in G, e una sezione trasversale ricostruita da z-stack a livello della linea bianca puntata è mostrata in F. Il nucleo delle cellule è marcato con DAPI (blu).
Barre di scala: 100 μm (A, B); 200 μm (C, D) ; 20 μm (F, G). Clicca qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1. Luce incidente e corrispondenti immagini a fluorescenza tdTomato di un P5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn orecchio interno del topo a tre fasi della dissezione. Il sacco endolinfatico e il dotto possono essere facilmente visualizzati utilizzando la fluorescenza tdTomato.
(A-B) Regione dell'orecchio interno nella parte posteriore di un mezzo cranio intatto di un P5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn mouse.
(C-D) La rimozione della pelle e di parte del cranio consente una migliore visualizzazione della regione del sacco endolinfatico.
(E, F) Orecchio interno isolato con il sacco endolinfatico ancora associato al tessuto congiuntivo.
(A, C, E) Immagini catturate in luce incidente. (B, D, F) tdFluorescenza del pomodoro del tessuto corrispondente. Barre della scala: 2 mm (A-B), 1 mm (C-F). Clicca qui per scaricare questo file.
Figura supplementare 2. Confronto della fluorescenza di sacche endolinfatiche isolate di R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn e R26LSL-RCL-tdT/+ compagni di cucciolata a E16.5 e P5. tdLa fluorescenza del pomodoro facilita notevolmente il riconoscimento del sacco endolinfatico e del dotto.
(A-C) Sacche endolinfatiche microdissezionate di E16.5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn (A) e R26LSL-RCL-tdT/+ topi compagni di cucciolata (B, C).
(D-F) Sacche endolinfatiche microdissezionate di P5 R26LSL-RCL-tdT/+; Tg(ATP6V1B1-Cre)1Rnel/Mn (D) e R26LSL-RCL-tdT/+ topi compagni di cucciolata (E, F).
(A, B, D, E) tdFluorescenza del pomodoro. (C, F) Immagini a luce incidente corrispondenti a B ed E. Barre di scala: 500 μm. Clicca qui per scaricare questo file.
Discussione
Molti ricercatori hanno utilizzato sezioni incorporate in paraffina o congelate per studi morfologici del sacco endolinfatico. Lo svantaggio delle preparazioni sezionate è che può essere difficile osservare completamente i complicati contatti cellula-cellula perché la dimensione e la forma di ciascuna cellula epiteliale nel sacco endolinfatico è estremamente variabile, formando uno strato cellulare rugoso e pseudostratificato. L'immunocolorazione a montaggio intero e l'imaging z-stack, descritti in questo protocollo, consentono una migliore visualizzazione della struttura tridimensionale del sacco endolinfatico.
Per una microdissezione di successo, il punto critico è visualizzare mentalmente l'intero contorno del sacco endolinfatico, anche se è invisibile nel topo wild type. L'osservazione del reporter fluorescente, mostrato nella Figura 3 e nella Figura supplementare 1-2, può essere utile per riconoscere la localizzazione e le dimensioni del sacco endolinfatico nei topi.
Mentre questo metodo di dissezione a montaggio intero è stato utilizzato per l'immunocolorazione nel protocollo di cui sopra, questa tecnica può essere utilizzata anche per raccogliere il tessuto del sacco endolinfatico per l'analisi dell'espressione genica, come RT-qPCR, espressione di microarray e persino RNA-seq a singola cellula. I risultati dell'analisi dell'RNA-seq a singola cellula utilizzando tessuti preparati con questo protocollo sono stati precedentemente riportati16. Per l'analisi dell'espressione genica delle cellule epiteliali del sacco endolinfatico, è preferibile raccogliere l'epitelio isolato in modo che non vi sia contaminazione con altri tessuti adiacenti. Sebbene il sacco endolinfatico embrionale possa essere separato dai tessuti connettivi adiacenti, è molto più difficile farlo in età avanzata. Per i campioni di topi anziani, l'incubazione con collagenasi/dispasi per 5 minuti a 37 °C è incoraggiata e facilita l'isolamento dell'epitelio del sacco endolinfatico.
Uno degli svantaggi dell'immunocolorazione a montatura intera descritta in questo protocollo è che la struttura tridimensionale originale può essere influenzata da traumi durante la dissezione o il montaggio della preparazione tra vetrino e vetrino. È necessario prestare attenzione per evitare artefatti dovuti a manipolazioni.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata supportata in parte dal Programma di Ricerca Intramurale del NIH, NIDCD (NIH Intramural Research Funds Z01-DC000060 e ZIC DC000081 to the Advanced Imaging Core). Siamo grati ai dottori Raoul D. Nelson e R. Lance Miller (Università dello Utah, Salt Lake City, UT) e alla dottoressa Susan Wall (Emory University School of Medicine, Atlanta, GA) per aver condiviso i topi Tg(ATP6V1B1-Cre) e al personale della struttura per animali NIDCD per essersi preso cura dei nostri animali. Esprimiamo la nostra gratitudine al Dr. Philine Wangeman per la bellissima illustrazione dell'orecchio interno. Ringraziamo i dottori Thomas B. Friedman e Robert J. Morell per aver esaminato criticamente questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| EDTA 0.5 M | Crystalgen | 221-057 | |
| 1 mL TUBERCULIN syringe with 27G x 13mm | BD | 309623 | |
| 9-well spot glass plate | Pyrex | 13-748B | |
| Alexa Fluor 555-conjugated phalloidin | ThermoFisher Scientific | A34055 | |
| Artery Scissors - Ball Tip | Fine Science Tools | 14080-11 | |
| Bovine serum albumin | Sigma Aldrich | A3059 | |
| Camera to capture images in incident light | Leica | DFC 495 | |
| Camera to capture fluorescent images | Leica | DFC 7000 GT | |
| Centrifuge tubes 15 mL | Corning | 430053 | |
| Centrifuge tubes 50 mL | Corning | 430829 | |
| Collagenase/Dispase | Roche | 10269638001 | |
| Confocal microscope | Zeiss | LSM 880 | |
| Cover Glass | Corning | 2940-223 | |
| Dumont #4 Forceps | Fine Science Tools | 11241-30 | |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Alternative: Extra Fine Micro Dissecting Scissors; Straight; Sharp Points; 20mm Blade Length; 3 1/2" Overall Length | Roboz | RS-5880 | |
| Goat anti-rabbit Alexa Fluor 488-conjugated secondary antibody | ThermoFisher Scientific | A11034 | |
| MicroSlides Superfrost | VWR | 48311-702 | |
| Orbital shaker, for example Mini Shaker | Daigger | 980275 | |
| Paraformaldehyde (PFA) 16% Aqueous Solution | Electron Microscopy Sciences | 15710 | |
| Phosphate-Buffered Saline (10X) pH 7.4 | ThermoFisher Scientific | AM9624 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36931 | |
| Rabbit anti-Pendrin antibodies | In-house | RRID:AB_2713943, PB826 (Choi et al., 2011) | |
| Ring Forceps | Fine Science Tools | 11106-09 | |
| Rocking shaker, for example GyroMini | Labnet | S0500 | |
| Stereomicroscope equipped with a PlanApo 1.0x objective | Leica | ||
| Stainless Steel Single Edge Blades, .009" | GEM Personna | 62-0176 | |
| Tissue culture dish 60 mm | Falcon | 353002 | |
| Transparent nail polish | |||
| Triton X-100 | ACROS Organics | 32737-1000 |
Riferimenti
- Dror, A. A., Brownstein, Z., Avraham, K. B. Integration of human and mouse genetics reveals pendrin function in hearing and deafness. Cellular Physiology and Biochemistry. 28 (3), 535-544 (2011).
- Reardon, W., CF, O. M., Trembath, R., Jan, H., Phelps, P. D. Enlarged vestibular aqueduct: a radiological marker of pendred syndrome, and mutation of the PDS gene. QJM. 93 (2), 99-104 (2000).
- Griffith, A. J., Wangemann, P. Hearing loss associated with enlargement of the vestibular aqueduct: mechanistic insights from clinical phenotypes, genotypes, and mouse models. Hearing Research. 281 (1-2), 11-17 (2011).
- Gurkov, R., Pyyko, I., Zou, J., Kentala, E. What is Meniere's disease? A contemporary re-evaluation of endolymphatic hydrops. Journal of Neurology. 263, 71-81 (2016).
- Eckhard, A., et al. Water channel proteins in the inner ear and their link to hearing impairment and deafness. Molecular Aspects of Medicine. 33 (5-6), 612-637 (2012).
- Choi, B. Y., et al. Mouse model of enlarged vestibular aqueducts defines temporal requirement of Slc26a4 expression for hearing acquisition. Journal of Clinical Investigation. 121 (11), 4516-4525 (2011).
- Miyashita, T., et al. Presence of FXYD6 in the endolymphatic sac epithelia. Neuroscience Letters. 513 (1), 47-50 (2012).
- Royaux, I. E., et al. Localization and functional studies of pendrin in the mouse inner ear provide insight about the etiology of deafness in pendred syndrome. Journal of the Association for Research in Otolaryngology. 4 (3), 394-404 (2003).
- Kim, H. M., Wangemann, P. Epithelial cell stretching and luminal acidification lead to a retarded development of stria vascularis and deafness in mice lacking pendrin. PLoS One. 6 (3), 17949 (2011).
- Dahlmann, A., von During, M. The endolymphatic duct and sac of the rat: a histological, ultrastructural, and immunocytochemical investigation. Cell and Tissue Research. 282 (2), 277-289 (1995).
- Everett, L. A., et al. Targeted disruption of mouse Pds provides insight about the inner-ear defects encountered in Pendred syndrome. Human Molecular Genetics. 10 (2), 153-161 (2001).
- Miller, R. L., et al. The V-ATPase B1-subunit promoter drives expression of Cre recombinase in intercalated cells of the kidney. Kidney International. 75 (4), 435-439 (2009).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Wang, L., Jiang, H., Brigande, J. V. Gene transfer to the developing mouse inner ear by in vivo electroporation. Journal of Visualized Experiments. (64), e3643 (2012).
- Currle, D. S., Hu, J. S., Kolski-Andreaco, A., Monuki, E. S. Culture of mouse neural stem cell precursors. Journal of Visualized Experiments. (2), 152 (2007).
- Honda, K., et al. Molecular architecture underlying fluid absorption by the developing inner ear. Elife. 6, (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon