Method Article
小鼠内淋巴囊解剖
* 这些作者具有相同的贡献
摘要
本研究描述了如何从不同年龄的小鼠内耳解剖内淋巴囊。类似解剖的结果显示在内淋巴囊增大的 Slc26a4 缺失小鼠模型中。在内淋巴囊中表达荧光报告基因的转基因小鼠作为模型呈现,以易于可视化内淋巴囊和教育工具。
摘要
对人类听力和平衡障碍的突变小鼠模型的研究揭示了许多可能导致人类表型的结构和功能变化。尽管在了解耳蜗和前庭神经感觉上皮细胞的发育和功能方面取得了重要进展,但关于内淋巴囊的发育、细胞组成、分子途径和功能特征的知识有限。这在很大程度上是由于难以可视化和显微解剖这种组织,它是一个仅由一层细胞组成的上皮细胞。这里介绍的研究描述了一种从不同年龄的野生型小鼠内耳进入和显微解剖内淋巴囊的方法。类似解剖的结果显示在前庭导水管扩大的 Pendrin 缺陷小鼠模型中。提出了一种具有荧光内淋巴囊的转基因小鼠。这种报告小鼠可用于通过有限的解剖轻松可视化内淋巴囊并确定其大小。它也可以用作教授如何解剖内淋巴囊的教育工具。这些解剖程序应该有助于进一步描述内耳这个研究不足的部分的特征。
引言
哺乳动物的内耳由耳蜗、球囊、椭圆囊、三个半规管和内淋巴囊组成(图 1A)。这些器官包括一个连续的、充满液体的上皮,称为膜迷路,相邻器官直接或通过小管结构连接,例如联合管、囊状导管、耳管或内淋巴管。与内耳的其他器官相比,内淋巴囊具有独特的特性。首先,它缺乏感觉上皮细胞。相反,内淋巴囊具有专门用于离子转运的细胞。其次,虽然膜迷路被封闭在骨迷路中,但内淋巴囊是一个例外,它部分突出岩骨并进入颅内腔。这种形态在内耳的进化过程中似乎是高度保守的。第三,内淋巴囊是在其他器官形成之前,在早期胚胎阶段从耳囊发育而来的第一个结构。此外,一些病理与增大的内淋巴囊或异常的内淋巴室有关。SLC26A4 中存在致病性变异(也称为 pendrin 基因)会导致一种相对常见的感音神经性听力损失,这是由与扩大的前庭导水管 (EVA) 相关的内淋巴囊扩大引起的1。当与甲状腺肿相关时,它被称为 Pendred 综合征 2,3。一些人还认为梅尼埃病与内淋巴隔室异常(积液)有关4。内淋巴囊的独特特征和与其形态变化相关的病理学与内耳发育和维持的关键作用一致。
尽管它很重要,但关于内淋巴囊的发育、细胞组成、分子途径和功能特征的知识仍然有限。这至少部分是由于难以可视化和显微解剖这种组织。内淋巴囊是一个袋状结构,由单层上皮细胞组成,上皮细胞通常是半透明的,很难通过光学立体显微镜从围绕它的结膜组织中识别出来。尽管少数研究人员已经开发了整装式解剖技术并发表了他们的实验结果5,6,7,8,9,10,但没有出版物关注该程序的技术细节。
在这项研究中,描述了为从不同年龄的野生型小鼠内耳中整体进入和分离内淋巴囊而开发的显微解剖方法。类似解剖的结果显示在小鼠模型中,缺乏 SLC26A4 的表达,其内淋巴管和囊扩大。报道了具有编码在内淋巴囊中表达的 Cre 重组酶的转基因的小鼠品系。在存在 Cre 表达的荧光报告基因(此处为 tdTomato)的情况下,荧光可用于通过有限的解剖轻松可视化内淋巴囊并获取有关其大小的信息。该报告小鼠系也可用作练习和完善内淋巴囊清扫术的教育工具。解剖内淋巴囊组织的能力应该有助于进一步表征这个未被充分研究但必不可少的内耳成分。
研究方案
所有动物实验和程序均根据国家神经疾病和中风研究所/国家耳聋和其他沟通障碍研究所动物护理和使用委员会 (#1264) 和东京医科齿科大学机构动物护理和使用委员会 (A2020-058A) 批准的协议进行。
注:C57BL/6J小鼠(库存号000664),Pds - / - 也称为Slc26a4 - / - 小鼠(129S-Slc26a4 tm1Egr / AjgJ,编号018424)11,B6;CBA-Tg(ATP6V1B1-Cre)1Rnel/mm 小鼠12 和 Ai9(LSL-RCL-tdT) (B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze,编号 007909)小鼠13 可从杰克逊实验室获得,并可根据要求提供。所有基因分型程序之前都已描述过。B6;培育先前与菌株 C57BL/6J 回交至少五代的 CBA-Tg(ATP6V1B1-Cre)1Rnel/MM 小鼠用于实验。两种性别的动物都可以用这种方法进行研究,没有明显的差异。过夜交配后的第一天算作胚胎第 0.5 天 (E0.5)。
1. 在颅骨中采集和固定完整的内耳
- 使用机构批准的程序对实验动物或怀孕时间的母鼠实施安乐死,例如,使用 CO2 吸入。如果可能,请在通风橱下工作,以避免或尽量减少小鼠过敏原的传播。在验证对爪子或尾巴捏等痛苦刺激没有反应后,将动物斩首。对于怀孕的母犬,如果其内耳不用于进一步的实验,则可以将颈椎脱位用作斩首的替代方法。
- 使用带有球尖的动脉剪刀通过剖腹手术14 收获胚胎,以在此过程中保护胚胎。使用环形镊子操作胚胎。将子宫角置于冰上的4°C PBS中,并如前所述15 分离每个胚胎,然后再将其斩首。
- 从后到前将头部一分为二:首先切开皮肤,然后切开头骨顶部,每次切开大约三分之一的头骨,这样头骨就不会弯曲。然后立即切开头骨的底部。
注意:对于胚胎,建议使用锋利的刀片,而不是剪刀。至关重要的是,在所有年龄段,头骨在一分为二时都不会变形。 - 在不触摸或弯曲颅骨的情况下,小心地去除半脑以露出骨迷路(图 1B,补充图 1A-B)。
- 对于出生后第 5 天或以上的小鼠,横切外耳道并将皮肤向前拉向鼻子。修剪内耳周围的颅骨(补充图 1C)。
- 将每只动物的两个半颅骨和内耳尽可能完整地转移到含有 10 mL 4 °C 4% 多聚甲醛 (PFA) 的玻璃瓶或试管中,用 1x PBS 稀释,并在通风橱下保持冰。
注意:在此步骤中,请勿尝试从颅骨中取出内耳,因为这样做可能会损坏内淋巴管和囊。 - 在 4 °C 下在摇床上孵育 1 小时。如果使用荧光报告基因处理动物组织,请将装有标本的试管保存在铝箔或盒子中,以尽量减少暴露在光线下。
注意:如果对研究微管和相关分子感兴趣,应在室温 (RT) 下使用 RT 固定剂进行组织固定。 - 将 PFA 丢弃在通风橱中的适当容器中。在 RT 的摇床上用 10 mL 的 1x PBS 洗涤 3 次,每次 15 分钟,以在解剖前去除固定剂。
2. 内淋巴囊显微解剖
- 将每个内耳制剂转移到含有 1x PBS 的 35 mm 组织培养皿中。
- 将制剂放入培养皿中,使第 8 对脑神经的根部朝上。用 #4 镊子抓住耳蜗,将组织保持在这个位置(图 1C)。
- 确定重要的标志:前庭导水管、前后半规管、普通股和乙状窦(静脉)(图 1D)。
注意:野生型小鼠的内淋巴囊是半透明的,难以观察。为了成功对内淋巴囊进行显微解剖,了解其解剖结构和定位非常重要(图 1E)。 - 在 1 mL 注射器上使用 27 G 针头切开硬脑膜和前庭导水管,以及内淋巴囊周围的底层结缔组织(图 1D,F)。
注:对于成年小鼠,在显微解剖前使用 10% EDTA (pH 7.4) 对制剂进行脱钙是有用的,但不是必需的,以促进前庭导水管的切口。对于出生后第 5 天以后的开放内淋巴囊的解剖,建议将切口线放置在前庭导水管上略微前方,以切开内淋巴囊腔(图 2A)。 - 用镊子握住位于内淋巴囊外侧的结缔组织,然后拉起组织以将其从颞骨上剥离(图 1G)。
- 小心清除任何残留的碎屑。该制剂通常包括内淋巴囊上皮、周围的结缔组织、前庭导水管的一部分和乙状结肠窦(图 1H-I)。如有必要,将内淋巴囊上皮与周围组织分开(图 1J)。
- (可选)为了解剖打开的内淋巴囊,握住制剂的茎部分,以便可以观察管腔的横截面。将 27 G 针头插入管腔并移动它,将内淋巴囊切成两片(图 2B-C)。用镊子握住每个片状组织的边缘,并将它们彼此分开(图 2D-F)。
3. 免疫组化
- 显微解剖后,使用 #5 镊子将内淋巴囊转移到 9 孔点玻璃板中。
- 使用显微镜确保内淋巴囊保持不变,使用 200 μL 移液器除去所有 1x PBS,除了一滴含有组织。加入 200 μL 透化和封闭溶液(1x PBS 与 0.15% Triton X-100 (PBS-TX) 和 5% 牛血清白蛋白 (BSA)),并在 RT 下在轨道振荡器上孵育 1 小时。
- 除去一滴含有组织外的所有封闭溶液后,加入 200 μL 一抗并在 4 °C 下孵育过夜。 在封闭溶液中以 1:1000 稀释的抗 pendrin 抗体6 可用于鉴定内淋巴囊中富含线粒体的细胞,尽管在富含核糖体的细胞亚群中也观察到微弱的表达16 (图 5)。
- 在 RT 下用 1x PBS 洗涤 3 次 15 分钟后,与二抗孵育。对于此处介绍的标记,将 200 μL 荧光染料偶联的二抗在封闭溶液中以 1:500 从商业原液中稀释,并将组织在摇动平台上在黑暗中在 RT 上孵育 1 小时。识别 β-肌动蛋白 (ACTB) 的荧光染料偶联鬼笔环肽可用于突出内淋巴囊和导管以及它们周围的结膜组织的存在(图 5A、C、FG)。
- 使用含 DAPI 的抗褪色封固剂将内淋巴囊安装在载玻片和盖玻片之间。让载玻片在 RT 下避光干燥 1 小时后,在盖玻片和载玻片之间的连接处涂上透明指甲油以密封它们并限制气泡的形成。如果试图可视化上皮细胞顶端 与 基底外侧表面蛋白质的差异分布,建议在安装步骤中通过切开边缘并打开囊来打开囊。
- 使用共聚焦显微镜成像。首先用 10 倍目标可视化内淋巴囊制备物,以提供囊标记的全局视图(图 5A-D)。然后使用 63 倍物镜获得目标蛋白质在内淋巴囊富含线粒体和核糖体的细胞中分布的详细视图(图 5F-G)。
结果
来自出生后第 5 天 (P5) 小鼠的野生型内淋巴囊显微解剖的每个步骤在相关视频中都有详细介绍,图 1 和图 2 展示了该解剖和打开内淋巴囊的关键步骤的快照。
按照该方案,在胚胎第 16.5 天 (E16.5)、P5 和 P30 用 tdTomato 荧光解剖内淋巴囊的代表性结果如图 3 和补充图 1 和补充图 2 所示。使用荧光解剖显微镜,在携带转基因 Tg(ATP6V1B1-Cre) 的小鼠去除大脑后,在 Cre 表达报告基因存在的情况下可以很容易地在颅骨中观察到内淋巴囊:Ai9 (LSL-RCL-tdT)(参见图 3A-B 和补充图 1,用于在解剖不同阶段的入射光和 tdTomato 荧光中捕获的图像内淋巴囊)。在这些小鼠中,Cre 在沿内淋巴囊和导管的整个细胞中表达为马赛克(图 3,另见补充图 2,用于有与无荧光报告基因的内淋巴囊的可视化)。虽然该报告基因的表达对 Atp6v1b1 的内源性表达不具有特异性,其仅限于内淋巴囊16 的富含线粒体的细胞,该上皮细胞的两种细胞类型之一(图 5E),但它有助于识别和解剖内淋巴囊。
从小鼠模型解剖的用于扩大前庭导水管的内耳如图 4 所示。与对照同窝小鼠相比,缺乏 SLC26A4 (pendrin) 的小鼠的内淋巴囊和导管增大。
有和没有结膜组织的完整内淋巴囊免疫组织化学的代表性图像如图 5 所示。还介绍了 P5 野生型小鼠打开的内淋巴囊的免疫组织化学结果(图 5F-G)。内淋巴囊由折叠成袋状结构的单层上皮组成,在其管腔内含有淋巴液。该上皮由两种细胞类型组成,富含线粒体的细胞和富含核糖体的细胞(图 5E)。由于内淋巴液不再存在,整个安装的内淋巴囊将被压平。囊将显示为两层交织在一起的上皮层,因此很难确定在该上皮中表达的蛋白质的亚细胞定位。通过打开内淋巴囊,可以很容易地看到单层上皮,并且可以更明确地确定目标蛋白质相对于内淋巴囊腔的相对分布。可以更准确地确定这些蛋白质的潜在根尖 (管腔,内淋巴所在) 与基础富集。例如,SLC26A4富集在富含线粒体的细胞的顶端侧(图 5F)。
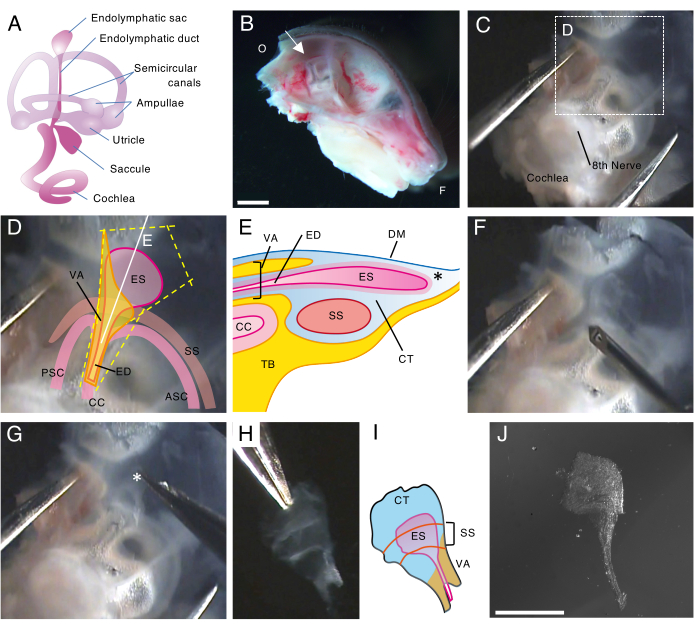
图 1.出生后第 5 天 (P5) 野生型小鼠内淋巴囊的整装解剖。
(A) 发达的小鼠内耳膜迷路示意图(右)。指示内淋巴囊的位置,以及耳蜗和前庭结构。该图是从 Honda 等人 16 修改而来的。
(B) 显示左半颅骨的中矢状面。图示了内淋巴囊的位置(箭头)。(O,枕骨;F,额叶)
(C) 耳囊以及颞骨的鳞状部分。
(D) 覆盖在图 C 虚线框上的重要标志。(ES,内淋巴囊;ED,内淋巴管;VA,前庭导水管;ASC,前半规管;PSC,后半规管;CC, 普通园;SS,乙状结肠窦)
(E) 横截面示意图以及图 D 上穿过内淋巴囊的连续白线。内淋巴囊的近端被称为前庭导水管的骨管和内淋巴管覆盖。在远端,被结合组织 (CT) 包围的内淋巴囊延伸并突出到骨迷路的外侧,并夹在硬脑膜 (DM) 和乙状窦之间,以及颞骨 (TB) 的鳞状部分。
(F) 用细针在内淋巴囊周围切割(沿着图 D 上的黄色虚线)。
(G) 将组织保持在星号(*,也显示在图 E 中)所示的位置并将其剥离,小心地从颞骨中取出制剂。
(H) 一个孤立的全内淋巴囊和周围组织。
(I) 这个分离的内淋巴囊与周围组织的示意图。
(J) 无周围组织的离体内淋巴囊。
比例尺:2 毫米 (B)、1 毫米 (J)。 请单击此处查看此图的较大版本。
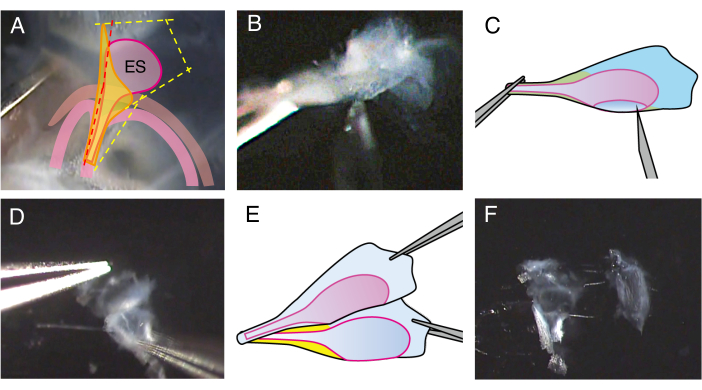
图 2.解剖 P5 野生型小鼠的打开的内淋巴囊。
(A) 在步骤 2.4 中,前庭导水管上的切口线位于略微前方(红色虚线),以切开内淋巴囊腔。
(B) 握住制剂的茎部,将 27 号针头插入管腔,然后移动,将内淋巴囊切成两片。
(C) 面板 B 的示意图。
(D) 用镊子握住每张片材的边缘,将它们彼此分开。
(E) 面板 D 的示意图。
(F) 内淋巴囊分为两片,包括上皮和周围组织。 请单击此处查看此图的较大版本。
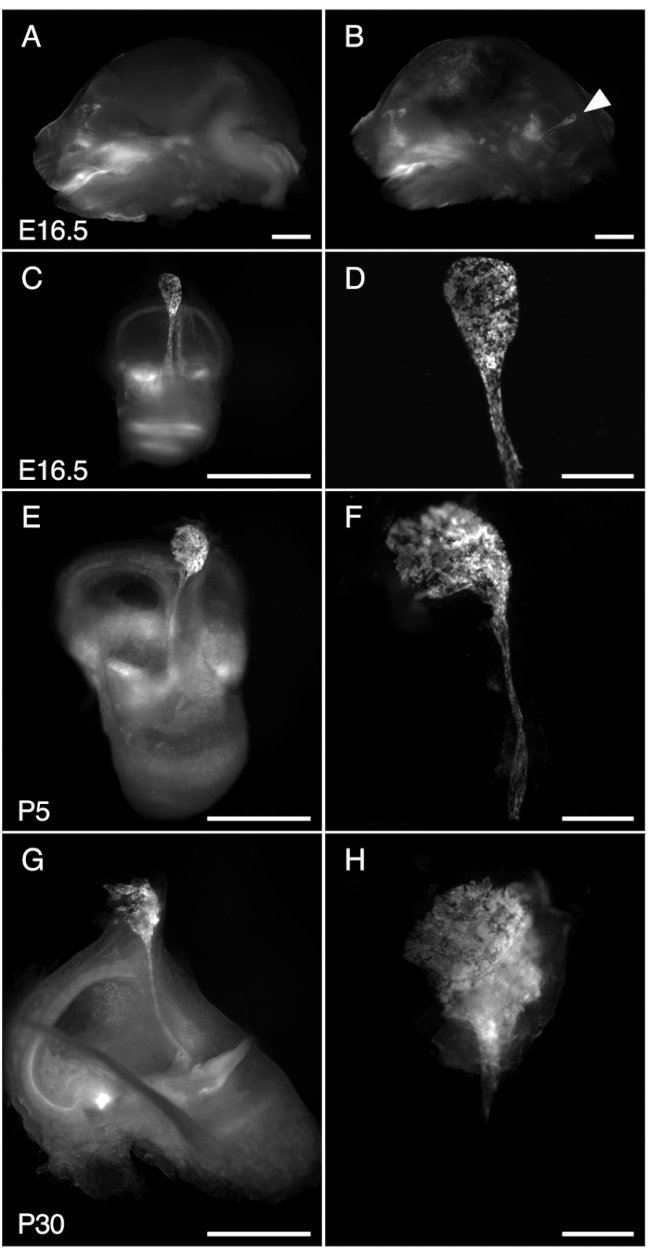
图 3.解剖 R26LSL-RCL-tdT/+;Tg(ATP6V1B1-Cre)1Rnel/Mn 小鼠内淋巴囊在 E16.5、P5 和 P30 处。显示的所有图像均显示了使用立体显微镜获得的 tdTomato 荧光,该体视显微镜配备了用于检测 tdTomato 荧光的 1 x 物镜。
(一、二)E16.5 R26LSL-RCL-tdT/+ 颅骨的中矢状段;Tg(ATP6V1B1-Cre)1Rnel/Mn 小鼠在 (A) 和 (B) 半脑切除之前。tdTomato 荧光勾勒出内耳的位置。即使不解剖(箭头),内淋巴囊也很容易看到。
(C、E、G)分别来自 E16.5 、 P5 和 P30 小鼠的分离内耳。
(D、F 和 H)相应显微解剖的内淋巴囊和导管的更高放大倍率图像。在 P30 处,内淋巴管被包裹在骨骼中,因此特别难以分离。比例尺:2 mm(A、B、C、E、G)、500 μm(D、F、H)。 请单击此处查看此图的较大版本。
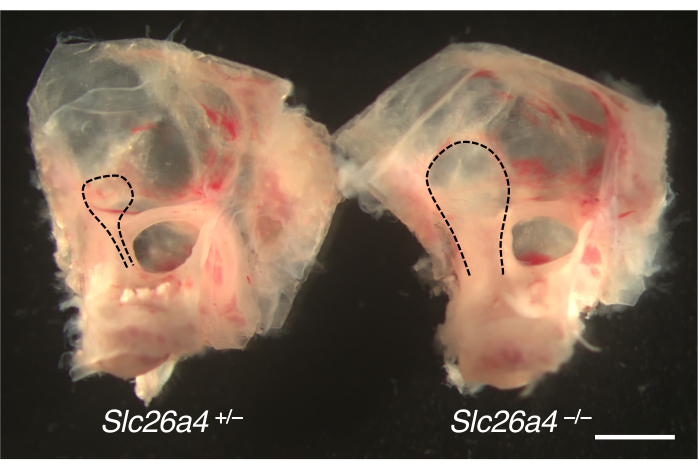
图 4.耳囊的大体解剖结构,内淋巴囊扩大。P105 处 Slc26a4+/-(左)和 Slc26a4-/-(右)小鼠同窝小鼠的内耳。与 Slc26a4 + / - 小鼠相比,Slc26a4 - / - 小鼠的前庭导水管和内淋巴囊和导管(黑色虚线)扩大。比例尺:2 毫米。请单击此处查看此图的较大版本。
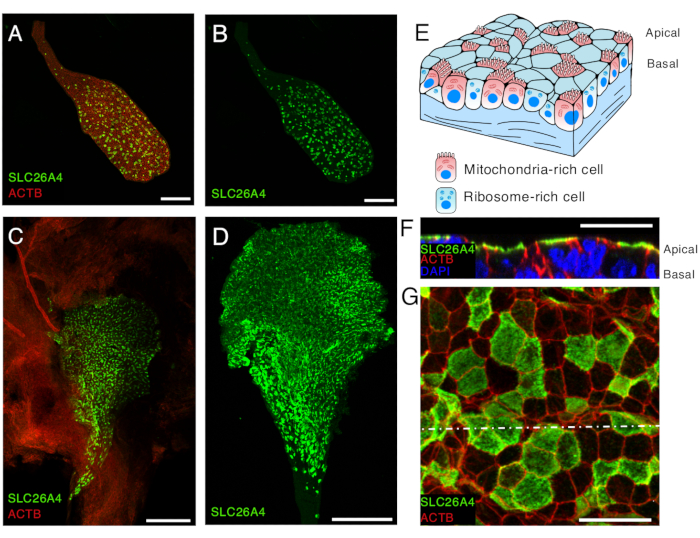
图 5.SLC26A4 E16.5 和 P5 处内淋巴囊上皮中富含线粒体的细胞的表达。
(一、二)从用抗 SLC26A4 抗体(绿色)标记的 E16.5 小鼠和标记 β-肌动蛋白的鬼笔环肽(ACTB,红色)中分离的内淋巴囊。
(C) 用抗 SLC26A4 抗体(绿色)标记的 P5 小鼠打开的内淋巴囊的低放大倍率图像。鬼笔环肽(ACTB,红色)可用于突出显示内淋巴囊及其周围结膜组织的存在。
(D) 用抗 SLC26A4 抗体(绿色)标记的分离内淋巴囊。
(E) 内淋巴囊上皮的示意图,突出了两种细胞类型的存在:富含线粒体的细胞,其顶端表面覆盖着微绒毛,以及富含核糖体的细胞。
(F-G)打开内淋巴囊并用抗SLC26A4抗体(绿色)和鬼笔环肽(ACTB,红色)标记后,P5 处内淋巴囊上皮的高倍率图像。根尖膜水平的代表性图像显示在 G 中,在点状白线水平上从 z 堆栈重建的横截面显示在 F 中。细胞核用 DAPI(蓝色)标记。
比例尺:100 μm (A, B);200 μm (C, D) ;20 μm (F, G) 的。 请单击此处查看此图的较大版本。
补充图 1.P5 R26 的入射光和相应的 tdTomato 荧光图像 LSL-RCL-tdT/+;Tg(ATP6V1B1-Cre)1Rnel/Mn 小鼠内耳在解剖的三个步骤中。 使用 tdTomato 荧光可以很容易地可视化内淋巴囊和导管。
(A-B)P5 R26LSL-RCL-tdT/+ 完整半颅骨后部的内耳区域;Tg(ATP6V1B1-Cre)1Rnel/Mn 小鼠。
(C-D)切除皮肤和部分颅骨可以更好地观察内淋巴囊区域。
(E, F)孤立的内耳,内淋巴囊仍与结膜组织相关。
(A、C、E)在入射光下捕获的图像。(B, D, F) tdTomato 相应组织的荧光。比例尺:2 毫米 (AB)、1 毫米 (CF)。 请点击此处下载此文件。
补充图 2.R26LSL-RCL-tdT/+ 离体内淋巴囊的荧光比较;Tg(ATP6V1B1-Cre)1Rnel/Mn和 R26LSL-RCL-tdT/+ 同窝小鼠在 E16.5 和 P5。 tdTomato 荧光极大地促进了内淋巴囊和导管的识别。
(A-C)E16.5 R26LSL-RCL-tdT/+ 的显微解剖内淋巴囊;Tg(ATP6V1B1-Cre)1Rnel/Mn (A) 和 R26LSL-RCL-tdT/+ 同窝小鼠 (B, C)。
(D-F)P5 R26LSL-RCL-tdT/+ 的显微解剖内淋巴囊;Tg(ATP6V1B1-Cre)1Rnel/Mn (D) 和 R26LSL-RCL-tdT/+ 同窝小鼠 (E、F)。
(A, B, D, E) td番茄荧光。(C、F)对应于 B 和 E 的入射光图像。比例尺:500 μm。 请点击此处下载此文件。
讨论
许多研究人员使用石蜡包埋或冷冻切片进行内淋巴囊的形态学研究。切片制剂的缺点是难以完全观察复杂的细胞间接触,因为内淋巴囊中每个上皮细胞的大小和形状都非常可变,形成皱纹和假复层细胞层。本协议中描述的整体免疫染色和 z 堆栈成像可以更好地可视化内淋巴囊的三维结构。
为了成功的显微解剖,关键是在脑海中可视化内淋巴囊的整个轮廓,即使它在野生型小鼠中是不可见的。观察图 3 和补充图 1-2 中所示的荧光报告基因,有助于识别小鼠内淋巴囊的定位和大小。
虽然这种整装解剖方法在上述方案中用于免疫染色,但该技术也可用于收获内淋巴囊组织用于基因表达分析,例如 RT-qPCR、微阵列表达,甚至单细胞 RNA-seq。使用该方案制备的组织进行单细胞 RNA-seq 分析的结果先前已报道16。对于内淋巴囊上皮细胞的基因表达分析,优选收集分离的上皮细胞,这样就不会受到其他邻近组织的污染。虽然胚胎内淋巴囊可以与相邻的结缔组织分离,但在以后的年龄要困难得多。对于来自老年小鼠的标本,鼓励在37°C下与胶原酶/分散酶孵育5分钟,并促进内淋巴囊上皮的分离。
该方案中描述的整体免疫染色的缺点之一是,在解剖或将制备物安装在载玻片和盖玻片之间时,原始的三维结构可能会受到创伤的影响。需要小心避免因操作而产生伪影。
披露声明
作者没有什么可披露的。
致谢
这项研究部分得到了 NIH 校内研究计划 NIDCD(NIH 校内研究基金 Z01-DC000060 和 ZIC DC000081高级成像核心)的支持。我们感谢 Raoul D. Nelson 博士和 R. Lance Miller 博士(犹他大学盐湖城,犹他州)和 Susan Wall 博士(埃默里大学医学院,佐治亚州亚特兰大)分享 Tg(ATP6V1B1-Cre) 小鼠,并感谢 NIDCD 动物设施工作人员照顾我们的动物。我们感谢 Philine Wangeman 博士为内耳绘制的美丽插图。我们感谢 Thomas B. Friedman 博士和 Robert J. Morell 博士对这份手稿的批判性审查。
材料
| Name | Company | Catalog Number | Comments |
| EDTA 0.5 M | Crystalgen | 221-057 | |
| 1 mL TUBERCULIN syringe with 27G x 13mm | BD | 309623 | |
| 9-well spot glass plate | Pyrex | 13-748B | |
| Alexa Fluor 555-conjugated phalloidin | ThermoFisher Scientific | A34055 | |
| Artery Scissors - Ball Tip | Fine Science Tools | 14080-11 | |
| Bovine serum albumin | Sigma Aldrich | A3059 | |
| Camera to capture images in incident light | Leica | DFC 495 | |
| Camera to capture fluorescent images | Leica | DFC 7000 GT | |
| Centrifuge tubes 15 mL | Corning | 430053 | |
| Centrifuge tubes 50 mL | Corning | 430829 | |
| Collagenase/Dispase | Roche | 10269638001 | |
| Confocal microscope | Zeiss | LSM 880 | |
| Cover Glass | Corning | 2940-223 | |
| Dumont #4 Forceps | Fine Science Tools | 11241-30 | |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | |
| Dumont #55 Forceps | Fine Science Tools | 11255-20 | |
| Extra Fine Bonn Scissors | Fine Science Tools | 14084-08 | |
| Alternative: Extra Fine Micro Dissecting Scissors; Straight; Sharp Points; 20mm Blade Length; 3 1/2" Overall Length | Roboz | RS-5880 | |
| Goat anti-rabbit Alexa Fluor 488-conjugated secondary antibody | ThermoFisher Scientific | A11034 | |
| MicroSlides Superfrost | VWR | 48311-702 | |
| Orbital shaker, for example Mini Shaker | Daigger | 980275 | |
| Paraformaldehyde (PFA) 16% Aqueous Solution | Electron Microscopy Sciences | 15710 | |
| Phosphate-Buffered Saline (10X) pH 7.4 | ThermoFisher Scientific | AM9624 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36931 | |
| Rabbit anti-Pendrin antibodies | In-house | RRID:AB_2713943, PB826 (Choi et al., 2011) | |
| Ring Forceps | Fine Science Tools | 11106-09 | |
| Rocking shaker, for example GyroMini | Labnet | S0500 | |
| Stereomicroscope equipped with a PlanApo 1.0x objective | Leica | ||
| Stainless Steel Single Edge Blades, .009" | GEM Personna | 62-0176 | |
| Tissue culture dish 60 mm | Falcon | 353002 | |
| Transparent nail polish | |||
| Triton X-100 | ACROS Organics | 32737-1000 |
参考文献
- Dror, A. A., Brownstein, Z., Avraham, K. B. Integration of human and mouse genetics reveals pendrin function in hearing and deafness. Cellular Physiology and Biochemistry. 28 (3), 535-544 (2011).
- Reardon, W., CF, O. M., Trembath, R., Jan, H., Phelps, P. D. Enlarged vestibular aqueduct: a radiological marker of pendred syndrome, and mutation of the PDS gene. QJM. 93 (2), 99-104 (2000).
- Griffith, A. J., Wangemann, P. Hearing loss associated with enlargement of the vestibular aqueduct: mechanistic insights from clinical phenotypes, genotypes, and mouse models. Hearing Research. 281 (1-2), 11-17 (2011).
- Gurkov, R., Pyyko, I., Zou, J., Kentala, E. What is Meniere's disease? A contemporary re-evaluation of endolymphatic hydrops. Journal of Neurology. 263, 71-81 (2016).
- Eckhard, A., et al. Water channel proteins in the inner ear and their link to hearing impairment and deafness. Molecular Aspects of Medicine. 33 (5-6), 612-637 (2012).
- Choi, B. Y., et al. Mouse model of enlarged vestibular aqueducts defines temporal requirement of Slc26a4 expression for hearing acquisition. Journal of Clinical Investigation. 121 (11), 4516-4525 (2011).
- Miyashita, T., et al. Presence of FXYD6 in the endolymphatic sac epithelia. Neuroscience Letters. 513 (1), 47-50 (2012).
- Royaux, I. E., et al. Localization and functional studies of pendrin in the mouse inner ear provide insight about the etiology of deafness in pendred syndrome. Journal of the Association for Research in Otolaryngology. 4 (3), 394-404 (2003).
- Kim, H. M., Wangemann, P. Epithelial cell stretching and luminal acidification lead to a retarded development of stria vascularis and deafness in mice lacking pendrin. PLoS One. 6 (3), 17949 (2011).
- Dahlmann, A., von During, M. The endolymphatic duct and sac of the rat: a histological, ultrastructural, and immunocytochemical investigation. Cell and Tissue Research. 282 (2), 277-289 (1995).
- Everett, L. A., et al. Targeted disruption of mouse Pds provides insight about the inner-ear defects encountered in Pendred syndrome. Human Molecular Genetics. 10 (2), 153-161 (2001).
- Miller, R. L., et al. The V-ATPase B1-subunit promoter drives expression of Cre recombinase in intercalated cells of the kidney. Kidney International. 75 (4), 435-439 (2009).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Wang, L., Jiang, H., Brigande, J. V. Gene transfer to the developing mouse inner ear by in vivo electroporation. Journal of Visualized Experiments. (64), e3643 (2012).
- Currle, D. S., Hu, J. S., Kolski-Andreaco, A., Monuki, E. S. Culture of mouse neural stem cell precursors. Journal of Visualized Experiments. (2), 152 (2007).
- Honda, K., et al. Molecular architecture underlying fluid absorption by the developing inner ear. Elife. 6, (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。