A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج جانجليوسيد وتنقيته وتوصيفه
In This Article
Summary
Gangliosides هي جليكوسفينغوليبيد حاملة لحمض السياليك وفيرة بشكل خاص في الدماغ. تتطلب طبيعتها البرمائية تقنيات استخراج وتنقية عضوية / مائية لضمان الاسترداد الأمثل والتحليلات الدقيقة. توفر هذه المقالة لمحات عامة عن استخراج العقدة التحليلية والإعدادية وتنقيتها وتحليل كروماتوغرافيا الطبقة الرقيقة.
Abstract
Gangliosides هي جليكوسفينغوليبيد تحتوي على واحد أو أكثر من بقايا حمض السياليك. توجد على جميع الخلايا والأنسجة الفقارية ولكنها وفيرة بشكل خاص في الدماغ. يتم التعبير عنها في المقام الأول على النشرة الخارجية للأغشية البلازمية للخلايا ، فهي تعدل أنشطة بروتينات سطح الخلية عن طريق الارتباط الجانبي ، وتعمل كمستقبلات في تفاعلات الخلايا الخلوية وهي أهداف لمسببات الأمراض والسموم. يؤدي خلل التنظيم الوراثي للتخليق الحيوي للعقدة في البشر إلى اضطرابات خلقية حادة في الجهاز العصبي. بسبب طبيعتها البرمائية ، يتطلب استخراج وتنقية وتحليل العقديات تقنيات تم تحسينها من قبل العديد من الباحثين في سنوات 80 منذ اكتشافها. هنا ، نصف طرقا على مستوى مقاعد البدلاء لاستخراج وتنقية وتحليلات نوعية وكمية أولية للجانجليسيدات الرئيسية من الأنسجة والخلايا التي يمكن إكمالها في غضون ساعات قليلة. كما نصف طرقا لعزل وتنقية الأنواع الرئيسية من الجانجليوسيد على نطاق أوسع من الدماغ. توفر هذه الطرق معا وصولا تحليليا وتحضيريا إلى هذه الفئة من الجزيئات النشطة بيولوجيا.
Introduction
تعرف الجانجليوسيدات بأنها جليكوسفينغوليبيد تحمل واحدا أو أكثر من بقايا حمض السياليك1. يتم التعبير عنها في المقام الأول على سطح الخلية مع مويتي الدهون سيراميد الكارهة للماء المضمنة في النشرة الخارجية لغشاء البلازما والجليكان المحب للماء الذي يمتد إلى الفضاء خارج الخلية2. على الرغم من توزيعها على نطاق واسع في الخلايا والأنسجة الفقارية، إلا أنها وفيرة بشكل خاص في دماغ الفقاريات3، حيث تم اكتشافها لأول مرة وتسميتها4.
تختلف هياكل الجليكان العقدي وهي أساس تسميتها (الشكل 1). يتكون جليكان جانجليوسيد من نواة سكر محايدة تحمل أعدادا وتوزيعات مختلفة من أحماض السياليك. أصغر جانجليوسيد ، GM4 ، يحتوي على سكرين فقط (حمض السياليك المرتبط بالجالاكتوز)5. قد تحتوي العقديات الكبيرة التي تحدث بشكل طبيعي على أكثر من اثني عشر سكرية إجمالية6 أو ما يصل إلى سبعة أحماض سياليك على نواة محايدة واحدة7. كما تختلف الجزيئات الدهنية من السيراميد ، حيث تحتوي على أطوال سفينغوزين مختلفة ومجموعة متنوعة من أميدات الأحماض الدهنية. في دماغ الفقاريات ، تسود أربعة أنواع من الجانجليوسيد ، GM1 و GD1a و GD1b و GT1b. يتم تنظيم تعبير Ganglioside من الناحية التنموية ، والأنسجة المحددة ، ونوع الخلية محددة.

الشكل 1: العقد الدماغية الرئيسية وسلائفها الاصطناعية الحيوية. يتم عرض الهياكل باستخدام تسمية الرمز ل Glycans11. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تعمل Gangliosides على المستوى الجزيئي عن طريق إشراك وتعديل البروتينات في أغشيتها الخاصة (تنظيم رابطة الدول المستقلة) أو عن طريق إشراك بروتينات ربط الجليكان في الوسط خارج الخلية ، بما في ذلك السموم البكتيرية والليكتين على الخلايا الأخرى (التعرف عبر الإنترنت)3. يؤدي الارتباط المحدد للجانجليوسيدات بالبروتينات التنظيمية و / أو الارتباط الذاتي مع جزيئات أخرى في طوافات دهنية إلى تغييرات في سلوك الخلية التي تؤثر على بنية الجهاز العصبي ووظيفته ، وتطور السرطان ، والتمثيل الغذائي ، والالتهاب ، واعتلال البروتين العصبي ، والأمراض المعدية8. وبسبب أدوارها الخلوية المتنوعة، يمكن أن توفر طرق عزلها وتحليلها رؤى معززة في تنظيم العمليات الفسيولوجية والمرضية. هنا ، يتم توفير طرق تم التحقق من صحتها للاستخراج والتحليل السريع على نطاق صغير ، والعزل على نطاق تحضيري للجانجليوسيدات من الدماغ. وتناقش الفرص والتحديات للتطبيق على الأنسجة الأخرى.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم جمع الأنسجة وفقا لشروط مصرح بها من قبل لجنة جونز هوبكنز لرعاية الحيوانات واستخدامها.
1. استخراج العقديات على نطاق صغير وتنقية جزئية
تنبيه: استخدم التهوية المناسبة عند العمل مع المذيبات المتطايرة والسامة. تجنب البلاستيك في جميع أنحاء. سوف تستخرج المذيبات المكونات الكيميائية من العديد من المواد البلاستيكية التي تتداخل مع التحليلات اللاحقة. البولي تترافلورو إيثيلين (PTFE) هو استثناء. يجب استخدام الإغلاقات المبطنة ب PTFE لتغطية قوارير التخزين الزجاجية.
- إستخلاص
- يزن دماغ فأر واحد طازج أو مذاب (أو نصف دماغ سهمي ، ~ 0.2-0.5 جم) ويوضع في مجانس Potter-Elvehjem المبرد مسبقا في دلو من الثلج.
ملاحظة: يمكن استخدام الأدمغة المجمدة سابقا بعد ذوبان الجليد عند 0-4 درجة مئوية. - أضف 4.1 مل لكل غرام من الأنسجة الرطبة بالماء وقم بتجانس 10 سكتات دماغية.
ملاحظة: نسب المذيبات الدقيقة هي مفتاح الاستخراج الأمثل والتقسيم ، والهدف هو الكلوروفورم والميثانول المائي (4: 8: 3) على افتراض أن أنسجة المخ مائية بنسبة 80٪. - أضف 13 مل لكل غرام من الوزن الرطب للميثانول ، وانتقل إلى درجة الحرارة المحيطة (22 درجة مئوية) واخلط.
ملاحظة: سيظهر الحل غائما. إضافة الميثانول في هذه الخطوة ، دون الكلوروفورم ، يحسن هطول الأمطار البروتينية. جميع الخطوات اللاحقة في درجة الحرارة المحيطة (22 درجة مئوية). - ينقل إلى أنبوب زجاجي سميك الجدران مغطى بالمسمار مع غطاء لولبي مبطن ب PTFE عند درجة الحرارة المحيطة (22 درجة مئوية) ويخلط جيدا. أضف 6.5 مل لكل غرام من الأنسجة الرطبة من الكلوروفورم والغطاء واخلطها جيدا. جهاز طرد مركزي عند 450 × جم لمدة 15 دقيقة. انقل السوبرنات الشفاف إلى أنبوب جديد مغطى بالمسمار وقم بقياس الحجم ، "حجم المستخلص المسترد".
- يزن دماغ فأر واحد طازج أو مذاب (أو نصف دماغ سهمي ، ~ 0.2-0.5 جم) ويوضع في مجانس Potter-Elvehjem المبرد مسبقا في دلو من الثلج.
- قسم
- أضف 0.173x "حجم المستخلص المسترد" من الماء إلى السطح الشفاف والغطاء والدوامة بقوة وأجهزة الطرد المركزي كما هو موضح في الخطوة 1.1.4.
ملاحظة: الهدف هو الحصول على الكلوروفورم - الميثانول - المائي بنسبة 4: 8: 5.6. سيكون الخليط غائما ويزول إلى مرحلتين: مرحلة علوية غنية بالأحياء المائية ومرحلة أقل غنية بالكلوروفورم بنسبة ~ 4: 1. انتظر لمدة 60 دقيقة أو جهاز طرد مركزي عند 450 × g لمدة 15 دقيقة لفصل الطور الكامل. - انقل المرحلة العليا ، التي تحتوي على العقديات ، إلى أنبوب زجاجي جديد مع غطاء لولبي مبطن ب PTFE.
- أضف 0.173x "حجم المستخلص المسترد" من الماء إلى السطح الشفاف والغطاء والدوامة بقوة وأجهزة الطرد المركزي كما هو موضح في الخطوة 1.1.4.
- كروماتوغرافيا خرطوشة الطور العكسي
- باستخدام حقنة زجاجية سعة 5 مل ، اغسل خرطوشة استخراج الطور الصلب tC18 (400 ملغ) ب 3 مل من الميثانول ، ثم 3 مل من الكلوروفورم والميثانول والماء (2:43:55). قم بتحميل المرحلة العليا من الخطوة 1.2.2 على خرطوشة tC18 باستخدام نفس المحقنة الزجاجية، واجمع التدفق وإعادة تحميله على العمود لتحسين الامتزاز.
- باستخدام المحقنة الزجاجية ، اغسل الخرطوشة ب 3 مل من ماء الكلوروفورم والميثانول (2:43:55) ثم 3 مل من ماء الميثانول (1: 1).
- قم بإخراج العقديات مع 3 مل من الميثانول في أنبوب جديد مغطى بالمسمار. يتبخر حتى يجف تحت تيار لطيف من النيتروجين عند ≤ 45 درجة مئوية. تذوب في الميثانول عند 1 مل لكل غرام من الوزن الرطب الأصلي للأنسجة.
2. استخراج وتنقية العقد على نطاق واسع
تنبيه: عند العمل مع المذيبات المتطايرة، استخدم الخلاطات المقاومة للانفجار. لا تستخدم البلاستيك باستثناء PTFE. رباعي هيدروفوران ، الكلوروفورم ، وإيثيل الأثير هي مركبات عضوية متطايرة سامة. اعمل في غطاء دخان مع قفازات واقية ونظارات سلامة.
- إستخلاص
- إذابة الدماغ البقري المجمد عند 4 درجات مئوية لعدة ساعات. تشريح المادة الرمادية من السحايا والمادة البيضاء.
ملاحظة: يتم وصف الإجراء التالي ل 100 ± 20 جم من المادة الرمادية الدماغية المعزولة وهو قابل للتطوير. - ضع 100 غرام من المادة الرمادية في الدماغ في الخلاط وأضف 1 مل لكل غرام من الوزن الرطب للدماغ من 10 مللي متر من المخزن المؤقت لفوسفات البوتاسيوم المبرد درجة الحموضة 6.8. تجانس على انخفاض لمدة 20 ثانية. أضف 8 مل من رباعي هيدروفوران لكل غرام من الوزن الرطب للدماغ وتجانس على مستوى منخفض لمدة 10 ثوان. صب في زجاجات الطرد المركزي الزجاجية وأجهزة الطرد المركزي في 5000 × غرام لمدة 15 دقيقة في درجة الحرارة المحيطة (22 درجة مئوية).
- جمع supernatant ، وقياس حجمه ، ونقله إلى قمع فاصل زجاجي. أضف 0.3 مل من إيثيل الأثير لكل مل من الأثريونات. رج المزيج بقوة، ثم اتركيه للجلوس دون إزعاج لمدة 30 دقيقة تنفصل خلالها مرحلتان، مرحلة الأثير العلوي ومرحلة مائية سفلى. جمع المرحلة السفلى ، التي تحتوي على gangliosides ، في زجاجة زجاجية مع غطاء مبطن PTFE.
- إلى المرحلة العليا (الأثير) المتبقية في القمع الفاصل ، أضف 0.1 مل من الماء لكل مل من supernatant الأصلي (الخطوة 2.1.3). رج بقوة ، واسمح للمراحل بالانفصال ، وجمع المرحلة السفلية (المائية) ودمجها مع المرحلة السفلية السابقة. تبخر المراحل السفلية مجتمعة إلى مسحوق جاف ووزنها.
- إذابة الدماغ البقري المجمد عند 4 درجات مئوية لعدة ساعات. تشريح المادة الرمادية من السحايا والمادة البيضاء.
- تصبن
- أضف 10 مل من 100 مللي متر من NaOH المائي لكل مسحوق غرام في أنبوب مغلق. تخلط وتحضن في 37 درجة مئوية لمدة 3 ساعات. اتركه يبرد ويتكيف مع الرقم الهيدروجيني 4.5 عن طريق إضافة 100 mM مائي HCl. قم بقياس الحجم ونقله إلى قمع فاصل زجاجي.
ملاحظة: أحماض السياليك هي لابيل حمضي. تجنب التحمض أقل من الرقم الهيدروجيني 4.5. - استنادا إلى الحجم المائي ، أضف 2.67 مجلدا من الميثانول ، واخلطه بلطف ، ثم أضف 1.33 مجلدا من الكلوروفورم لإنشاء محلول أحادي الطور من الكلوروفورم - الميثانول - المائي (4: 8: 3). تخلط جيدا.
- استنادا إلى الحجم المائي الأصلي ، أضف 2.6 حجم من الماء لجلب الخليط إلى الكلوروفورم والميثانول المائي بنسبة 4: 8: 5.6. رج بقوة ، ثم اسمح له بالجلوس دون إزعاج لفصل مرحلتين ، مرحلة علوية قطبية تحتوي على العقديات ومرحلة سفلية غير قطبية. جمع المرحلة العليا في زجاجة زجاجية مع غطاء مبطن PTFE.
ملاحظة: لن تظهر الدهون غير السياليل على ألواح كروماتوغرافيا الطبقة الرقيقة (TLC) الملطخة باستخدام الريسورسينول ولكنها ستظهر عند استخدام بقعة p-anisaldehyde. الغرض من هذا التصبن هو إزالة مركبات O-acetylated مثل الدهون الفوسفاتية.
- أضف 10 مل من 100 مللي متر من NaOH المائي لكل مسحوق غرام في أنبوب مغلق. تخلط وتحضن في 37 درجة مئوية لمدة 3 ساعات. اتركه يبرد ويتكيف مع الرقم الهيدروجيني 4.5 عن طريق إضافة 100 mM مائي HCl. قم بقياس الحجم ونقله إلى قمع فاصل زجاجي.
- كروماتوغرافيا الطور العكسي
- قبل الغسل المسبق لخرطوشة استخراج الطور الصلب tC18 على نطاق واسع (10 جم) عن طريق تمرير 50 مل من كل من المذيبات الثلاثة التالية عبر العمود باستخدام الفراغ أو الضغط (<1 دقيقة لكل غسلة): الميثانول ، الميثانول - الماء (1: 1) ، ثم الكلوروفورم - الميثانول - الماء (2: 43: 55). قم بتحميل المرحلة العليا من الخطوة 2.2.3 على العمود عن طريق الفراغ أو الضغط ، وجمع التدفق من خلاله ، وإعادة تحميله ، وجمع التدفق من خلاله.
- اغسل العمود ب 30 مل من الكلوروفورم والميثانول والماء (2:43:55) ، ثم 30 مل من الميثانول والماء (1: 1) ، ثم قم بإخراج الجانجليوسيدات مع 50 مل من الميثانول ، ومرة أخرى مع 10 مل من الميثانول ، وجمع كل غسل وكل استخلاص على حدة. باستخدام TLC (أدناه) يؤكد أن ganglioside غائب عن التدفق من خلال ويغسل ويخرج في أول عملية إزالة (50 مل ميثانول). تبخر العقديات المطفأة إلى مسحوق جاف ووزنها.
ملاحظة: الغرض من كروماتوغرافيا tC18 هو فصل العقديات عن كل من الملوثات القطبية الأقل والأكثر قطبا. العائد المختلط للدماغ العقدي بعد التصبن هو ~ 120 ملغ لكل غرام من مستخلص الدماغ الجاف (الخطوة 2.1.4). يشير ظهور العقديات بواسطة TLC في التدفق أو الغسيل إلى أن عمود استخراج الطور الصلب كان مشبعا. بعد إزالة الميثانول ، قد يتم التخلص من العمود بشكل أكبر باستخدام الكلوروفورم الميثانول (1: 1) لالتقاط دهون قطبية أقل.
- تنقية HPLC للجانجليوسيدات الفردية
- تحضير مذيب HPLC A: الأسيتونيتريل -5 mM العازل لفوسفات الصوديوم المائي الرقم الهيدروجيني 5.6 (83:17) والمذيب B: الأسيتونيتريل -20 mM فوسفات الصوديوم العازلة ، الرقم الهيدروجيني 5.6 (1: 1). ديغا كلا المذيبين لمدة 5 دقائق.
- قم بالتوازن المسبق لعمود HPLC (عمود 20 × 250 مم معبأ بكرات سيليكا مستعبدة بالأمين (NH2) ، قطرها 5 ميكرومتر ، حجم مسام 100 Å) مع مذيب A بنسبة 100٪ لمدة 20 دقيقة عند 5 مل / دقيقة. اضبط كاشف النفايات السائلة لعمود HPLC للأشعة فوق البنفسجية على 215 نانومتر.
- يذوب مسحوق الجانجليوسيد من الطور العكسي في الماء عند 5 ملغم / مل. حقن 0.5 مل من خليط العقديات على HPLC وتشغيل تدرج المذيب (الجدول 1) عند 5 مل / دقيقة ، وجمع الكسور. ستظهر Gangliosides كقمم A215 مع أوقات الاحتفاظ (العقد الدماغية الرئيسية) من 25-70 دقيقة: GM1 ≈ 28 دقيقة. GD1a ≈ 38 دقيقة; GD1b ≈ 46 دقيقة ؛ GT1b ≈ 65 دقيقة. أعد التوازن لمدة 20 دقيقة باستخدام المذيب A بعد كل تشغيل. تحليل الكسور بواسطة كروماتوغرافيا الطبقة الرقيقة.
| الوقت (دقيقة) | ٪ أ | ٪ ب |
| 0 | 100 | 0 |
| 7 | 100 | 0 |
| 12 | 63 | 37 |
| 82 | 54 | 46 |
| 82.01 | 0 | 100 |
| 92 | 0 | 100 |
الجدول 1: تدرج المذيبات ل HPLC.
3. تحليل كروماتوغرافيا الطبقة الرقيقة (TLC) للجانجليوسيدات
تحذير: الكلوروفورم هو مركب عضوي متطاير سام. اعمل في غطاء دخان مع قفازات واقية ونظارات سلامة.
- تشغيل المذيبات وإعداد لوحة TLC
- تحضير مذيب جاري من الكلوروفورم والميثانول المائي بنسبة 0.25٪ KCl (60:35:8 حسب الحجم). تصب في غرفة TLC زجاجية مقاس 10 سم × 10 سم مع غطاء من الفولاذ المقاوم للصدأ بحيث يكون عمق المذيب ~ 0.5 سم. قم بالتغطية واسمح بالتوازن في منطقة خالية من التيارات الهوائية لمدة >10 دقائق.
ملاحظة: لعزل غرفة TLC عن التيارات الهوائية ، يمكن إنشاء أو شراء صندوق أكريليك من 5 جوانب (الشكل 2). لا تستخدم ورق الترشيح المشبع بالمذيبات داخل الغرفة. - ضع صفيحة TLC عالية الأداء 10 سم × 10 سم أو 5 سم × 10 سم من هلام السيليكا المغطى بالزجاج المدعوم بالزجاج في فرن تجفيف على درجة حرارة 125 درجة مئوية لمدة 10 دقائق. اتركيه ليبرد. استخدم قلم رصاص #2 باهت لرسم خطوط اكتشاف 5 مم مع فواصل 2 مم على طول خط 1 سم فوق الجزء السفلي من اللوحة وعلى الأقل 1 سم من كلا الجانبين (الشكل 3). تجنب إزعاج طبقة السيليكا أثناء وضع العلامات.
- قم بإعداد مزيج قياسي من الجانجليوسيدات النقية في الميثانول الذي يحتوي على 100 ميكرومتر GM1 و 50 ميكرومتر لكل من GD1a و GD1b و 33 ميكرومتر من GT1b.
ملاحظة: يحتوي هذا الخليط على 100 بمول من حمض السياليك جانجليوسيد لكل ميكرولتر لكل من الجانجليوسيدات الأربعة ، وهي كمية توفر إشارة لونية قوية عن طريق تلطيخ ريسورسينول ، وهو يعتمد على حمض السياليك.
- تحضير مذيب جاري من الكلوروفورم والميثانول المائي بنسبة 0.25٪ KCl (60:35:8 حسب الحجم). تصب في غرفة TLC زجاجية مقاس 10 سم × 10 سم مع غطاء من الفولاذ المقاوم للصدأ بحيث يكون عمق المذيب ~ 0.5 سم. قم بالتغطية واسمح بالتوازن في منطقة خالية من التيارات الهوائية لمدة >10 دقائق.
- دقة جانجليوسيد
- اغسل حقنة هاميلتون سعة 10 ميكرولتر بإبرة مشطوفة بالميثانول. اسحب 1 ميكرولتر من الميثانول في حقنة زجاجية لملء الحجم الميت للإبرة ثم 1 ميكرولتر من العينة أو المعيار. ضع العينة بالتساوي على الخطوط المحددة مسبقا مقاس 5 مم حتى يبقى <1 ميكرولتر من المذيب (الميثانول) في المحقنة. اترك اللوحة لتجف عند درجة الحرارة المحيطة (22 درجة مئوية) بعد رصد جميع العينات.
ملاحظة: اغسل المحقنة بالميثانول بين تحميل العينة. يمكن استخدام منفاخ هواء غير مدفأ عند مستوى منخفض لتسريع التجفيف. - ضع اللوحة المرقطة والمجففة في غرفة TLC المتوازنة مسبقا مع غمر الحافة السفلية في المذيب الجاري وقم بتغطيتها وحمايتها من التيارات الهوائية (الشكل 2). اسمح للمذيب الجاري بالتقدم إلى أعلى اللوحة عن طريق العمل الشعري حتى تصل مقدمة المذيب إلى مسافة 1 سم من الجزء العلوي من اللوحة. قم بإزالة ووضع علامة على مقدمة المذيب على حافة اللوحة بقلم رصاص. اسمح للمذيبات بالتبخر تماما إما دون إزعاج أو تحت تدفق هواء معتدل.
- اغسل حقنة هاميلتون سعة 10 ميكرولتر بإبرة مشطوفة بالميثانول. اسحب 1 ميكرولتر من الميثانول في حقنة زجاجية لملء الحجم الميت للإبرة ثم 1 ميكرولتر من العينة أو المعيار. ضع العينة بالتساوي على الخطوط المحددة مسبقا مقاس 5 مم حتى يبقى <1 ميكرولتر من المذيب (الميثانول) في المحقنة. اترك اللوحة لتجف عند درجة الحرارة المحيطة (22 درجة مئوية) بعد رصد جميع العينات.

الشكل 2: معدات Ganglioside TLC وإعدادها. تمتلئ غرفة الحوض الصغير المزدوج ≈ 0.5 سم على كلا الجانبين بمذيب قيد التشغيل. يتم وضع اللوحة على جانب واحد مع نهاية الأصل مغمورة في المخزن المؤقت قيد التشغيل. الغرفة مغطاة بصندوق أكريليك لتجنب التيارات الهوائية. اللوحة A، منظر جانبي قبل إدخال اللوحة. مستوى المذيب مرئي على بعد بضعة مم فوق قاع الغرفة ؛ اللوحة B، منظر أمامي أثناء التطوير. تكون جبهة المذيبات مرئية عند حوالي 40٪ من الطريق إلى أعلى اللوحة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تلطيخ جانجليوسيد
تحذير: بقع الكاشف سامة. حمض الهيدروكلوريك قابل للتآكل وسام. قم بإعداد الكواشف ورشها في غطاء الدخان باستخدام قفازات واقية ونظارات أمان.
ملاحظة: يمكن تصوير اللوحة لتحليل الصور النوعي أو تخزينها عن طريق إزالة المشابك وتثبيت لوحة الغطاء في مكانها بشريط شفاف. يمكن إجراء التحليل الكمي عن طريق قياس الكثافة لمعايير جانجليوسيد المرصودة في الممرات المجاورة.- إعداد كاشف رذاذ ريسورسينول للكشف عن gangliosides على أساس أحماض السياليك الخاصة بهم. قم بإذابة 6 جم من الريسورسينول في 100 مل من الماء للحصول على مخزون ريسورسينول بنسبة 6٪. قم بإذابة 1 غرام من CuSO4 في 100 مل من الماء لصنع مخزون 1٪. إلى 64.7 مل من الماء أضف 5 مل من مخزون الريسورسينول بنسبة 6٪ ، و 0.31 مل من مخزون CuSO4 بنسبة 1٪ ثم أضف ببطء 30 مل من HCl المركز وحرك بلطف. يمكن تخزينها في 4 درجات مئوية لمدة شهر.
- في غطاء الدخان الكيميائي ، ضع لوحة TLC مع gangliosides المحلولة ، ينتهي الأصل ، في صندوق من الورق المقوى المقطوع لحماية جدران الغطاء من رذاذ الحمض. ضع كاشف رذاذ ريسورسينول في بخاخ TLC زجاجي ، وقم بإرفاقه بمصدر للنيتروجين المضغوط ، ورش اللوحة برفق قطريا في الاتجاهين الرأسي والأفقي. رش سطح المادة الماصة TLC بشكل موحد ، ولكن بخفة.
- قم بتغطية اللوحة على الفور بلوحة غطاء زجاجية جافة نظيفة من نفس الأبعاد وقم بتثبيت لوحة الغطاء في مكانها باستخدام مشابك الموثق (الشكل 3). سخني الطبق المغطى على حرارة 125 درجة مئوية لمدة 20 دقيقة. ستظهر Gangliosides باللون الأرجواني الداكن على خلفية بيضاء.
ملاحظة: يجب ألا تظهر اللوحة مبللة عند اكتمال الرش. يمكن تصميم ألواح الغطاء عن طريق كشط المادة الماصة من ألواح TLC المستخدمة سابقا باستخدام شفرة حلاقة أحادية الحافة.
تحذير: مسحوق السيليكا سام للرئتين. استخدم قناعا وتخلص من السيليكا في حاوية مغلقة.
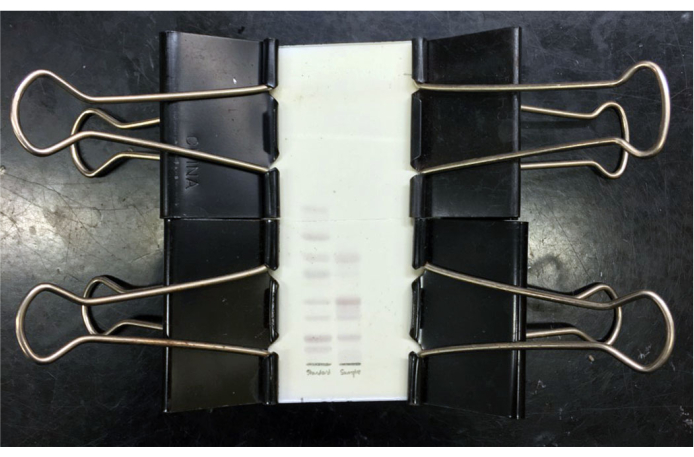
الشكل 3: لوحة TLC من العقديات المختلطة التي تم حلها. لوحة TLC من معايير ganglioside المختلطة التي تم حلها (الممر الأيسر) و gangliosides المادة الرمادية البقرية المختلطة النقية (الممر الأيمن) بعد تلطيخ الريسورسينول وتسخينه مع لوحة غطاء زجاجي مقطوعة في مكانها. العقديات القياسية (من الأعلى إلى الأسفل) هي GM3 و GM2 و GM1 و GD3 و GD1a و GD1b و GT1b و GQ1b. بعد التبريد ، يمكن تصوير اللوحة و / أو لوحة الغطاء المسجلة في مكانها للتخزين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تلطيخ الدهون العامة للجانجليوسيدات والفوسفوليبيدات.
تحذير: حمض الكبريتيك سام وقابل للتآكل. إضافة حمض مركز إلى الإيثانول طارد للحرارة ويجب أن يتم ببطء. تحضير كاشف تلطيخ في غطاء الدخان مع قفازات واقية ونظارات السلامة.- تحضير بقعة p-anisaldehyde عن طريق إضافة 15 مل من حمض الكبريتيك المركز ببطء إلى 500 مل من الإيثانول. يحرك المزيج لمدة 30 دقيقة للسماح للمحلول بأن يبرد قبل المتابعة. يضاف 15 مل p-anisaldehyde ويحرك بلطف. يمكن تخزين هذا في درجة حرارة الغرفة (22 درجة مئوية) حتى ستة أشهر.
- في غطاء الدخان الكيميائي ، اغمس لوحة TLC مع العقديات المحلولة ، نهاية الأصل ، في كوب يحتوي على بقعة p-anisaldehyde. غمر إلى الجبهة الجري لمدة ≥ 2 ثانية. إزالة TLC من البقعة والسماح لتصريف. قم بتسخين لوحة TLC على صفيحة ساخنة في درجة حرارة منخفضة لتطويرها.
ملاحظة: ستظهر الدهون داكنة على خلفية أرجوانية. يمكن استرداد محلول التلطيخ للاستخدام المتكرر.
Access restricted. Please log in or start a trial to view this content.
النتائج
توفر الطرق الموصوفة في القسم 1 (على نطاق صغير) العقديات بكمية ونقاء كافيين لتحديد العقد الرئيسية في الدماغ نوعيا وكميا. الانتعاش من دماغ الفأر هو ~ 1 ميكرومول جانجليوسيد لكل غرام من الوزن الرطب للدماغ (1 نانومول / ميكرولتر) عند تحضيره كما هو موضح. توفر دقة TLC البالغة 1 ميكرولتر (1 نانومول) باستخد...
Access restricted. Please log in or start a trial to view this content.
Discussion
إن طرق استخراج وعزل العصابات الصغيرة والكبيرة النطاق المبلغ عنها هنا ليست فريدة من نوعها - فهناك العديد من أساليب استخراج وتنقية المذيبات المختلفة التي توفر نتائج ممتازة12. وقد ثبت أن الطرق التي تم الإبلاغ عنها هنا للتنقية على نطاق صغير من الدماغ ، من فريدمان وسفينرهولم
Access restricted. Please log in or start a trial to view this content.
Disclosures
ولا يدعي صاحبا البلاغ أي مصالح متنافسة.
Acknowledgements
تم دعم هذا العمل من قبل الصندوق المشترك للمعاهد الوطنية للصحة (NIH) لمنحة Glycoscience U01CA241953. تم دعم MJP من قبل برنامج واجهة الكيمياء والبيولوجيا في جامعة جونز هوبكنز (T32GM080189).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe - Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe - Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved