A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיצוי גנגליוסייד, טיהור ופרופיל
In This Article
Summary
גנגליוסידים הם גליקוספינגוליפידים נושאי חומצה סיאלית הנמצאים בשפע במיוחד במוח. טבעם האמפיפתי דורש טכניקות מיצוי וטיהור אורגניות/מימיות כדי להבטיח התאוששות אופטימלית וניתוחים מדויקים. מאמר זה מספק סקירות כלליות של מיצוי גנגליוסיד בקנה מידה אנליטי ומכין, טיהור, וניתוח כרומטוגרפיה שכבה דקה.
Abstract
גנגליוסדים הם גליקוספינגוליפידים המכילים שאריות חומצה סיאלית אחת או יותר. הם נמצאים על כל התאים והרקמות החולייתיים אבל הם נפוצים במיוחד במוח. בא לידי ביטוי בעיקר על העלון החיצוני של קרום הפלזמה של תאים, הם לווסת את הפעילות של חלבונים פני התא באמצעות שיוך לרוחב, לפעול כקולטנים באינטראקציות תא-תא והם מטרות עבור פתוגנים ורעלים. דיסרגציה גנטית של ביוסינטזה ganglioside בבני אדם גורמת להפרעות חמורות במערכת העצבים המולדת. בשל אופיים האמפיפי, החילוץ, הטיהור והניתוח של גנגליוסידים דורשים טכניקות שעברו אופטימיזציה על ידי חוקרים רבים ב -80 השנים שחלפו מאז גילוים. כאן, אנו מתארים שיטות ברמת הספסל לחילוץ, טיהור, וניתוחים איכותיים וכמותיים ראשוניים של גנגליוסדים גדולים מרקמות ותאים שניתן להשלים תוך מספר שעות. אנו מתארים גם שיטות לבידוד וטיהור בקנה מידה גדול יותר של מינים גנגליוסידים מרכזיים מהמוח. יחד, שיטות אלה מספקות גישה בקנה מידה אנליטי ומכין לסוג זה של מולקולות ביואקטיביות.
Introduction
גנגליוסידים מוגדרים כגליקוספינגולפידים הנושאים שאריות חומצה סיאלית אחת או יותר1. הם באים לידי ביטוי בעיקר על פני השטח של התא עם moiety השומנים הסרמיד ההידרופובי שלהם מוטבע בעלון החיצוני של קרום הפלזמה ואת הגליקנים ההידרופיליים שלהם המשתרעים לתוך החלל החוץ תאי2. למרות שהם מופצים באופן נרחב בתאים וברקמות בעלי חוליות, הם נפוצים במיוחד במוח החוליות3, שם הם התגלו לראשונה ושמם 4.
המבנים של הגליקנים של גנגליוסייד משתנים ומהווים את הבסיס למינוח שלהם (איור 1). גליקנים גנגליוזידים מורכבים מליבת סוכר נייטרלית הנושאת מספרים שונים והפצות של חומצות סיאליות. בגנגליוסיד הקטן ביותר, GM4, יש רק שני סוכרים (חומצה סיאלית הקשורה לגלקטוז)5. גנגליוסידים טבעיים גדולים יותר עשויים להכיל יותר מתריסר סוכרים סה"כ6 או עד שבע חומצות סיאליות על ליבה נייטרלית אחת7. שלהם ceramide שומנים שומנים גם להשתנות, בעל אורכי ספינגוזין שונים ומגוון של חומצות שומן amides. במוח החוליות שולטים ארבעה מינים של גנגליוסיד, GM1, GD1a, GD1b ו- GT1b. ביטוי Ganglioside מוסדר מבחינה התפתחותית, ספציפי לרקמות, וסוג התא הספציפי.

איור 1: גנגליוסידים מוחיים עיקריים ומבשרי הביוסינתזה שלהם. מבנים מוצגים באמצעות מינוח סמלים עבור Glycans11. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
גנגליוסידים פועלים ברמה המולקולרית על ידי עיסוק ווויסות חלבונים בממברנות שלהם (ויסות cis) או על ידי עיסוק בחלבונים מחייבים גליקנים במילייה החוץ-תאי, כולל רעלנים חיידקיים ולקטינים בתאים אחרים (זיהוי טרנס)3. קשירה ספציפית של gangliosides חלבונים רגולטוריים ו/או קשר עצמי עם מולקולות אחרות לתוך רפסודות שומנים בדם גורמת לשינויים בהתנהגות התא המשפיעים על מבנה ותפקוד מערכת העצבים, התקדמות סרטן, חילוף החומרים, דלקת, חלבונים עצביים, ומחלות זיהומיות8. בשל תפקידיהם התאיים המגוונים, שיטות הבידוד והניתוח שלהם יכולות לספק תובנות משופרות על ויסות תהליכים פיזיולוגיים ופתולוגיים. כאן, שיטות מאומתות לחילוץ וניתוח מהיר בקנה מידה קטן, ובידוד בקנה מידה הכנה של גנגליוסידים מהמוח מסופקים. הזדמנויות ואתגרים ליישום לרקמות אחרות נדונים.
Protocol
איסוף הרקמות בוצע בתנאים שאושרו על ידי הוועדה לטיפול בבעלי חיים ושימוש בג'ונס הופקינס.
1. מיצוי גנגליוסייד בקנה מידה קטן וטיהור חלקי
שים לב: השתמש באוורור מתאים בעת עבודה עם ממיסים נדיפים ורעילים. הימנע פלסטיק לאורך כל הדרך; ממסים יחלצו רכיבים כימיים מפלסטיק רבים המפריעים לניתוחים הבאים. פוליטרפלואורואתילן (PTFE) הוא יוצא מן הכלל; יש להשתמש בסגירות מצופות PTFE כדי לכסות בקבוקוני אחסון מזכוכית.
- חילוץ
- שקול מוח עכבר טרי או מופשר יחיד (או חצי מוח קשתי, ~ 0.2-0.5 גרם) ומניחים בהומוגניזר פוטר-Elvehjem prechilled בדלי קרח.
הערה: ניתן להשתמש במוחות קפואים בעבר לאחר הפשרה בטמפרטורה של 0-4 מעלות צלזיוס. - מוסיפים 4.1 מ"ל לרקמה g משקל רטוב של מים והומוגני עם 10 משיכות.
הערה: יחסי ממס מדויקים הם המפתח לחילוץ ומחיצה אופטימליים, המטרה היא כלורופורם-מתנול-מימי (4:8:3) בהנחה שרקמת המוח היא 80% מימית. - מוסיפים 13 מ"ל למשקל רטוב של רקמת g של מתנול, עוברים לטמפרטורת הסביבה (22 °C (22 °F) ומערבבים.
הערה: הפתרון ייראה מעונן. תוספת של מתנול בשלב זה, ללא כלורופורם, מייעלת משקעי חלבון. כל השלבים הבאים הם בטמפרטורת הסביבה (22 °C (22 °F). - מעבירים לצינור זכוכית עבה מוקף קירות עם מכסה בורג מצופה PTFE בטמפרטורת הסביבה (22 מעלות צלזיוס) ומערבבים היטב. יש להוסיף 6.5 מ"ל ל-g רקמה במשקל רטוב של כלורופורם, כובע וערבבו היטב. צנטריפוגה ב 450 x g במשך 15 דקות. העבר את supernatant ברור לצינור בורג-capped טרי ולמדוד את עוצמת הקול, "נפח תמצית התאושש".
- שקול מוח עכבר טרי או מופשר יחיד (או חצי מוח קשתי, ~ 0.2-0.5 גרם) ומניחים בהומוגניזר פוטר-Elvehjem prechilled בדלי קרח.
- מחיצה
- הוסף 0.173x "נפח תמצית התאושש" של מים כדי supernatant ברור, כובע, מערבולת במרץ, צנטריפוגה כמתואר בשלב 1.1.4.
הערה: המטרה היא לקבל כלורופורם-מתנול-מימי ביחס 4:8:5.6. התערובת תהיה מעוננת ותפתור לשני שלבים: שלב עליון עשיר במימה ובשלב עשיר בכלורופורם נמוך יותר ביחס ~ 4:1. המתינו 60 דקות או צנטריפוגה בטמפרטורה של 450 x גרם למשך 15 דקות להפרדת פאזה מלאה. - העבר את השלב העליון, המכיל את gangliosides, לתוך צינור זכוכית טרי עם כובע בורג מצופה PTFE.
- הוסף 0.173x "נפח תמצית התאושש" של מים כדי supernatant ברור, כובע, מערבולת במרץ, צנטריפוגה כמתואר בשלב 1.1.4.
- כרומטוגרפיה של מחסנית פאזה הפוכה
- באמצעות מזרק זכוכית 5 מ"ל, לשטוף מחסנית חילוץ שלב מוצק tC18 (400 מ"ג) עם 3 מ"ל של מתנול, ולאחר מכן 3 מ"ל של כלורופורם-מתנול-מים (2:43:55). טען את השלב העליון משלב 1.2.2 על מחסנית tC18 באמצעות מזרק זכוכית זהה, לאסוף את הזרימה דרך ולטעון אותו מחדש על העמודה כדי למטב את הספיחה.
- באמצעות מזרק הזכוכית, לשטוף את המחסנית עם 3 מ"ל של כלורופורם-מתנול-מים (2:43:55) ולאחר מכן 3 מ"ל של מתנול-מים (1:1).
- לשאוב את gangliosides עם 3 מ"ל של מתנול לתוך צינור בורג כתרים טרי. להתאדות ליובש תחת זרם עדין של חנקן ב ≤ 45 °C (45 °F). ממיסים במתנול ב 1 מ"ל לכל גרם של משקל רטוב רקמה מקורית.
2. חילוץ וטיהור גנגליוסייד בקנה מידה גדול
אזהרה: בעת עבודה עם ממיסים נדיפים, השתמש בבלנדרים עמידים בפני פיצוץ. אין להשתמש בפלסטיק למעט PTFE. טטרהידרופורן, כלורופורם ואתיל אתר הם תרכובות אורגניות רעילות נדיפות. עבוד בברדס אדים עם כפפות מגן ומשקפי בטיחות.
- חילוץ
- להפשיר מוח בקר קפוא ב 4 °C (65 °F) במשך כמה שעות. לנתח את החומר האפור מקרום המוח וחומר לבן.
הערה: ההליך הבא מתואר עבור 100 ± 20 גרם של חומר אפור במוח מבודד והוא מדרגי. - מניחים 100 גרם של חומר אפור במוח בבלנדר ומוסיפים 1 מ"ל לכל גרם משקל רטוב במוח של 10 מ"מ מצונן אשלגן פוספט חיץ pH 6.8. הומוגניזציה על נמוך עבור 20 s. מוסיפים 8 מ"ל טטרהידרופורן לכל גרם משקל רטוב במוח והומוגניים על נמוך במשך 10 שניות. Decant לתוך בקבוקי צנטריפוגות זכוכית וצנטריפוגה ב 5,000 x g במשך 15 דקות בטמפרטורת הסביבה (22 °C (22 °F).
- לאסוף את supernatant, למדוד את נפחו, ולהעביר למשפך הפרדת זכוכית. הוסף 0.3 מ"ל של אתיל אתר לכל מ"ל של supernatant. לנער במרץ, ולאחר מכן לאפשר לשבת באין מפריע במשך 30 דקות שבמהלכן שני שלבים, שלב אתר עליון שלב מימית תחתון, נפרדים. לאסוף את השלב התחתון, המכיל את gangliosides, לתוך בקבוק זכוכית עם כובע מצופה PTFE.
- לשלב העליון (האתרי) שנותר במשפך המפריד, הוסף 0.1 מ"ל מים לכל מ"ל של סופר-נרטיב מקורי (שלב 2.1.3). לנער במרץ, לאפשר לשלבים להיפרד, לאסוף את השלב התחתון (מימי) ולשלב עם השלב התחתון הקודם. התאדו את השלבים התחתונים המשולבים לאבקה יבשה ושקלו.
- להפשיר מוח בקר קפוא ב 4 °C (65 °F) במשך כמה שעות. לנתח את החומר האפור מקרום המוח וחומר לבן.
- סאפוניפיקציה
- הוסיפו 10 מ"ל של 100 מ"מ מימית NaOH לכל אבקת g בצינור אטום. מערבבים ודגורים בטמפרטורה של 37 מעלות צלזיוס למשך 3 שעות. אפשר להתקרר ולהתאים ל- pH 4.5 על ידי תוספת טיפה של 100 מ"מ מימית HCl. למדוד את עוצמת הקול ולעבור למשפך הפרדת זכוכית.
הערה: חומצות סיאליות הן חומצה labile; הימנע החמצה מתחת pH 4.5. - בהתבסס על הנפח מימי, להוסיף 2.67 כרכים של מתנול, לערבב בעדינות, ולאחר מכן להוסיף 1.33 כרכים של כלורופורם כדי ליצור פתרון חד פאזי של כלורופורם-מתנול-מימית (4:8:3). מערבבים היטב.
- בהתבסס על הנפח המימי המקורי, הוסף 2.6 כרכים של מים כדי להביא את התערובת לכלורופורם-מתנול-מימי ביחס של 4:8:5.6. לנער במרץ, ולאחר מכן לאפשר לשבת באין מפריע להפריד בין שני שלבים, שלב עליון קוטבי המכיל את gangliosides ואת שלב תחתון לא קוטבי. לאסוף את השלב העליון בבקבוק זכוכית עם כובע מצופה PTFE.
הערה: שומנים שאינם סיילציה לא יופיעו על לוחות כרומטוגרפיה שכבה דקה (TLC) מוכתמים באמצעות resorcinol אבל יופיע בעת שימוש בכתם p-anisaldehyde. מטרת סאפוניפיקציה זו היא להסיר את תרכובות O-אצטילציה כגון פוספוליפידים.
- הוסיפו 10 מ"ל של 100 מ"מ מימית NaOH לכל אבקת g בצינור אטום. מערבבים ודגורים בטמפרטורה של 37 מעלות צלזיוס למשך 3 שעות. אפשר להתקרר ולהתאים ל- pH 4.5 על ידי תוספת טיפה של 100 מ"מ מימית HCl. למדוד את עוצמת הקול ולעבור למשפך הפרדת זכוכית.
- כרומטוגרפיה של פאזה הפוכה
- לפני לשטוף מחסנית חילוץ שלב מוצק בקנה מידה גדול (10 גרם) tC18 על ידי העברת 50 מ"ל של כל אחד משלושת הממסים הבאים דרך הטור באמצעות ואקום או לחץ (<1 דקות כל לשטוף): מתנול, מתנול-מים (1:1), ולאחר מכן כלורופורם-מתנול-מים (2:43:55). טען את השלב העליון משלב 2.2.3 לעמודה על ידי ואקום או לחץ, לאסוף את הזרימה דרך, לטעון מחדש, ולאסוף את הזרימה דרך.
- לשטוף את הטור עם 30 מ"ל של כלורופורם-מתנול-מים (2:43:55), ואז 30 מ"ל מתנול-מים (1:1), ואז לרומם את gangliosides עם 50 מ"ל מתנול, ושוב עם 10 מ"ל מתנול, איסוף כל לשטוף וכל ההמלטה בנפרד. באמצעות TLC (להלן) לאשר כי ganglioside נעדר מן הזרימה דרך ושוטף ו eluted בהמלטה הראשונה (50 מ"ל מתנול). התאדו את הגנגליוסידים המנוטרלים לאבקה יבשה ושקלו.
הערה: המטרה של כרומטוגרפיה tC18 היא להפריד gangliosides מן פחות ויותר מזהמים קוטביים. תשואה מעורבת של גנגליוסיד במוח לאחר סאפוניפיקציה היא ~ 120 מ"ג לכל תמצית מוח יבשה (שלב 2.1.4). הופעת gangliosides על ידי TLC בזרימה דרך או שטיפות מציין את עמוד החילוץ שלב מוצק היה רווי. לאחר ההמלטות מתנול, הטור עשוי להיות מואר עוד יותר עם כלורופורם-מתנול (1:1) כדי ללכוד פחות שומנים קוטביים.
- טיהור HPLC של גנגליוסידים בודדים
- הכנת HPLC ממס A: אצטוניטריל-5 מ"מ מימית נתרן פוספט מאגר pH 5.6 (83:17) וממס B: אצטוניטריל-20 מ"מ מאגר נתרן פוספט, pH 5.6 (1:1). דגה שני הממסים במשך 5 דקות.
- לפני שיווי המשקל של עמודת HPLC (עמודת HPLC בגודל 20 x 250 מ"מ עמוסה בכדורי סיליקה מלוכדים (NH2), קוטר 5 מיקרומטר, גודל נקבוביות 100 Å) עם 100% ממס A למשך 20 דקות ב-5 מ"ל/דקה. הגדר גלאי שפכים טור UV HPLC ל 215 ננומטר.
- להמיס את אבקת ganglioside מן השלב ההפוך להבהיר במים ב 5 מ"ג / מ"ל. הזרקו 0.5 מ"ל של תערובת הגנגליוסיד ל-HPLC והפעילו את שיפוע הממס (טבלה 1) ב-5 מ"ל/דקה, תוך איסוף שברים. Gangliosides יופיע כמו פסגות A215 עם זמני שימור (gangliosides המוח העיקרי) של 25-70 דקות: GM1 ≈ 28 דקות; GD1a ≈ 38 דקות; GD1b ≈ 46 דקות; GT1b ≈ 65 דקות. שיווי משקל מחדש 20 דקות עם ממס A לאחר כל ריצה. נתח שברים לפי כרומטוגרפיה של שכבה דקה.
| זמן (דקה) | %A | %B |
| 0 | 100 | 0 |
| 7 | 100 | 0 |
| 12 | 63 | 37 |
| 82 | 54 | 46 |
| 82.01 | 0 | 100 |
| 92 | 0 | 100 |
טבלה 1: מעבר צבע ממס עבור HPLC.
3. ניתוח כרומטוגרפיה של שכבה דקה (TLC) של גנגליוסידים
אזהרה: כלורופורם הוא תרכובת אורגנית נדיפה רעילה. עבוד בברדס אדים עם כפפות מגן ומשקפי בטיחות.
- הפעלת הכנת ממס וצלחת TLC
- הכן ממס פועל של כלורופורם-מתנול-מימי 0.25% KCl (60:35:8 לפי נפח). יוצקים לתוך תא TLC זכוכית 10 ס"מ x 10 ס"מ עם כיסוי נירוסטה, כך עומק הממס הוא ~ 0.5 ס"מ. לכסות ולאפשר שיווי משקל באזור ללא זרמי אוויר במשך >10 דקות.
הערה: כדי לבודד את תא ה-TLC מזרמי אוויר, ניתן לבנות או לרכוש תיבה בעלת 5 צדדים אקרילית (איור 2). אין להשתמש בנייר סינון רווי ממס בתוך התא. - מניחים צלחת TLC עם 10 ס"מ על 10 ס"מ או 5 ס"מ על 10 ס"מ על גבי ג'ל סיליקה מצופה זכוכית מגובה זכוכית בעלת ביצועים גבוהים בתנור ייבוש בטמפרטורה של 125 מעלות צלזיוס למשך 10 דקות. אפשר להתקרר. השתמשו בעיפרון מס' 2 קהה כדי לצייר קווי תצפית של 5 מ"מ עם הפרדות של 2 מ"מ לאורך קו בגובה 1 ס"מ מעל החלק התחתון של הצלחת ולפחות 1 ס"מ משני הצדדים (איור 3). הימנע מהפרעה לשכבת הסיליקה בעת הסימון.
- הכינו תערובת סטנדרטית של גנגליוסידים טהורים במתנול המכילים 100 מיקרומטר GM1, 50 מיקרומטר כל אחד של GD1a ו- GD1b ו -33 מיקרומטר של GT1b.
הערה: תערובת זו מכילה 100 pmol של חומצה סיאלית ganglioside לכל μL עבור כל אחד מארבעת gangliosides, כמות המספקת אות צבעוני חזק על ידי הכתמת resorcinol, שהוא חומצה סיאלית תלויה.
- הכן ממס פועל של כלורופורם-מתנול-מימי 0.25% KCl (60:35:8 לפי נפח). יוצקים לתוך תא TLC זכוכית 10 ס"מ x 10 ס"מ עם כיסוי נירוסטה, כך עומק הממס הוא ~ 0.5 ס"מ. לכסות ולאפשר שיווי משקל באזור ללא זרמי אוויר במשך >10 דקות.
- רזולוציית גנגליוסייד
- לשטוף מזרק המילטון 10-μL עם מחט משופעת עם מתנול. צייר 1 μL מתנול לתוך מזרק זכוכית כדי למלא את הנפח המת מחט ולאחר מכן 1 μL של מדגם או סטנדרטי. לזהות את המדגם באופן שווה על קווים מסומנים מראש 5 מ"מ עד <1 μL של ממס (מתנול) נשאר במזרק. אפשר לצלחת להתייבש בטמפרטורת הסביבה (22 °C (60 °F) לאחר שכל הדגימות מזוהות.
הערה: לשטוף את המזרק עם מתנול בין טעינת מדגם. מפוח אוויר לא מחומם שנקבע ברמה נמוכה יכול לשמש להאצת הייבוש. - הניחו את הצלחת המנוקדת והמיובשת בתא TLC המתואם מראש כשהקצה התחתון שקוע בממס הרץ ובכיסוי והגן מפני זרמי אוויר (איור 2). אפשר ממס פועל כדי להתקדם במעלה הצלחת על ידי פעולה נימית עד חזית הממס מגיע בתוך 1 ס"מ של החלק העליון של הצלחת. הסר וסמן את חזית הממס בקצה הצלחת עם עיפרון. אפשר לממסים להתאדות לחלוטין או ללא הפרעה או תחת זרימת אוויר קלה.
- לשטוף מזרק המילטון 10-μL עם מחט משופעת עם מתנול. צייר 1 μL מתנול לתוך מזרק זכוכית כדי למלא את הנפח המת מחט ולאחר מכן 1 μL של מדגם או סטנדרטי. לזהות את המדגם באופן שווה על קווים מסומנים מראש 5 מ"מ עד <1 μL של ממס (מתנול) נשאר במזרק. אפשר לצלחת להתייבש בטמפרטורת הסביבה (22 °C (60 °F) לאחר שכל הדגימות מזוהות.

איור 2: ציוד TLC של גנגליוסייד והגדרתם. תא שוקת תאומים מלא עד ≈ 0.5 ס"מ משני הצדדים עם ממס פועל. הלוח ממוקם על צד אחד כאשר קצה המקור שקוע במאגר הפועל. התא מכוסה בקופסת אקריליק כדי להימנע מזרמי אוויר. לוח A, תצוגה צדדית לפני הכנסת לוח. רמת הממס נראית כמה מ"מ מעל תחתית התא; לוח ב', מבט קדמי במהלך הפיתוח. חזית הממס נראית בכ -40% מהדרך במעלה הצלחת. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- מכתים גנגליוסיד
אזהרה: כתמי ריאגנט רעילים. חומצה הידרוכלורית היא מאכלת ורעילה. היכונו ורססו ריאגנטים במכסה מנוע אדים עם כפפות מגן ומשקפי בטיחות.
הערה: ניתן לצלם את הצלחת לניתוח תמונה איכותית או לאחסן אותה על ידי הסרת המלחציים ואבטחת לוחית הכיסוי במקום עם סרט דבק ברור. ניתוח כמותי יכול להתבצע על ידי מדידת צפיפות של תקני ganglioside הבחין בנתיבים סמוכים.- הכן ריאגנט תרסיס resorcinol לגילוי של gangliosides מבוסס על חומצות סיאליות שלהם. להמיס 6 גרם של resorcinol במים 100 מ"ל עבור מלאי resorcinol 6%. להמיס 1 גרם של CuSO4 ב 100 מ"ל של מים כדי להפוך את מניה 1%. ל 64.7 מ"ל של מים להוסיף 5 מ"ל של 6% מלאי resorcinol, 0.31 מ"ל של 1% מניית CuSO4 ולאחר מכן לאט להוסיף 30 מ"ל של HCl מרוכז ומערבבים בעדינות. ניתן לאחסן בטמפרטורה של 4 °C (65 °F) למשך חודש.
- במכסה מנוע אדים כימי, מניחים את צלחת TLC עם gangliosides נפתר, מקור בסופו של דבר, בקופסת קרטון לחתוך כדי להגן על הקירות של מכסה המנוע מפני תרסיס חומצה. מניחים ריאגנט תרסיס resorcinol במרסס TLC זכוכית, לצרף למקור של חנקן בלחץ, ולרסס קלות את הצלחת באלכסון בכיוונים האנכיים והאופקיים. לרסס את משטח TLC סורבט באופן אחיד, אבל בקלילות.
- כסו מיד את הצלחת בצלחת כיסוי זכוכית יבשה ונקייה באותם ממדים ואבטחו את לוחית הכיסוי במקומה עם מהדקי קלסר (איור 3). מחממים את הצלחת המכוסה בטמפרטורה של 125 מעלות צלזיוס למשך 20 דקות. גנגליוסידים יופיעו סגול כהה על רקע לבן.
הערה: הצלחת לא אמורה להיראות רטובה כאשר הריסוס הושלם. ניתן לעצב לוחות כיסוי על ידי גירוד הסורבנט מלוחות TLC שהיו בשימוש בעבר באמצעות סכין גילוח חד-קצה.
אזהרה: אבקת סיליקה רעילה לריאות. השתמשו במסכה והשליכו סיליקה במיכל אטום.
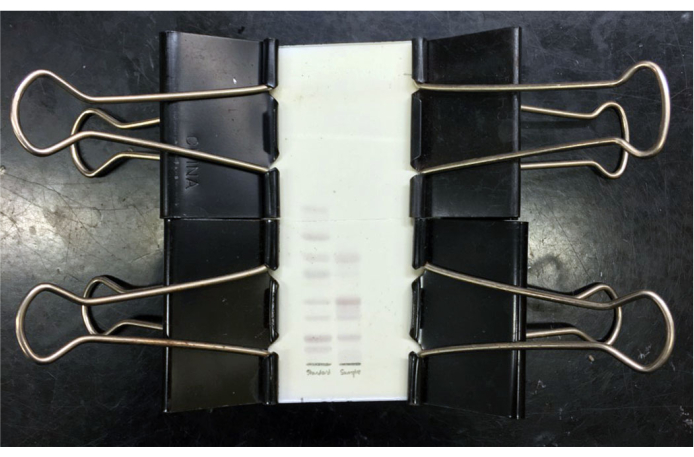
איור 3: לוח TLC של גנגליוסיד מעורב שנפתר. צלחת TLC של תקני ganglioside מעורבים נפתרו (נתיב שמאלי) ו gangliosides חומר אפור מעורב מטוהר (נתיב ימין) לאחר מכתים resorcinol וחימום עם צלחת כיסוי זכוכית קצוץ במקום. גנגליוסדים סטנדרטיים (מלמעלה למטה) הם GM3, GM2, GM1, GD3, GD1a, GD1b, GT1b ו- GQ1b. לאחר הקירור, ניתן לצלם את הצלחת ו/או את לוחית הכיסוי המודבקת במקום לאחסון. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- כתמי שומנים כלליים לגנגליוסדים ופוספוליפידים.
זהירות: חומצה גופרתית רעילה וקורוזיבית. תוספת של חומצה מרוכזת לאתנול היא אקסותרמית ויש לעשות זאת לאט. הכינו ריאגנט מכתים בברדס אדים עם כפפות מגן ומשקפי בטיחות.- הכינו כתם p-אניסלדהיד על ידי הוספה איטית של 15 מ"ל של חומצה גופרתית מרוכזת ל-500 מ"ל של אתנול. מערבבים במשך 30 דקות כדי לאפשר לפתרון להתקרר לפני שתמשיך. מוסיפים 15 מ"ל p-anisaldehyde ומערבבים בעדינות. זה עשוי להיות מאוחסן בטמפרטורת החדר (22 °C (6 °F) עד שישה חודשים.
- במכסה מנוע של אדים כימיים, טובלים את צלחת ה- TLC בגנגליוסדים פתורים, מקורם מסתיים למטה, לכוס המכילה את כתם ה- p-anisaldehyde. שקועים לחזית הריצה למשך ≥ 2 שניות. הסר TLC מהכתם ולאפשר לנקז. מחממים את צלחת TLC על צלחת חמה בטמפרטורה נמוכה לפתח.
הערה: שומנים ייראו כהים על רקע סגול. פתרון הכתמה עשוי להיות משוחזר לשימוש חוזר ונשנה.
תוצאות
השיטות המתוארות בסעיף 1 (בקנה מידה קטן) מספקות גנגליוסידים בכמות מספקת ובטוהר להגדרה איכותית וכמותית של גנגליוסידים מוחיים עיקריים. התאוששות ממוח העכבר היא ~ 1 μmol ganglioside לכל משקל רטוב במוח g (1 nmol / μL) כאשר מוכן כמתואר. רזולוציית TLC של 1 μL (1 nmol) באמצעות סעיף 3 מספקת חומר רב לגילוי רסוצינול ופותרת...
Discussion
השיטות להפקת גנגליוסיד בקנה מידה קטן וגדול ובידוד שדווחו כאן אינן ייחודיות - ישנן גישות מיצוי וטיהור ממסים רבות ושונות המספקות תוצאות מצוינות12. השיטות שדווחו כאן לטיהור בקנה מידה קטן מהמוח, מפרדמן וסוונרהולם13, הוכחו כמייעלות את ההתאוששות והוכחו כחסונות ופשוטות ...
Disclosures
המחברים טוענים שאין אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי הקרן המשותפת של המכונים הלאומיים לבריאות (NIH) עבור מענק Glycoscience U01CA241953. MJP נתמך על ידי התוכנית לממשק כימיה-ביולוגיה באוניברסיטת ג'ונס הופקינס (T32GM080189).
Materials
| Name | Company | Catalog Number | Comments |
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe - Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe - Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved