需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
神经节苷脂提取、纯化和分析
摘要
神经节苷脂是含唾液酸的鞘糖脂,在大脑中特别丰富。它们的两性性质需要有机/水提取和纯化技术,以确保最佳的回收率和准确的分析。本文概述了分析和制备规模的神经节苷脂提取,纯化和薄层色谱分析。
摘要
神经节苷脂是含有一种或多种唾液酸残基的鞘氨醇脂。它们存在于所有脊椎动物细胞和组织上,但在大脑中特别丰富。它们主要在细胞质膜的外叶上表达,通过横向关联调节细胞表面蛋白的活性,在细胞 - 细胞相互作用中充当受体,并且是病原体和毒素的靶标。人类神经节苷脂生物合成的遗传失调导致严重的先天性神经系统疾病。由于其两性性质,神经节苷脂的提取,纯化和分析需要许多研究人员自发现以来80年来已经优化的技术。在这里,我们描述了用于从组织和细胞中提取,纯化以及主要神经节苷脂的初步定性和定量分析的台级方法,这些方法可以在几个小时内完成。我们还描述了从大脑中更大规模地分离和纯化主要神经节苷脂物种的方法。总之,这些方法为这类生物活性分子提供了分析和制备规模的访问。
引言
神经节苷脂被定义为含有一种或多种唾液酸残基的鞘氨醇脂1。它们主要在细胞表面表达,其疏水性神经酰胺脂质部分嵌入质膜的外小叶中,亲水聚糖延伸到细胞外空间2。虽然它们广泛分布在脊椎动物细胞和组织中,但它们在脊椎动物的大脑中特别丰富3,它们在那里首次被发现并命名4。
神经节苷脂聚糖的结构各不相同,是其命名法的基础(图1)。神经节苷脂聚糖由中性糖核组成,具有不同数量和分布的唾液酸。最小的神经节苷脂GM4只有两种糖(唾液酸与半乳糖结合)5。较大的天然神经节苷脂可能含有十几种总糖6 或多达七种唾液酸,单个中性核心7。它们的神经酰胺脂质部分也各不相同,具有不同的鞘氨醇长度和多种脂肪酸酰胺。在脊椎动物的大脑中,有四种神经节苷脂,GM1,GD1a,GD1b和GT1b占主导地位。神经节苷脂表达具有发育调控性、组织特异性和细胞类型特异性。

图1:主要的脑神经节苷脂及其生物合成前体。 结构使用聚糖符号命名法显示11。 请点击此处查看此图的放大版本。
神经节苷脂通过在其自身膜中参与和调节蛋白质(顺式调节)或通过在细胞外环境中参与聚糖结合蛋白,包括其他细胞上的细菌毒素和凝集素(反式识别)在分子水平上起作用3。神经节苷脂与调节蛋白的特异性结合和/或与其他分子的自关联转化为脂筏导致细胞行为的变化,从而影响神经系统结构和功能、癌症进展、代谢、炎症、神经元蛋白病和传染病8。由于它们的细胞作用多种多样,它们的分离和分析方法可以增强对生理和病理过程调节的见解。在这里,提供了经过验证的快速小规模提取和分析方法,以及从大脑中分离神经节苷脂的制备性规模。讨论了应用于其他组织的机遇和挑战。
研究方案
组织收集是在约翰霍普金斯动物护理和使用委员会授权的条件下进行的。
1.小规模神经节苷脂提取和部分纯化
注意:使用挥发性和有毒溶剂时,请使用适当的通风。避免自始至终使用塑料;溶剂将从许多塑料中提取化学成分,从而干扰后续分析。聚四氟乙烯(PTFE)是一个例外;PTFE衬里瓶盖应用于玻璃储存瓶盖。
- 萃取
- 称量一个新鲜或解冻的小鼠大脑(或矢状半脑,约0.2-0.5克),并放入波特 - Elvehjem均质机中,预先装在一桶冰中。
注意:以前冷冻的大脑可以在0-4°C解冻后使用。 - 每克组织湿重水加入4.1 mL,并匀浆10次。
注意:准确的溶剂比例是最佳提取和分配的关键,假设脑组织含水率为80%,则目标是氯仿 - 甲醇水溶液(4:8:3)。 - 每克组织加入13 mL湿重的甲醇,转移到环境温度(22°C)并混合。
注意:解决方案将显示为多云。在此步骤中加入甲醇,不含氯仿,可优化蛋白质沉淀。所有后续步骤均在环境温度(22°C)下进行。 - 在环境温度(22°C)下转移到带有PTFE衬里螺旋盖的厚壁玻璃螺旋盖管中并充分混合。每克组织加入6.5毫升湿重的氯仿,盖上盖子,并充分混合。以450× g 离心15分钟。将清澈的上清液转移到新的螺旋盖管中,并测量体积,"恢复的提取物体积"。
- 称量一个新鲜或解冻的小鼠大脑(或矢状半脑,约0.2-0.5克),并放入波特 - Elvehjem均质机中,预先装在一桶冰中。
- 分区
- 将0.173x"回收的提取物体积"的水加入到清澈的上清液中,盖上盖子,剧烈涡旋,然后按照步骤1.1.4中所述离心。
注:目标是使氯仿-甲醇水溶液的比例为4:8:5.6。混合物将浑浊并分解为两相:上富水相和下富氯仿相,比例约为4:1。等待60分钟或以450×g离心15分钟以完全相分离。 - 将含有神经节苷脂的上相转移到带有PTFE衬里螺旋盖的新鲜玻璃管中。
- 将0.173x"回收的提取物体积"的水加入到清澈的上清液中,盖上盖子,剧烈涡旋,然后按照步骤1.1.4中所述离心。
- 反相墨盒色谱法
- 使用5mL玻璃注射器,用3mL甲醇洗涤tC18固相萃取盒(400mg),然后洗涤3mL氯仿 - 甲醇 - 水(2:43:55)。使用相同的玻璃注射器将步骤1.2.2中的上相加载到tC18墨盒上,收集流出物并将其重新加载到色谱柱上以优化吸附。
- 使用玻璃注射器,用3mL氯仿 - 甲醇 - 水(2:43:55)洗涤墨盒,然后用3 mL甲醇水(1:1)洗涤墨盒。
- 用3 mL甲醇洗脱神经节苷脂到新鲜的螺旋盖管中。在≤45°C的温和氮气流下蒸发至干。 溶于甲醇中,每克原始组织湿重1 mL。
2.大规模神经节苷脂提取纯化
注意:使用挥发性溶剂时,请使用防爆搅拌机。请勿使用除聚四氟乙烯以外的塑料。四氢呋喃、氯仿和乙醚是有毒的挥发性有机化合物。在通风橱中工作,戴上防护手套和安全护目镜。
- 萃取
- 在4°C下解冻冷冻牛脑数小时。从脑膜和白质中解剖灰质。
注意:以下程序描述了100±20克分离的脑灰质,并且是可扩展的。 - 将100g脑灰质放入搅拌机中,每g脑湿重加入1mL冷冻10mM磷酸钾缓冲液pH 6.8。低速均质20秒。每克脑湿重加入8 mL四氢呋喃,并在低浓度下匀浆10秒。倒入玻璃离心机瓶中,并在环境温度(22°C)下以5,000× g 离心15分钟。
- 收集上清液,测量其体积,然后转移到玻璃分离漏斗中。每毫升上清液加入0.3毫升乙醚。剧烈摇晃,然后静置30分钟,在此期间,两个相,上醚相和下水相,分开。将含有神经节苷脂的下相收集到带有PTFE衬里盖的玻璃瓶中。
- 向分离漏斗中剩余的上部(醚)相,每mL原始上清液加入0.1mL水(步骤2.1.3)。剧烈摇晃,让相分离,收集下相(水)相并与前一个下相结合。将组合的下相蒸发成干粉并称重。
- 在4°C下解冻冷冻牛脑数小时。从脑膜和白质中解剖灰质。
- 皂化
- 在密封管中每克粉末加入10毫升100 mM水溶液NaOH。混合并在37°C下孵育3小时。通过滴加100 mM水性HCl,冷却并调节至pH 4.5。测量体积并转移到玻璃分离漏斗中。
注意:唾液酸是酸性不稳定的;避免酸化低于pH 4.5。 - 根据水体积,加入2.67体积的甲醇,轻轻混合,然后加入1.33体积的氯仿,制成氯仿-甲醇-水溶液(4:8:3)。混合均匀。
- 在原水体积的基础上,加入2.6体积的水,使混合物以4∶8∶5.6的比例使氯仿-甲醇-水溶液。剧烈摇晃,然后不受干扰地静置以分离两相,极性上相包含神经节苷脂和非极性下相。将上相收集在带有PTFE衬里盖的玻璃瓶中。
注意:使用间苯二酚染色的薄层色谱(TLC)板上不会出现非唾液酰化脂质,但在使用 对茴香醛染色剂时会出现。这种皂化的目的是除去O-乙酰化化合物,如磷脂。
- 在密封管中每克粉末加入10毫升100 mM水溶液NaOH。混合并在37°C下孵育3小时。通过滴加100 mM水性HCl,冷却并调节至pH 4.5。测量体积并转移到玻璃分离漏斗中。
- 反相色谱
- 使用真空或压力(每次洗涤1分钟)将50 mL以下三种溶剂中的每一种通过塔(每次洗涤<1分钟)预洗大规模(10g)tC18固相萃取盒:甲醇,甲醇 - 水(1:1),然后氯仿 - 甲醇 - 水(2:43:55)。通过真空或压力将步骤2.2.3中的上相加载到塔上,收集流经,重新加载并收集流经。
- 用30 mL氯仿-甲醇-水(2:43:55)洗涤色谱柱,然后用30 mL甲醇-水(1:1)洗涤色谱柱,然后用50 mL甲醇洗脱神经节苷脂,再次用10 mL甲醇洗脱,分别收集每次洗涤和每次洗脱。使用TLC(下图)确认神经节苷脂不存在,并在第一次洗脱(50 mL甲醇)中洗涤和洗脱。将洗脱的神经节苷脂蒸发成干粉并称重。
注意:tC18色谱的目的是将神经节苷脂从较少和更多的极性污染物中分离出来。皂化后的混合脑神经节苷脂产量为每克干脑提取物〜120mg(步骤2.1.4)。通过TLC在流经或洗涤中出现神经节苷脂表明固相萃取柱饱和。甲醇洗脱后,柱可进一步用氯仿甲醇(1:1)洗脱,以捕获较少的极性脂质。
- 单个神经节苷脂的高效液相色谱纯化
- 准备HPLC溶剂A:乙腈-5 mM磷酸钠水溶液缓冲液pH 5.6(83:17)和溶剂B:乙腈-20 mM磷酸钠缓冲液,pH值5.6(1:1)。将两种溶剂脱气5分钟。
- 将HPLC色谱柱(20 x 250 mm色谱柱,内装有胺键合(NH2)二氧化硅球,直径5μm,孔径100 Å)与100%溶剂A以5 mL /分钟预平衡20分钟。将紫外HPLC柱出水检测器设置为215 nm。
- 将反相洗脱液中的神经节苷脂粉末溶解在水中,浓度为5mg / mL。将0.5mL神经节苷脂混合物注入HPLC,并以5mL / min的速度运行溶剂梯度(表1),收集馏分。神经节苷脂将表现为A215 峰,保留时间(主要脑神经节苷脂)为25-70分钟:GM1≈28分钟;GD1a ≈ 38 分钟;GD1b ≈ 46 分钟;GT1b ≈ 65 分钟每次运行后用溶剂A重新平衡20分钟。通过薄层色谱分析馏分。
| 时间(分钟) | %A | %B |
| 0 | 100 | 0 |
| 7 | 100 | 0 |
| 12 | 63 | 37 |
| 82 | 54 | 46 |
| 82.01 | 0 | 100 |
| 92 | 0 | 100 |
表1:HPLC的溶剂梯度。
3. 神经节苷脂的薄层色谱(TLC)分析
注意:氯仿是一种有毒的挥发性有机化合物。在通风橱中工作,戴上防护手套和安全护目镜。
- 运行溶剂和TLC板制备
- 制备氯仿 - 甲醇 - 水溶液0.25%KCl(体积60∶35∶8)的运行溶剂。倒入带有不锈钢盖的10 cm x 10 cm玻璃TLC室中,使溶剂深度约为0.5 cm。盖上盖子,让其在没有气流的区域平衡>10分钟。
注:为了将TLC腔室与气流隔离,可以构建或购买亚克力5面盒(图2)。请勿在腔室内使用溶剂饱和的滤纸。 - 将10 cm x 10 cm或5 cm x 10 cm硅胶涂层玻璃背高性能TLC板置于125°C的干燥箱中10分钟。让其冷却。使用变钝的#2铅笔沿着板底上方1厘米处且距离两侧至少1厘米的线绘制5毫米的点画线,其中2毫米的间隔(图3)。避免在打标时扰乱二氧化硅层。
- 在含有100μM GM1,GD1a和GD1b各50μM以及GT1b各33μM的甲醇中制备纯神经节苷脂的标准混合物。
注意:对于四种神经节苷脂中的每一种,该混合物每μL含有100 pmol的神经节苷脂唾液酸,该量通过间苯二酚染色提供强烈的比色信号,这是唾液酸依赖性的。
- 制备氯仿 - 甲醇 - 水溶液0.25%KCl(体积60∶35∶8)的运行溶剂。倒入带有不锈钢盖的10 cm x 10 cm玻璃TLC室中,使溶剂深度约为0.5 cm。盖上盖子,让其在没有气流的区域平衡>10分钟。
- 神经节苷脂分辨率
- 用甲醇斜针清洗10μL汉密尔顿注射器。将1μL甲醇吸入玻璃注射器中以填充针头死体积,然后填充1μL样品或标准品。将样品均匀地点在5mm预标记的管线上,直到<1μL溶剂(甲醇)留在注射器中。发现所有样品后,让板在环境温度(22°C)下干燥。
注意:在上样之间用甲醇清洗注射器。未加热的鼓风机设置为低电平可用于加速干燥。 - 将斑点和干燥的板放入预先交换的TLC室中,底部边缘浸入运行溶剂中,盖上盖子并防止气流(图2)。让运行的溶剂通过毛细管作用向上推进板,直到溶剂前端到达板顶部1cm以内。取下并用铅笔标记板边缘的溶剂前部。让溶剂完全不受干扰地蒸发或在温和的气流下蒸发。
- 用甲醇斜针清洗10μL汉密尔顿注射器。将1μL甲醇吸入玻璃注射器中以填充针头死体积,然后填充1μL样品或标准品。将样品均匀地点在5mm预标记的管线上,直到<1μL溶剂(甲醇)留在注射器中。发现所有样品后,让板在环境温度(22°C)下干燥。

图2:Ganglioside TLC设备和设置。 双槽室在两侧用流动溶剂填充至≈0.5厘米。板靠一侧放置,原点端浸入运行缓冲液中。腔室覆盖有亚克力盒,以避免气流。面板A,板插入前的侧视图。溶剂液位在腔室底部上方几毫米处可见;面板 B,开发过程中的前视图。溶剂前部在板的约40%处可见。 请点击此处查看此图的放大版本。
- 神经节苷脂染色
注意:试剂污渍有毒。盐酸具有腐蚀性和毒性。准备试剂并将其喷洒在通风橱中,戴上防护手套和安全护目镜。
注:该板可以成像以进行定性图像分析,也可以通过取下夹具并用透明胶带将盖板固定到位来存储。定量分析可以通过测量在相邻车道中发现的神经节苷脂标准的密度测定来执行。- 制备间苯二酚喷雾试剂,用于基于唾液酸检测神经节苷脂。将6g间苯二酚溶解在100mL水中,制成6%间苯二酚储备液。将1克CuSO4 溶解在100毫升水中,制成1%的储备液。在64.7mL水中加入5mL的6%间苯二酚储备液,0.31mL的1%CuSO4 储备液,然后缓慢加入30mL浓缩HCl并轻轻搅拌。可在 4 °C 下储存一个月。
- 在化学通风橱中,将带有已分解神经节苷脂的TLC板(原点最终)放在一个切开的纸板箱中,以保护烟罩壁免受酸性喷雾。将间苯二酚喷雾试剂置于玻璃TLC喷雾器中,附着在加压氮气源上,并在垂直和水平方向上对角线轻轻喷洒板。均匀但轻轻地喷洒TLC吸附剂表面。
- 立即用相同尺寸的干净干燥的玻璃盖板,并用粘合剂夹将盖板固定到位(图3)。将覆盖的板在125°C下加热20分钟。神经节苷脂在白色背景上呈现深紫色。
注意:喷涂完成后,板不应显得湿润。盖板可以通过使用单刃剃须刀片从以前使用的TLC板上刮下吸附剂来成型。
注意:硅微粉对肺部有毒。使用面膜并将二氧化硅处理在密封容器中。
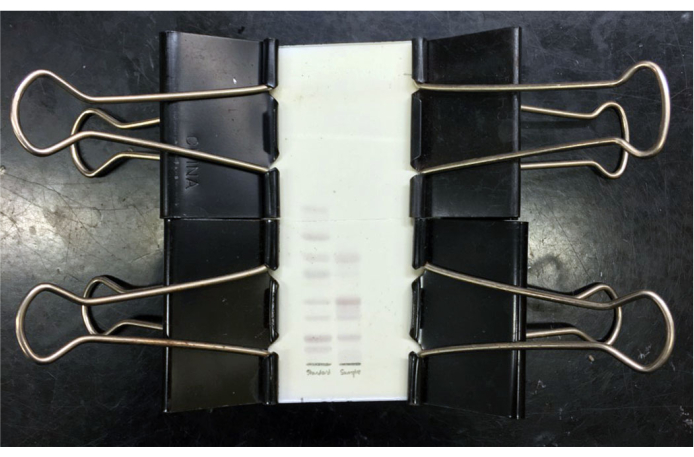
图3:分辨混合神经节苷脂的TLC板。 TLC板将间苯二酚染色和加热后,将混合神经节苷脂(左泳道)和纯化的混合牛灰质神经节苷脂(右泳道)分离,并用玻璃盖板夹到位。标准神经节苷脂(从上到下)是GM3,GM2,GM1,GD3,GD1a,GD1b,GT1b和GQ1b。冷却后,可以对板进行成像和/或将盖板贴到位以进行存储。 请点击此处查看此图的放大版本。
- 神经节苷脂和磷脂的一般脂质染色。
注意:硫酸具有毒性和腐蚀性。在乙醇中加入浓酸是放热的,必须缓慢进行。在通风橱中准备染色试剂,戴上防护手套和安全护目镜。- 通过将15 mL浓硫酸缓慢加入500 mL乙醇 中来制备对茴香醛染色剂。搅拌30分钟,让溶液冷却,然后再继续。加入 15 mL 对茴香醛,轻轻搅拌。这可以在室温(22°C)下储存长达六个月。
- 在化学通风橱中,将具有分辨神经节苷脂的TLC板浸入含有 对茴香醛染色剂的烧杯中。浸入跑步前部≥2秒。从污渍中去除TLC,然后排出。在低温下加热热板上的TLC板以显影。
注意:在紫色背景上,脂质将显示为深色。染色液可以回收重复使用。
结果
第1节(小规模)中描述的方法为主要脑神经节苷脂的定性和定量测定提供了足够数量和纯度的神经节苷脂。当按照所述制备时,从小鼠脑中恢复的神经节苷脂每g脑湿重(1 nmol / μL)〜 1μmol。使用第3节的1μL(1 nmol)的TLC分辨率为间苯二酚检测提供了充足的材料,并解决了所有主要的脑神经节苷脂,如图 4所示的野生型和转基因小鼠。虽然使用第1节制备的混合神经节苷脂并?...
讨论
这里报道的小规模和大尺度神经节苷脂提取和分离方法并非独一无二 - 有许多不同的溶剂提取和纯化方法可提供出色的结果12。这里报道的从Fredman和Svennerholm13中进行小规模纯化的大脑的方法被证明可以优化恢复,并且多年来在我们的实验室中已被证明是强大而直接的。适用于TLC和MS的分离和纯化可以在几个小时内从完整组织到分离的神经节苷脂轻松完成。MS可?...
披露声明
提交人声称没有利益冲突。
致谢
这项工作得到了美国国立卫生研究院(NIH)糖科学共同基金U01CA241953的支持。MJP得到了约翰霍普金斯大学化学 - 生物学界面计划(T32GM080189)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe - Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe - Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
参考文献
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。