このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ガングリオシドの抽出、精製、プロファイリング
要約
ガングリオシドは、シアル酸を含むスフィンゴ糖脂質であり、脳内に特に豊富に存在する。それらの両親媒性の性質は、最適な回収と正確な分析を確実にするために有機/水性抽出および精製技術を必要とする。この記事では、分析および分取スケールのガングリオシドの抽出、精製、および薄層クロマトグラフィー分析の概要を提供します。
要約
ガングリオシドは、1つ以上のシアル酸残基を含むスフィンゴ糖脂質である。それらはすべての脊椎動物の細胞および組織に見られるが、脳に特に豊富に存在する。主に細胞の原形質膜の外側小葉に発現し、横方向の会合を介して細胞表面タンパク質の活性を調節し、細胞間相互作用における受容体として作用し、病原体および毒素の標的である。ヒトにおけるガングリオシド生合成の遺伝的調節不全は、重度の先天性神経系障害をもたらす。ガングリオシドの両親媒性の性質上、ガングリオシドの抽出、精製、および分析には、発見以来80年間に多くの研究者によって最適化された技術が必要です。ここでは、数時間で完了できる組織および細胞からの主要なガングリオシドの抽出、精製、および予備的な定性的および定量的分析のためのベンチレベルの方法について説明する。我々はまた、脳からの主要なガングリオシド種のより大きなスケールの単離および精製のための方法を記述する。一緒に、これらの方法は、生理活性分子のこのクラスへの分析的および分取スケールアクセスを提供します。
概要
ガングリオシドは、1つ以上のシアル酸残基を有するスフィンゴ糖脂質1として定義される。それらは主に細胞表面で発現し、その疎水性セラミド脂質部分は原形質膜の外小葉に埋め込まれ、親水性グリカンは細胞外空間に広がっています2。脊椎動物の細胞や組織に広く分布していますが、脊椎動物の脳3に特に豊富に存在しており、そこで最初に発見され命名されました4。
ガングリオシドグリカンの構造はさまざまで、その命名法の基礎となっている(図1)。ガングリオシドグリカンは、シアル酸の異なる数および分布を有する中性糖コアからなる。最小のガングリオシドであるGM4は、2つの糖(ガラクトースに結合したシアル酸)のみを有する5。より大きな天然に存在するガングリオシドは、単一の中性コア上に1ダース以上の総糖6 または最大7つのシアル酸を含むことができる7。それらのセラミド脂質部分も変化し、異なるスフィンゴシン長および様々な脂肪酸アミドを有する。脊椎動物の脳では、4つのガングリオシド種、GM1、GD1a、GD1b、およびGT1bが優勢である。ガングリオシド発現は、発生的に調節され、組織特異的であり、かつ細胞型特異的である。

図1:主要な脳ガングリオシドおよびその生合成前駆体。 構造は、グリカン11のシンボル命名法を用いて示されている。 この図の拡大版を表示するには、ここをクリックしてください。
ガングリオシドは、自身の膜にタンパク質を関与させ調節することによって(シス調節)、または他の細胞上の細菌毒素およびレクチンを含む細胞外環境におけるグリカン結合タンパク質を関与させること(トランス認識)によって分子レベルで機能する3。ガングリオシドの調節タンパク質への特異的結合および/または他の分子との脂質ラフトへの自己会合は、神経系の構造および機能、癌の進行、代謝、炎症、神経細胞タンパク質障害、および感染症に影響を与える細胞挙動の変化をもたらす8。それらの多様な細胞の役割のために、それらの単離および分析のための方法は、生理学的および病理学的プロセスの調節に関する強化された洞察を提供することができる。ここでは、迅速な小規模抽出および分析のための検証された方法、および脳からのガングリオシドの分取スケール単離が提供される。他の組織への適用のための機会と課題が議論される。
プロトコル
組織採取は、ジョンズ・ホプキンス動物ケア・使用委員会によって承認された条件下で行った。
1. 小規模ガングリオシド抽出と部分精製
警告: 揮発性および有毒な溶剤を使用する場合は、適切な換気を行ってください。全体にプラスチックを避けます;溶剤は、その後の分析を妨げる多くのプラスチックから化学成分を抽出します。ポリテトラフルオロエチレン(PTFE)は例外です。PTFEライニングされたクロージャーは、ガラス貯蔵バイアルをキャップするために使用する必要があります。
- 抽出
- 1匹の新鮮または解凍したマウス脳(または矢状半脳、〜0.2〜0.5g)を計量し、氷のバケツで予冷したポッター・エルヴェヘムホモジナイザーに入れる。
注:以前に凍結した脳は、0〜4°Cで解凍した後に使用することができます。 - g組織湿重量の水あたり4.1mLを加え、10ストロークで均質化する。
注:正確な溶媒比は最適な抽出と分配の鍵であり、脳組織が80%水性であると仮定すると、目標はクロロホルム - メタノール - 水性(4:8:3)です。 - メタノールの組織湿重量gあたり13mLを加え、周囲温度(22°C)にシフトして混合する。
注: ソリューションが曇って表示されます。この工程でのメタノールの添加は、クロロホルムなしで、タンパク質沈殿を最適化する。その後のすべてのステップは周囲温度(22°C)です。 - PTFEライニングスクリューキャップを備えた厚肉ガラススクリューキャップチューブに周囲温度(22°C)で移し、十分に混合します。クロロホルムの組織湿重量gあたり6.5mLを加え、キャップし、十分に混合する。450 x g で15分間遠心分離する。透明な上清を新鮮なスクリューキャップ付きチューブに移し、体積を測定する、「回収抽出量」。
- 1匹の新鮮または解凍したマウス脳(または矢状半脳、〜0.2〜0.5g)を計量し、氷のバケツで予冷したポッター・エルヴェヘムホモジナイザーに入れる。
- 分割
- 透明な上清に0.173倍の「回収された抽出量」の水を加え、キャップ、渦を激しく加え、ステップ1.1.4で説明したように遠心分離する。
注:目標は、クロロホルム - メタノール - 水性を4:8:5.6の比率にすることです。混合物は白濁し、2つの相に分解される:上部水性リッチ相および下部クロロホルムリッチ相は〜4:1の比率で。完全な相分離のために60分間待つか、450 x gで遠心分離機で15分間待ちます。 - ガングリオシドを含む上部相を、PTFEライニングスクリューキャップを備えた新鮮なガラス管に移す。
- 透明な上清に0.173倍の「回収された抽出量」の水を加え、キャップ、渦を激しく加え、ステップ1.1.4で説明したように遠心分離する。
- 逆相カートリッジクロマトグラフィー
- 5 mL のガラスシリンジを使用して、tC18 固相抽出カートリッジ (400 mg) を 3 mL のメタノールで洗浄し、次に 3 mL のクロロホルム - メタノール - 水 (2:43:55) で洗浄します。同じガラスシリンジを使用してステップ1.2.2の上相をtC18カートリッジにロードし、フロースルーを収集してカラムに再ロードして吸着を最適化します。
- ガラスシリンジを使用して、3 mLのクロロホルム - メタノール - 水(2:43:55)でカートリッジを洗浄し、次に3 mLのメタノール - 水(1:1)で洗浄する。
- ガングリオシドを3mLのメタノールで溶かし、新鮮なスクリューキャップ付きチューブに入れる。≤ 45°Cで窒素の穏やかな流れの下で蒸発乾固させる。 元の組織湿重量のgあたり1mLでメタノールに溶解する。
2. 大規模ガングリオシドの抽出と精製
警告: 揮発性溶剤を扱う場合は、耐爆発性ブレンダーを使用してください。PTFE以外のプラスチックは使用しないでください。テトラヒドロフラン、クロロホルム、およびエチルエーテルは、有毒な揮発性有機化合物である。保護手袋と安全ゴーグルを備えたヒュームフードで作業してください。
- 抽出
- 凍結したウシ脳を4°Cで数時間解凍する。髄膜と白質から灰白質を解剖する。
注:次の手順は、100〜20gの単離された脳灰白質±ついて説明されており、スケーラブルです。 - ブレンダーに脳灰白質100gを入れ、冷却した10mMリン酸カリウム緩衝液pH6.8の脳湿重量あたり1mLを加える。20秒間ローで均質化します。脳湿重量gあたり8mLのテトラヒドロフランを加え、10秒間低めに均質化する。ガラス遠沈ボトルにデカントし、周囲温度(22°C)で5,000 x g で15分間遠心分離します。
- 上清を集め、その体積を測定し、ガラスの分液漏斗に移す。上清1 mLあたり0.3 mLのエチルエーテルを加える。激しく振ってから、30分間邪魔されずに座らせ、その間に2つの相、上部エーテル相と下部水相が分離する。ガングリオシドを含む下相をPTFEライニングキャップ付きのガラス瓶に集める。
- 分液漏斗に残っている上部(エーテル)相に、元の上清のmLあたり0.1mLの水を加える(ステップ2.1.3)。激しく振って、相が分離するのを許し、より低い(水性の)相を集め、そして前のより低い相と結合する。結合された下部相を乾燥粉末に蒸発させ、重量を量る。
- 凍結したウシ脳を4°Cで数時間解凍する。髄膜と白質から灰白質を解剖する。
- 鹸化
- 密閉チューブに1g粉末あたり10mLの100mMNaOH水溶液を加える。混合し、37°Cで3時間インキュベートする。冷却し、100 mM HCl 水溶液を滴下して pH 4.5 に調整します。体積を測定し、ガラス分液ロートに移します。
注:シアル酸は酸不安定です。pH 4.5以下の酸性化を避けてください。 - 水溶液容量に基づいて、2.67容量のメタノールを加え、穏やかに混合し、次いで1.33容量のクロロホルムを加えて、クロロホルム - メタノール - 水性の単相溶液(4:8:3)を作成する。よく混ぜる。
- 元の水容量に基づいて、2.6容量の水を加えて、混合物をクロロホルム - メタノール - 水性に4:8:5.6の比率で持たせる。激しく振ってから、邪魔されずに座らせて、ガングリオシドを含む極上相と非極性下相の2つの相を分離する。PTFEライニングキャップ付きのガラス瓶に上相を集めます。
注:非シアリル化脂質は、レゾルシノールを使用して染色された薄層クロマトグラフィー(TLC)プレートには表示されませんが、 p-アニスアルデヒド染色を使用する場合に表示されます。このケン化の目的は、リン脂質などのOアセチル化化合物を除去することである。
- 密閉チューブに1g粉末あたり10mLの100mMNaOH水溶液を加える。混合し、37°Cで3時間インキュベートする。冷却し、100 mM HCl 水溶液を滴下して pH 4.5 に調整します。体積を測定し、ガラス分液ロートに移します。
- 逆相クロマトグラフィー
- 真空または圧力(<1分各洗浄)を用いてカラムに以下の3つの溶媒のそれぞれ50mLを通すことによって、大規模(10g)tC18固相抽出カートリッジを予備洗浄する:メタノール、メタノール - 水(1:1)、次いでクロロホルム - メタノール - 水(2:43:55)。ステップ2.2.3から上相を真空または圧力でカラムにロードし、流れを集め、リロードし、流れを集めます。
- カラムを 30 mL のクロロホルム - メタノール - 水 (2:43:55)、次いで 30 mLのメタノール - 水 (1:1) で洗浄し、次いでガングリオシドを 50 mL のメタノールで溶出し、再度 10 mL のメタノールで洗浄し、各洗浄液と各溶出液を別々に回収する。TLC(下記)を用いて、ガングリオシドが流れから存在しないことを確認し、洗浄し、第1の溶出(50mLメタノール)で溶出した。溶出したガングリオシドを乾燥粉末に蒸発させ、秤量する。
注: tC18 クロマトグラフィーの目的は、ガングリオシドを極性の低い汚染物質と極性の高い汚染物質の両方から分離することです。ケン化後の混合脳ガングリオシド収量は、乾燥脳抽出物1gあたり~120 mgである(工程2.1.4)。TLCによるガングリオシドの出現は、フロースルーまたは洗浄において、固相抽出カラムが飽和していたことを示す。メタノール溶出後、カラムをさらにクロロホルム-メタノール(1:1)で溶出して極性の低い脂質を捕捉することができます。
- 個々のガングリオシドのHPLC精製
- HPLCを調製する 溶媒A:アセトニトリル-5 mM リン酸ナトリウム水溶液緩衝液 pH 5.6 (83:17) および溶媒 B: アセトニトリル-20 mM リン酸ナトリウム緩衝液、pH 5.6 (1:1)。両方の溶媒を5分間脱気する。
- HPLCカラム(アミン結合(NH2)シリカ球体を充填した20 x 250 mmカラム、直径5 μm、細孔径100 Å)を100%溶媒Aで5 mL/minで20分間予備平衡化します。UV HPLCカラム廃液検出器を215nmに設定します。
- 逆相溶出液からのガングリオシド粉末を5mg/mLの水に溶解する。0.5 mLのガングリオシド混合物をHPLCに注入し、溶媒勾配(表1)を5 mL/minで実行し、画分を採取する。ガングリオシドは、保持時間(主要な脳ガングリオシド)が25〜70分のA215 ピークとして現れます:GM1≈28分。GD1a≈38分。GD1b≈46分。GT1b≈65分。各ランの後に溶媒Aで20分間再平衡化する。薄層クロマトグラフィーで画分を分析します。
| 時間 (分) | %A | %B |
| 0 | 100 | 0 |
| 7 | 100 | 0 |
| 12 | 63 | 37 |
| 82 | 54 | 46 |
| 82.01 | 0 | 100 |
| 92 | 0 | 100 |
表1:HPLCの溶媒勾配。
3. ガングリオシドの薄層クロマトグラフィー(TLC)分析
警告: クロロホルムは有毒な揮発性有機化合物です。保護手袋と安全ゴーグルを備えたヒュームフードで作業してください。
- ランニング溶剤およびTLCプレート調製
- クロロホルム-メタノール-0.25%KCl水溶液(体積比60:35:8)のランニング溶媒を調製する。溶剤の深さが〜0.5cmになるように、ステンレス製のカバーを備えた10cm x 10cmのガラスTLCチャンバーに注ぎます。気流のない場所で>10分間、カバーして平衡化させます。
メモ:TLCチャンバを気流から隔離するために、アクリル製の5面ボックスを構築または購入することができます(図2)。チャンバー内で溶剤飽和ろ紙を使用しないでください。 - 10 cm x 10 cmまたは5 cm x 10 cmのシリカゲルコーティングされたガラス裏打ち高性能TLCプレートを、125°Cの乾燥オーブンに10分間置く。冷ます。鈍い#2鉛筆を使用して、プレートの底から1cm上、両側から少なくとも1cmの線に沿って、2mmの分離で5mmのスポッティングラインを描きます(図3)。マーキング中にシリカ層を乱さないでください。
- 100μM GM1、GD1aおよびGD1bのそれぞれ50μMおよびGT1bの33μMを含むメタノール中に純粋なガングリオシドの標準混合物を調製する。
注:この混合物は、4つのガングリオシドのそれぞれについて、1μLあたり100pmolのガングリオシドシアル酸を含み、これはシアル酸依存性であるレゾルシノール染色によって強い比色シグナルを提供する量である。
- クロロホルム-メタノール-0.25%KCl水溶液(体積比60:35:8)のランニング溶媒を調製する。溶剤の深さが〜0.5cmになるように、ステンレス製のカバーを備えた10cm x 10cmのガラスTLCチャンバーに注ぎます。気流のない場所で>10分間、カバーして平衡化させます。
- ガングリオシド解像度
- 10 μL のハミルトン シリンジを斜めの針でメタノールで洗浄します。1 μL のメタノールをガラスシリンジに引き込んで針のデッドボリュームを満たし、次に 1 μL のサンプルまたは標準液を満たします。シリンジに<1 μLの溶媒(メタノール)が残るまで、サンプルを5 mmのプレマークされたラインに均等に配置します。すべてのサンプルがスポットされた後、プレートを周囲温度(22°C)で乾燥させます。
注:サンプルローディングの間にシリンジをメタノールで洗浄してください。低に設定された非加熱送風機を使用して、乾燥を促進することができます。 - 点在して乾燥させたプレートを、下端をランニング溶剤に浸した状態で予め平衡化したTLCチャンバーに入れ、空気流から保護して覆います(図2)。溶媒前部がプレートの上部から1cm以内に達するまで、走っている溶媒が毛細管現象によってプレートを上方に前進させる。プレートの端にある溶剤の前面を取り除き、鉛筆で印を付けます。溶媒が邪魔されずに、または穏やかな空気の流れの下で完全に蒸発するのを許してください。
- 10 μL のハミルトン シリンジを斜めの針でメタノールで洗浄します。1 μL のメタノールをガラスシリンジに引き込んで針のデッドボリュームを満たし、次に 1 μL のサンプルまたは標準液を満たします。シリンジに<1 μLの溶媒(メタノール)が残るまで、サンプルを5 mmのプレマークされたラインに均等に配置します。すべてのサンプルがスポットされた後、プレートを周囲温度(22°C)で乾燥させます。

図2:ガングリオシドTLC機器とセットアップ ツイントラフチャンバーは、両側に0.5cm≈に充填され、ランニング溶剤で満たされます。プレートは、原点端がランニングバッファに浸漬された状態で片側に対して配置される。チャンバは、気流を避けるためにアクリルボックスで覆われています。パネルAは、プレート挿入前の側面図。溶媒レベルは、チャンバ底部から数mm上に見える。パネルB、開発中の正面図。溶剤前面は、プレートを上る道の約40%で見えます。 この図の拡大版を表示するには、ここをクリックしてください。
- ガングリオシド染色
警告: 試薬の汚れは有毒です。塩酸は腐食性で有毒です。保護手袋と安全ゴーグルを備えたヒュームフードに試薬を準備してスプレーします。
メモ:プレートは、定性的な画像分析のために画像化することも、クランプを取り外してカバープレートを透明なテープで所定の位置に固定して保管することもできます。定量分析は、隣接するレーンにスポットされたガングリオシド標準物質のデンシトメトリーを測定することによって行うことができる。- シアル酸に基づくガングリオシドの検出のためのレゾルシノールスプレー試薬を調製する。6gのレゾルシノールを100mLの水に溶解し、6%レゾルシノールストックとする。CuSO4 1 g を 100 mL の水に溶かし、1% のストックを作ります。64.7 mLの水に5 mLの6%レゾルシノールストック、0.31 mLの1% CuSO4 ストックを加え、濃縮HCl30 mLをゆっくりと加え、穏やかにかき混ぜる。4°Cで1ヶ月間保存してもよい。
- 化学ヒュームフードに、分解されたガングリオシドを含むTLCプレートを、フードの壁を酸スプレーから保護するために、切り取られた段ボール箱に入れます。レゾルシノール噴霧試薬をガラスTLC噴霧器に入れ、加圧窒素源に取り付け、プレートを垂直方向および水平方向に斜めに軽く噴霧する。TLC吸着剤表面を均一に、しかし軽くスプレーする。
- 直ちに同じ寸法の清潔な乾燥ガラス製カバープレートでプレートを覆い、バインダークリップでカバープレートを所定の位置に固定します(図3)。蓋付きプレートを125°Cで20分間加熱する。ガングリオシドは白い背景に対して濃い紫色に見えます。
メモ:スプレーが完了しても、プレートは濡れていないように見えるはずです。カバープレートは、シングルエッジカミソリの刃を使用して、以前に使用されたTLCプレートから吸着剤をこすり取ることによって製造することができる。
警告: シリカ粉末は肺に有毒です。マスクを使用し、密閉容器にシリカを廃棄してください。
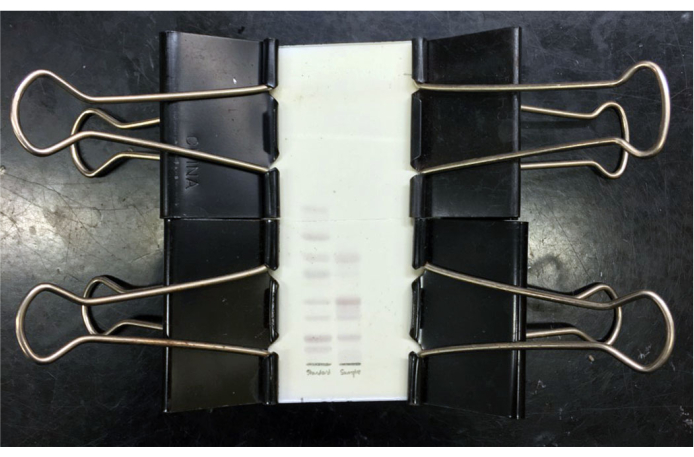
図3:分解された混合ガングリオシドのTLCプレート。 分解した混合ガングリオシ標準物質のTLCプレート(左レーン)および精製された混合ウシ灰白質ガングリオシド(右レーン)は、所定の位置にクリップしたガラスカバープレートでレゾルシノール染色および加熱を行った後である。標準的なガングリオシド(上から下)はGM3、GM2、GM1、GD3、GD1a、GD1b、GT1bおよびGQ1bである。冷却後、プレートを画像化したり、カバープレートを所定の位置にテープで固定したりして保管することができます。 この図の拡大版を表示するには、ここをクリックしてください。
- ガングリオシドおよびリン脂質に対する一般的な脂質染色。
警告: 硫酸は有毒で腐食性があります。エタノールへの濃酸の添加は発熱性であり、ゆっくりと行わなければならない。ヒュームフードに保護手袋と安全ゴーグルで染色試薬を準備します。- 500mLのエタノールに15mLの濃硫酸をゆっくりと加えて p-アニスアルデヒド染色剤を調製する。30分間攪拌して、溶液を冷却してから先に進む。15mLの p-アニスアルデヒドを加え、穏やかにかき混ぜる。これは、室温(22°C)で6ヶ月まで保存することができる。
- 化学ヒュームフードに、分解されたガングリオシド(起源の端が下がっているTLCプレート)を 、p-アニスアルデヒド染色を含むビーカーに浸します。ランニングフロントに2秒≥沈めます。汚れからTLCを取り除き、排水します。ホットプレート上のTLCプレートを低温で加熱して現像する。
注:脂質は紫色の背景に対して暗く表示されます。染色液は、繰り返し使用するために回収してもよい。
結果
セクション1(小規模)に記載された方法は、主要な脳ガングリオシドの定性的および定量的決定に十分な量および純度でガングリオシドを提供する。マウス脳からの回収率は、記載されたように調製した場合、脳湿重量gあたり〜1μmolガングリオシド(1nmol/μL)である。セクション3を用いた1 μL(1 nmol)のTLC分解能は、レゾルシノール検出のための十分な材料を提供し、 図4に野...
ディスカッション
ここで報告された小規模および大規模のガングリオシドの抽出および単離の方法は、独自のものではなく、優れた結果を提供する多くの異なる溶媒抽出および精製アプローチがあります12。FredmanとSvennerholm13からの脳からの小規模精製のためにここで報告された方法は、回復を最適化することが示され、私たちの研究室で長年にわたって堅牢で簡単であるこ...
開示事項
著者らは競合する利害関係を主張していない。
謝辞
この研究は、米国国立衛生研究所(NIH)の共通基金(Common Fund for Glycoscience)助成金U01CA241953の支援を受けた。MJPは、ジョンズ・ホプキンス大学の化学-生物学界面プログラム(T32GM080189)の支援を受けた。
資料
| Name | Company | Catalog Number | Comments |
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe - Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe - Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
参考文献
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved