É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Extração de ganglioside, purificação e perfil
Neste Artigo
Resumo
Gangliosides são glicósfoliópidos portadores de ácido sálico que são particularmente abundantes no cérebro. Sua natureza anfíppática requer técnicas orgânicas/aquosas de extração e purificação para garantir uma recuperação ideal e análises precisas. Este artigo fornece visões gerais da extração de ganglioside em escala analítica e preparatória, purificação e análise de cromatografia de camada fina.
Resumo
Gangliosides são glicosfingolipidos que contêm um ou mais resíduos de ácido sálico. Eles são encontrados em todas as células vertebrados e tecidos, mas são especialmente abundantes no cérebro. Expressos principalmente no folheto externo das membranas plasmáticas das células, eles modulam as atividades das proteínas da superfície celular via associação lateral, atuam como receptores nas interações células-células e são alvos de patógenos e toxinas. A desregulação genética da biossíntese ganglioside em humanos resulta em graves distúrbios do sistema nervoso congênito. Devido à sua natureza anfípppica, a extração, a purificação e a análise de gangliosides exigem técnicas que foram otimizadas por muitos investigadores nos 80 anos desde sua descoberta. Aqui, descrevemos métodos de nível de bancada para a extração, purificação e análises qualitativas e quantitativas preliminares de grandes gangliosides de tecidos e células que podem ser completadas em poucas horas. Também descrevemos métodos para isolamento em maior escala e purificação de grandes espécies de ganglioside do cérebro. Juntos, esses métodos proporcionam acesso analítico e de escala preparatória a essa classe de moléculas bioativas.
Introdução
Os gangliosides são definidos como glicosfingolipids com um ou mais resíduos de ácido sálico1. Eles são expressos principalmente na superfície celular com sua moiety lipídica de ceramida hidrofóbica incorporada no folheto externo da membrana plasmática e seus glicanos hidrofílicos estendendo-se para o espaço extracelular2. Embora amplamente distribuídas em células vertebradas e tecidos, elas são particularmente abundantes no cérebro vertebrado3, onde foram descobertos pela primeira vez e nomeados4.
As estruturas dos glicanos gangliosas variam e são a base para sua nomenclatura (Figura 1). Os glicanos ganglios são compostos por um núcleo de açúcar neutro com diferentes números e distribuições de ácidos sálicos. O menor ganglioside, GM4, tem apenas dois açúcares (ácido sálico ligado à galactose)5. Gangliosides maiores e naturais podem conter bem mais de uma dúzia de açúcares totais6 ou até sete ácidos sálicos em um único núcleo neutro7. Seus moieties lipídios de ceramida também variam, tendo diferentes comprimentos de sphingosina e uma variedade de amides de ácido graxo. No cérebro vertebrado predominam quatro espécies de ganglioside, GM1, GD1a, GD1b e GT1b. A expressão ganglioside é regulada pelo desenvolvimento, específica do tecido e tipo celular específico.

Figura 1: Grandes gângsteres cerebrais e seus precursores biossintéticos. As estruturas são mostradas usando a nomenclatura de símbolos para Glycans11. Clique aqui para ver uma versão maior desta figura.
Os ganglios funcionam no nível molecular ao engajar e modular proteínas em suas próprias membranas (regulação cis) ou por envolver proteínas de ligação glica no meio extracelular, incluindo toxinas bacterianas e lectinas em outras células (reconhecimento trans)3. A ligação específica de gangliosides a proteínas regulatórias e/ou auto-associação com outras moléculas em vigas lipídicas resulta em mudanças no comportamento celular que impactam a estrutura e função do sistema nervoso, progressão do câncer, metabolismo, inflamação, proteinopatias neuronais e doenças infecciosas8. Devido às suas diversas funções celulares, os métodos para seu isolamento e análise podem fornecer insights aprimorados sobre a regulação dos processos fisiológicos e patológicos. Aqui, são fornecidos métodos validados para extração e análise rápida em pequena escala e isolamento em escala preparatória de gangliosides do cérebro. São discutidas oportunidades e desafios para a aplicação a outros tecidos.
Protocolo
A coleta de tecidos foi realizada em condições autorizadas pelo Comitê de Uso e Cuidados e Uso de Animais johns Hopkins.
1. Extração de ganglioside em pequena escala e purificação parcial
ATENÇÃO: Tenha ventilação adequada ao trabalhar com solventes voláteis e tóxicos. Evite o plástico por toda parte; solventes extrairão componentes químicos de muitos plásticos que interferem com análises subsequentes. Politetrafluoroetileno (PTFE) é uma exceção; Os fechamentos alinhados ao PTFE devem ser usados para tampar frascos de armazenamento de vidro.
- Extração
- Pesar um único cérebro de rato fresco ou descongelado (ou meio-cérebro sagital, ~ 0,2-0,5 g) e coloque em um homogeneizador Potter-Elvehjem pré-edetado em um balde de gelo.
NOTA: Cérebros previamente congelados podem ser usados após o descongelamento a 0-4 °C. - Adicione 4,1 mL por g de tecido molhado peso de água e homogeneize com 10 tacadas.
NOTA: As razões precisas de solventes são fundamentais para a extração e partição ideais, o objetivo é clorofórmio-metanol-aquoso (4:8:3) assumindo que o tecido cerebral é 80% aquoso. - Adicione 13 mL por g de tecido úmido de metanol, mude para temperatura ambiente (22 °C) e misture.
NOTA: A solução parecerá nublada. A adição de metanol nesta etapa, sem clorofórmio, otimiza a precipitação proteica. Todas as etapas subsequentes estão em temperatura ambiente (22 °C). - Transfira para um tubo de vidro de parede grossa com uma tampa de parafuso forrada com PTFE a temperatura ambiente (22 °C) e misture bem. Adicione 6,5 mL por g de tecido úmido peso de clorofórmio, tampa e misture bem. Centrifugar a 450 x g por 15 min. Transfira o supernatante claro para um tubo fresco com tampa de parafuso e meça o volume de "volume de extrato recuperado".
- Pesar um único cérebro de rato fresco ou descongelado (ou meio-cérebro sagital, ~ 0,2-0,5 g) e coloque em um homogeneizador Potter-Elvehjem pré-edetado em um balde de gelo.
- Partição
- Adicione 0,173x "volume de extrato recuperado" de água ao supernanato claro, tampa, vórtice vigorosamente e centrífuga, conforme descrito na etapa 1.1.4.
NOTA: O objetivo é ter clorofórmio-metanol-aquoso na razão 4:8:5.6. A mistura será nublada e se resolverá em duas fases: uma fase superior rica em aquoso e uma fase inferior rica em clorofórmio na proporção ~ 4:1. Aguarde 60 min ou centrífuga a 450 x g por 15 min para separação completa da fase. - Transfira a fase superior, que contém os gangliosides, em um tubo de vidro fresco com uma tampa de parafuso forrada com PTFE.
- Adicione 0,173x "volume de extrato recuperado" de água ao supernanato claro, tampa, vórtice vigorosamente e centrífuga, conforme descrito na etapa 1.1.4.
- Cromatografia do cartucho de fase inversa
- Utilizando uma seringa de vidro de 5 mL, lave um cartucho de extração de fase sólida tC18 (400 mgs) com 3 mL de metanol, depois 3 mL de clorofórmio-metanol-água (2:43:55). Carregue a fase superior da etapa 1.2.2 para o cartucho tC18 usando a mesma seringa de vidro, colete o fluxo-through e recarregue-o na coluna para otimizar a adsorção.
- Usando a seringa de vidro, lave o cartucho com 3 mL de clorofórmio-metanol-água (2:43:55) e 3 mL de água metanol (1:1).
- Elute os gangliosides com 3 mL de metanol em um tubo fresco com tampa de parafuso. Evaporar até a secura sob um fluxo suave de nitrogênio a ≤ 45 °C. Dissolva-se em metanol a 1 mL por g de peso molhado de tecido original.
2. Extração e purificação de ganglioside em larga escala
ATENÇÃO: Ao trabalhar com solventes voláteis, use liquidificadores resistentes a explosão. Não use plásticos, exceto PTFE. Tetrahidrofuran, clorofórmio e éter etílico são compostos orgânicos tóxicos voláteis. Trabalhe em um capô de fumaça com luvas de proteção e óculos de segurança.
- Extração
- Descongele o cérebro bovino congelado a 4 °C por várias horas. Dissecar a matéria cinzenta de meninges e matéria branca.
NOTA: O procedimento a seguir é descrito por 100 ± 20 g de matéria cinzenta cerebral isolada e é escalável. - Coloque 100 g de matéria cinzenta cerebral em um liquidificador e adicione 1 mL por g de peso úmido cerebral de 10 mM tampão de fosfato de potássio pH 6.8. Homogeneize em baixo para 20 s. Adicione 8 mL de tetrahidrofuran por g de peso molhado cerebral e homogeneize em baixo por 10 s. Decante em garrafas de centrífuga de vidro e centrífuga a 5.000 x g por 15 min a temperatura ambiente (22 °C).
- Colete o supernatante, meça seu volume e transfira para um funil separador de vidro. Adicione 0,3 mL de éter etílico por mL do supernante. Agite vigorosamente, depois deixe descansar por 30 minutos durante os quais duas fases, uma fase superior do éter e uma fase aquosa inferior, se separam. Colete a fase inferior, que contém os gangliosides, em uma garrafa de vidro com uma tampa alinhada com PTFE.
- À fase superior (éter) restante no funil separador, adicione 0,1 mL de água por mL de supernante original (passo 2.1.3). Agite vigorosamente, permita que as fases se separem, colete a fase inferior (aquosa) e combine com a fase inferior anterior. Evaporar as fases inferiores combinadas para um pó seco e pesar.
- Descongele o cérebro bovino congelado a 4 °C por várias horas. Dissecar a matéria cinzenta de meninges e matéria branca.
- Saponificação
- Adicione 10 mL de 100 mM aquoso NaOH por g em pó em um tubo selado. Misture e incubar a 37 °C por 3 h. Deixe esfriar e ajustar ao pH 4.5 pela adição dropwise de 100 mM HCl. Meça o volume e transfira para um funil separador de vidro.
NOTA: Os ácidos sálicos são labile ácido; evitar a acidificação abaixo do pH 4.5. - Com base no volume aquoso, adicione 2,67 volumes de metanol, misture suavemente e adicione 1,33 volumes de clorofórmio para criar uma solução monárquica de clorofórmio-metanol-aquoso (4:8:3). Misture bem.
- Com base no volume aquoso original, adicione 2,6 volumes de água para levar a mistura ao clorofórmio-metanol-aquoso a uma razão de 4:8:5.6. Agite vigorosamente, então deixe sentar-se imperturbável para separar duas fases, uma fase superior polar contendo os gangliosides e uma fase inferior não polar. Colete a fase superior em uma garrafa de vidro com uma tampa forrada com PTFE.
NOTA: Lipídios não sialados não aparecerão em placas de cromatografia de camada fina (TLC) manchadas usando resorcinol, mas aparecerão ao usar uma mancha de p-anisaldeído. O objetivo desta saponificação é remover os compostos o-acetilados, como fosfolipídios.
- Adicione 10 mL de 100 mM aquoso NaOH por g em pó em um tubo selado. Misture e incubar a 37 °C por 3 h. Deixe esfriar e ajustar ao pH 4.5 pela adição dropwise de 100 mM HCl. Meça o volume e transfira para um funil separador de vidro.
- Cromatografia de fase inversa
- Pré-lave um cartucho de extração de fase sólida tC18 em grande escala (10 g) tC18 passando 50 mL de cada um dos três solventes a seguir através da coluna usando vácuo ou pressão (<1 min cada lavagem): metanol, água metanol (1:1), depois clorofórmio-metanol-água (2:43:55). Carregue a fase superior da etapa 2.2.3 para a coluna por vácuo ou pressão, colete o fluxo através, recarregue e colete o fluxo através.
- Lave a coluna com 30 mL de clorofórmio-metanol-água (2:43:55), depois 30 mL de metanol-água (1:1), depois elute os gangliosides com 50 mL de metanol, e novamente com 10 mL de metanol, coletando cada lavagem e cada eluição separadamente. O uso do TLC (abaixo) confirma que o ganglioside está ausente do fluxo através e lava e eluindo na primeira elução (50 mL de metanol). Evaporar os gângsteres elucidos para um pó seco e pesar.
NOTA: O objetivo da cromatografia tC18 é separar os gangliosides de contaminantes cada vez mais polares. Rendimento de ganglioside cerebral misto após a saponificação é ~ 120 mg por g extrato cerebral seco (passo 2.1.4). A aparência de gangliosides por TLC no fluxo através ou lava-se indica que a coluna de extração de fase sólida estava saturada. Após a elução do metanol, a coluna pode ser ainda mais elucidada com clorofórmio-metanol (1:1) para capturar lipídios menos polares.
- Purificação do HPLC de gangliosides individuais
- Prepare o solvente HPLC A: acetonitrilo-5 mM tampão de fosfato de sódio aquoso pH 5.6 (83:17) e Solvente B: acetonitrilo-20 mM tampão fosfato de sódio, pH 5.6 (1:1). Degas ambos solventes por 5 minutos.
- Pré-equilibre uma coluna HPLC (coluna de 20 x 250 mm embalada com esferas de sílica amina (NH2), 5 μm de diâmetro, 100 tamanho poros Å) com 100% solvente A por 20 min a 5 mL/min. Defina um detector de efluentes da coluna UV HPLC a 215 nm.
- Dissolva o pó de ganglioside da fase inversa eluia na água a 5 mg/mL. Injete 0,5 mL da mistura de ganglioside no HPLC e execute o gradiente de solvente (Tabela 1) a 5 mL/min, coletando frações. Gangliosides aparecerá como picos A215 com tempos de retenção (principais gangliosides cerebrais) de 25-70 min: GM1 ≈ 28 min; GD1a ≈ 38 min; GD1b ≈ 46 min; GT1b ≈ 65 min. Ree equilibre 20 min com Solvente A após cada execução. Analise frações por cromatografia de camada fina.
| Tempo (min) | %A | %B |
| 0 | 100 | 0 |
| 7 | 100 | 0 |
| 12 | 63 | 37 |
| 82 | 54 | 46 |
| 82.01 | 0 | 100 |
| 92 | 0 | 100 |
Tabela 1: Gradiente de solvente para HPLC.
3. Análise de cromatografia de camada fina (TLC) de gangliosides
ATENÇÃO: O clorofórmio é um composto orgânico tóxico e volátil. Trabalhe em um capô de fumaça com luvas de proteção e óculos de segurança.
- Preparação de solvente e placa TLC em execução
- Prepare um solvente em funcionamento de clorofórmio-metanol-aquoso 0,25% KCl (60:35:8 em volume). Despeje em uma câmara TLC de vidro de 10 cm x 10 cm com uma tampa de aço inoxidável para que a profundidade do solvente seja de ~ 0,5 cm. Cubra e deixe equilibrar em uma área livre de correntes de ar por >10 min.
NOTA:Para isolar a câmara TLC das correntes de ar, uma caixa acrílica de 5 lados pode ser construída ou comprada (Figura 2). Não use papel filtro saturado de solvente dentro da câmara. - Coloque uma placa TLC de 10 cm x 10 cm ou 5 cm x 10 cm revestida de gel de sílica revestida de vidro em forno de secagem a 125 °C por 10 minutos. Deixe esfriar. Use um lápis embotado #2 para desenhar linhas de manchas de 5 mm com separações de 2 mm ao longo de uma linha 1 cm acima do fundo da placa e pelo menos 1 cm de cada lado (Figura 3). Evite perturbar a camada de sílica durante a marcação.
- Prepare uma mistura padrão de gangliodouros puros em metanol contendo 100 μM GM1, 50 μM cada um de GD1a e GD1b e 33 μM de GT1b.
NOTA: Esta mistura contém 100 pmol de ácido sálico ganglioside por μL para cada um dos quatro gânglios, uma quantidade que fornece um forte sinal colorimétrico por coloração resorcinol, que é dependente de ácido sálico.
- Prepare um solvente em funcionamento de clorofórmio-metanol-aquoso 0,25% KCl (60:35:8 em volume). Despeje em uma câmara TLC de vidro de 10 cm x 10 cm com uma tampa de aço inoxidável para que a profundidade do solvente seja de ~ 0,5 cm. Cubra e deixe equilibrar em uma área livre de correntes de ar por >10 min.
- Resolução ganglioside
- Lave uma seringa Hamilton de 10 μL com uma agulha chanfrada com metanol. Desenhe 1 μL de metanol em uma seringa de vidro para encher o volume morto da agulha e, em seguida, 1 μL de amostra ou padrão. Localizá-lo uniformemente nas linhas pré-marcadas de 5 mm até que < 1 μL de solvente (metanol) permaneça na seringa. Deixe a placa secar à temperatura ambiente (22 °C) depois que todas as amostras forem avistadas.
NOTA: Lave a seringa com metanol entre o carregamento da amostra. Um soprador de ar não aquecido em baixo pode ser usado para acelerar a secagem. - Coloque a placa manchada e seca na câmara TLC pré-aquilibrada com a borda inferior imersa no solvente em funcionamento e cubra e proteja das correntes de ar (Figura 2). Deixe que o solvente em execução avance pela placa por ação capilar até que a frente do solvente atinja dentro de 1 cm da parte superior da placa. Retire e marque a frente do solvente na borda da placa com um lápis. Permita que os solventes evaporem completamente imperturbáveis ou sob fluxo de ar suave.
- Lave uma seringa Hamilton de 10 μL com uma agulha chanfrada com metanol. Desenhe 1 μL de metanol em uma seringa de vidro para encher o volume morto da agulha e, em seguida, 1 μL de amostra ou padrão. Localizá-lo uniformemente nas linhas pré-marcadas de 5 mm até que < 1 μL de solvente (metanol) permaneça na seringa. Deixe a placa secar à temperatura ambiente (22 °C) depois que todas as amostras forem avistadas.

Figura 2: Equipamento TLC ganglioside e configuração. Uma câmara de cocho duplo é preenchida para ≈ 0,5 cm em ambos os lados com solvente em funcionamento. A placa é colocada contra um lado com a extremidade de origem imersa no buffer de execução. A câmara é coberta com uma caixa de acrílico para evitar correntes de ar. Painel A, vista lateral antes da inserção da placa. O nível do solvente é visível alguns mm acima do fundo da câmara; Painel B, visão frontal durante o desenvolvimento. A frente do solvente é visível em cerca de 40% do caminho até a placa. Clique aqui para ver uma versão maior desta figura.
- Coloração de ganglioside
ATENÇÃO: As manchas de reagente são tóxicas. O ácido clorídrico é corrosivo e tóxico. Prepare e pulverize reagentes em um capô de fumaça com luvas de proteção e óculos de segurança.
NOTA: A placa pode ser imageada para análise de imagem qualitativa ou armazenada removendo os grampos e fixando a placa de cobertura no lugar com fita clara. A análise quantitativa pode ser realizada medindo a densitometria dos padrões de ganglioside vistos em pistas adjacentes.- Prepare o reagente de spray de resorcinol para a detecção de gangliosides com base em seus ácidos sálicos. Dissolva 6 g de resorcinol em 100 mL de água para um estoque resorcinol de 6%. Dissolva 1 g de CuSO4 em 100 mL de água para fazer um estoque de 1%. A 64,7 mL de água adicione 5 mL do estoque resorcinol de 6%, 0,31 mL do estoque cuso4 de 1% e adicione lentamente 30 mL de HCl concentrado e mexa suavemente. Pode ser armazenado a 4 °C por um mês.
- Em um capô de fumaça química, coloque a placa TLC com gangliosides resolvidos, a origem acaba, em uma caixa de papelão cortada para proteger as paredes do capô do spray ácido. Coloque o reagente de spray de resorcinol em um pulverizador TLC de vidro, conecte-se a uma fonte de nitrogênio pressurizado e pulverize levemente a placa diagonalmente nas direções vertical e horizontal. Pulverize a superfície sorbent TLC uniformemente, mas levemente.
- Cubra imediatamente a placa com uma placa de cobertura de vidro seco e limpa das mesmas dimensões e fixe a placa de cobertura no lugar com clipes de aglutinante (Figura 3). Aqueça a placa coberta a 125 °C por 20 minutos. Gangliosides aparecerá roxo escuro contra um fundo branco.
NOTA: A placa não deve parecer molhada quando a pulverização estiver completa. As placas de cobertura podem ser feitas raspando o sorbent de placas TLC usadas anteriormente usando uma lâmina de barbear de borda única.
ATENÇÃO: O pó de sílica é tóxico para os pulmões. Use uma máscara e descarte a sílica em um recipiente selado.
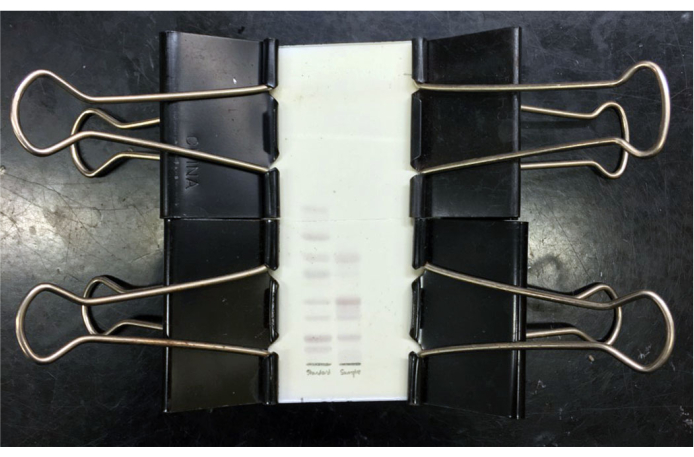
Figura 3: placa TLC de ganglioside misturado resolvido. Placa TLC de padrões de ganglioside misto resolvidos (faixa esquerda) e gangliosides de matéria cinzenta bovina purificada (faixa direita) após coloração e aquecimento resorcinol com placa de tampa de vidro cortada no lugar. Os gangliosides padrão (de cima para baixo) são GM3, GM2, GM1, GD3, GD1a, GD1b, GT1b e GQ1b. Após o resfriamento, a placa pode ser imageada e/ou a placa de cobertura colada no lugar para armazenamento. Clique aqui para ver uma versão maior desta figura.
- Mancha labial geral para gangliosides e fosfolipídios.
ATENÇÃO: O ácido sulfúrico é tóxico e corrosivo. A adição de ácido concentrado ao etanol é exotérmica e deve ser feita lentamente. Prepare o reagente de coloração em um capô de fumaça com luvas de proteção e óculos de segurança.- Prepare a mancha de p-anisaldeído adicionando lentamente 15 mL de ácido sulfúrico concentrado a 500 mL de etanol. Mexa por 30 minutos para permitir que a solução esfrie antes de prosseguir. Adicione 15 mL p-anisaldeído e mexa delicadamente. Isso pode ser armazenado em temperatura ambiente (22 °C) até seis meses.
- Em um capô de fumaça química, mergulhe a placa TLC com gangliosides resolvidos, a origem acabe para baixo, em um béquer contendo a mancha de p-anisaldeído. Submerso para a frente de corrida para ≥ 2 s. Remova o TLC da mancha e deixe drenar. Aqueça a placa TLC em uma placa quente a baixa temperatura para se desenvolver.
NOTA: Os lipídios aparecerão escuros contra um fundo roxo. A solução de coloração pode ser recuperada para uso repetido.
Resultados
Os métodos descritos na seção 1 (pequena escala) fornecem gangliosides em quantidade e pureza suficientes para a determinação qualitativa e quantitativa de grandes lesões cerebrais. A recuperação do cérebro do camundongo é ~ 1 μmol ganglioside por g peso molhado cerebral (1 nmol/μL) quando preparado como descrito. A resolução TLC de 1 μL (1 nmol) usando a seção 3 fornece material amplo para detecção de resorcinol e resolve todos os principais gangliodolos cerebrais como mostrado para o tipo selvagem e ...
Discussão
Os métodos de extração e isolamento de ganglioside de pequeno e grande porte relatados aqui não são únicos - existem muitas abordagens diferentes de extração e purificação de solventes que fornecem excelentes resultados12. Os métodos relatados aqui para purificação em pequena escala do cérebro, de Fredman e Svennerholm13, mostraram-se para otimizar a recuperação e provaram ser robustos e diretos ao longo de muitos anos em nosso laboratório. O isolamento e p...
Divulgações
Os autores afirmam que não há interesses concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo Fundo Comum dos Institutos Nacionais de Saúde (NIH) para a concessão da Glicociência U01CA241953. O MJP foi apoiado pelo Programa de Interface Química-Biologia da Johns Hopkins (T32GM080189).
Materiais
| Name | Company | Catalog Number | Comments |
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe - Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe - Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
Referências
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler's Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados