Method Article
التجميد السريع باستخدام جهاز تجميد ساندويتش للحفاظ على البنية الفائقة جيدة من العينات البيولوجية في المجهر الإلكترون
In This Article
Summary
هنا نعرض كيفية استخدام جهاز تجميد شطيرة للتجميد السريع للعينات البيولوجية، بما في ذلك البكتيريا والخميرة والخلايا المستزرعة والخلايا المعزولة والأنسجة الحيوانية والبشرية، والفيروسات. كما نعرض كيفية إعداد العينات للقسمة فائقة بعد التجميد السريع.
Abstract
وقد استخدم التثبيت الكيميائي لمراقبة البنية الفوقية للخلايا والأنسجة. ومع ذلك، لا يحافظ هذا الأسلوب بشكل كاف على البنية الفوقية للخلايا؛ وعادة ما يلاحظ القطع الأثرية واستخراج محتويات الخلية. التجميد السريع هو بديل أفضل للحفاظ على بنية الخلية. وقد استخدمت تجميد شطيرة من الخميرة الحية أو البكتيريا تليها تجميد استبدال لمراقبة ultrastructure الطبيعية الرائعة من الخلايا. في الآونة الأخيرة ، تم استخدام تجميد ساندويتش الخلايا المستزرعة الثابتة بالجلوتارالدهيد أو الأنسجة البشرية للكشف عن البنية الفائقة للخلايا والأنسجة.
وقد أجريت هذه الدراسات حتى الآن باستخدام جهاز لتجميد السندويشات المصنوع يدويا، وكانت التطبيقات المقدمة للدراسات في مختبرات أخرى محدودة. وقد تم مؤخرا جهاز تجميد شطيرة جديدة ملفقة ومتاحة الآن تجاريا. وتبين هذه الورقة كيفية استخدام جهاز تجميد الساندويتشات للتجميد السريع للعينات البيولوجية، بما في ذلك البكتيريا والخميرة والخلايا المستزرعة والخلايا المعزولة والأنسجة الحيوانية والبشرية والفيروسات. كما يظهر إعداد عينات للتقطيع فائقة بعد التجميد السريع وإجراءات استبدال التجميد ، وتضمين الراتنج ، وتقليم الكتل ، وقطع الأجزاء فائقة التقنية ، واستعادة المقاطع ، والتلطيخ ، وتغطية الشبكات بأحلام الدعم.
Introduction
المجهر الإلكتروني هو أداة قوية لدراسة البنية الفوقية للخلايا. وقد استخدم التثبيت الكيميائي مع إجراءات الجفاف التقليدية لمراقبة البنية الفوقية للخلايا والأنسجة. ومع ذلك، لا تحافظ هذه الطريقة بشكل كاف على البنية الفوقية للخلايا، وعادة ما يتم ملاحظة القطع الأثرية واستخراج محتويات الخلية. التجميد السريع واستبدال تجميد الخلايا والأنسجة هي بدائل أفضل للحفاظ على بنية الخلية.
وقد استخدمت ثلاث طرق رئيسية لتجميد الخلايا بسرعة1: 1) يتم تنفيذ يغرق تجميد العينات في cryogen تبريد, مثل البروبان, واستخدمت منذ أوائل 1950s2; 2) يتم إجراء تجميد كتلة معدنية باردة من قبل الخلايا والأنسجة انتقد بسرعة على كتلة معدنية تبريدها مع النيتروجين السائل أو الهيليوم السائل3،4؛ و 3) ويتم تجميد الضغط العالي عن طريق تجميد الخلايا والأنسجة مع النيتروجين السائل تحت ضغط عال5،6،7.
تجميد الساندويتش هو نوع من تجميد الغطس الذي تقوم به sandwiching المواد البيولوجية رقيقة بين اثنين من الأقراص النحاس وتجميد بسرعة لهم عن طريق الغطس في البروبان السائل8،9،10. في هذه الطريقة ، يتم تبريد العينات الرقيقة جدا (سمكها بضعة ميكرومترات) بسرعة مع cryogen باستخدام معدن يحتوي على الموصلية الحرارية الجيدة من كلا الجانبين. وهكذا، فإن هذه الطريقة تزيل الحرارة بشكل فعال من العينات، مما يجعل من الممكن تجميد الخلايا بشكل ثابت دون تلف بلوري جليدي. تجميد الشطائر، يليه تجميد استبدال الخميرة الحية والخلايا البكتيرية، ويكشف عن البنية الفائقة الطبيعية للخلايا10،11،12،13،14،15،16.
في الآونة الأخيرة، تم العثور على هذه الطريقة لتكون مفيدة للحفاظ على صور الخلايا واضحة من الكائنات الحية الدقيقة glutaraldehyde الثابتة17،18،19،20،21،22،23،24، الخلايا المستزرعة25،26،27، والخلايا والأنسجة البشرية1،28 . على الرغم من أن هذه الدراسات قد أجريت باستخدام جهاز تجميد شطيرة مصنوعةيدويا 29، وكانت التطبيقات لدراسات أخرى في مختبرات أخرى محدودة ، فقد تم تصنيع جهاز تجميد ساندويتش جديد (SFD)28 وهو متاح الآن تجاريا.
وتبين هذه الورقة كيفية استخدام SFD للتجميد السريع للعينات البيولوجية، بما في ذلك البكتيريا والخميرة والخلايا المستزرعة والخلايا المعزولة والأنسجة الحيوانية والبشرية والفيروسات. كما يظهر إعداد عينات للتقطيع فائقة بعد التجميد السريع ، وكذلك إجراءات استبدال التجميد ، وتضمين الراتنج ، وتقليم الكتل ، وقطع الأجزاء فائقة التقنية ، واستعادة المقاطع ، والتلطيخ ، وتغطية الشبكات مع أفلام الدعم.
Protocol
ملاحظة: وافقت لجنة أخلاقيات البحوث الطبية الحيوية التابعة لكلية الدراسات العليا للطب، جامعة شيبا (3085) على بروتوكول الدراسة الخاص بالعينات البشرية. 2- إن التيتروكسيد أوزميوم مادة كيميائية خطيرة؛ وينبغي التعامل معها ارتداء قفازات في غطاء محرك السيارة الدخان. الشكل 1 يظهر جهاز تجميد شطيرة والأدوات اللازمة28. ويبين الشكل 2 المواد اللازمة لإجراء تجارب تجميد الشطائر. تمتلئ قارورة الزجاج مع الأسيتون التي تحتوي على tetroxide osmium والاحتفاظ بها في -80 درجة مئوية حتى الاستخدام (الشكل 2B). الأقراص النحاسية هي 3 ملم في القطر، مع عدم وجود ثقوب، لديها حرف على جانب واحد، وتتوفر تجاريا(الشكل 2C).
1. التجميد السريع لتعليق الخلايا من أجل استبدال التجميد
ملاحظة: يظهر الإجراء بأكمله في الشكل 3.
- خلايا
- استخدام تعليق الخلية من البكتيريا والخميرة (الشكل 2A)، والخلايا المستزرعة، والخلايا المعزولة لتجميد شطيرة.
ملاحظة: يمكن استخدام كل من الخلايا الحية والغلوتارالدهيد الثابتة28.
- استخدام تعليق الخلية من البكتيريا والخميرة (الشكل 2A)، والخلايا المستزرعة، والخلايا المعزولة لتجميد شطيرة.
- إعداد البروبان السائل
ملاحظة: استخدام cryogloves ونظارات واقية عند التعامل مع النيتروجين السائل. وبما أن البروبان متفجر، ينبغي الحرص على عدم استخدام الحرائق في نفس الغرفة، وينبغي إبقاء النوافذ مفتوحة.- ملء حاوية النيتروجين السائل من SFD مع النيتروجين السائل (الشكل 4A). ملء حاوية البروبان السائل مع البروبان السائل عن طريق إدخال غاز البروبان باستخدام فوهة غرامة (الشكل 4B، C). تسريع تماسك البروبان باستخدام شريط معدني تبريد (الشكل 1 والشكل 4D، ه).
- إعداد أقراص النحاس
- وضع أقراص النحاس على زجاج الشريحة مع عدم وجود حرف الجانب لأعلى (الشكل 2D) وعلاج مع توهج التفريغ في 10 السلطة الفلسطينية، 400 فولت، 1 مأ لمدة 30 ق (الشكل 4F،G) لجعل سطح القرص hydrophilic باستخدام جهاز بصق أيون30.
- شطيرة وتجميد يغرق من تعليق الخلية
- نقل تعليق الخلية إلى أنبوب الطرد المركزي 2 مل (الشكل 5A) والطرد المركزي في 2,900 × غرام لمدة 10 ق في درجة حرارة الغرفة (الشكل 5B, C). إزالة supernatant، وتعليق بيليه للحصول على تعليق سميكة (انظر المناقشة).
- ضع كمية صغيرة من تعليق الخلية (~ 0.02 ميكرولتر) على قرص نحاسي(الشكل 5D-F)،قم بتغطيتها بقرص نحاسي آخر(الشكل 5G)،والتقط الأقراص باستخدام ملاقط(الشكل 5H).
ملاحظة: لقياس ~ 0.02 ميكرولتر من تعليق الخلية، لاحظ 0.1 قطرات μL من التعليق تحت المنظار المجسم وتقسيمها إلى قطرات التي هي1/5th من هذا الحجم. - جعل بئر في وسط البروبان الصلبة مع شريط معدني رقيقة (الشكل 5I). تعيين ملاقط في SFD وتجميدها بسرعة عن طريق الضغط على زر الحقن للجهاز (الشكل 5J، ك).
ملاحظة: يجب الحرص على عدم تجفيف العينات وعدم وضع القرصين تماما فوق بعضهما البعض (وإلا، فإن فصلها سيصبح صعبا جدا في الخطوة التالية).
- شطيرة وتجميد الأنسجة الحيوانية والبشرية
- استخدام الأنسجة الحيوانية والبشرية (~ 0.5 مم × 0.5 مم × 1.5 مم) ثابتة في 2.5٪ غلوتارالدهيد-0.1 متر عازل فوسفات (الرقم الحموضة 7.4) (الشكل 6A، B). شريحة لهم في 0.1- إلى 0.2- مقطع سميك مم مع شفرة حلاقة تحت مجسم(الشكل 6C,D).
- ضع قطرة صغيرة (~ 0.02 ميكرولتر) من محلول الجلوتارالدهيد على قرص نحاسي(الشكل 6E، F). ثم استخدم الملاقط لوضع قطعة من الأنسجة في الجلوتارالدهيد على القرص النحاسي(الشكل 6G، H) وتغطيتها بقرص نحاسي آخر(الشكل 6I-K).
- تجميد بسرعة الأقراص مع الأنسجة في البروبان ذوبان SFD، كما هو موضح في القسم 1.4(الشكل 5J،K).
ملاحظة: كما glutaraldehyde مادة كيميائية خطيرة، ينبغي التعامل معها ارتداء قفازات في غطاء محرك السيارة الدخان. لا ينبغي غسل الأنسجة مع المخازن المؤقتة عند وضعها على قرص نحاسي ولكن أبقى غارقة في محلول الجلوتارالدهيد لأن الجلوتارالدهيد له تأثير مضادللتجميد 1.
- استخدام الأنسجة الحيوانية والبشرية (~ 0.5 مم × 0.5 مم × 1.5 مم) ثابتة في 2.5٪ غلوتارالدهيد-0.1 متر عازل فوسفات (الرقم الحموضة 7.4) (الشكل 6A، B). شريحة لهم في 0.1- إلى 0.2- مقطع سميك مم مع شفرة حلاقة تحت مجسم(الشكل 6C,D).
- تجميد استبدال مع أسيتون أوسميوم
- نقل الأقراص إلى النيتروجين السائل في حمام عمل (الشكل 7A، ب). باستخدام زوج من ملاقط تبريد في النيتروجين السائل، فصل الأقراص من بعضها البعض لفضح العينة (الشكل 7C-E).
- ضع الأقراص مع الخلايا في قارورة زجاجية(الشكل 7F)التي تمتلئ 1 مل من الأسيتون تحتوي على 2٪ من التيتروكسيد osmium (الشكل 2B) التي تم وضعها في النيتروجين السائل وseded (الشكل 4H).
- نقل الأقراص إلى الفريزر العميق والاحتفاظ بها في -80 درجة مئوية لمدة 2-4 أيام لتجميد استبدال الخلايا (الشكل 3). نقع ملاقط المستخدمة في الماء في درجة حرارة الغرفة لتدفئتها (الشكل 7G) لتجميد العينات التالية.
ملاحظة: يجب أن تكون ملاقط للتعامل مع العينة دافئة (درجة حرارة الغرفة) لأن الملاقط الباردة قد تجمد العينة قبل التجميد السريع ، مما يؤدي إلى تكوين بلورات الثلج.
- عينة الاحترار والتضمين
- جلب تدريجيا العينات إلى درجة حرارة الغرفة (2 ساعة في -20 درجة مئوية، 2 ساعة في 4 درجة مئوية، و 15 دقيقة في درجة حرارة الغرفة، الشكل 3 والشكل 8A)،ونقل الأقراص إلى أنابيب بلاستيكية 2 مل التي تمتلئ 1 مل من الأسيتون (الشكل 3 والشكل 8B، C).
- إعداد راتنج الايبوكسي عن طريق خلط الكواشف في حاوية بلاستيكية يمكن التخلص منها باستخدام ستيرر(الشكل 8D-F).
- تبادل الأسيتون في الخطوة 1.7.1 على التوالي مع 30٪ الراتنج (في الأسيتون)، 60٪ الراتنج، و 90٪ الراتنج في درجة حرارة الغرفة لمدة 1 ساعة لكل منهما. ثم تبادل الراتنج 90٪ مع 100٪ الراتنج في 37°C بين عشية وضحاها. وأخيرا، تضمين العينات في راتنج 100٪ (الشكل 8G-J) في قالب تضمين السيليكون، وبوليمرة لهم في 60 درجة مئوية لمدة 24 ساعة (الشكل 3).
ملاحظة: يجب أن تظل العينات متصلة بالأقراص النحاسية طوال الإجراء بأكمله (لتسهيل عملية القسمة). لا ينصح باستخدام جهاز دوار أو اهتزاز أثناء عملية التضمين لأنها تساهم قليلا في اختراق الراتنج في الخلية. وعلاوة على ذلك، فإن الاهتزاز من الجهاز يؤدي في بعض الأحيان العينات لفصل من الأقراص النحاسية. الحضانة في 37 درجة مئوية بين عشية وضحاها من شأنه أن يسرع اختراق الراتنج في الخلية بسبب الطاقة الحرارية (الراتنج لن يبوليمر لأنه لا يحتوي على أي مسرع).
- تقليم كتل العينة
- إخراج كتل بلمرة من قوالب تضمين السيليكون (الشكل 9A). اكتب رقم العينة على الكتلة (الشكل 9B).
- إزالة أقراص النحاس من كتلة مع شفرة حلاقة (الشكل 9C، D) وتقليم العينات جزءا لا يتجزأ من سطح الكتلة إلى 0.7 ملم × 0.7 ملم باستخدام شفرة التشذيب بالموجات فوق الصوتية ( الشكل9E) وشفرات الحلاقة (الشكل 9F-H) تحت مجسم31.
- تعيين كتلة في حامل عينة من ultramicrotome (الشكل 9I) وقطع وجه كتلة بسلاسة مع سكين تقليم الماس (الشكل 9J، ك).
- قطع أقسام فائقة النحافة
- إزالة كتلة من ultramicrotome (الشكل 10A)31، تعيينها في مجسم ، وتقليم مزيد من 0.2 ملم × 0.3 ملم مع شفرة حلاقة (الشكل 10B، C).
- تطبيق النيوبرين على الشبكات لجعلها لاصقة (الشكل 10D). تعيين كتلة مرة أخرى على ultramicrotome، وتغطية ultramicrotome مع غطاء من البلاستيك (الشكل 10E)31، وقطع 50-70 نانومتر سميكة أقسام (الشكل 10F-H).
- استرداد المقاطع باستخدام حلقة (الشكل 10I)، جبل لهم على 300 أو 400 شبكات النحاس شبكة تعامل مع النيوبرين، وتجفيفها (الشكل 10J).
- تلطيخ المقاطع والمراقبة تحت المجهر الإلكتروني
- تعيين الشبكات مع أقسام في الأخدود من أنبوب سيليكون نصف (الشكل 11A)31، ونقع في محلول خلات أورانيل والرصاص سيترات لمدة 3 دقائق لكل لتلطيخ (الشكل 11B-E)32.
- للخميرة والعينات الفطرية، ووضع الشبكات على ورقة تصفية (4 ملم × 4 ملم)، والتقاطها مع ملاقط، وتغطيتها مع البلازما البوليمرات النفثالين فيلم33 على سطح الماء (الشكل 11F،G). إدراج الشبكات في المجهر الإلكتروني ومراقبة في 100 كيلو فولت (الشكل 11H، I).
2. التجميد السريع للفيروسات والجزيئات الكلية
- إعداد الإيثان السائل
ملاحظة: استخدام cryogloves ونظارات واقية عند التعامل مع النيتروجين السائل. وبما أن الإيثان متفجر، ينبغي الحرص على عدم استخدام الحرائق في نفس الغرفة، وينبغي إبقاء النوافذ مفتوحة. يستخدم الإيثان لأنه يتبخر في المجهر الإلكتروني في حين أن البروبان لا يفعل ذلك.- ملء حاوية النيتروجين السائل من SFD مع النيتروجين السائل. ملء حاوية الإيثان السائل مع الإيثان السائل عن طريق إدخال غاز الإيثان من خلال فوهة غرامة.
- إعداد وتجميد سريع للشبكات الصغيرة والعينات
- جعل كلا الوجهين من hydrophilic microgrids عن طريق التعامل معها مع توهج التفريغ (10 السلطة الفلسطينية، 400 V، 1 MA) باستخدام جهاز بصق أيون30.
- تعيين الشبكة الصغرى في SFD وتطبيق 2 ميكرولتر من الفيروس أو تعليق الجزيئية الكلية (1 ملغ البروتين / مل) على الشبكات الدقيقة. إزالة السائل الزائد باستخدام ورقة تصفية وتجميد بسرعة microgrid عن طريق الضغط على زر الحقن للجهاز.
- وضع الشبكة الصغرى المجمدة في حامل نقل التبريد والمراقبة تحت المجهر الإلكتروني
- نقل الشبكات الدقيقة المجمدة في النيتروجين السائل، وضعت في حامل نقل التبريد تبريده في درجة حرارة النيتروجين السائل مسبقا، ومراقبة تحت المجهر الإلكتروني في درجة حرارة منخفضة34.
النتائج
تم جمع الخلايا الحية من الكائنات الحية الدقيقة المعلقة عن طريق الطرد المركزي ، وتقع بين قرصين نحاسيين ، مجمدة بسرعة مع SFD ، بديل التجميد ، مضمنة في راتنج الايبوكسي ، مقطعة للغاية ، ملطخة ، ولوحظت تحت المجهر الإلكتروني باتباع الإجراءات المذكورة أعلاه. الشكل 12 يظهر أقسام فائقة من الإشريكية القولونية (البكتيريا، الشكل 12A، ب)16 وSaccharomyces cerevisiae (الخميرة، الشكل 12C)15. لاحظ أن الصور واضحة جدا وتظهر مورفولوجيا الطبيعية.
تم جمع تعليق الخلايا الثابتة الغلوتارالدهيدي للخلايا المستزرعة والخلايا الحيوانية المعزولة وتجميدها بسرعة مع SFD ، واستبدال التجميد ، ومراقبتها تحت المجهر الإلكتروني باتباع الإجراءات المذكورة أعلاه. الشكل 13 يظهر أقسام فائقة من الخلايا المستزرعة (الشكل 13A-C)1،28 والخلايا المعزولة من تجويف البطن الماوس ( الشكل13D)28. الشكل 14 يظهر أقسام فائقة من الجلد البشري (الشكل 14A-D) ومعطف برتقالي ( الشكل14E)1. لاحظ أن الصور هي أيضا واضحة جدا وتظهر مورفولوجيا الطبيعية. ويبين الشكل 15 الجسيمات الأساسية لفيروس التهاب الكبد B المجمدة بسرعة مع SFD ولاحظها المجهر الإلكتروني المبرد34. كما هو الحال مع الخلايا الأخرى ، والصور واضحة جدا وتظهر مورفولوجيا الطبيعية.
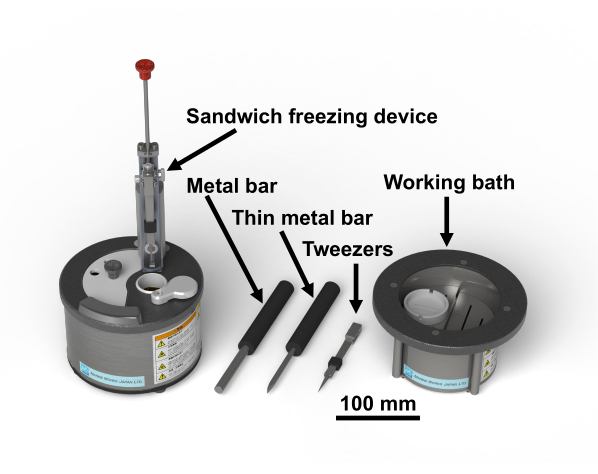
الشكل 1: ساندويتش تجميد الجهاز28 والأدوات اللازمة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: المواد اللازمة لإجراء تجارب تجميد شطيرة. (أ) عينة: ميكروجراف خفيف من Cerevisiae Saccharomyces (الخميرة). شريط المقياس = 10 ميكرومتر (B) قنينات زجاجية (10 مل) تحتوي على 1 مل من الأسيتون مع 2٪ من التيتروكسيد أوسميوم. (C) أقراص نحاسية تظهر سطحا بدون حرف (يسار) وسطح بحرف (يمين). شريط المقياس = 3 مم. المسح المجهري الإلكتروني. (D)تم وضع أقراص النحاس مع عدم وجود حرف الجانب حتى على شريحة زجاجية مع شريط لاصق على الوجهين (*). شريط مقياس = 3 مم (E) شفرة حلاقة ذات حدين وشفرة حلاقة مكسورة ذات حدين لتقطيع الأنسجة الحيوانية والبشرية ، وشفرة حلاقة ذات حدين لتقليم الكتل ، ولوحة ممزقة لتقطيع الأنسجة الحيوانية والبشرية. (F) ملاقط مع رغوة البوليسترين مقذوف لحماية الأصابع من البرد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
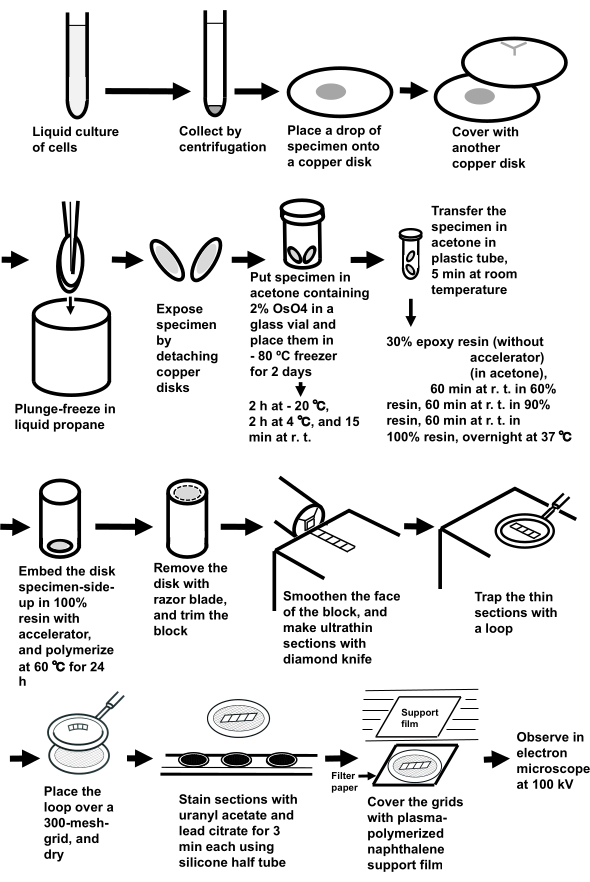
الشكل 3:إعداد عينة من تعليق الخلية باستخدام طريقة تجميد شطيرة. الاختصارات: r.t. = درجة حرارة الغرفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تم صبإعداد البروبان السائل والأقراص النحاسية والمثبتة. (أ) النيتروجين السائل (السهم) في حاوية النيتروجين السائل لجهاز تجميد الساندويتش. (ب)تم إدخال غاز البروبان في حاوية البروبان السائل من خلال فوهة غرامة. (ج) البروبان السائل (السهم). (د)تم استخدام شريط معدني (السهم) لتبريد البروبان السائل لتسريع تماسك البروبان السائل. (ه) البروبان الصلب (السهم). (F) جهاز ion sputter (السهم) لصنع أقراص النحاس hydrophilic مع توهج التفريغ. (G) توهج التفريغ. (H) زجاج قوارير وضعت في النيتروجين السائل في حمام العمل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: التجميد السريع لتعليق الخلية (الخميرة) باستخدام جهاز تجميد الساندويتش. (أ) نقل ثقافة الخميرة إلى أنبوب الطرد المركزي. (ب) أجهزة الطرد المركزي الدقيق. (ج) بيليه من Saccharomyces cerevisiae في أنبوب الطرد المركزي (السهم). (د)نقل العينة مع micropipette من أنبوب الطرد المركزي. (ه) وضع العينة على القرص النحاسي. (F)قطرة صغيرة من عينة على القرص النحاسي (السهم). (G) تغطي العينة مع قرص نحاسي آخر. (H) التقاط القرصين مع ملاقط. (I)صنع بئر في البروبان الصلبة باستخدام شريط معدني رقيقة. (J) يغرق تجميد العينة عن طريق الضغط على زر الحقن. (ك)التجميد كاملة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6:إعداد عينة من الأنسجة البشرية (الجلد). (أ, ب) أنسجة الجلد البشري ثابتة في الجلوتارالدهيد في طبق بيتري. شريط مقياس = 5 مم (C، D) تم تقطيع الأنسجة (السهم) باستخدام اثنين من شفرات الحلاقة ذات الحدين على لوحة ممزقة. (E, F) تم وضع قطرة صغيرة من محلول الجلوتارالدهيد (السهم) على قرص نحاسي. (G, H) تم وضع قطعة من أنسجة الجلد على القرص النحاسي باستخدام ملاقط. (I)تم استخدام قرص آخر لتغطية القرص النحاسي مع أنسجة الجلد. (J)تم التقاط الأقراص تقع مع ملاقط. (ك)عقدت الأقراص تقع بلطف مع ملاقط. لاحظ الفجوة بين نصائح ملاقط (السهم) الحفاظ عليها لتجنب سحق الأنسجة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: نقل العينة إلى النيتروجين السائل وفصل الأقراص. (أ) نقل الأقراص (السهم) إلى النيتروجين السائل في حمام العمل. (ب) أقراص في النيتروجين السائل (السهم). (ج) تم وضع ملاقط في النيتروجين السائل لتبريدها في حمام العمل. (D, E) فصل الأقراص النحاسية (الأسهم) باستخدام ملاقط. (F) نقل القرص (السهم) إلى قارورة زجاجية مع ملاقط. (G) الاحترار ملاقط في الماء لتجميد العينة القادمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: عينة الاحترار والتضمين. (أ) عينات في قارورة زجاجية في درجة حرارة الغرفة. (ب)نقل الأقراص (السهم) إلى أنبوب بلاستيكي 2 مل مع ملاقط. (ج) أقراص النحاس (السهم) في الأسيتون في أنبوب بلاستيكي. (د) قياس الراتنجات مع أنبوب الحقن (السهم). (ه)نقل الراتنج إلى كوب المتاح (السهم). (F) خلط الراتنج باستخدام ستيرر. (G) وضعت كمية صغيرة من الراتنج في ثقوب قالب سيليكون تضمين. (H) تمت إزالة الراتنج الزائد في الشبكات مع ورقة التصفية. (أنا, ي) وضعت أقراص النحاس مع عينات في الجزء السفلي من الثقوب من العفن تضمين مع الجانب عينة حتى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9: تشذيب كتلة العينة. (أ) إخراج كتل بلمرة من قوالب تضمين. (ب)تم كتابة رقم العينة على الكتلة. (C, D) تمت إزالة القرص النحاسي من الكتلة باستخدام شفرة حلاقة. شريط مقياس ل (D) = 1 مم (E-G) تم تشذيب العينة بشفرة قطع بالموجات فوق الصوتية وشفرة حلاقة. شريط مقياس ل (G) = 1 مم (H) تكبير عالي من (G). نقطة مضيئة فردية هي خلية. تم تضمين الخلايا في طبقة واحدة10. شريط مقياس = 10 ميكرومتر. (I-K) تم قطع سطح الكتلة على نحو سلس مع سكين تقليم الماس. شريط المقياس ل (K) = 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10: قطع الأقسام فوق البنفسجية. (أ) تمت إزالة كتلة العينة من microtome31. (ب, ج) تم تشذيب العينة بشكل أكبر بشفرة حلاقة. شريط مقياس ل (C) = 0.5 مم (D) تم تطبيق النيوبرين على الشبكات لجعلها عصا. (ه)غطت ultramicrotome مع البلاستيك لتجنب تدفق الهواء أثناء تقسيم ultrathin. (واو)امتلأ قارب سكين الماس بالماء. (G, H) تم قطع أقسام Ultrathin إلى سمك 70 نانومتر. شريط مقياس ل (H) = 1 مم (I, J) تم استرداد المقاطع باستخدام حلقة ثم جفت. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 11: تلطيخ الأقسام. (أ) وضعت الشبكات في الأخدود من أنبوب سيليكون نصف. (ب) كانت غارقة في خلات أورانيل لتلطيخ. (ج)تم جمع خلات أورانيل المستخدمة على فيلم شمعي الختم الذاتي. (د)تم غسل الشبكات بطائرة مائية و (E) ثم نقعت في سترات الرصاص. (F) البلازما بلمرة النفثالين فيلم طرحت على الماء و (G) تستخدم لتغطية شبكة وضعت على 4 مم × 4 مم ورقة تصفية. (ح)وضعت الشبكة في حامل عينة و (I) لوحظ في المجهر الإلكتروني. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
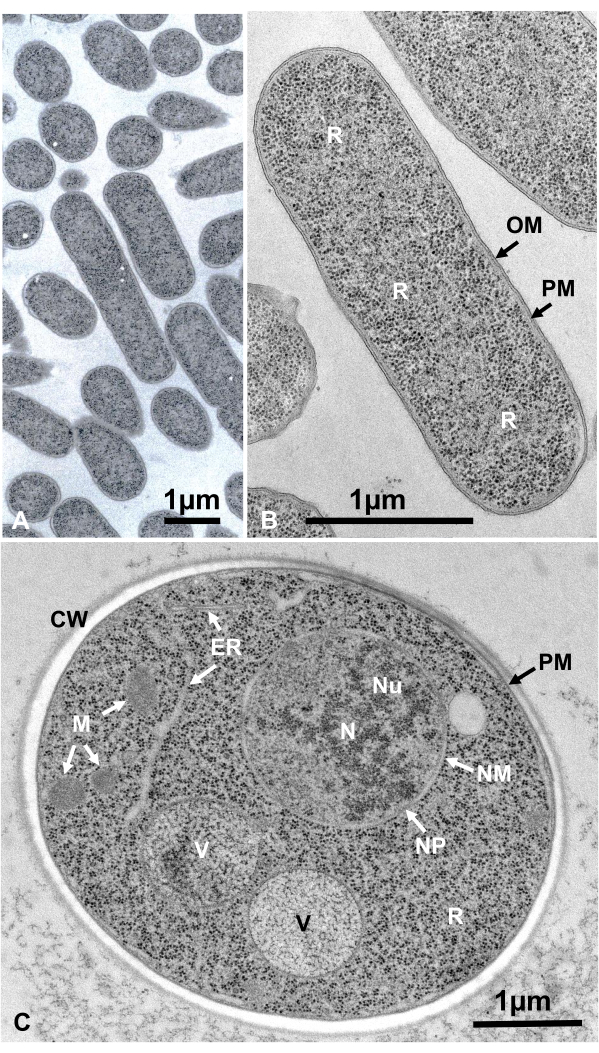
الشكل 12: أقسام Ultrathin من الإشريكية القولونية (البكتيريا، A، B) وSaccharomyces cerevisiae (الخميرة، C). (أ)لاحظ أن العينات مضمنة بكثافة وتجانس ولا تظهر أي تشوه. (ب, ج) تظهر هياكل الأغشية مورفولوجيا واضحة وسلسة ، والريبوسومات واضحة بما يكفي بحيث يمكن تعداد كل جسيم16. (ج)نواة الخميرة و vacuoles تظهر شكل دائرة حقيقية، والتي قد تكون مورفولوجيا الطبيعية. مصفوفة الميتوكوندريا يظهر مظهر الإلكترون الكثيفة، والتي قد تكون سمة من سمات الخلايا الحية التي يتم إصلاحها عن طريق التجميد السريع. أشرطة المقياس = 1 ميكرومتر. الاختصارات: CW = جدار الخلية; ER = الشبكية الإنتوبلازمية; NM = الغشاء النووي. NP = المسام النووية؛ OM = الغشاء الخارجي. PM = أغشية البلازما; R = ريبوسومات; N = النواة؛ M = الميتوكوندريا. (ب)مستنسخ من يامادا وآخرون16 بإذن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
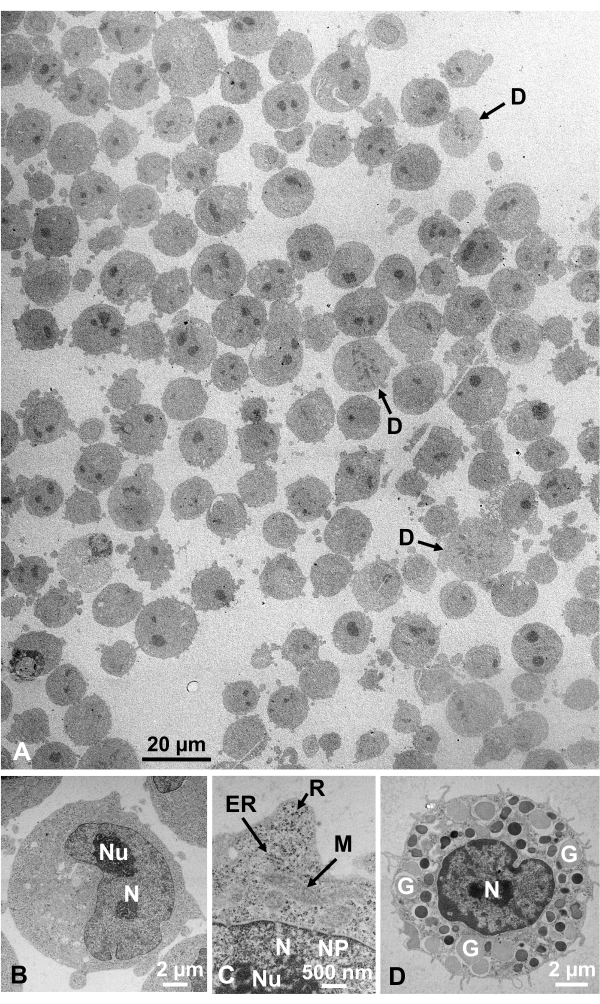
الشكل 13: أقسام Ultrathin. (A-C) K562 الخلايا المستزرعة. (D) خلية سارية معزولة من الماوس. (أ)لاحظ أن العينات مضمنة بكثافة وتجانس ولا تظهر أي تشوه. مقياس شريط = 20 ميكرومتر (ب-D) في التكبير عالية، نواة، نيوكليولوس، الغشاء النووي، المسام النووية، reticulum endoplasmic، الميتوكوندريا، الريبوسومات، والحبيبات لوحظ بوضوح. أشرطة المقياس = 2 ميكرومتر (B)، 500 نانومتر (C)، 2 ميكرومتر (D). المختصرات: N = النواة؛ N = النواة؛ N = النواة= N = النواة= Nu = النيوكليولوس; NM = الغشاء النووي، NP = المسام النووية. ER = الشبكية الإنتوبلازمية; M = الميتوكوندريا; R = ريبوسومات; G = حبيبات; D = تقسيم الخلايا. (أ)مستنسخ من ياماغوتشي وآخرون1 بإذن. (ب-د)مستنسخة من ياماغوتشي وآخرون28 بإذن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
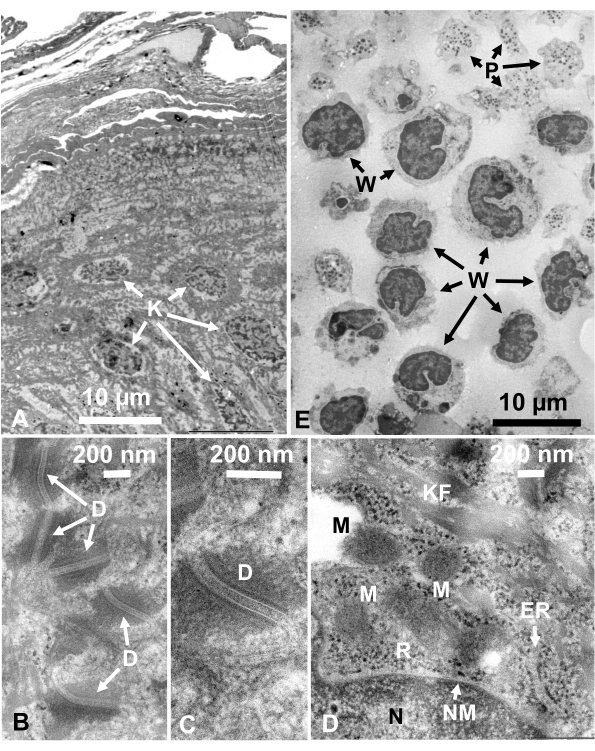
الشكل 14: ألتراثين أقسام. (أ-د) جلد الإنسان و (ه) معطف برتقالي. (أ-ه) لاحظ أن الأنسجة وصور الخلايا واضحة وطبيعية وتظهر تباينا جيدا ، على الرغم من أن الأقسام رقيقة جدا (50 نانومتر). مصفوفة الميتوكوندريا يظهر مظهر كثيف، وهو مشابه لتلك المصفوفات الميتوكوندريا الكثيفة من الخلايا الحية المجمدة بسرعة(D). أشرطة المقياس = 10 ميكرومتر (A، E)، 200 نانومتر (B-D). المختصرات: D = desmosomes; ER = الشبكية الإنتوبلازمية; K = الكيراتينوسي; KF = ألياف الكيراتين. M = الميتوكوندريا; N = النواة؛ NM = الغشاء النووي. P = الصفائح الدموية; R = ريبوسومات; W = خلايا الدم البيضاء. مستنسخة من ياماغوتشي وآخرون28 بإذن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
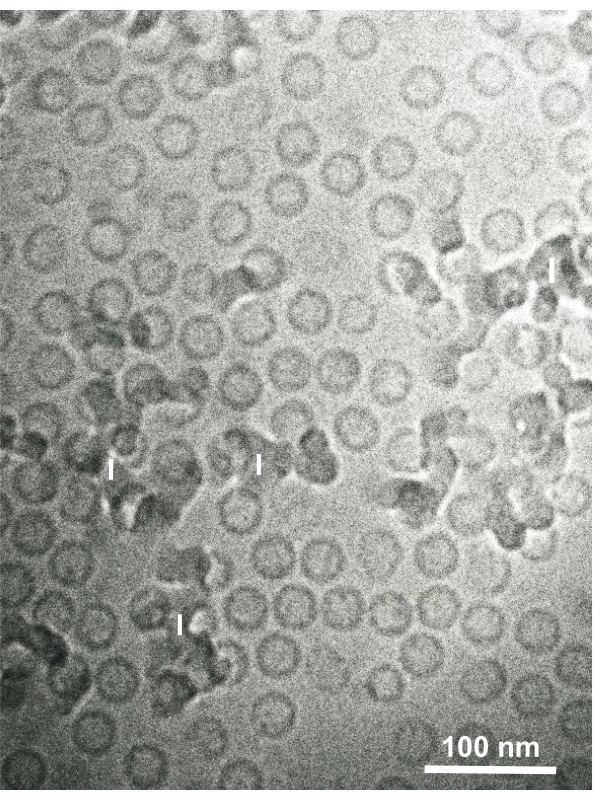
الشكل 15:جسيمات فيروس التهاب الكبد B الأساسية (HBV) مجمدة بسرعة مع الإيثان السائل باستخدام جهاز تجميد الساندويتشات ولاحظها المجهر الإلكتروني المبرد. الجسيمات المجوفة الكروية هي جزيئات أساسية HBV. شريط المقياس = 100 نانومتر. المختصرات: HBV = فيروس التهاب الكبد B; أنا = الجليد. مستنسخة من ياماغوتشي وآخرون28 بإذن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وتستند المناقشة التالية إلى أكثر من 120 تجربة استبدال تجميد تجميد السندويشات على أكثر من 000 1 عينة وأكثر من 70 تجربة مجهرية لتجميد التجميد والإلكترونات على أكثر من 75 عينة أجريت على مدى 36 عاما.
معدل النجاح لتجميد جيدة عن طريق تجميد شطيرة
يعتمد معدل النجاح في تحقيق تجميد جيد على العينات. Saccharomyces cerevisiae (الخميرة) الخلايا المستزرعة في المتوسط YPD (1٪ استخراج الخميرة، 2٪ بيبتون، 2٪ dextrose) أعطى ما يقرب من 100٪ نجاح لتجميد جيدة دون تشكيل الكريستال الجليد10،11،15،35،36. أنواع الخميرة الأخرى، بما في ذلك شيزوساككروميس37،38،39،كريبتوكوس14،40،41،42،43،44،45، إكسوفيالا13،41،46،47،48، 49، فوساريوم50،51،52، أوريوباسيديوم53، كانديدا54،55، فيلوميس56، أسبرجر 57، وتريتشوسبورون ، كما أظهرت تجميد جيدة. البكتيريا، بما في ذلك البكتيريا الفطرية58و59 و E. القولونية16،وأظهرت أيضا تجميد جيدة. وأظهرت الخلايا المستزرعة والخلايا الحيوانية المعزولة تجميد جيد لكل من الخلايا الحية والغلوتارالدهيد الثابتة1،25،26،27،60. Glutaraldehyde ثابتة الحيوانات والأنسجة البشرية شرائح إلى 0.1 إلى 0.2 ملم سمك أظهرت أيضا تجميد جيدة معظم الوقت1,28.
شروط لتجميد جيد
استخدام الخلايا فقط في مرحلة النمو المناسبة وحالة. يجب أن تكون الخلايا في الثقافة في المرحلة الأسية. تطبيق كميات صغيرة جدا من تعليق الخلية من العينات المركزة (لS. cerevisiae، ~ 0.02 ميكرولتر من 3-5 × 109 خلايا / مل) على القرص النحاسي. يجب أن تكون شرائح الغلوتارالدهيد الثابتة من الأنسجة الحيوانية أو البشرية صغيرة جدا (يفضل أن تكون 0.3 مم × 0.3 مم × 0.1 مم). لأن قطع شرائح الأنسجة سميكة 0.1 ملم من الصعب، شريحة العديد من الأنسجة واختيار شرائح رقيقة ونصف شفافة. العمل بسرعة ولكن بعناية، ولا تدع العينات تجف. في التقاط الأقراص النحاسية مكدسة مع ملاقط، لا تضغط على الأقراص من الصعب جدا لتجنب سحق الخلايا والأنسجة. تحميل العينات هو الخطوة الأكثر أهمية لتجميد ناجحة، والظروف المطلوبة هي نفس الشروط لتجميد جيدة لتجميد الضغط العالي. القراء يجب أن تشير إلى استعراض ممتاز من قبل ماكدونالد61.
تطبيقات أخرى
تعرض هذه الورقة ميكروجرافات إلكترونية للبكتيريا والخميرة والخلايا المستزرعة والخلايا الحيوانية المعزولة والأنسجة البشرية وجسيمات الفيروس. لاحظنا تجميد جيد للطحالب البحرية الثابتة الغلوتارارالدهايد. ومع ذلك، تم تدمير هياكل الخلية من الطحالب الخضراء المياه العذبة الحية من قبل تشكيل الكريستال الجليد. خلط الخلايا مع 20٪ ألبوم مصل البقر (BSA) يضمن أن البنية الفوقية كانت محفوظة بشكل جيد مع عدم وجود ضرر بلوري جليدي. وكان استخدام 20٪ BSA مفيدة أيضا للحفاظ على البنية الفوقية للخلايا ساق من الفطر. التجارب على تجميد الخلايا النباتية والأنسجة عن طريق تطبيق 20٪ BSA جارية. على الرغم من أن المسح المجهري الإلكتروني لعينات التجميد التجميد البديلة لم تتم محاولة، وقد تم الإبلاغ عن مراقبة هياكل الخلايا المحفوظة جيدا سابقا9.
ملاحظات حول طريقة تجميد الشطائر
من الأفضل ملاحظة البنية الفوقية للخلايا القريبة من الأصل من خلال التجميد السريع واستبدال الخلايا الحية بالتجميد. يمكن تجنب تشكيل بلورة الجليد مع SFD عن طريق الحد من سمك الخلايا إلى ≤30 ميكرومتر1. إصلاح الأنسجة مع الجلوتارالدهيد غالبا ما تسفر عن الحفاظ على أفضل من بنية الخلية لمراقبة الخلايا المستزرعة تعليق لأن تثبيت الجلوتارالدهيد يجعل بنية الخلية أكثر صلابة ويمنع التغيرات الهيكلية المفرطة المحتملة أثناء جمع والطرد المركزي من الخلايا الحية1. كما يسمح تثبيت الغلوتاراندهيد بتمديد عمق التجميد إلى 0.2 مم1، على غرار ما حققته طريقة التجميد عالي الضغط (HPF). لذلك ، يمكن استبدال آلة HPF ب SFD للتجميد العميق للأنسجة الحيوانية والبشرية.
لأن الأنسجة glutaraldehyde الثابتة يمكن تخزينها لأكثر من 2 سنوات28، يمكن إجراء تجميد شطيرة وفقا لراحة المستخدم. إصلاح الأنسجة مع الجلوتارالدهايد يسهل أيضا تقسيم الأنسجة لأن الأنسجة تصبح أكثر صلابة مع التثبيت. على عكس جهاز HPF ، يمكن استخدام SFD للتجميد السريع للفيروسات للفحص المجهري للإلكترون المبرد وللبكتيريا والخلايا النواة. وعلاوة على ذلك، بالمقارنة مع جهاز HPF، فإن SFD صغيرة ومحمولة وأقل تكلفة، ويمكن الحصول عليها من قبل المزيد من المختبرات. نأمل أن تساعد هذه السمات من SFD المزيد من المختبرات تحقيق أهدافها البحثية28.
ملامح مورفولوجيا الطبيعية للخلايا
هياكل الخلية هي في حالتها الطبيعية إذا كانت تظهر المظهر التالي: هياكل الغشاء من الغشاء الخارجي (الشكل 12A, B), غشاء البلازما ( الشكل12B,C; الشكل 13A-D; والشكل 14E), المغلف النووي (الشكل 12C, الشكل 13B-D, والشكل 14D-E), الميتوكوندريا (الشكل 12C, الشكل 13C, والشكل 14D), وvacuoles (الشكل 12C) تظهر ملامح سلسة. النواة و vacuoles دائرية تقريبا (الشكل 12C). الريبوسومات تظهر مظهر واضح الإلكترون الكثيفة مع قطر ~ 20 نانومتر (الشكل 12B, C; الشكل 13C؛ والشكل 14D). السيتوبلازم هو إلكترون لوسنت (الشكل 12B، C؛ الشكل 13C؛ والشكل 14D).
تأثير تثبيت الغلوتارارالدهايد على مورفولوجيا الخلايا
تم إجراء تثبيت الغلوتارانديهيد للأنسجة الحيوانية أو البشرية قبل تجميد السندويشات للحصول على بنية فائقة خالية من الكريستال الجليدي. تظهر الصور الدقيقة التي تم الحصول عليها بهذه الطريقة صورا واضحة بشكل رائع مماثلة لتلك التي تم الحصول عليها عن طريق التجميد السريع للأنسجة الحية (الشكل 14)1. الدراسات على خلايا الخميرة، والكائنات الحية الدقيقة في أعماق البحار، والخلايا المستزرعة تبين أن تشوه ultrastructure يرجع أساسا إلى تثبيت التيتروكسيد أوسميوم والجفاف عن طريق الإيثانول في درجة حرارة الغرفة1،17،18،28. الصغيرة ذكرت أيضا أنه على الرغم من تثبيت الغلوتارالدهيد لا يدمر تنظيم أكتين في الخلايا الليفية المستزرعة، تثبيت التيتروكسيد أوسميوم والجفاف عن طريق الأسيتون أو الإيثانول في درجة حرارة الغرفة تدمير actin المنظمة62.
ومن ثم، ينبغي إجراء دراسة مفصلة عن آثار تثبيت الجلوتارالدهيد على مورفولوجيا الخلايا. Ohno وضعت في الجسم الحي طريقة cryofixation حيث يتم تجميد الأنسجة الحية بسرعة دون وقف إمدادات الدم63. تم استبدال الأنسجة بالتجميد وتضمينها في راتنج الايبوكسي ، ولوحظت أقسام فائقة النحافة. وأظهرت الصور المجهرية الإلكترونية البنية الفوقية الأقرب إلى الأصلية للأنسجة الحية مقارنة بتلك التي تم الحصول عليها عن طريق الجفاف الكيميائي التقليدي والتجمد السريع للأنسجة الطازجة غير المثبتة. لذلك، قد يكون من المثير للاهتمام مقارنة البنية الفائقة التي تم الحصول عليها عن طريق استبدال تثبيت تجميد الغلوتارالدهيد (الطريقة الحالية) وتلك التي يتم استبدالها في الجسم الحي تجميد التبريد لدراسة آثار تثبيت الجلوتارارالدهيد.
مراعاة البيئة وزيادة الكفاءة التجريبية
نحن نستخدم أنابيب بلاستيكية 2 مل لاستبدال الراتنج. مل واحد من الراتنج المخفف يكفي لكل خطوة استبدال. يمكن التخلص من الأنابيب البلاستيكية المستخدمة بعد كل تجربة. وهذا يمكن أن يوفر الوقت والجهد لغسل قوارير الزجاج عندما يتم استخدامها لاستبدال الراتنج. بالإضافة إلى ذلك، يمكن استخدام محلول خلات أورانيل مرارا وتكرارا لقسمتلطيخ 32. بعد تلطيخ المقاطع ، يمكن حفظ محلول خلات أورانيل وإعادة استخدامه. وبما أن خلات الأورانيل مادة مشعة، فإن إعادة استخدامها تساعد على تجنب توليد النفايات وتساهم في حماية البيئة.
البلازما البوليمرات فيلم النفثالين
البلازما بلمرة فيلم النفثالين هو فيلم الكربون ثلاثي الأبعاد البوليمرات المصنوعة من غاز النفثالين عن طريق بلازما البلمرة تحت توهجالتفريغ 33. الفيلم مرن ضد قصف الإلكترونات والمواد الكيميائية ، نظيفة جدا وشفافة ضد الإلكترونات ، ولها سطح مستو وبنية غير متبلورة. وهكذا، فإن فيلم النفثالين البلازمي البلمرة، وهو متاح تجاريا، ممتاز ويوصى به كفيلم دعم.
Disclosures
ولا يعلن صاحبا البلاغ عن وجود تضارب في المصالح.
Acknowledgements
اي
Materials
| Name | Company | Catalog Number | Comments |
| Sandwich Freezing Device | Marine works Japan, Ltd, Yokosuka, Japan | MW-SFD-01 | with metal bar, thin metal bar, tweezers, and working bath |
| 10 mL glass vials | - | Scintillation counter vials for fixative | |
| Acetone | - | ||
| Osmium tetroxide | Nisshin EM Co. Ltd., Tokyo | 3004 | 0.1 g |
| Deep freezer | Sanyo Co. Ltd., Osaka | MDF-C8V1 | |
| Copper disk | Nisshin EM Co. Ltd., Tokyo | - | Refer to this paper |
| Slide glass | - | ||
| Double-sided adhesive tape | - | ||
| Single-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FAS-10 |
| Double-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FA-10 |
| Shredded board | Nisshin EM Co. Ltd., Tokyo | 428 | |
| Tweezers | Nisshin EM Co. Ltd., Tokyo | - | Several pairs |
| Tweezers with polystyrene foam | - | One pair | |
| Glutaraldehyde | Nisshin EM Co. Ltd., Tokyo | 3052 | |
| Liquid nitrogen | - | ||
| Propane gas | - | Cryogen | |
| Ion sputter apparatus | Hitachi high technologies, Tokyo | Hitachi E102 | |
| Micropipette | - | For 1 mL, 200 μL, and 2 μL | |
| Microcentrifuge | Tomy digital biology Co. Ltd., Tokyo | Capsulefuge, PMC-060 | |
| Stereomicroscope | Nikon Co. Ltd., Tokyo et al. | - | SMZ 645 |
| LED illumination for stereomicroscope | Nikon Co. Ltd., Tokyo et al. | SM-LW 61 Ji | |
| Disposable plastic container | - | 50 mL and 200 mL | |
| Ethane gas | - | Cryogen | |
| 2 mL Eppendorf tubes | - | For embedding | |
| Disposable plastic syringes | - | 1 mL, 5 mL, 10 mL, and 20 mL | |
| Magnetic stirrer | - | ||
| Epoxy resin | Nisshin EM Co. Ltd., Tokyo | 340 | Quetol 812 set |
| Silicon embedding mold | Nisshin EM Co. Ltd., Tokyo | 4217 | 7 mm in diameter, 13 mm deep |
| Incubater | - | For 37 °C and 60 °C | |
| Trimming stage | Sunmag Co. Ltd., Tokyo | - | Tilting mechanism equipped, Refer to this paper |
| LED illumination for trimming stage | Sunmag Co. Ltd., Tokyo | - | Refer to this paper |
| Ultrasonic Trimming Blade | Nisshin EM Co. Ltd., Tokyo | 5240 | EM-240, Refer to this paper |
| Ultramicrotome | Leica Microsystems, Vienna | Ultracut S | |
| Grids | Nisshin EM Co. Ltd., Tokyo | 2633, 2634 | 300 mesh, 400 mesh |
| 0.5% Neoprene W solution | Nisshin EM Co. Ltd., Tokyo | 605 | |
| Perfect Loop | Nisshin EM Co. Ltd., Tokyo | 2351 | Fot retrieving sections |
| Half Tube for section staining | Nisshin EM Co. Ltd., Tokyo | 463 | Refer to this pape |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Syringe filter | Toyo Roshi Kaisha, Ltd., Tokyo | DISMIC-03CP | Cellulose acetate, 0.45 μm |
| Transmission electron microscope | JEOL Co. Ltd., Tokyo | JEM-1400 |
References
- Yamaguchi, M., et al. Good ultrastructural preservation of human tissues and cultured cells by glutaraldehyde fixation, sandwich freezing, and freeze-substitution. Cytologia. 85 (1), 15-26 (2020).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Technique. 3 (2), 177-210 (1986).
- Van Harreveld, A., Crowell, J. Electron microscopy after rapid freezing on a metal surface and substitution fixation. The Anatomical Record. 149, 381-385 (1964).
- Aoki, N., Ito, M., Ejiri, S., Ozawa, H. Ultrastructure of human skin by a rapid freezing technique: structural preservation and antigenicity. Journal of Investigative Dermatology. 102 (3), 354-361 (1994).
- Moor, H., Steinbrecht, R. A., Zierold, K. Theory and practice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. , 175-191 (1987).
- McDonald, K. L., Morphew, M., Vertkade, P., Muller-Reichert, T. Recent advances in high-pressure freezing: Equipment-and specimen-loading methods. Methods in Molecular Biology. 369, 143-173 (2007).
- Sosinsky, G. E., et al. The combination of chemical fixation procedures with high pressure freezing and freeze substitution preserves highly labile tissue ultrastructure for electron tomography applications. Journal of Structural Biology. 161 (3), 359-371 (2008).
- Costello, M. J. Ultra-rapid freezing of the biological samples. Scanning Electron Microscopy. , 361-370 (1980).
- Baba, M., Osumi, M. Transmission and scanning electron microscopic examination of intracellular organelles in freeze-substituted Kloeckera and Saccharomyces cerevisiae yeast cells. Journal of Electron Microscopy Technique. 5 (3), 249-261 (1987).
- Yamaguchi, M., Okada, H., Namiki, Y. Smart specimen preparation for freeze-substitution and serial ultrathin sectioning of yeast cells. Journal of Electron Microscopy. 58 (4), 261-266 (2009).
- Yamaguchi, M., et al. Electron microscopy of hepatitis B virus core antigen expressing yeast cells by freeze-substitution fixation. European Journal of Cell Biology. 47 (1), 138-143 (1988).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. Journal of Cell Biology. 124 (6), 903-913 (1994).
- Yamaguchi, M., et al. The spindle pole body duplicates in early G1 phase in a pathogenic yeast Exophiala dermatitidis: an ultrastructural study. Experimental Cell Research. 279 (1), 71-79 (2002).
- Yamaguchi, M., Biswas, S. K., Ohkusu, M., Takeo, K. Dynamics of the spindle pole body of the pathogenic yeast Cryptococcus neoformans examined by freeze-substitution electron microscopy. FEMS Microbiology Letters. 296 (2), 257-265 (2009).
- Yamaguchi, M., et al. Structome of Saccharomyces cerevisiae determined by freeze-substitution and serial ultrathin sectioning electron microscopy. Journal of Electron Microscopy. 60 (5), 321-335 (2011).
- Yamada, H., et al. Structome analysis of Escherichia coli cells by serial ultrathin sectioning reveals the precise cell profiles and the ribosome density. Microscopy. 66 (4), 283-294 (2017).
- Yamaguchi, M., Ohkusu, M., Sameshima, M., Kawamoto, S. Safe specimen preparation for electron microscopy of pathogenic fungi by freeze-substitution after glutaraldehyde fixation. Japanese Journal of Medical Mycology. 46 (3), 187-192 (2005).
- Yamaguchi, M., et al. Improved preservation of fine structure of deep-sea microorganisms by freeze-substitution after glutaraldehyde fixation. Journal of Electron Microscopy. 60 (4), 283-287 (2011).
- Yamaguchi, M., et al. Prokaryote or eukaryote? A unique microorganism from the deep-sea. Journal of Electron Microscopy. 61 (6), 423-431 (2012).
- Yamada, H., Chikamatsu, K., Aono, A., Mitarai, S. Pre-fixation of virulent Mycobacterium tuberculosis with glutaraldehyde preserves exquisite ultrastructure on transmission electron microscopy through cryofixation and freeze-substitution with osmium-acetone at ultralow temperature. Journal of Microbiological Methods. 96, 50-55 (2014).
- Yamaguchi, M. An electron microscopic study of microorganisms: from influenza virus to deep-sea microorganisms. JSM Mycotoxins. 65 (2), 81-99 (2015).
- Yamaguchi, M., et al. High-voltage electron microscopy tomography and structome analysis of unique spiral bacteria from the deep sea. Microscopy. 65 (4), 363-369 (2016).
- Yamaguchi, M., Yamada, H., Uematsu, K., Horinouchi, Y., Chibana, H. Electron microscopy and structome analysis of unique amorphous bacteria from the deep sea. Cytologia. 83 (3), 337-342 (2018).
- Yamaguchi, M., Yamada, H., Chibana, H. Deep-sea bacteria harboring bacterial endosymbionts in a cytoplasm?: 3D electron microscopy by serial ultrathin sectioning of freeze-substituted specimen. Cytologia. 85 (3), 209-211 (2020).
- Yamaguchi, M., Takahashi-Nakaguchi, A., Aida, Y., Sato-Okamoto, M., Chibana, H. Convenient method for better preservation of fine structures of cultured macrophages and engulfed yeast cells by freeze-substitution fixation. Microscopy. 66 (3), 209-211 (2017).
- Aoki, S., et al. Shift in energy metabolism caused by glucocorticoids enhances the effect of cytotoxic anticancer drugs against acute lymphoblastic leukemia cells. Oncotarget. 8 (55), 94271-94285 (2017).
- Hirao, T., et al. Altered intracellular signaling by imatinib increases the anticancer effects of tyrosine kinase inhibitors in chronic myelogenous leukemia cells. Cancer Science. 109 (1), 121-131 (2018).
- Yamaguchi, M., et al. Sandwich freezing device for rapid freezing of viruses, bacteria, yeast, cultured cells, and animal and human tissues in electron microscopy. Microscopy. 70 (2), 215-223 (2021).
- Yamaguchi, M. Troubleshooting in specimen preparation of microorganisms. Kenbikyo. 42, 26-28 (2007).
- Yamaguchi, M., Aoyama, T., Yamada, N., Chibana, H. Quantitative measurement of hydrophilicity/hydrophobicity of the plasma-polymerized naphthalene film (Super support film) and other support films and grids in electron microscopy. Microscopy. 65 (55), 444-450 (2016).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Yamaguchi, M., Shimizu, M., Yamaguchi, T., Ohkusu, M., Kawamoto, S. Repeated use of uranyl acetate solution for section staining in transmission electron microscopy. Plant Morphology. 17 (1), 57-59 (2005).
- Yamaguchi, M., Tanaka, A., Suzuki, T. A support film of plasma-polymerized naphthalene for electron microscopy: method of preparation and application. Journal of Electron Microscopy. 41 (1), 7-13 (1992).
- Yamaguchi, M., et al. Cryo-electron microscopy of hepatitis B virus core particles produced by transformed yeast: comparison with negative staining and ultrathin sectioning. Journal of Electron Microscopy. 37 (6), 337-341 (1988).
- Yamaguchi, M., et al. Dynamics of hepatitis B virus core antigen in a transformed yeast cell: analysis with an inducible system. Journal of Electron Microscopy. 43 (6), 386-393 (1994).
- Yamaguchi, M., Miyatsu, T., Mizokami, H., Matsuoka, L., Takeo, K. Translocation of hepatitis B virus core particles through nuclear pores in transformed yeast cells. Journal of Electron Microscopy. 45 (4), 321-324 (1996).
- Sipiczki, M., Takeo, K., Yamaguchi, M., Yoshida, S., Miklos, I. Environmentally controlled dimorphic cycle in fission yeast. Microbiology. 144, 1319-1330 (1998).
- Sipiczki, M., et al. Role of cell shape in determination of the division plane in Schizosaccharomyces pombe: random orientation of septa in spherical cells. Journal of Bacteriology. 182 (6), 1693-1701 (2000).
- Encz, i. K., Yamaguchi, M., Sipiczki, M. Morphology transition genes in the dimorphic fission yeast Schizosaccharomyces japonicus. Antonie van Leeuwenhoek. 92 (2), 143-154 (2007).
- Kopecka, M., et al. Microtubules and actin cytoskeleton in Cryptococcus neoformans compared with ascomycetous budding and fission yeasts. European Journal of Cell Biology. 80 (4), 303-311 (2001).
- Yamaguchi, M., Biswas, S. K., Kita, S., Aikawa, E., Takeo, K. Electron microscopy of pathogenic yeasts Cryptococcus neoformans and Exophiala dermatitidis by high-pressure freezing. Journal of Electron Microscopy. 51 (1), 21-27 (2002).
- Ikeda, R., et al. Contribution of the mannan backbone of cryptococcal glucuroxylomannan and a glycolytic enzyme of Staphylococcus aureus to contact-mediated killing of Cryptococcus neoformans. Journal of Bacteriology. 189 (13), 4815-4826 (2007).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Cryptococcus neoformans: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. Journal of Electron Microscopy. 59 (2), 165-172 (2010).
- Kozubowski, L., et al. Ordered kinetochore assembly in the human pathogenic basidiomycetous yeast Cryptococcus neoformans. MBio. 4 (5), 00614 (2013).
- Stepanova, A. A., Yamaguchi, M., Chibana, H., Vasilyeva, N. V. Ultrastructural aspects of cell components migration during budding in the yeast Cryptococcus leurentii. Problems in Medical Mycology. 18 (3), 24-29 (2016).
- Ohkusu, M., et al. Cellular and nuclear characteristics of Exophiala dermatitidis. Studies in Mycology. 43 (43), 143-150 (1999).
- Yamaguchi, M., Biswas, S. K., Suzuki, Y., Furukawa, H., Takeo, K. Three-dimensional reconstruction of a pathogenic yeast Exophiala dermatitidis cell by freeze-substitution and serial sectioning electron microscopy. FEMS Microbiology Letters. 219 (1), 17-21 (2003).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Exophiala dermatitidis: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. European Journal of Cell Biology. 82 (10), 531-538 (2003).
- Biswas, S. K., Yamaguchi, M., Naoe, N., Takashima, T., Takeo, K. Quantitative three-dimensional structural analysis of Exophiala dermatitidis yeast cells by freeze-substitution and serial ultrathin sectioning. Journal of Electron Microscopy. 52 (2), 133-143 (2003).
- Takaya, N., et al. Cytochrome P450nor, a novel class of mitochondrial cytochrome P450 involved in nitrate respiration in the fungus Fusarium oxysporum. Archives of Biochemistry and Biophysics. 372 (2), 340-346 (1999).
- Zhou, Z., et al. Ammonia fermentation, a novel anoxic metabolism of nitrate by fungi. Journal of Biological Chemistry. 277 (3), 1892-1896 (2002).
- Takasaki, K., et al. Fungal ammonia fermentation, a novel metabolic mechanism that couples the dissimilatory and assimilatory pathways of both nitrate and ethanol. Role of acetyl CoA synthetase in anaerobic ATP synthesis. Journal of Biological Chemistry. 279 (13), 12414-12420 (2004).
- Kopecka, M., et al. Analysis of microtubules and F-actin structures in hyphae and conidia development in opportunistic human pathogenic black yeast Aureobasidium pullulans. Microbiology. 149, 865-876 (2003).
- Ueno, K., Namiki, Y., Mitani, H., Yamaguchi, M., Chibana, H. Differential cell wall remodeling of two chitin synthase deletants Δchs3A and Δchs3B in the pathogenic yeast Candida glabrata. FEMS Yeast Research. 11 (5), 398-407 (2011).
- Ikezaki, S., et al. Mild heat stress affects on the cell wall structure in Candida albicans biofilm. Medical Mycology Journal. 60 (2), 29-37 (2019).
- Gabriel, M., et al. The cytoskeleton in the unique cell reproduction by conidiogenesis of the long-neck yeast Fellomyces (Sterigmatomyces) fuzhouensis. Protoplasma. 229 (1), 33-44 (2006).
- Yoshimi, A., et al. Functional analysis of the α-1,3-glucan synthase genes agsA and agsB in Aspergillus nidulans: agsB is the major α-1,3-glucan synthase in this fungus. PLoS One. 8 (1), 54893 (2013).
- Yamada, H., Mitarai, S., Chikamatsu, K., Mizuno, K., Yamaguchi, M. Novel freeze-substitution electron microscopy provides new aspects of virulent Mycobacterium tuberculosis with visualization of the outer membrane and satisfying biosafety requirements. Journal of Microbiological Methods. 80 (1), 14-18 (2010).
- Yamada, H., Yamaguchi, M., Chikamatsu, K., Aono, A., Mitarai, S. Structome analysis of virulent Mycobacterium tuberculosis, which survives with only 700 ribosomes at density per 0.1 fl cytoplasm. PLoS One. 10 (1), 0117109 (2015).
- Shiratori, R., et al. Glycolytic suppression dramatically changes the intracellular metabolic profile of multiple cancer cell lines in a mitochondrial metabolism-dependent manner. Scientfic Reports. 9 (1), 18699 (2019).
- McDonald, K. L. Out with the old and in with the new: rapid specimen preparation procedures for electron microscopy of sectioned biological material. Protoplasma. 251 (2), 429-448 (2014).
- Small, J. V. Organization of actin in the leading edge of cultured cells: influence of osmium tetroxide and dehydration on the ultrastructure of actin meshworks. Journal of Cell Biology. 91 (3), 695-705 (1981).
- Ohno, S., Terada, N., Fujii, Y., Ueda, H., Takayama, I. Dynamic structure of glomerular capillary loop as revealed by an in vivo cryotechnique. Virchows Archiv. 427 (5), 519-527 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved