Method Article
Schnelles Einfrieren mit Sandwich-Gefriergerät zur guten ultrastrukturellen Konservierung biologischer Proben in der Elektronenmikroskopie
In diesem Artikel
Zusammenfassung
Hier zeigen wir, wie man das Sandwich-Gefriergerät zum schnellen Einfrieren von biologischen Proben verwendet, einschließlich Bakterien, Hefen, kultivierten Zellen, isolierten Zellen, tierischem und menschlichem Gewebe und Viren. Wir zeigen auch, wie man Proben für ultradünne Schnitte nach schnellem Einfrieren vorbereitet.
Zusammenfassung
Chemische Fixierung wurde verwendet, um die Ultrastruktur von Zellen und Geweben zu beobachten. Diese Methode bewahrt jedoch die Ultrastruktur von Zellen nicht ausreichend; Artefakte und extraktion von Zellinhalten werden normalerweise beobachtet. Schnelles Einfrieren ist eine bessere Alternative zur Erhaltung der Zellstruktur. Das Einfrieren von lebender Hefe oder Bakterien mit anschließender Gefriersubstitution wurde zur Beobachtung der exquisiten natürlichen Ultrastruktur von Zellen verwendet. In jüngster Zeit wurde auch das Sandwich-Einfrieren von Glutaraldehyd-fixierten kultivierten Zellen oder menschlichem Gewebe verwendet, um die Ultrastruktur von Zellen und Geweben aufzudecken.
Diese Studien wurden bisher mit einem handgefertigten Sandwich-Gefriergerät durchgeführt, und die Anwendungen für Studien in anderen Labors waren begrenzt. Ein neues Sandwich-Gefriergerät wurde kürzlich hergestellt und ist jetzt im Handel erhältlich. Die vorliegende Arbeit zeigt, wie das Sandwich-Gefriergerät zum schnellen Einfrieren von biologischen Proben, einschließlich Bakterien, Hefen, kultivierten Zellen, isolierten Zellen, tierischem und menschlichem Gewebe und Viren, verwendet werden kann. Gezeigt werden auch die Vorbereitung von Proben für das ultradünne Schneiden nach schnellem Einfrieren und Verfahren zur Gefriersubstitution, Harzeinbettung, Trimmen von Blöcken, Schneiden von ultradünnen Abschnitten, Wiederherstellen von Schnitten, Färben und Abdecken von Gittern mit Stützfolien.
Einleitung
Die Elektronenmikroskopie ist ein leistungsfähiges Werkzeug zur Untersuchung der Zellmikrostruktur. Die chemische Fixierung mit herkömmlichen Dehydrationsverfahren wurde zur Beobachtung der Ultrastruktur von Zellen und Geweben verwendet. Diese Methode bewahrt jedoch die Ultrastruktur von Zellen nicht ausreichend, und Artefakte und die Extraktion von Zellinhalten werden normalerweise beobachtet. Schnelles Einfrieren und Gefriersubstitution von Zellen und Geweben sind bessere Alternativen für die Erhaltung der Zellstruktur.
Drei Hauptmethoden wurden verwendet, um Zellen schnell einzufrieren1: 1) Das Eintauchen von Proben in ein gekühltes Kryogen wie Propan wird durchgeführt und wurde seit den frühen 1950er Jahren verwendet2; 2) Das Einfrieren kalter Metallblöcke erfolgt durch schnelles Schlagen von Zellen und Geweben auf einen Metallblock, der mit flüssigem Stickstoff oder flüssigem Helium gekühlt wird3,4; und 3) Das Hochdruckgefrieren erfolgt durch Einfrieren von Zellen und Geweben mit flüssigem Stickstoff unter hohem Druck5,6,7.
Sandwich-Gefrieren ist eine Art Tauchgefrieren, das durchgeführt wird, indem dünne biologische Materialien zwischen zwei Kupferscheiben eingeklemmt und schnell eingefroren werden, indem in flüssiges Propan getaucht wird8,9,10. Bei dieser Methode werden sehr dünne Proben (einige Mikrometer dick) mit einem Metall, das von beiden Seiten eine gute Wärmeleitfähigkeit aufweist, schnell mit Kryogen abgekühlt. So entfernt diese Methode effektiv Wärme von den Proben und ermöglicht es, Zellen stabil einzufrieren, ohne Eiskristallschäden. Sandwich-Einfrieren, gefolgt von Gefriersubstitution von lebenden Hefe- und Bakterienzellen, zeigt die natürliche Ultrastruktur der Zellen10,11,12,13,14,15,16.
Kürzlich hat sich diese Methode als nützlich erwiesen, um klare Zellbilder von Glutaraldehyd-fixierten Mikroorganismen17, 18,19,20,21,22,23,24,kultivierten Zellen 25 ,26,27undmenschlichenZellen und Geweben1,28 zu erhalten . Obwohl diese Studien mit einem handgefertigten Sandwich-Gefriergerät29durchgeführt wurden und Anwendungen für andere Studien in anderen Labors begrenzt waren, wurde ein neues Sandwich-Gefriergerät (SFD) hergestellt28 und ist jetzt kommerziell erhältlich.
Die vorliegende Arbeit zeigt, wie die SFD für das schnelle Einfrieren von biologischen Proben verwendet werden kann, einschließlich Bakterien, Hefen, kultivierten Zellen, isolierten Zellen, tierischem und menschlichem Gewebe und Viren. Gezeigt werden auch die Vorbereitung von Proben für das ultradünne Schneiden nach schnellem Einfrieren sowie Verfahren zur Gefriersubstitution, Harzeinbettung, Trimmen von Blöcken, Schneiden von ultradünnen Abschnitten, Wiederherstellen von Schnitten, Färben und Abdecken von Gittern mit Stützfolien.
Protokoll
HINWEIS: Das Protokoll der Studie für menschliche Proben wurde von der Ethikkommission für biomedizinische Forschung der Graduate School of Medicine der Chiba University (3085) genehmigt. Osmiumtetroxid ist eine gefährliche Chemikalie; es sollte mit Handschuhen im Abzug gehandhabt werden. Abbildung 1 zeigt die Sandwich-Gefriervorrichtung und die erforderlichen Werkzeuge28. Abbildung 2 zeigt die Materialien, die für die Durchführung von Sandwich-Gefrierexperimenten erforderlich sind. Glasfläschchen werden mit osmiumtetroxidhaltigem Aceton gefüllt und bis zur Verwendung bei -80 °C aufbewahrt (Abbildung 2B). Kupferscheiben haben einen Durchmesser von 3 mm, keine Löcher, haben einen Buchstaben auf einer Seite und sind kommerziell erhältlich (Abbildung 2C).
1. Schnelles Einfrieren von Zellsuspensionen zur Gefriersubstitution
HINWEIS: Die gesamte Prozedur ist in Abbildung 3 dargestellt.
- Zellen
- Verwenden Sie Zellsuspensionen von Bakterien, Hefe(Abbildung 2A),kultivierten Zellen und isolierten Zellen zum Einfrieren von Sandwiches.
HINWEIS: Es können sowohl lebende als auch Glutaraldehyd-fixierte Zellen verwendet werden28.
- Verwenden Sie Zellsuspensionen von Bakterien, Hefe(Abbildung 2A),kultivierten Zellen und isolierten Zellen zum Einfrieren von Sandwiches.
- Herstellung von flüssigem Propan
HINWEIS: Verwenden Sie Kryogloves und Schutzbrillen, wenn Sie mit flüssigem Stickstoff umgehen. Da Propan explosiv ist, sollte darauf geachtet werden, dass keine Brände im selben Raum verwendet werden, und die Fenster sollten offen gehalten werden.- Füllen Sie den Flüssigstickstoffbehälter des SFD mit flüssigem Stickstoff (Abbildung 4A). Füllen Sie den Behälter für flüssiges Propan mit flüssigem Propan, indem Sie Propangas mit einer feinen Düse einführen (Abbildung 4B, C). Beschleunigen Sie die Erstarrung von Propan mit einem gekühlten Metallstab (Abbildung 1 und Abbildung 4D,E).
- Vorbereitung von Kupferscheiben
- Legen Sie Kupferscheiben auf ein Objektträgerglas mit der No-Letter-Seite nach oben (Abbildung 2D) und behandeln Sie mit Glühentladung bei 10 Pa, 400 Volt, 1 mA für 30 s (Abbildung 4F,G), um die Scheibenoberfläche hydrophil mit einer Ionensputtervorrichtung30zu machen.
- Sandwiching und Plunge-Freezing der Zellsuspension
- Die Zellsuspension wird in ein 2-ml-Zentrifugenröhrchen(Abbildung 5A)überführt und bei 2.900 × g für 10 s bei Raumtemperatur zentrifugiert(Abbildung 5B,C). Entfernen Sie den Überstand und suspendieren Sie das Pellet, um eine dicke Suspension zu erhalten (siehe Diskussion).
- Legen Sie eine kleine Menge der Zellsuspension (~0,02 μL) auf eine Kupferscheibe (Abbildung 5D-F), bedecken Sie sie mit einer weiteren Kupferscheibe (Abbildung 5G), und heben Sie die Scheiben mit einer Pinzette auf (Abbildung 5H).
HINWEIS: Um ~0,02 μL der Zellsuspension zu messen, beobachten Sie 0,1 μL Tropfen der Suspension unter dem Stereomikroskop und teilen Sie sie in Tröpfchen auf, die 1/5 dieses Volumens betragen. - Machen Sie eine Vertiefung in der Mitte des festen Propans mit der dünnen Metallstange (Abbildung 5I). Stellen Sie die Pinzette in eine SFD und frieren Sie sie schnell ein, indem Sie den Injektionsknopf der Apparatur drücken (Abbildung 5J, K).
HINWEIS: Es sollte darauf geachtet werden, die Proben nicht zu trocknen und die beiden Scheiben nicht vollständig übereinander zu legen (sonst würde das Lösen im nächsten Schritt sehr schwierig werden).
- Sandwiching und Tauchgefrieren von tierischem und menschlichem Gewebe
- Verwenden Sie tierisches und menschliches Gewebe (~ 0,5 mm x 0,5 mm x 1,5 mm), das in 2,5% Glutaraldehyd-0,1 M Phosphatpuffer (pH 7,4) fixiert ist (Abbildung 6A,B). Schneiden Sie sie mit einer Rasierklinge unter einem Stereomikroskop in 0,1 bis 0,2 mm dicke Abschnitte (Abbildung 6C, D).
- Geben Sie einen kleinen Tropfen (~ 0,02 μL) Glutaraldehydlösung auf eine Kupferscheibe (Abbildung 6E, F). Dann verwenden Sie eine Pinzette, um ein Stück Gewebe in das Glutaraldehyd auf der Kupferscheibe zu legen (Abbildung 6G,H) und bedecken Sie es mit einer anderen Kupferscheibe ( Abbildung6I-K).
- Schnell frieren Sie die Scheiben mit den Geweben im schmelzenden Propan der SFD ein, wie in Abschnitt 1.4 beschrieben (Abbildung 5J, K).
HINWEIS: Da Glutaraldehyd eine gefährliche Chemikalie ist, sollte es mit Handschuhen im Abzug gehandhabt werden. Gewebe sollten nicht mit Puffern gewaschen werden, wenn sie auf eine Kupferscheibe gelegt werden, sondern in Glutaraldehydlösung getränkt bleiben, da Glutaraldehyd eine Frostschutzwirkung hat1.
- Verwenden Sie tierisches und menschliches Gewebe (~ 0,5 mm x 0,5 mm x 1,5 mm), das in 2,5% Glutaraldehyd-0,1 M Phosphatpuffer (pH 7,4) fixiert ist (Abbildung 6A,B). Schneiden Sie sie mit einer Rasierklinge unter einem Stereomikroskop in 0,1 bis 0,2 mm dicke Abschnitte (Abbildung 6C, D).
- Gefriersubstitution mit Osmiumaceton
- Die Scheiben werden in einem Arbeitsbad in flüssigen Stickstoff überführt (Abbildung 7A,B). Mit einer in flüssigem Stickstoff gekühlten Pinzette die Scheiben voneinander lösen, um die Probe freizulegen (Abbildung 7C-E).
- Legen Sie die Scheiben mit den Zellen in eine Glasfläschchen (Abbildung 7F), die mit 1 ml Aceton gefüllt ist, das 2% Osmiumtetroxid enthält (Abbildung 2B), das in flüssigen Stickstoff gegeben und erstarrt ist (Abbildung 4H).
- Die Scheiben in einen Tiefkühlschrank überführen und 2-4 Tage bei -80°C aufbewahren, um die Zellen einzufrieren (Abbildung 3). Die gebrauchte Pinzette bei Raumtemperatur in Wasser einweichen, um sie zu erwärmen (Abbildung 7G) für das Einfrieren der folgenden Proben.
HINWEIS: Eine Pinzette für die Handhabung der Probe sollte warm sein (Raumtemperatur), da eine kalte Pinzette die Probe vor dem schnellen Einfrieren einfrieren kann, was zur Bildung von Eiskristallen führt.
- Probenerwärmung und -einbettung
- Bringen Sie die Proben allmählich auf Raumtemperatur (2 h bei -20 ° C, 2 h bei 4 ° C und 15 min bei Raumtemperatur, Abbildung 3 und Abbildung 8A) und übertragen Sie die Scheiben auf 2-ml-Kunststoffröhrchen, die mit 1 ml Aceton gefüllt sind (Abbildung 3 und Abbildung 8B,C).
- Bereiten Sie Epoxidharz vor, indem Sie die Reagenzien in einem Einwegbehälter aus Kunststoff mit einem Rührer mischen (Abbildung 8D-F).
- Tauschen Sie das Aceton in Schritt 1.7.1 nacheinander mit 30% Harz (in Aceton), 60% Harz und 90% Harz bei Raumtemperatur für jeweils 1 h aus. Tauschen Sie dann das 90% Harz über Nacht gegen 100% Harz bei 37 ° C aus. Schließlich werden die Proben in 100% Harz(Abbildung 8G-J)in die Silikoneinbettungsform eingebettet und bei 60 °C für 24 h polymerisiert (Abbildung 3).
HINWEIS: Die Proben sollten während des gesamten Verfahrens an den Kupferscheiben befestigt bleiben (um das Schneiden zu erleichtern). Die Verwendung eines rotierenden oder schüttelnden Geräts wird während des Einbettungsprozesses nicht empfohlen, da sie wenig zum Eindringen des Harzes in die Zelle beitragen. Darüber hinaus führt die Vibration der Apparatur manchmal dazu, dass sich die Proben von den Kupferscheiben lösen. Eine Inkubation bei 37 ° C über Nacht würde das Eindringen des Harzes in die Zelle aufgrund der thermischen Energie beschleunigen (das Harz würde nicht polymerisieren, da es keinen Beschleuniger enthält).
- Beschneiden von Probenblöcken
- Nehmen Sie die polymerisierten Blöcke aus den Silikoneinbettungsformen heraus (Abbildung 9A). Schreiben Sie die Probennummer auf den Block (Abbildung 9B).
- Entfernen Sie die Kupferscheiben mit einer Rasierklinge aus dem Block (Abbildung 9C,D), und schneiden Sie die auf der Blockoberfläche eingebetteten Proben mit einer Ultraschall-Trimmklinge ( Abbildung 9E ) und Rasierklingen ( Abbildung9F-H) unter einem Stereomikroskop31 auf 0,7 mm x 0,7mm ab.
- Setzen Sie den Block in einen Probenhalter eines Ultramikrotoms (Abbildung 9I) und schneiden Sie die Vorderseite des Blocks mit einem Diamantschneidmesser glatt ab (Abbildung 9J, K).
- Schneiden von ultradünnen Abschnitten
- Entfernen Sie den Block aus dem Ultramikrotom (Abbildung 10A)31, setzen Sie ihn in ein Stereomikroskop, und schneiden Sie ihn mit einer Rasierklinge weiter auf 0,2 mm x 0,3 mm zu (Abbildung 10B, C).
- Tragen Sie Neopren auf die Gitter auf, um sie klebrig zu machen (Abbildung 10D). Setzen Sie den Block wieder auf das Ultramikrotom, bedecken Sie das Ultramikrotom mit einer Kunststoffabdeckung (Abbildung 10E)31, und schneiden Sie 50-70 nm dicke Abschnitte (Abbildung 10F-H).
- Rufen Sie die Abschnitte mit einer Schleife auf (Abbildung 10I), montieren Sie sie auf 300 oder 400 Mesh Kupfergittern, die mit Neopren behandelt wurden, und trocknen Sie sie (Abbildung 10J).
- Färbung von Schnitten und Beobachtung unter dem Elektronenmikroskop
- Die Gitter mit Abschnitten in der Nut des halben Silikonschlauches (Abbildung 11A)31) setzen und in Uranylacetatlösung und Bleicitrat jeweils 3 min zur Färbung einweichen (Abbildung 11B-E)32.
- Für Hefe- und Pilzproben legen Sie die Gitter auf ein Filterpapier (4 mm x 4 mm), nehmen Sie sie mit einer Pinzette auf und bedecken Sie sie mit plasmapolymerisiertem Naphthalinfilm33 auf der Wasseroberfläche (Abbildung 11F,G). Setzen Sie die Gitter in ein Elektronenmikroskop ein und beobachten Sie bei 100 kV (Abbildung 11H,I).
2. Schnelles Einfrieren von Viren und Makromolekülen
- Herstellung von flüssigem Ethan
HINWEIS: Verwenden Sie Kryogloves und Schutzbrillen, wenn Sie mit flüssigem Stickstoff umgehen. Da Ethan explosiv ist, sollte darauf geachtet werden, dass keine Brände im selben Raum verwendet werden, und die Fenster sollten offen gehalten werden. Ethan wird verwendet, weil es im Elektronenmikroskop verdampft, während Propan dies nicht tut.- Füllen Sie den Flüssigstickstoffbehälter des SFD mit flüssigem Stickstoff. Füllen Sie den Behälter mit flüssigem Ethan, indem Sie Ethangas durch eine feine Düse einführen.
- Vorbereitung und schnelles Einfrieren von Microgrids und Proben
- Machen Sie beide Seiten der Mikronetze hydrophil, indem Sie sie mit einer Ionensputtervorrichtung30mit Glühentladung (10 Pa, 400 V, 1 mA) behandeln.
- Stellen Sie das Mikrogitter in der SFD ein und tragen Sie 2 μL des Virus oder der makromolekularen Suspension (1 mg Protein/ml) auf die Mikrogitter auf. Entfernen Sie überschüssige Flüssigkeit mit Filterpapier und frieren Sie das Mikronetz schnell ein, indem Sie den Injektionsknopf des Geräts drücken.
- Setzen des gefrorenen Mikronetzes in einen Kryo-Transferhalter und Beobachtung unter dem Elektronenmikroskop
- Übertragen Sie die gefrorenen Mikronetze in flüssigen Stickstoff, setzen Sie sie in einen kryo-transferhalter, der zuvor bei flüssiger Stickstofftemperatur gekühlt wird, und beobachten Sie unter einem Elektronenmikroskop bei niedriger Temperatur34.
Ergebnisse
Lebende Zellen von Mikroorganismen in Suspension wurden durch Zentrifugation gesammelt, zwischen zwei Kupferscheiben eingeklemmt, schnell mit SFD eingefroren, gefriersubstituiert, in Epoxidharz eingebettet, ultradünn geschnitten, gefärbt und unter einem Elektronenmikroskop nach den oben beschriebenen Verfahren beobachtet. Abbildung 12 zeigt ultradünne Abschnitte von Escherichia coli (Bakterien, Abbildung 12A,B)16 und Saccharomyces cerevisiae (Hefe, Abbildung 12C)15. Beachten Sie, dass die Bilder sehr klar sind und eine natürliche Morphologie zeigen.
Glutaraldehyd-fixierte Zellsuspensionen von kultivierten Zellen und isolierten tierischen Zellen wurden gesammelt und schnell mit SFD eingefroren, gefriersubstituiert und unter einem Elektronenmikroskop beobachtet, indem die oben beschriebenen Verfahren befolgt wurden. Abbildung 13 zeigt ultradünne Schnitte von kultivierten Zellen (Abbildung 13A-C)1,28 und isolierten Zellen aus der Bauchhöhle der Maus ( Abbildung13D)28. Abbildung 14 zeigt ultradünne Abschnitte der menschlichen Haut (Abbildung 14A-D) und des Buffy-Fells ( Abbildung14E)1. Beachten Sie, dass die Bilder auch sehr klar sind und eine natürliche Morphologie zeigen. Abbildung 15 zeigt Hepatitis-B-Viruskernpartikel, die schnell mit SFD eingefroren und durch Kryo-Elektronenmikroskopiebeobachtet wurden 34. Wie bei den anderen Zellen sind die Bilder sehr klar und zeigen eine natürliche Morphologie.
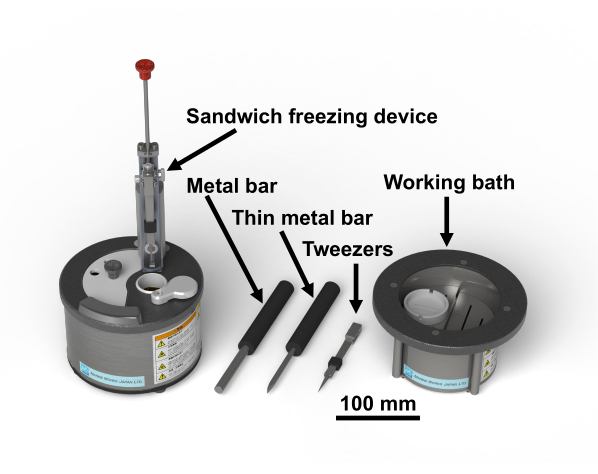
Abbildung 1: Sandwich-Gefriervorrichtung28 und die notwendigen Werkzeuge. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Materialien, die für die Durchführung von Sandwich-Gefrierversuchen erforderlich sind. (A) Probe: Leichte Mikroaufnahme von Saccharomyces cerevisiae (Hefe). Maßstabsbalken = 10 μm. (B) Glasfläschchen (10 ml) mit 1 mL Aceton mit 2% Osmiumtetroxid. (C) Kupferscheiben, die eine Fläche ohne Buchstaben (links) und eine Fläche mit einem Buchstaben (rechts) zeigen. Maßstabsleiste = 3 mm. Rasterelektronenmikroskopie. (D) Kupferscheiben ohne Buchstabenseite nach oben wurden mit doppelseitigem Klebeband (*) auf einen Glasobjektträger gelegt. Mensur = 3 mm. (E) Ein zweischneidiges Rasiermesser und ein gebrochenes zweischneidiges Rasiermesser zum Schneiden von tierischem und menschlichem Gewebe, ein einschneidiges Rasiermesser zum Trimmen von Blöcken und geschreddertes Brett zum Schneiden von tierischem und menschlichem Gewebe. (F) Pinzette mit extrudiertem Polystyrolschaum zum Schutz der Finger vor Kälte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
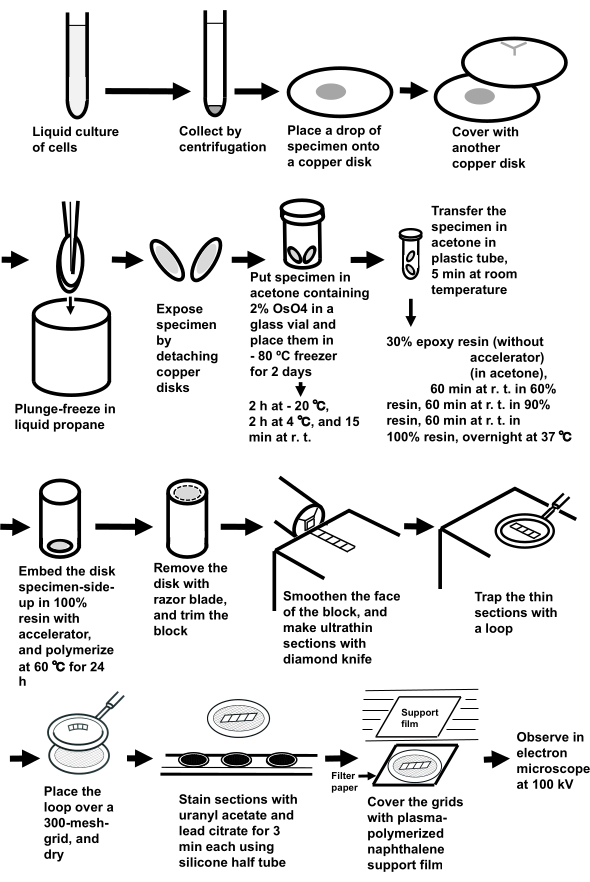
Abbildung 3: Probenvorbereitung von Zellsuspensionen nach dem Sandwich-Gefrierverfahren. Abkürzungen: r.t. = Raumtemperatur. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Herstellung von flüssigem Propan, Kupferscheiben und Fixiermittel. (A) Flüssiger Stickstoff (Pfeil) wurde in den Flüssigstickstoffbehälter der Sandwich-Gefriervorrichtung gegossen. (B) Propangas wurde durch eine feine Düse in einen flüssigen Propanbehälter eingebracht. (C) Flüssiges Propan (Pfeil). (D)Ein Metallstab (Pfeil) wurde verwendet, um flüssiges Propan zu kühlen, um die Erstarrung von flüssigem Propan zu beschleunigen. (E) Erstarrtes Propan (Pfeil). (F) Ionensputterapparatur (Pfeil) zur Herstellung von Kupferscheiben hydrophil mit Glühentladung. (G) Glühentladung. (H) Durchstechflaschen aus Glas in flüssigem Stickstoff in einem Arbeitsbad. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Schnelles Einfrieren der Zellsuspension (Hefe) mit der Sandwich-Gefriervorrichtung. (A) Übertragung der Hefekultur in das Zentrifugenröhrchen. B) Mikrozentrifuge. (C) Pellet von Saccharomyces cerevisiae im Zentrifugenröhrchen (Pfeil). ( D) Übertragung der Probe mit einer Mikropipette aus dem Zentrifugenröhrchen. E) Die Probe wird auf die Kupferscheibe gelegt. (F) Ein kleiner Tropfen einer Probe auf der Kupferscheibe (Pfeil). (G) Abdeckung der Probe mit einer weiteren Kupferscheibe. (H) Aufheben der beiden Scheiben mit einer Pinzette. (I) Herstellen einer Vertiefung im festen Propan unter Verwendung der dünnen Metallstange. (J) Eintauchen der Probe durch Drücken des Injektionsknopfes. (K) Das Einfrieren ist abgeschlossen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Vorbereitung einer Probe menschlicher Gewebe (Haut). (A, B) Menschliches Hautgewebe fixiert in Glutaraldehyd in einer Petrischale. Mensurbalken = 5 mm. (C, D) Taschentücher (Pfeil) wurden mit zwei zweischneidigen Rasierern auf einem zerkleinerten Brett geschnitten. (E, F) Ein kleiner Tropfen Glutaraldehydlösung (Pfeil) wurde auf eine Kupferscheibe gegeben. (G, H) Ein Stück Hautgewebe wurde mit einer Pinzette auf die Kupferscheibe gelegt. (I) Eine andere Scheibe wurde verwendet, um die Kupferscheibe mit dem Hautgewebe zu bedecken. (J) Die Sandwichscheiben wurden mit einer Pinzette aufgenommen. (K) Die Sandwichscheiben wurden vorsichtig mit einer Pinzette gehalten. Beachten Sie den Abstand zwischen den Pinzettenspitzen (Pfeil), der aufrechterhalten wird, um ein Zerquetschen des Gewebes zu vermeiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Bild 7: Überführung der Probe in flüssigen Stickstoff und Lösen der Scheiben. (A) Übertragung der Scheiben (Pfeil) in flüssigen Stickstoff in einem Arbeitsbad. (B) Scheiben aus flüssigem Stickstoff (Pfeil). (C) Pinzetten wurden in flüssigen Stickstoff gelegt, um sie im Arbeitsbad zu kühlen. (D, E) Abnehmen der Kupferscheiben (Pfeile) mit einer Pinzette. (F) Übertragen der Scheibe (Pfeil) in die Glasfläschchen mit einer Pinzette. (G) Erwärmen der Pinzette in Wasser zum Einfrieren des nächsten Exemplars. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Erwärmung und Einbettung der Proben. (A) Proben in Glasfläschchen bei Raumtemperatur. (B) Übergabe der Scheiben (Pfeil) in ein 2 ml Kunststoffrohr mit Pinzette. (C) Kupferscheiben (Pfeil) in Aceton in einem Kunststoffrohr. (D) Messharze mit einem Injektionsrohr (Pfeil). (E) Das Harz in einen Einwegbecher (Pfeil) überführen. (F) Mischen des Harzes mit einem Rührer. (G) Eine kleine Menge Harz wurde in die Löcher der Silikoneinbettungsform gegeben. (H) Überschüssiges Harz in den Gittern wurde mit Filterpapier entfernt. (I, J) Kupferscheiben mit Proben wurden mit der Probenseite nach oben in den Boden der Löcher der Einbettungsform gelegt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Bild 9: Beschneiden des Probenblocks. (A) Herausnehmen polymerisierter Blöcke aus den Einbettformen. (B) Auf dem Block stand eine Musternummer. (C, D) Die Kupferscheibe wurde mit einem Rasiermesser aus dem Block entfernt. Mensur für (D) = 1 mm. (E-G) Die Probe wurde mit einer Ultraschall-Schneidklinge und einer Rasierklinge beschnitten. Maßstabsbalken für (G) = 1 mm. (H) Hohe Vergrößerung von (G). Ein einzelner Lichtblick ist eine Zelle. Die Zellen wurden in eine einzige Schicht10eingebettet. Mensur = 10 μm. (I-K) Die Oberfläche des Blocks wurde mit einem Diamantschneidmesser glatt geschnitten. Maßstabsleiste für (K) = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Bild 10: Schneiden ultradünner Schnitte. (A) Der Probenblock wurde aus dem Mikrotom31entfernt. (B, C) Das Exemplar wurde mit einer Rasierklinge weiter beschnitten. Maßstabsleiste für (C) = 0,5 mm. (D) Neopren wurde auf Gitter aufgetragen, damit sie haften. (E) Das Ultramikrotom wurde mit Kunststoff bedeckt, um einen Luftstrom während des ultradünnen Schneidens zu vermeiden. (F) Das Diamantmesserboot war mit Wasser gefüllt. (G, H) Ultradünne Schnitte wurden auf eine Dicke von 70 nm geschnitten. Maßstabsbalken für (H) = 1 mm. (I, J) Die Schnitte wurden mit einer Schlaufe entnommen und anschließend getrocknet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Bild 11: Färbeschnitte. (A) Die Gitter wurden in die Nut des halben Silikonschlauches gelegt. (B) Sie wurden zur Färbung in Uranylacetat eingeweicht. (C) Das verwendete Uranylacetat wurde auf selbstversiegelnder Wachsfolie gesammelt. (D) Die Gitter wurden mit einem Wasserstrahl gewaschen und (E) dann in Bleicitrat getränkt. (F) Plasmapolymerisierte Naphthalinfolie wurde auf Wasser geschwommen und (G) verwendet, um ein Gitter abzudecken, das auf 4 mm x 4 mm Filterpapier platziert wurde. (H) Das Gitter wurde in einen Probenhalter gelegt und (I) in einem Elektronenmikroskop beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
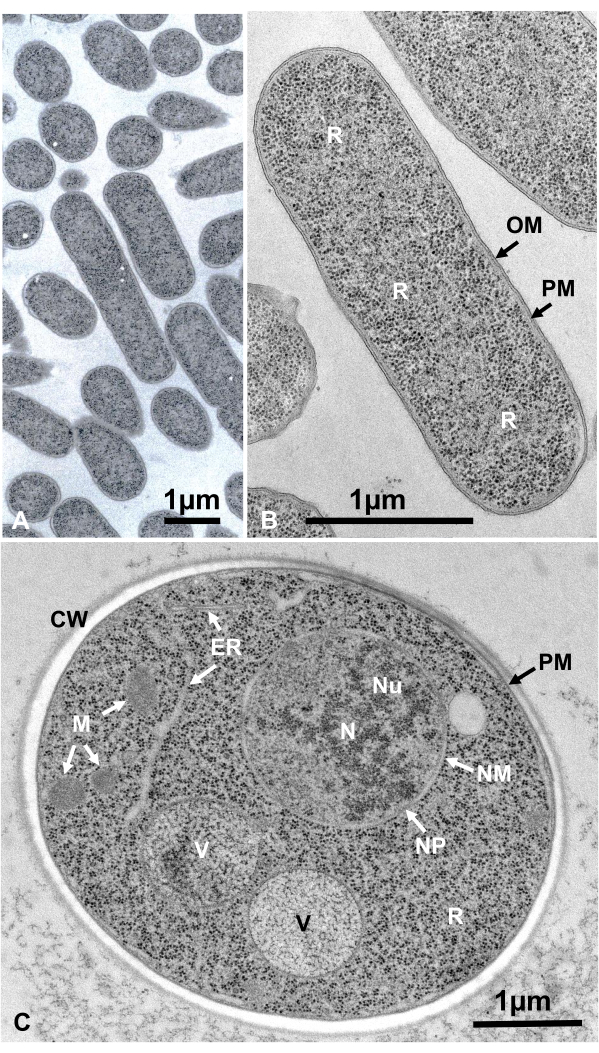
Abbildung 12: Ultradünne Abschnitte von Escherichia coli (Bakterien, A, B) und Saccharomyces cerevisiae (Hefe, C). (A) Es ist zu beachten, daß die Proben dicht und homogen eingebettet sind und keine Verformung aufweisen. (B, C) Membranstrukturen zeigen eine klare und glatte Morphologie, und Ribosomen sind klar genug, dass jedes Partikel aufgezählt werden kann16. (C) Hefekern und Vakuolen zeigen eine echte Kreisform, die ihre natürliche Morphologie sein kann. Die Matrix der Mitochondrien zeigt ein elektronendichtes Aussehen, was ein Merkmal lebender Zellen sein kann, die durch schnelles Einfrieren fixiert werden. Maßstabsbalken = 1 μm. Abkürzungen: CW = Zellwand; ER = endoplasmatisches Retikulum; NM = Kernmembran; NP = Kernporen; OM = äußere Membran; PM = Plasmamembranen; R = Ribosomen; N = Kern; M = Mitochondrien. (B) ist mit Genehmigung von Yamada et al.16 wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
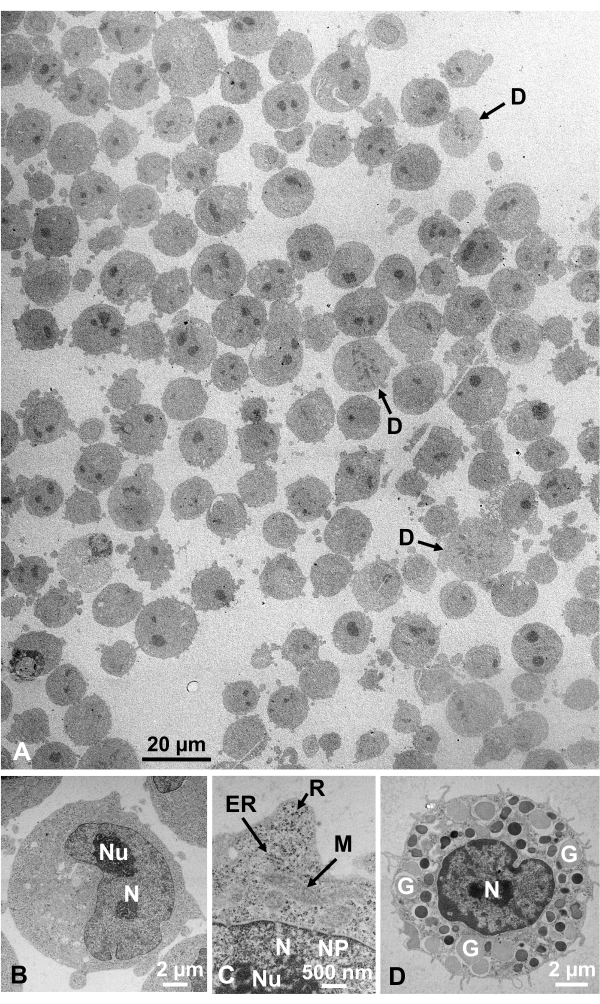
Abbildung 13: Ultradünne Abschnitte. (A-C) K562 kultivierte Zellen. (D) Eine isolierte Mastzelle aus der Maus. (A) Es ist zu beachten, daß die Proben dicht und homogen eingebettet sind und keine Verformung aufweisen. Maßstabsbalken = 20 μm. (B-D) Bei hoher Vergrößerung werden Kern, Nukleolus, Kernmembran, Kernporen, endoplasmatisches Retikulum, Mitochondrien, Ribosomen und Granula deutlich beobachtet. Maßstabsbalken = 2 μm (B), 500 nm (C), 2 μm (D). Abkürzungen: N = Kern; Nu = Nukleolus; NM = Kernmembran, NP = Kernporen; ER = endoplasmatisches Retikulum; M = Mitochondrien; R = Ribosomen; G = Granulat; D = sich teilende Zellen. (A) ist mit Genehmigung von Yamaguchi et al.1 wiedergegeben. (B-D) werden von Yamaguchi et al.28 mit Genehmigung reproduziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
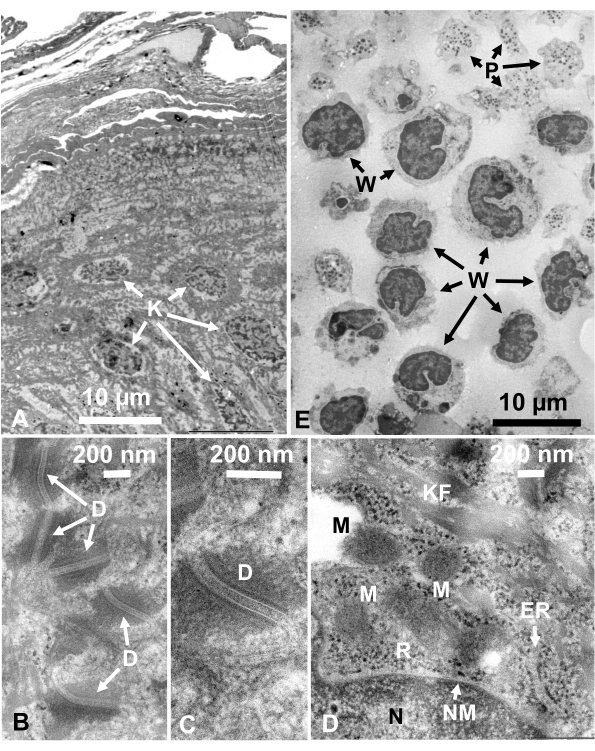
Bild 14: Ultradünne Abschnitte. (A-D) menschliche Haut und (E) Buffy Fell. (A-E) Beachten Sie, dass Gewebe- und Zellbilder klar und natürlich sind und einen guten Kontrast aufweisen, obwohl die Abschnitte sehr dünn sind (50 nm). Die Matrix der Mitochondrien zeigt ein dichtes Aussehen, das dem von dichten mitochondrialen Matrizen schnell gefrorener lebender Zellen ähnelt (D). Maßstabsbalken = 10 μm (A, E), 200 nm (B-D). Abkürzungen: D = Desmosomen; ER = endoplasmatisches Retikulum; K = Keratinozyten; KF = Keratinfasern; M = Mitochondrien; N = Kern; NM = Kernmembran; P = Thrombozyten; R = Ribosomen; W = weiße Blutkörperchen. Reproduziert von Yamaguchi et al.28 mit Genehmigung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
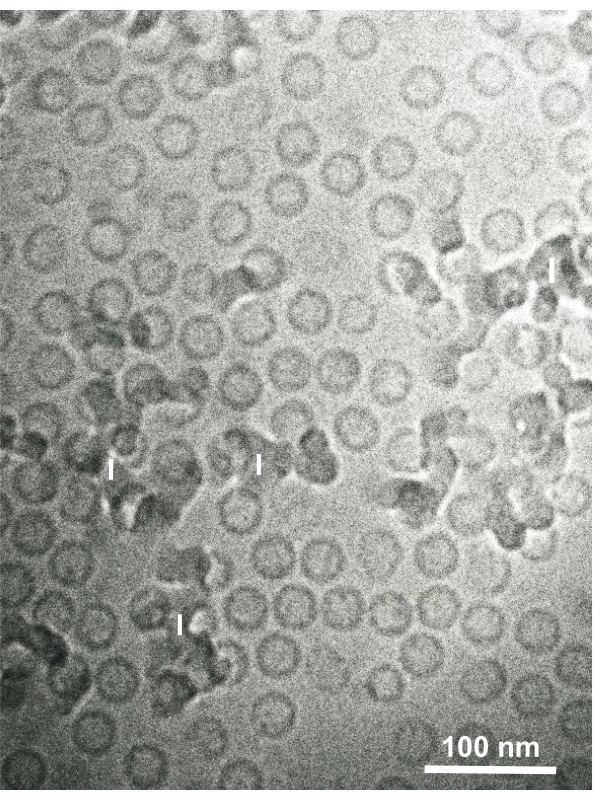
Abbildung 15: Kernpartikel des Hepatitis-B-Virus (HBV), die mit dem Sandwich-Gefriergerät schnell mit flüssigem Ethan eingefroren und durch Kryo-Elektronenmikroskopie beobachtet wurden. Sphärische Hohlpartikel sind HBV-Kernpartikel. Maßstabsleiste = 100 nm. Abkürzungen: HBV = Hepatitis-B-Virus; I = Eis. Reproduziert von Yamaguchi et al.28 mit Genehmigung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die folgende Diskussion basiert auf mehr als 120 Sandwich-Gefrier-Gefrier-Substitutionsexperimenten an mehr als 1.000 Proben und mehr als 70 Tauch-Gefrier-Kryo-Elektronenmikroskopie-Experimenten an mehr als 75 Proben, die über 36 Jahre durchgeführt wurden.
Erfolgsquote für gutes Einfrieren durch Sandwich-Einfrieren
Die Erfolgsquote beim Erreichen eines guten Einfrierens hängt von den Proben ab. Saccharomyces cerevisiae (Hefe) Zellen, die in YPD-Medium (1% Hefeextrakt, 2% Pepton, 2% Dextrose) kultiviert wurden, gaben fast 100% Erfolg für gutes Einfrieren ohne Eiskristallbildung10,11,15,35,36. Andere Hefearten, einschließlich Shizosaccharomyces37,38,39,Cryptococcus14,40,41,42,43,44,45, Exophiala13,41,46,47,48, 49, Fusarium50,51,52, Aureobasidium53, Candida54,55, Fellomyces56, Aspergillus57und Trichosporon zeigten ebenfalls ein gutes Einfrieren. Bakterien, darunter Mycobacterium58,59 und E. coli16, zeigten ebenfalls ein gutes Einfrieren. Kultivierte Zellen und isolierte tierische Zellen zeigten ein gutes Einfrieren sowohl für lebende als auch für Glutaraldehyd-fixierte Zellen1,25,26,27,60. Glutaraldehyd-fixierte tierische und menschliche Gewebe, die auf 0,1 bis 0,2 mm Dicke geschnitten wurden, zeigten auch die meiste Zeit ein gutes Einfrieren1,28.
Bedingungen für ein gutes Einfrieren
Verwenden Sie nur Zellen im entsprechenden Wachstumsstadium und Zustand. Zellen in Kultur sollten sich in der exponentiellen Phase befinden. Tragen Sie sehr geringe Mengen an Zellsuspensionen konzentrierter Proben (für S. cerevisiae, ~ 0,02 μL von 3-5 × 109 Zellen / ml) auf die Kupferscheibe auf. Glutaraldehyd-fixierte Scheiben tierischen oder menschlichen Gewebes sollten ebenfalls sehr klein sein (vorzugsweise 0,3 mm x 0,3 mm x 0,1 mm). Da das Schneiden von 0,1 mm dicken Gewebescheiben schwierig ist, schneiden Sie viele Gewebe in Scheiben und wählen Sie dünne und halbtransparente Scheiben aus. Arbeiten Sie schnell, aber vorsichtig und lassen Sie die Proben nicht austrocknen. Wenn Sie die gestapelten Kupferscheiben mit einer Pinzette aufnehmen, drücken Sie die Scheiben nicht zu stark an, um zu vermeiden, dass die Zellen und Gewebe zerquetscht werden. Die Probenbeladung ist der wichtigste Schritt für ein erfolgreiches Einfrieren, und die erforderlichen Bedingungen sind die gleichen wie die Bedingungen für ein gutes Einfrieren beim Hochdruckgefrieren. Leser sollten sich auf die ausgezeichnete Rezension von McDonald61beziehen.
Sonstige Anwendungen
Diese Arbeit präsentiert elektronenmikroskopische Aufnahmen eines Bakteriums, einer Hefe, von kultivierten Zellen, isolierten tierischen Zellen, menschlichen Geweben und Viruspartikeln. Wir beobachteten ein gutes Einfrieren von Glutaraldehyd-fixierten Meeresalgen. Die Zellstrukturen lebender Süßwasser-Grünalgen wurden jedoch durch Eiskristallbildung zerstört. Das Mischen von Zellen mit 20% Rinderserumalbumin (BSA) stellte sicher, dass die Ultrastruktur gut erhalten blieb und keine Eiskristallschäden verursacht wurden. Die Verwendung von 20% BSA war auch vorteilhaft für die Erhaltung der Ultrastruktur von Stielzellen eines Pilzes. Experimente zum Einfrieren von Pflanzenzellen und -geweben durch Anwendung von 20% BSA sind im Gange. Obwohl die Rasterelektronenmikroskopie von Sandwich-Gefrier-Gefrier-substituierten Proben nicht versucht wurde, wurde zuvor über die Beobachtung gut erhaltener Zellstrukturen berichtet9.
Hinweise zur Sandwich-Gefriermethode
Die nah-native Ultrastruktur von Zellen lässt sich am besten durch schnelles Einfrieren und Gefriersubstitution lebender Zellen beobachten. Die Eiskristallbildung mit der SFD kann vermieden werden, indem die Dicke der Zellen auf ≤30 μm1begrenzt wird. Die Fixierung von Geweben mit Glutaraldehyd führt oft zu einer besseren Erhaltung der Zellstruktur für die Beobachtung von Suspensionskulturzellen, da die Glutaraldehydfixierung die Zellstruktur steifer macht und mögliche ultrastrukturelle Veränderungen während der Sammlung und Zentrifugation lebender Zellen verhindert1. Die Glutaraldehyd-Fixierung ermöglicht auch die Erweiterung der Gefriertiefe auf bis zu 0,2 mm1,ähnlich wie beim Hochdruckgefrieren (HPF). Daher kann die HPF-Maschine durch die SFD für das Tiefgefrieren von tierischem und menschlichem Gewebe ersetzt werden.
Da Glutaraldehyd-fixierte Gewebe länger als 2 Jahre28gelagert werden können, kann das Einfrieren von Sandwiches nach Belieben des Benutzers durchgeführt werden. Die Fixierung von Geweben mit Glutaraldehyd erleichtert auch die Gewebeschnitte, da die Gewebe mit der Fixierung starrer werden. Im Gegensatz zur HPF-Maschine kann die SFD zum schnellen Einfrieren von Viren für die Kryo-Elektronenmikroskopie sowie für Bakterien und eukaryotische Zellen verwendet werden. Darüber hinaus ist die SFD im Vergleich zur HPF-Maschine klein, tragbar, kostengünstiger und kann von mehr Labors erworben werden. Wir hoffen, dass diese Merkmale der SFD mehr Laboren helfen, ihre Forschungsziele zu erreichen28.
Merkmale der natürlichen Morphologie von Zellen
Zellstrukturen befinden sich in ihrem natürlichen Zustand, wenn sie folgendes Aussehen aufweisen: Membranstrukturen der äußeren Membran (Abbildung 12A, B), Plasmamembran ( Abbildung12B,C; Abbildung 13A-D; und Abbildung 14E), Kernhülle (Abbildung 12C, Abbildung 13B-Dund Abbildung 14D-E), Mitochondrien ( Abbildung12C, Abbildung 13Cund Abbildung 14D) und Vakuolen ( Abbildung12C) zeigen glatte Konturen. Der Kern und die Vakuolen sind fast kreisförmig (Abbildung 12C). Ribosomen zeigen ein klares elektronendichtes Aussehen mit einem Durchmesser von ~20 nm (Abbildung 12B,C; Abbildung 13C; und Abbildung 14D). Das Zytoplasma ist elektronenluzent (Abbildung 12B, C; Abbildung 13C; und Abbildung 14D).
Einfluss der Glutaraldehyd-Fixierung auf die Zellmorphologie
Die Glutaraldehyd-Fixierung wurde für tierisches oder menschliches Gewebe vor dem Einfrieren des Sandwiches durchgeführt, um eine eiskristallfreie Ultrastruktur zu erhalten. Die mit dieser Methode erhaltenen Mikroaufnahmen zeigen exquisit klare Bilder, die denen ähneln, die durch schnelles Einfrieren von lebendem Gewebe erhalten wurden (Abbildung 14)1. Die Untersuchungen an Hefezellen, Tiefseemikroorganismen und kultivierten Zellen zeigen, dass die Verformung der Ultrastruktur hauptsächlich auf die Fixierung und Dehydratisierung von Osmiumtetroxid durch Ethanol bei Raumtemperatur1,17,18,28zurückzuführen ist. Small berichtete auch, dass, obwohl die Glutaraldehyd-Fixierung die Organisation von Aktin in kultivierten Fibroblasten nicht zerstört, die Osmiumtetroxid-Fixierung und Dehydratisierung durch Aceton oder Ethanol bei Raumtemperatur die Aktinorganisation62zerstören.
Daher sollte eine detaillierte Studie über die Auswirkungen der Glutaraldehyd-Fixierung auf die Zellmorphologie durchgeführt werden. Ohno entwickelte eine In-vivo-Kryofixierungsmethode, bei der lebende Gewebe schnell eingefroren werden, ohne die Blutversorgung zu stoppen63. Die Gewebe wurden gefriersubstituiert und in Epoxidharz eingebettet, und ultradünne Abschnitte wurden beobachtet. Die elektronenmikroskopischen Bilder zeigten die native Ultrastruktur lebender Gewebe am nächsten an der Natur im Vergleich zu denen, die durch chemische Fixierung-konventionelle Dehydratisierung und durch das schnelle Einfrieren von frischem, nicht fixiertem Gewebe erhalten wurden. Daher kann es interessant sein, die Ultrastruktur zu vergleichen, die durch Glutaraldehyd-Fixierungs-Gefrier-Substitution (die vorliegende Methode) und die durch In-vivo-Kryofixierung-Gefrier-Substitution erhalten wird, um die Auswirkungen der Glutaraldehyd-Fixierung zu untersuchen.
Berücksichtigung der Umwelt und Steigerung der experimentellen Effizienz
Wir verwenden 2 mL Kunststoffröhrchen für die Substitution des Harzes. Ein ml verdünntes Harz reicht für jeden Substitutionsschritt aus. Die verwendeten Kunststoffröhrchen dürfen nach jedem Versuch entsorgt werden. Dies kann Zeit und Mühe beim Waschen von Glasfläschchen sparen, wenn sie zur Harzsubstitution verwendet werden. Zusätzlich kann Uranylacetatlösung wiederholt zur Schnittfärbung32verwendet werden. Nach dem Färben der Abschnitte kann die Uranylacetatlösung gespeichert und wiederverwendet werden. Da Uranylacetat eine radioaktive Substanz ist, hilft seine Wiederverwendung, die Entstehung von Abfällen zu vermeiden und trägt zum Schutz der Umwelt bei.
Plasmapolymerisierte Naphthalinfolie
Plasmapolymerisierter Naphthalinfilm ist ein dreidimensional polymerisierter Kohlenstofffilm, der aus Naphthalingas durch Plasmapolymerisation unter Glühentladung33hergestellt wird. Die Folie ist widerstandsfähig gegen Elektronenbeschuss und Chemikalien, sehr sauber, transparent gegen Elektronen und hat eine flache Oberfläche und amorphe Struktur. Somit ist die plasmapolymerisierte Naphthalinfolie, die im Handel erhältlich ist, hervorragend und wird als Trägerfilm empfohlen.
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt.
Danksagungen
Nichts
Materialien
| Name | Company | Catalog Number | Comments |
| Sandwich Freezing Device | Marine works Japan, Ltd, Yokosuka, Japan | MW-SFD-01 | with metal bar, thin metal bar, tweezers, and working bath |
| 10 mL glass vials | - | Scintillation counter vials for fixative | |
| Acetone | - | ||
| Osmium tetroxide | Nisshin EM Co. Ltd., Tokyo | 3004 | 0.1 g |
| Deep freezer | Sanyo Co. Ltd., Osaka | MDF-C8V1 | |
| Copper disk | Nisshin EM Co. Ltd., Tokyo | - | Refer to this paper |
| Slide glass | - | ||
| Double-sided adhesive tape | - | ||
| Single-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FAS-10 |
| Double-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FA-10 |
| Shredded board | Nisshin EM Co. Ltd., Tokyo | 428 | |
| Tweezers | Nisshin EM Co. Ltd., Tokyo | - | Several pairs |
| Tweezers with polystyrene foam | - | One pair | |
| Glutaraldehyde | Nisshin EM Co. Ltd., Tokyo | 3052 | |
| Liquid nitrogen | - | ||
| Propane gas | - | Cryogen | |
| Ion sputter apparatus | Hitachi high technologies, Tokyo | Hitachi E102 | |
| Micropipette | - | For 1 mL, 200 μL, and 2 μL | |
| Microcentrifuge | Tomy digital biology Co. Ltd., Tokyo | Capsulefuge, PMC-060 | |
| Stereomicroscope | Nikon Co. Ltd., Tokyo et al. | - | SMZ 645 |
| LED illumination for stereomicroscope | Nikon Co. Ltd., Tokyo et al. | SM-LW 61 Ji | |
| Disposable plastic container | - | 50 mL and 200 mL | |
| Ethane gas | - | Cryogen | |
| 2 mL Eppendorf tubes | - | For embedding | |
| Disposable plastic syringes | - | 1 mL, 5 mL, 10 mL, and 20 mL | |
| Magnetic stirrer | - | ||
| Epoxy resin | Nisshin EM Co. Ltd., Tokyo | 340 | Quetol 812 set |
| Silicon embedding mold | Nisshin EM Co. Ltd., Tokyo | 4217 | 7 mm in diameter, 13 mm deep |
| Incubater | - | For 37 °C and 60 °C | |
| Trimming stage | Sunmag Co. Ltd., Tokyo | - | Tilting mechanism equipped, Refer to this paper |
| LED illumination for trimming stage | Sunmag Co. Ltd., Tokyo | - | Refer to this paper |
| Ultrasonic Trimming Blade | Nisshin EM Co. Ltd., Tokyo | 5240 | EM-240, Refer to this paper |
| Ultramicrotome | Leica Microsystems, Vienna | Ultracut S | |
| Grids | Nisshin EM Co. Ltd., Tokyo | 2633, 2634 | 300 mesh, 400 mesh |
| 0.5% Neoprene W solution | Nisshin EM Co. Ltd., Tokyo | 605 | |
| Perfect Loop | Nisshin EM Co. Ltd., Tokyo | 2351 | Fot retrieving sections |
| Half Tube for section staining | Nisshin EM Co. Ltd., Tokyo | 463 | Refer to this pape |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Syringe filter | Toyo Roshi Kaisha, Ltd., Tokyo | DISMIC-03CP | Cellulose acetate, 0.45 μm |
| Transmission electron microscope | JEOL Co. Ltd., Tokyo | JEM-1400 |
Referenzen
- Yamaguchi, M., et al. Good ultrastructural preservation of human tissues and cultured cells by glutaraldehyde fixation, sandwich freezing, and freeze-substitution. Cytologia. 85 (1), 15-26 (2020).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Technique. 3 (2), 177-210 (1986).
- Van Harreveld, A., Crowell, J. Electron microscopy after rapid freezing on a metal surface and substitution fixation. The Anatomical Record. 149, 381-385 (1964).
- Aoki, N., Ito, M., Ejiri, S., Ozawa, H. Ultrastructure of human skin by a rapid freezing technique: structural preservation and antigenicity. Journal of Investigative Dermatology. 102 (3), 354-361 (1994).
- Moor, H., Steinbrecht, R. A., Zierold, K. Theory and practice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. , 175-191 (1987).
- McDonald, K. L., Morphew, M., Vertkade, P., Muller-Reichert, T. Recent advances in high-pressure freezing: Equipment-and specimen-loading methods. Methods in Molecular Biology. 369, 143-173 (2007).
- Sosinsky, G. E., et al. The combination of chemical fixation procedures with high pressure freezing and freeze substitution preserves highly labile tissue ultrastructure for electron tomography applications. Journal of Structural Biology. 161 (3), 359-371 (2008).
- Costello, M. J. Ultra-rapid freezing of the biological samples. Scanning Electron Microscopy. , 361-370 (1980).
- Baba, M., Osumi, M. Transmission and scanning electron microscopic examination of intracellular organelles in freeze-substituted Kloeckera and Saccharomyces cerevisiae yeast cells. Journal of Electron Microscopy Technique. 5 (3), 249-261 (1987).
- Yamaguchi, M., Okada, H., Namiki, Y. Smart specimen preparation for freeze-substitution and serial ultrathin sectioning of yeast cells. Journal of Electron Microscopy. 58 (4), 261-266 (2009).
- Yamaguchi, M., et al. Electron microscopy of hepatitis B virus core antigen expressing yeast cells by freeze-substitution fixation. European Journal of Cell Biology. 47 (1), 138-143 (1988).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. Journal of Cell Biology. 124 (6), 903-913 (1994).
- Yamaguchi, M., et al. The spindle pole body duplicates in early G1 phase in a pathogenic yeast Exophiala dermatitidis: an ultrastructural study. Experimental Cell Research. 279 (1), 71-79 (2002).
- Yamaguchi, M., Biswas, S. K., Ohkusu, M., Takeo, K. Dynamics of the spindle pole body of the pathogenic yeast Cryptococcus neoformans examined by freeze-substitution electron microscopy. FEMS Microbiology Letters. 296 (2), 257-265 (2009).
- Yamaguchi, M., et al. Structome of Saccharomyces cerevisiae determined by freeze-substitution and serial ultrathin sectioning electron microscopy. Journal of Electron Microscopy. 60 (5), 321-335 (2011).
- Yamada, H., et al. Structome analysis of Escherichia coli cells by serial ultrathin sectioning reveals the precise cell profiles and the ribosome density. Microscopy. 66 (4), 283-294 (2017).
- Yamaguchi, M., Ohkusu, M., Sameshima, M., Kawamoto, S. Safe specimen preparation for electron microscopy of pathogenic fungi by freeze-substitution after glutaraldehyde fixation. Japanese Journal of Medical Mycology. 46 (3), 187-192 (2005).
- Yamaguchi, M., et al. Improved preservation of fine structure of deep-sea microorganisms by freeze-substitution after glutaraldehyde fixation. Journal of Electron Microscopy. 60 (4), 283-287 (2011).
- Yamaguchi, M., et al. Prokaryote or eukaryote? A unique microorganism from the deep-sea. Journal of Electron Microscopy. 61 (6), 423-431 (2012).
- Yamada, H., Chikamatsu, K., Aono, A., Mitarai, S. Pre-fixation of virulent Mycobacterium tuberculosis with glutaraldehyde preserves exquisite ultrastructure on transmission electron microscopy through cryofixation and freeze-substitution with osmium-acetone at ultralow temperature. Journal of Microbiological Methods. 96, 50-55 (2014).
- Yamaguchi, M. An electron microscopic study of microorganisms: from influenza virus to deep-sea microorganisms. JSM Mycotoxins. 65 (2), 81-99 (2015).
- Yamaguchi, M., et al. High-voltage electron microscopy tomography and structome analysis of unique spiral bacteria from the deep sea. Microscopy. 65 (4), 363-369 (2016).
- Yamaguchi, M., Yamada, H., Uematsu, K., Horinouchi, Y., Chibana, H. Electron microscopy and structome analysis of unique amorphous bacteria from the deep sea. Cytologia. 83 (3), 337-342 (2018).
- Yamaguchi, M., Yamada, H., Chibana, H. Deep-sea bacteria harboring bacterial endosymbionts in a cytoplasm?: 3D electron microscopy by serial ultrathin sectioning of freeze-substituted specimen. Cytologia. 85 (3), 209-211 (2020).
- Yamaguchi, M., Takahashi-Nakaguchi, A., Aida, Y., Sato-Okamoto, M., Chibana, H. Convenient method for better preservation of fine structures of cultured macrophages and engulfed yeast cells by freeze-substitution fixation. Microscopy. 66 (3), 209-211 (2017).
- Aoki, S., et al. Shift in energy metabolism caused by glucocorticoids enhances the effect of cytotoxic anticancer drugs against acute lymphoblastic leukemia cells. Oncotarget. 8 (55), 94271-94285 (2017).
- Hirao, T., et al. Altered intracellular signaling by imatinib increases the anticancer effects of tyrosine kinase inhibitors in chronic myelogenous leukemia cells. Cancer Science. 109 (1), 121-131 (2018).
- Yamaguchi, M., et al. Sandwich freezing device for rapid freezing of viruses, bacteria, yeast, cultured cells, and animal and human tissues in electron microscopy. Microscopy. 70 (2), 215-223 (2021).
- Yamaguchi, M. Troubleshooting in specimen preparation of microorganisms. Kenbikyo. 42, 26-28 (2007).
- Yamaguchi, M., Aoyama, T., Yamada, N., Chibana, H. Quantitative measurement of hydrophilicity/hydrophobicity of the plasma-polymerized naphthalene film (Super support film) and other support films and grids in electron microscopy. Microscopy. 65 (55), 444-450 (2016).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Yamaguchi, M., Shimizu, M., Yamaguchi, T., Ohkusu, M., Kawamoto, S. Repeated use of uranyl acetate solution for section staining in transmission electron microscopy. Plant Morphology. 17 (1), 57-59 (2005).
- Yamaguchi, M., Tanaka, A., Suzuki, T. A support film of plasma-polymerized naphthalene for electron microscopy: method of preparation and application. Journal of Electron Microscopy. 41 (1), 7-13 (1992).
- Yamaguchi, M., et al. Cryo-electron microscopy of hepatitis B virus core particles produced by transformed yeast: comparison with negative staining and ultrathin sectioning. Journal of Electron Microscopy. 37 (6), 337-341 (1988).
- Yamaguchi, M., et al. Dynamics of hepatitis B virus core antigen in a transformed yeast cell: analysis with an inducible system. Journal of Electron Microscopy. 43 (6), 386-393 (1994).
- Yamaguchi, M., Miyatsu, T., Mizokami, H., Matsuoka, L., Takeo, K. Translocation of hepatitis B virus core particles through nuclear pores in transformed yeast cells. Journal of Electron Microscopy. 45 (4), 321-324 (1996).
- Sipiczki, M., Takeo, K., Yamaguchi, M., Yoshida, S., Miklos, I. Environmentally controlled dimorphic cycle in fission yeast. Microbiology. 144, 1319-1330 (1998).
- Sipiczki, M., et al. Role of cell shape in determination of the division plane in Schizosaccharomyces pombe: random orientation of septa in spherical cells. Journal of Bacteriology. 182 (6), 1693-1701 (2000).
- Encz, i. K., Yamaguchi, M., Sipiczki, M. Morphology transition genes in the dimorphic fission yeast Schizosaccharomyces japonicus. Antonie van Leeuwenhoek. 92 (2), 143-154 (2007).
- Kopecka, M., et al. Microtubules and actin cytoskeleton in Cryptococcus neoformans compared with ascomycetous budding and fission yeasts. European Journal of Cell Biology. 80 (4), 303-311 (2001).
- Yamaguchi, M., Biswas, S. K., Kita, S., Aikawa, E., Takeo, K. Electron microscopy of pathogenic yeasts Cryptococcus neoformans and Exophiala dermatitidis by high-pressure freezing. Journal of Electron Microscopy. 51 (1), 21-27 (2002).
- Ikeda, R., et al. Contribution of the mannan backbone of cryptococcal glucuroxylomannan and a glycolytic enzyme of Staphylococcus aureus to contact-mediated killing of Cryptococcus neoformans. Journal of Bacteriology. 189 (13), 4815-4826 (2007).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Cryptococcus neoformans: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. Journal of Electron Microscopy. 59 (2), 165-172 (2010).
- Kozubowski, L., et al. Ordered kinetochore assembly in the human pathogenic basidiomycetous yeast Cryptococcus neoformans. MBio. 4 (5), 00614 (2013).
- Stepanova, A. A., Yamaguchi, M., Chibana, H., Vasilyeva, N. V. Ultrastructural aspects of cell components migration during budding in the yeast Cryptococcus leurentii. Problems in Medical Mycology. 18 (3), 24-29 (2016).
- Ohkusu, M., et al. Cellular and nuclear characteristics of Exophiala dermatitidis. Studies in Mycology. 43 (43), 143-150 (1999).
- Yamaguchi, M., Biswas, S. K., Suzuki, Y., Furukawa, H., Takeo, K. Three-dimensional reconstruction of a pathogenic yeast Exophiala dermatitidis cell by freeze-substitution and serial sectioning electron microscopy. FEMS Microbiology Letters. 219 (1), 17-21 (2003).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Exophiala dermatitidis: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. European Journal of Cell Biology. 82 (10), 531-538 (2003).
- Biswas, S. K., Yamaguchi, M., Naoe, N., Takashima, T., Takeo, K. Quantitative three-dimensional structural analysis of Exophiala dermatitidis yeast cells by freeze-substitution and serial ultrathin sectioning. Journal of Electron Microscopy. 52 (2), 133-143 (2003).
- Takaya, N., et al. Cytochrome P450nor, a novel class of mitochondrial cytochrome P450 involved in nitrate respiration in the fungus Fusarium oxysporum. Archives of Biochemistry and Biophysics. 372 (2), 340-346 (1999).
- Zhou, Z., et al. Ammonia fermentation, a novel anoxic metabolism of nitrate by fungi. Journal of Biological Chemistry. 277 (3), 1892-1896 (2002).
- Takasaki, K., et al. Fungal ammonia fermentation, a novel metabolic mechanism that couples the dissimilatory and assimilatory pathways of both nitrate and ethanol. Role of acetyl CoA synthetase in anaerobic ATP synthesis. Journal of Biological Chemistry. 279 (13), 12414-12420 (2004).
- Kopecka, M., et al. Analysis of microtubules and F-actin structures in hyphae and conidia development in opportunistic human pathogenic black yeast Aureobasidium pullulans. Microbiology. 149, 865-876 (2003).
- Ueno, K., Namiki, Y., Mitani, H., Yamaguchi, M., Chibana, H. Differential cell wall remodeling of two chitin synthase deletants Δchs3A and Δchs3B in the pathogenic yeast Candida glabrata. FEMS Yeast Research. 11 (5), 398-407 (2011).
- Ikezaki, S., et al. Mild heat stress affects on the cell wall structure in Candida albicans biofilm. Medical Mycology Journal. 60 (2), 29-37 (2019).
- Gabriel, M., et al. The cytoskeleton in the unique cell reproduction by conidiogenesis of the long-neck yeast Fellomyces (Sterigmatomyces) fuzhouensis. Protoplasma. 229 (1), 33-44 (2006).
- Yoshimi, A., et al. Functional analysis of the α-1,3-glucan synthase genes agsA and agsB in Aspergillus nidulans: agsB is the major α-1,3-glucan synthase in this fungus. PLoS One. 8 (1), 54893 (2013).
- Yamada, H., Mitarai, S., Chikamatsu, K., Mizuno, K., Yamaguchi, M. Novel freeze-substitution electron microscopy provides new aspects of virulent Mycobacterium tuberculosis with visualization of the outer membrane and satisfying biosafety requirements. Journal of Microbiological Methods. 80 (1), 14-18 (2010).
- Yamada, H., Yamaguchi, M., Chikamatsu, K., Aono, A., Mitarai, S. Structome analysis of virulent Mycobacterium tuberculosis, which survives with only 700 ribosomes at density per 0.1 fl cytoplasm. PLoS One. 10 (1), 0117109 (2015).
- Shiratori, R., et al. Glycolytic suppression dramatically changes the intracellular metabolic profile of multiple cancer cell lines in a mitochondrial metabolism-dependent manner. Scientfic Reports. 9 (1), 18699 (2019).
- McDonald, K. L. Out with the old and in with the new: rapid specimen preparation procedures for electron microscopy of sectioned biological material. Protoplasma. 251 (2), 429-448 (2014).
- Small, J. V. Organization of actin in the leading edge of cultured cells: influence of osmium tetroxide and dehydration on the ultrastructure of actin meshworks. Journal of Cell Biology. 91 (3), 695-705 (1981).
- Ohno, S., Terada, N., Fujii, Y., Ueda, H., Takayama, I. Dynamic structure of glomerular capillary loop as revealed by an in vivo cryotechnique. Virchows Archiv. 427 (5), 519-527 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten