Method Article
Congelamento rápido usando dispositivo de congelamento de sanduíches para boa preservação ultraestrutural de espécimes biológicos em microscopia eletrônica
Neste Artigo
Resumo
Aqui mostramos como usar o dispositivo de congelamento de sanduíches para congelamento rápido de espécimes biológicos, incluindo bactérias, leveduras, células cultivadas, células isoladas, tecidos animais e humanos e vírus. Também mostramos como preparar espécimes para seção ultrathin após congelamento rápido.
Resumo
A fixação química tem sido usada para observar a ultraestrutura de células e tecidos. No entanto, este método não preserva adequadamente a ultraestrutura das células; artefatos e extração de conteúdo celular são geralmente observados. O congelamento rápido é uma alternativa melhor para a preservação da estrutura celular. O congelamento de sanduíches de levedura viva ou bactérias seguidas pela substituição congelante tem sido usado para observar a requintada ultraestrutura natural das células. Recentemente, o congelamento de sanduíches de células cultivadas fixas por glutaraldeído ou tecidos humanos também tem sido usado para revelar a ultraestrutura de células e tecidos.
Estes estudos foram realizados até agora com um dispositivo de congelamento de sanduíches artesanal, e as aplicações para estudos em outros laboratórios foram limitadas. Um novo dispositivo de congelamento de sanduíches foi fabricado recentemente e agora está disponível comercialmente. O presente artigo mostra como usar o dispositivo de congelamento de sanduíches para congelamento rápido de espécimes biológicos, incluindo bactérias, leveduras, células cultivadas, células isoladas, tecidos animais e humanos e vírus. Também é mostrado a preparação de espécimes para seção de ultrathin após congelamento rápido e procedimentos para substituição de congelamento, incorporação de resina, corte de blocos, corte de seções ultrathin, recuperação de seções, coloração e cobertura de grades com filmes de suporte.
Introdução
Microscopia eletrônica é uma ferramenta poderosa para estudar a ultraestrutura celular. A fixação química com procedimentos convencionais de desidratação tem sido usada para observar a ultraestrutura de células e tecidos. No entanto, este método não preserva adequadamente a ultraestrutura das células, e artefatos e a extração de conteúdo celular são geralmente observados. Congelamento rápido e congelamento de células e tecidos são melhores alternativas para a preservação da estrutura celular.
Três métodos principais foram empregados para congelar células rapidamente1: 1)o congelamento de mergulho é realizado por amostras mergulhadas em um criogen resfriado, como propano, e foi usado desde o início da década de 19502; 2) o congelamento do bloco de metal frio é realizado batendo rapidamente células e tecidos em um bloco metálico resfriado com nitrogênio líquido ou hélio líquido3,4; e 3) congelamento de alta pressão é feito por células e tecidos congelantes com nitrogênio líquido sob alta pressão5,6,7.
O congelamento de sanduíches é um tipo de congelamento de mergulho realizado por sanduíches de materiais biológicos finos entre dois discos de cobre e congelá-los rapidamente mergulhando em propano líquido8,9,10. Neste método, espécimes muito finos (alguns micrômetros de espessura) são rapidamente resfriados com criogen usando um metal que tem boa condutividade térmica de ambos os lados. Assim, este método remove efetivamente o calor dos espécimes, tornando possível congelar as células sem danos ao cristal de gelo. O congelamento de sanduíches, seguido de substituição congelante de levedura viva e células bacterianas, revela a ultraestrutura natural das células10,11,12,13,14,15,16.
Recentemente, este método tem sido útil para preservar imagens celulares claras de microrganismos fixos de glutaraldeído17,18,19,20,21,22,23,24, células cultivadas25,26,27, e células e tecidos humanos1,28 . Embora esses estudos tenham sido realizados usando um dispositivo de congelamento de sanduíches artesanal29, e aplicações para outros estudos em outros laboratórios foram limitadas, um novo dispositivo de congelamento de sanduíches (SFD) foi fabricado28 e agora está disponível comercialmente.
O presente artigo mostra como usar o SFD para congelamento rápido de espécimes biológicos, incluindo bactérias, leveduras, células cultivadas, células isoladas, tecidos animais e humanos e vírus. Também é mostrado a preparação de espécimes para seção de ultrathin após congelamento rápido, bem como procedimentos para substituição de congelamento, incorporação de resina, corte de blocos, corte de seções ultrathinas, recuperação de seções, coloração e cobertura de grades com filmes de suporte.
Protocolo
NOTA: O protocolo do estudo para amostras humanas foi aprovado pelo Comitê de Ética em Pesquisa Biomédica da Escola de Pós-Graduação em Medicina da Universidade de Chiba (3085). Tetroxida de ósmio é um produto químico perigoso; deve ser manuseado usando luvas no capô da fumaça. A Figura 1 mostra o dispositivo de congelamento do sanduíche e as ferramentas necessárias28. A Figura 2 mostra os materiais necessários para realizar experimentos de congelamento de sanduíches. Os frascos de vidro são preenchidos com acetona contendo tetroxida de ósmio e mantidos a -80°C até o uso(Figura 2B). Os discos de cobre têm 3 mm de diâmetro, sem furos, têm uma letra de um lado e estão disponíveis comercialmente(Figura 2C).
1. Congelamento rápido das suspensões celulares para substituição de congelamento
NOTA: Todo o procedimento é mostrado na Figura 3.
- Células
- Use suspensões celulares de bactérias, leveduras(Figura 2A),células cultivadas e células isoladas para congelamento de sanduíches.
NOTA: Podem ser utilizadas células vivas e com glutaraldeídofixos 28.
- Use suspensões celulares de bactérias, leveduras(Figura 2A),células cultivadas e células isoladas para congelamento de sanduíches.
- Preparação de propano líquido
NOTA: Use criogloves e óculos ao manusear nitrogênio líquido. Como o propano é explosivo, deve-se tomar cuidado para não usar fogos na mesma sala, e as janelas devem ser mantidas abertas.- Encha o recipiente de nitrogênio líquido do SFD com nitrogênio líquido(Figura 4A). Encha o recipiente de propano líquido com propano líquido introduzindo gás propano utilizando um bocal fino(Figura 4B,C). Acelere a solidificação do propano utilizando uma barra de metal resfriada(Figura 1 e Figura 4D,E).
- Preparação de discos de cobre
- Coloque discos de cobre em um copo de slides com o lado sem letras para cima(Figura 2D) e trate com descarga de brilho a 10 Pa, 400 volts, 1 mA para 30 s (Figura 4F,G) para tornar a superfície do disco hidrofílica usando um aparelho de sputter deíons 30.
- Sanduíche e congelamento da suspensão celular
- Transfira a suspensão celular para um tubo de centrífuga de 2 mL(Figura 5A) e centrífuga a 2.900 × g para 10 s à temperatura ambiente(Figura 5B,C). Remova o supernatante e suspenda a pelota para obter uma suspensão grossa (ver discussão).
- Coloque uma pequena quantidade da suspensão celular (~0,02 μL) em um disco de cobre(Figura 5D-F),cubra-o com outro disco de cobre(Figura 5G),e pegue os discos com pinças(Figura 5H).
NOTA: Para medir ~0,02 μL da suspensão celular, observe gotas de 0,1 μL da suspensão sob o estereoscópio e divida-as em gotículas que são 1/5 deste volume. - Faça um poço no centro do propano sólido com a barra de metal fina(Figura 5I). Coloque as pinças em um SFD e congele-as rapidamente pressionando o botão de injeção do aparelho (Figura 5J, K).
NOTA: Deve-se tomar cuidado para não secar os espécimes e não colocar os dois discos completamente sobre o outro (caso contrário, despreitá-los se tornaria muito difícil na etapa seguinte).
- Sanduíches e congelamento de tecidos animais e humanos
- Use tecidos animais e humanos (~0,5 mm x 0,5 mm x 1,5 mm) fixados em 2,5% de glutaraldeído-0,1 M tampão fosfato (pH 7,4)(Figura 6A, B). Corte-os em seções de 0,1 a 0,2 mm de espessura com uma lâmina de barbear sob um estereoscópio(Figura 6C,D).
- Coloque uma pequena gota (~0,02 μL) de solução de glutaraldeído em um disco de cobre(Figura 6E, F). Em seguida, use pinças para colocar um pedaço de tecido no glutaraldeído no disco de cobre(Figura 6G,H) e cobri-lo com outro disco de cobre(Figura 6I-K).
- Congele rapidamente os discos com os tecidos no propano de fusão do SFD, conforme descrito na seção 1.4 (Figura 5J,K).
NOTA: Como o glutaraldeído é um produto químico perigoso, deve ser manuseado usando luvas no capô da fumaça. Os tecidos não devem ser lavados com tampões quando colocados em um disco de cobre, mas mantidos encharcados em solução de glutaraldeído porque o glutaraldeído tem um efeito anti-congelamento1.
- Use tecidos animais e humanos (~0,5 mm x 0,5 mm x 1,5 mm) fixados em 2,5% de glutaraldeído-0,1 M tampão fosfato (pH 7,4)(Figura 6A, B). Corte-os em seções de 0,1 a 0,2 mm de espessura com uma lâmina de barbear sob um estereoscópio(Figura 6C,D).
- Substituição de congelamento com acetona de ósmio
- Transfira os discos em nitrogênio líquido em um banho de trabalho(Figura 7A,B). Usando um par de pinças resfriadas em nitrogênio líquido, retirem os discos um do outro para expor o espécime (Figura 7C-E).
- Coloque os discos com as células em um frasco de vidro(Figura 7F)que é preenchido com 1 mL de acetona contendo 2% de tetroxida de ósmio(Figura 2B)que foi colocada em nitrogênio líquido e solidificada(Figura 4H).
- Transfira os discos para um congelador profundo e mantenha-os a -80°C por 2-4 dias para a substituição congelante das células(Figura 3). Mergulhe as pinças usadas na água à temperatura ambiente para aquecê-las(Figura 7G) para o congelamento dos seguintes espécimes.
NOTA: A pinça para manusear o espécime deve ser quente (temperatura ambiente) porque pinças frias podem congelar o espécime antes do congelamento rápido, levando à formação de cristais de gelo.
- Aquecimento e incorporação de amostras
- Leve gradualmente os espécimes à temperatura ambiente (2h a -20°C, 2h a 4°C e 15 min à temperatura ambiente, Figura 3 e Figura 8A), e transfira os discos para tubos plásticos de 2 mL que são preenchidos com 1 mL de acetona(Figura 3 e Figura 8B,C).
- Prepare a resina epóxi misturando os reagentes em um recipiente plástico descartável usando um agitador(Figura 8D-F).
- Troque a acetona na etapa 1.7.1 sucessivamente com resina de 30% (em acetona), resina de 60% e 90% de resina à temperatura ambiente por 1h cada. Em seguida, troque a resina de 90% com 100% de resina a 37°C durante a noite. Por fim, incorpore as amostras em resina 100%(Figura 8G-J) no molde de incorporação de silício e polimerize-as a 60°C por 24 h(Figura 3).
NOTA: As amostras devem permanecer anexadas aos discos de cobre durante todo o procedimento (para facilitar a secção). O uso de um aparelho rotativo ou tremendo não é recomendado durante o processo de incorporação, pois eles contribuem pouco para a penetração da resina na célula. Além disso, a vibração do aparelho às vezes faz com que os espécimes se desprendem dos discos de cobre. A incubação a 37°C durante a noite aceleraria a penetração da resina na célula devido à energia térmica (a resina não polimerizaria porque não contém nenhum acelerador).
- Aparação de blocos de espécimes
- Retire os blocos polimerizados dos moldes de incorporação de silício(Figura 9A). Escreva o número da amostra no bloco(Figura 9B).
- Remova os discos de cobre do bloco com uma lâmina de barbear(Figura 9C,D) e corte as amostras embutidas na superfície do bloco para 0,7 mm x 0,7 mm usando uma lâmina de corte ultrassônica(Figura 9E) e lâminas de barbear(Figura 9F-H) sob um estereomicroscope31.
- Coloque o bloco em um suporte de espécime de um ultramicrotome (Figura 9I) e corte a face do bloco suavemente com uma faca de corte de diamante(Figura 9J,K).
- Cortando seções ultrathin
- Remova o bloco do ultramicroome (Figura 10A)31, coloque-o em um estereóquio e corte-o ainda mais para 0,2 mm x 0,3 mm com uma lâmina de barbear(Figura 10B,C).
- Aplique neoprene nas grades para torná-los adesivos(Figura 10D). Coloque o bloco de volta no ultramicromo, cubra o ultramicromo com uma tampa plástica(Figura 10E)31, e corte seções de 50-70 nm de espessura(Figura 10F-H).
- Recupere as seções usando um loop(Figura 10I),monte-as em 300 ou 400 redes de cobre de malha tratadas com neoprene, e seque-as(Figura 10J).
- Mancha de seções e observação sob o microscópio eletrônico
- Coloque as grades com seções na ranhura do tubo de silicone meio(Figura 11A)31, e mergulhe na solução de acetato deuranyl e citrato de chumbo por 3 min cada para coloração (Figura 11B-E)32.
- Para amostras de leveduras e fungos, coloque as grades em um papel filtro (4 mm x 4 mm), pegue-as com pinças e cubra-as com filme de naftalina polimerizada de plasma33 na superfície da água(Figura 11F,G). Insira as grades em um microscópio eletrônico e observe a 100 kV(Figura 11H,I).
2. Congelamento rápido de vírus e macromoléculas
- Preparação de etano líquido
NOTA: Use criogloves e óculos ao manusear nitrogênio líquido. Como o etano é explosivo, deve-se tomar cuidado para não usar fogos na mesma sala, e as janelas devem ser mantidas abertas. O etano é usado porque evapora no microscópio eletrônico, enquanto o propano não.- Encha o recipiente de nitrogênio líquido do SFD com nitrogênio líquido. Encha o recipiente de etano líquido com etano líquido introduzindo gás etano através de um bocal fino.
- Preparação e congelamento rápido de microgrids e espécimes
- Faça as duas faces da microgrids hidrofílica, tratando-as com descarga de brilho (10 Pa, 400 V, 1 mA) usando um aparelho de íon sputter30.
- Defina o microgrid no SFD e aplique 2 μL do vírus ou suspensão macromolecular (1 mg de proteína/mL) nos microgrids. Remova o excesso de líquido usando papel filtro e congele rapidamente o microgrid pressionando o botão de injeção do aparelho.
- Configuração do micrígrido congelado em um suporte de transferência criobito e observação sob o microscópio eletrônico
- Transfira os microgrids congelados em nitrogênio líquido, fixado em um suporte de transferência criobito resfriado à temperatura de nitrogênio líquido de antemão, e observe sob um microscópio eletrônico a baixa temperatura34.
Resultados
Células vivas de microrganismos em suspensão foram coletadas por centrifugação, sanduíches entre dois discos de cobre, rapidamente congelados com SFD, substituídos por congelamento, embutidos em resina epóxi, ultrafinas, manchadas e observadas sob um microscópio eletrônico seguindo os procedimentos descritos acima. A Figura 12 mostra seções ultrathinas de Escherichia coli (bactérias, Figura 12A, B)16 e Saccharomyces cerevisiae (levedura, Figura 12C)15. Note que as imagens são muito claras e mostram morfologia natural.
Suspensões celulares fixas de glutaraldeído de células cultivadas e células animais isoladas foram coletadas e rapidamente congeladas com SFD, substituídas por congelamento, e observadas sob um microscópio eletrônico seguindo os procedimentos descritos acima. A Figura 13 mostra seções ultrathinas de células cultivadas (Figura 13A-C)1,28 e células isoladas da cavidade abdominal do camundongo(Figura 13D)28. A Figura 14 mostra seções ultrathin da pele humana (Figura 14A-D) e casaco buffy(Figura 14E)1. Note que as imagens também são muito claras e mostram morfologia natural. A Figura 15 mostra partículas do núcleo do vírus da hepatite B rapidamente congeladas com SFD e observadas pela microscopia crio-elétron34. Como nas outras células, as imagens são muito claras e mostram morfologia natural.
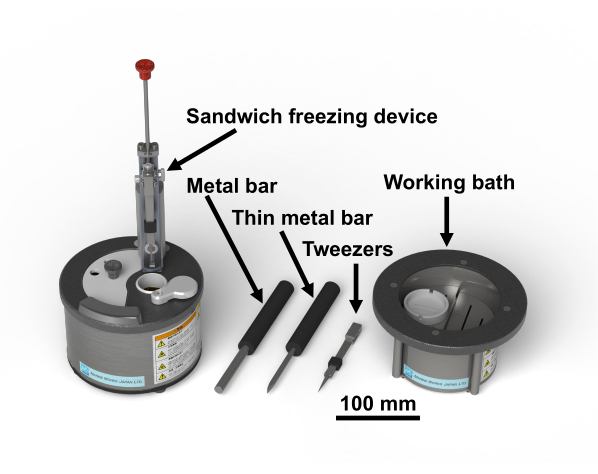
Figura 1: Dispositivo de congelamento desanduíches 28 e as ferramentas necessárias. Clique aqui para ver uma versão maior desta figura.

Figura 2: Materiais necessários para realizar experimentos de congelamento de sanduíches. (A) Espécime: Micrografia leve de Saccharomyces cerevisiae (levedura). Barra de escala = 10 μm. (B) Frascos de vidro (10 mL) contendo 1 mL de acetona com 2% de tetroxida de ósmio. (C) Discos de cobre mostrando uma superfície sem uma letra (esquerda) e uma superfície com uma letra (direita). Barra de escala = 3 mm. Microscopia eletrônica de varredura. (D) Discos de cobre sem letras para cima foram colocados em um slide de vidro com fita adesiva de dois lados (*). Barra de escala = 3 mm. (E) Uma navalha de dois gumes e uma navalha de dois gumes quebrada para cortar tecidos animais e humanos, uma navalha de borda única para blocos de corte e placa desfiada para cortar tecidos animais e humanos. (F) Pinças com espuma de poliestireno extrudada para proteger os dedos do frio. Clique aqui para ver uma versão maior desta figura.
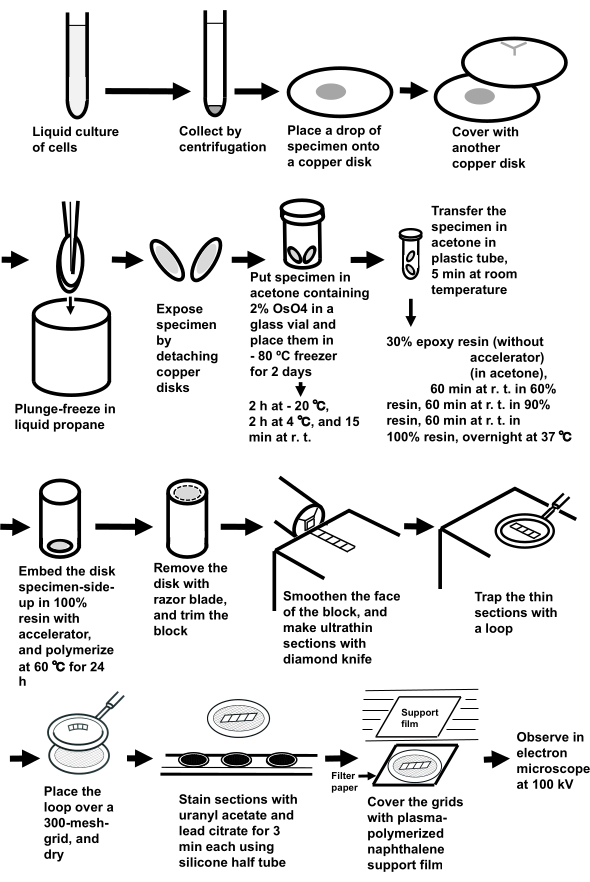
Figura 3: Preparação de amostras de suspensões celulares utilizando o método de congelamento do sanduíche. Abreviaturas: r.t. = temperatura ambiente. Clique aqui para ver uma versão maior desta figura.

Figura 4: A preparação de propano líquido, discos de cobre e fixação. (A) Nitrogênio líquido (seta) foi derramado no recipiente de nitrogênio líquido do dispositivo de congelamento do sanduíche. (B) O gás propano foi introduzido em um recipiente de propano líquido através de um bocal fino. (C) Propano líquido (seta). (D) Uma barra de metal (seta) foi usada para resfriar o propano líquido para acelerar a solidificação do propano líquido. (E) Propano solidificado (seta). (F) Aparelho sputter ion (seta) para fazer discos de cobre hidrofílicos com descarga de brilho. (G) Descarga de brilho. (H) Frascos de vidro colocados em nitrogênio líquido em um banho de trabalho. Clique aqui para ver uma versão maior desta figura.

Figura 5: Congelamento rápido da suspensão celular (levedura) utilizando o dispositivo de congelamento do sanduíche. (A) Transferência da cultura da levedura para o tubo de centrífuga. (B)Microcentrifuge. (C) Pelota de Saccharomyces cerevisiae no tubo centrífuga (seta). (D) Transferindo a amostra com uma micropipette do tubo centrífuga. (E) Colocar a amostra no disco de cobre. (F) Uma pequena gota de um espécime no disco de cobre (seta). (G) Cobrindo o espécime com outro disco de cobre. (H) Pegando os dois discos com pinças. (I) Fazendo um poço no propano sólido usando a barra de metal fina. (J) Mergulhar-congelamento do espécime apertando o botão de injeção. (K)O congelamento está completo. Clique aqui para ver uma versão maior desta figura.

Figura 6: Preparação de um espécime de tecidos humanos (pele). (A, B) Tecido de pele humano fixado em glutaraldeído em uma placa de Petri. Barra de escala = 5 mm.(C, D) Os tecidos (seta) foram cortados usando duas lâminas de dois gumes em uma tábua desfiada. (E, F) Uma pequena gota de solução de glutaraldeído (seta) foi colocada em um disco de cobre. (G, H) Um pedaço de tecido da pele foi colocado no disco de cobre usando pinças. Outrodisco foi usado para cobrir o disco de cobre com o tecido da pele. (J) Os discos sanduíches foram pegos com pinças. (K) Os discos sanduíches foram gentilmente segurados com pinças. Observe a lacuna entre as pontas da pinça (seta) mantidas para evitar esmagar os tecidos. Clique aqui para ver uma versão maior desta figura.

Figura 7: Transferir a amostra para nitrogênio líquido e separar os discos. (A) Transferir os discos (seta) para nitrogênio líquido em um banho de trabalho. (B) Discos em nitrogênio líquido (seta). (C) Pinças foram colocadas em nitrogênio líquido para esfriá-las no banho de trabalho. (D, E) Desprendendo os discos de cobre (setas) usando pinças. (F) Transferir o disco (seta) para o frasco de vidro com pinças. (G) Aquecer a pinça na água para congelar o próximo espécime. Clique aqui para ver uma versão maior desta figura.

Figura 8: Aquecimento e incorporação de amostras. (A) Espécimes em frascos de vidro à temperatura ambiente. (B) Transferir os discos (seta) para um tubo plástico de 2 mL com pinças. (C) Discos de cobre (seta) em acetona em um tubo plástico. (D) Medição de resinas com um tubo de injeção (seta). (E) Transferir a resina para um copo descartável (seta). (F) Misturando a resina usando um agitador. (G) Uma pequena quantidade de resina foi colocada nos orifícios do molde de incorporação de silicone. (H) O excesso de resina nas grades foi removido com papel filtro. (I, J) Discos de cobre com espécimes foram colocados na parte inferior dos orifícios do molde de incorporação com o lado da amostra para cima. Clique aqui para ver uma versão maior desta figura.

Figura 9: Aparar o bloco de espécimes. (A) Retirar blocos polimerizados dos moldes de incorporação. (B) O número do espécime foi escrito no bloco. (C, D) O disco de cobre foi removido do bloco com uma navalha. Barra de escala para (D) = 1 mm. (E-G) A amostra foi aparada com uma lâmina de corte ultrassônica e uma lâmina de barbear. Barra de escala para (G) = 1 mm. (H) Alta ampliação de (G). Um ponto brilhante individual é uma célula. As células foram embutidas em uma única camada10. Barra de escala = 10 μm. (I-K) A superfície do bloco foi cortada suavemente com uma faca de corte de diamante. Barra de escala para (K) = 1 mm. Clique aqui para ver uma versão maior desta figura.

Figura 10: Corte deseções ultrafinas. (A) O bloco da amostra foi removido do microtome31. (B, C) O espécime foi ainda aparado com uma lâmina de barbear. Barra de escala para (C) = 0,5 mm. (D) Neoprene foi aplicada em grades para fazê-los grudar. (E) O ultramicroome foi coberto com plástico para evitar o fluxo de ar durante a secção ultrathin. (F) O barco da faca de diamante estava cheio de água. (G, H) As seções ultrathin foram cortadas para uma espessura de 70 nm. Barra de escala para (H) = 1 mm. (I, J) As seções foram recuperadas usando um laço e depois secas. Clique aqui para ver uma versão maior desta figura.

Figura 11: Seções de coloração. (A) As grades foram colocadas na ranhura do tubo de meio silicone. (B) Eles estavam encharcados em acetato de urano para coloração. (C) O acetato urano usado foi coletado em filme de cera auto-vedação. (D) As grades foram lavadas com um jato de água e (E) em seguida encharcadas em citrato de chumbo. (F) O filme de naftalina polimerizado de plasma flutuou sobre a água e(G)usado para cobrir uma grade colocada em papel filtro de 4 mm x 4 mm. (H) A grade foi colocada em um suporte de espécime e (I) observada em um microscópio eletrônico. Clique aqui para ver uma versão maior desta figura.
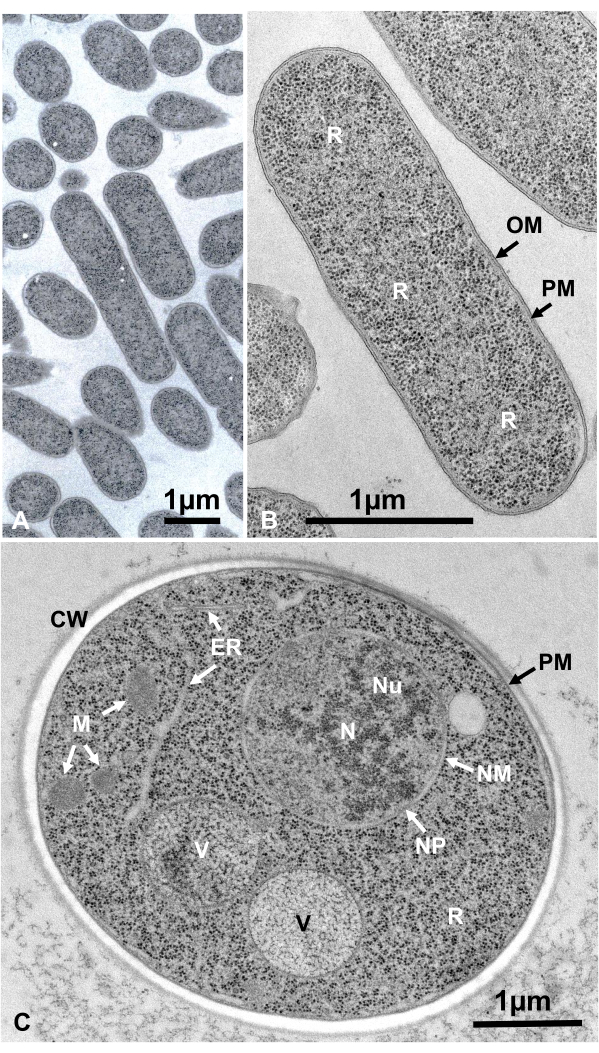
Figura 12: Seções ultrathinas de Escherichia coli (bactérias, A, B) e Saccharomyces cerevisiae (levedura, C). (A) Note que os espécimes são incorporados de forma densa e homogênea e não mostram deformação. (B, C) As estruturas da membrana mostram morfologia clara e lisa, e os ribossomos são claros o suficiente para que cada partícula possa ser enumerada16. (C) Núcleo de levedura e vacuoles mostram uma verdadeira forma de círculo, que pode ser sua morfologia natural. A matriz das mitocôndrias mostra uma aparência densa eletrônica, que pode ser uma característica de células vivas que são fixadas pelo congelamento rápido. Barras de escala = 1 μm. Abreviaturas: CW = parede celular; ER = rcúlume endoplasmático; NM = membrana nuclear; PN = poros nucleares; OM = membrana externa; PM = membranas plasmáticas; R = ribossomos; N = núcleo; M = mitocôndrias. (B) é reproduzido a partir de Yamada et al.16 com permissão. Clique aqui para ver uma versão maior desta figura.
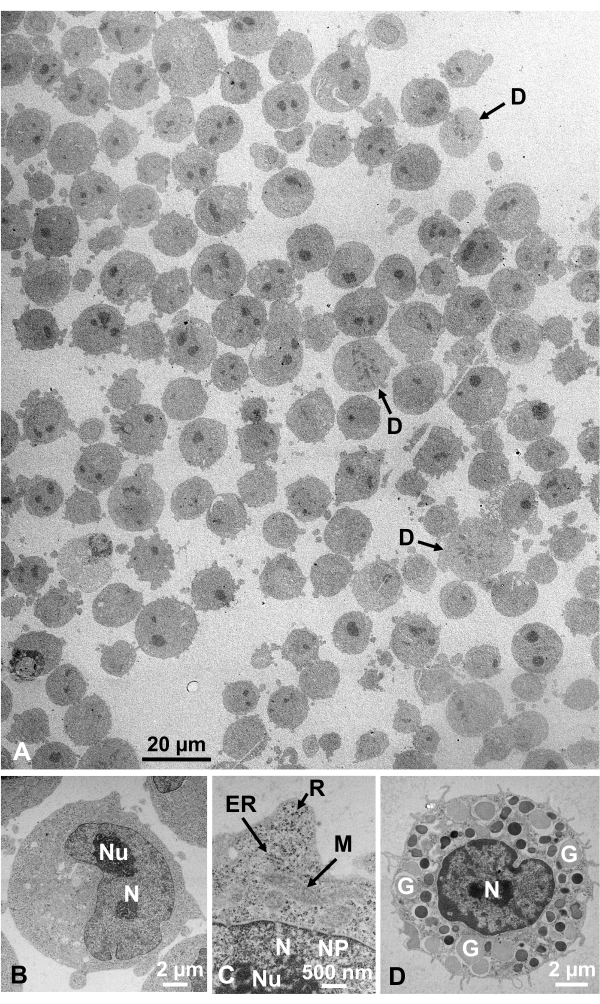
Figura 13: Seções ultrathinas. (A-C) Células cultivadas K562. (D) Uma célula de mastro isolada do mouse. (A) Note que os espécimes são incorporados de forma densa e homogênea e não mostram deformação. Barra de escala = 20 μm. (B-D) Em alta ampliação, núcleo, nucleoslus, membrana nuclear, poros nucleares, retículo endoplasmático, mitocôndrias, ribossomos e grânulos são claramente observados. Barras de escala = 2 μm(B),500 nm(C),2 μm(D). Abreviaturas: N = núcleo; Nu = nucleolus; NM = membrana nuclear, NP = poros nucleares; ER = rcúlume endoplasmático; M = mitocôndrias; R = ribossomos; G = grânulos; D = células divisórias. (A) é reproduzido de Yamaguchi et al.1 com permissão. (B-D) são reproduzidos a partir de Yamaguchi et al.28 com permissão. Clique aqui para ver uma versão maior desta figura.
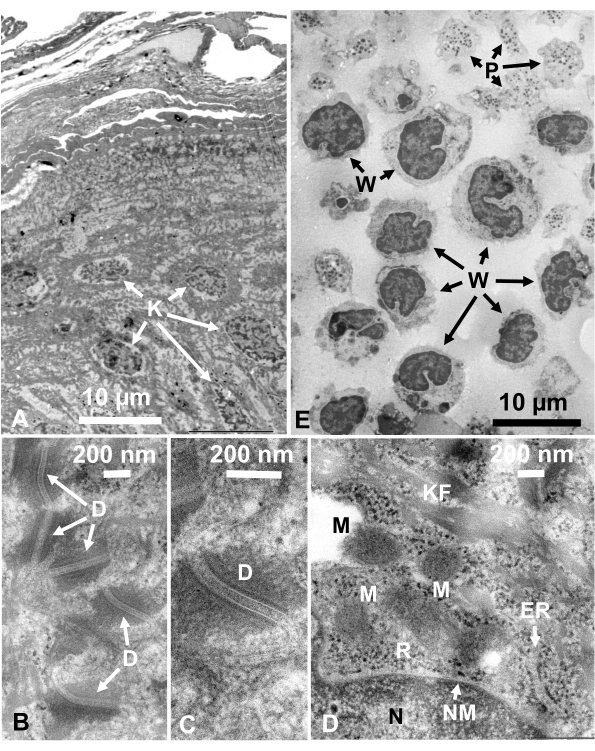
Figura 14: Seções ultrathin. (A-D) pele humana e(E)casaco buffy. (A-E) Observe que as imagens de tecido e células são claras e naturais e mostram bom contraste, embora as seções sejam muito finas (50 nm). A matriz das mitocôndrias apresenta uma aparência densa, semelhante à das densas matrizes mitocondriais de células vivas rapidamente congeladas(D). Barras de escala = 10 μm(A, E),200 nm(B-D). Abreviaturas: D = desmosômoss; ER = rcúlume endoplasmático; K = queratinócito; KF = fibras de queratina; M = mitocôndrias; N = núcleo; NM = membrana nuclear; P = plaqueta; R = ribossomos; W = glóbulos brancos. Reproduzido de Yamaguchi et al.28 com permissão. Clique aqui para ver uma versão maior desta figura.
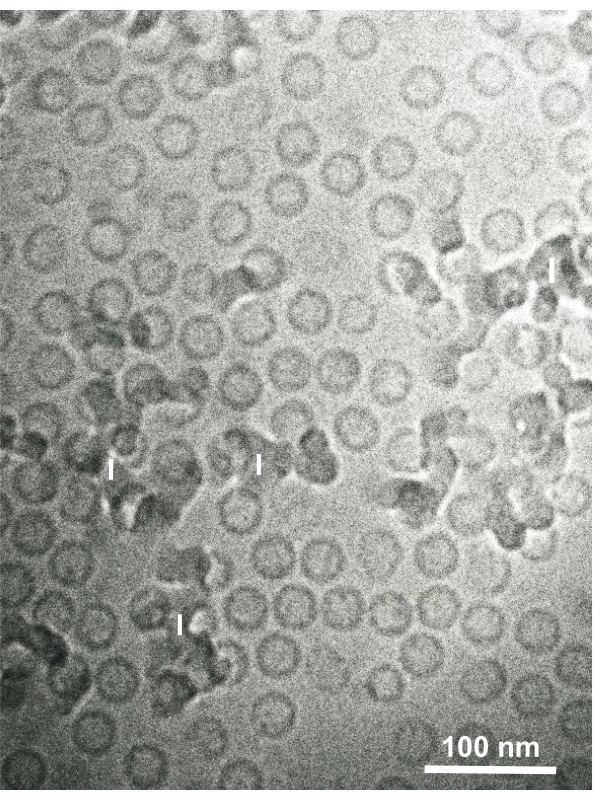
Figura 15: Partículas centrais do vírus da hepatite B (HBV) rapidamente congeladas com etano líquido usando o dispositivo de congelamento do sanduíche e observadas por microscopia crio-elétron. Partículas ocas esféricas são partículas do núcleo HBV. Barra de escala = 100 nm. Abreviaturas: HBV = vírus da hepatite B; I = gelo. Reproduzido de Yamaguchi et al.28 com permissão. Clique aqui para ver uma versão maior desta figura.
Discussão
A discussão a seguir baseia-se em mais de 120 experimentos de substituição de congelamento de sanduíches em mais de 1.000 amostras e mais de 70 experimentos de microscopia de congelamento-crio-elétron em mais de 75 amostras realizadas ao longo de 36 anos.
Taxa de sucesso para um bom congelamento por congelamento de sanduíches
A taxa de sucesso em alcançar um bom congelamento depende das amostras. Células saccharomyces cerevisiae (levedura) cultivadas em meio YPD (extrato de levedura de 1%, 2% peptone, 2% dextrose) deram quase 100% de sucesso para um bom congelamento sem formação de cristal de gelo10,11,15,35,36. Outras espécies de leveduras, incluindo Shizosaccharomyces37,38,39,Cryptococcus14,40,41,42,43,44,45, Exophiala13,41,46,47,48, 49, Fusarium50,51,52, Aureobasidium53, Candida54,55, Fellomyces56, Aspergillus57e Trichosporon, também apresentaram bom congelamento. Bactérias, incluindo Mycobacterium58,59 e E. coli16,também apresentaram bom congelamento. Células cultivadas e células animais isoladas apresentaram bom congelamento para as células vivas e glutaraldeídas1,25,26,27,60. Os tecidos animais e humanos fixados com glutaraldeído cortados a 0,1 a 0,2 mm de espessura também apresentaram bom congelamento na maior parte do tempo1,28.
Condições para um bom congelamento
Use apenas células no estágio e condição de crescimento adequados. As células na cultura devem estar em fase exponencial. Aplique quantidades muito pequenas de suspensões celulares de amostras concentradas (para S. cerevisiae, ~0,02 μL de 3-5 × 109 células/mL) no disco de cobre. As fatias fixadas de glutaraldeído de tecidos animais ou humanos também devem ser muito pequenas (de preferência 0,3 mm x 0,3 mm x 0,1 mm). Como cortar fatias de tecido de 0,1 mm de espessura é difícil, corte muitos tecidos e selecione fatias finas e meio transparentes. Trabalhe rápido, mas com cuidado, e não deixe as amostras secarem. Ao pegar os discos de cobre empilhados com pinças, não pressione os discos muito duros para evitar esmagar as células e tecidos. O carregamento de amostras é o passo mais importante para o congelamento bem sucedido, e as condições necessárias são as mesmas condições para um bom congelamento para congelamento de alta pressão. Os leitores devem consultar a excelente revisão do McDonald61.
Outras aplicações
Este artigo apresenta micrografias eletrônicas de uma bactéria, levedura, células cultivadas, células animais isoladas, tecidos humanos e partículas de vírus. Observamos um bom congelamento de algas marinhas fixas por glutaraldeído. No entanto, as estruturas celulares de algas verdes vivas foram destruídas pela formação de cristais de gelo. A mistura de células com 20% de albumina de soro bovino (BSA) garantiu que a ultraestrutura estava bem preservada sem danos ao cristal de gelo. O uso de 20% de BSA também foi benéfico para a preservação da ultraestrutura de células de talo de um cogumelo. Experimentos no congelamento de células e tecidos vegetais aplicando 20% de BSA estão em andamento. Embora a microscopia eletrônica de varredura de amostras com congelamento de sanduíche não tenha sido tentada, a observação de estruturas celulares bem preservadas foi relatada anteriormente9.
Notas sobre o método de congelamento de sanduíches
A ultraestrutura próxima da nativa das células é melhor observada pelo congelamento rápido e substituição congelante das células vivas. A formação de cristais de gelo com o SFD pode ser evitada limitando a espessura das células a ≤30 μm1. A fixação de tecidos com glutaraldeído muitas vezes produz melhor preservação da estrutura celular para observação de células cultivadas por suspensão, pois a fixação do glutaraldeído torna a estrutura celular mais rígida e previne as possíveis alterações ultraestruturais durante a coleta e centrifugação das células vivas1. A fixação do glutaraldeído também permite a extensão da profundidade de congelamento até 0,2 mm1, semelhante à alcançada pelo método de congelamento de alta pressão (HPF). Portanto, a máquina HPF pode ser substituída pelo SFD para congelamento profundo de tecidos animais e humanos.
Como os tecidos fixos com glutaraldeído podem ser armazenados por mais de 2 anos28,o congelamento do sanduíche pode ser realizado de acordo com a conveniência do usuário. A fixação de tecidos com glutaraldeído também facilita a seção tecidual porque os tecidos ficam mais rígidos com a fixação. Ao contrário da máquina HPF, o SFD pode ser usado para congelamento rápido de vírus para microscopia crio-elétron e para bactérias e células eucarióticas. Além disso, em comparação com a máquina HPF, o SFD é pequeno, portátil, menos caro, e pode ser adquirido por mais laboratórios. Esperamos que essas características do SFD ajudem mais laboratórios a atingir suas metas de pesquisa28.
Características da morfologia natural das células
As estruturas celulares estão em seu estado natural se apresentarem a seguinte aparência: Estruturas de membrana da membrana externa(Figura 12A, B),membrana plasmática(Figura 12B, C; Figura 13A-D; e Figura 14E), envelope nuclear(Figura 12C, Figura 13B-D, e Figura 14D-E),mitocôndrias(Figura 12C, Figura 13Ce Figura 14D), e vacuoles(Figura 12C) apresentam contornos suaves. O núcleo e os vacúolos são quase circulares (Figura 12C). Ribossomos mostram uma aparência clara denso de elétrons com um diâmetro de ~20 nm (Figura 12B,C; Figura 13C; e Figura 14D). O citoplasma é elétron-lucent (Figura 12B,C; Figura 13C; e Figura 14D).
Efeito da fixação de glutaraldeído na morfologia celular
A fixação de glutaraldeído foi realizada para tecidos animais ou humanos antes do congelamento do sanduíche para obter ultraestrutura sem cristal de gelo. Os micrografos obtidos por este método mostram imagens requintadamente claras semelhantes às obtidas pelo rápido congelamento dos tecidos vivos(Figura 14)1. Os estudos sobre células de levedura, microrganismos em alto mar e células cultivadas mostram que a deformação da ultraestrutura deve-se principalmente à fixação de tetroxida de ósmio e desidratação por etanol à temperatura ambiente1,17,18,28. Small também relatou que, embora a fixação do glutaraldeído não destrua a organização da actina em fibroblastos cultivados, a fixação de tetroxida de ósmio e a desidratação por acetona ou etanol à temperatura ambiente destroram a organizaçãoactin 62.
Assim, deve ser realizado um estudo detalhado sobre os efeitos da fixação do glutaraldeído na morfologia celular. Ohno desenvolveu um método de criofixação in vivo onde os tecidos vivos são rapidamente congelados sem parar o suprimento de sangue63. Os tecidos foram substituídos por congelamento e embutidos em resina epóxi, e foram observadas seções ultrathin. As imagens microscópicas eletrônicas mostraram a ultraestrutura nativa mais próxima dos tecidos vivos em comparação com aquelas obtidas pela fixação química-desidratação convencional e pelo rápido congelamento de tecidos frescos não fixados. Portanto, pode ser interessante comparar a ultraestrutura obtida pela substituição de congelamento de fixação de glutaraldeído (o método atual) e aqueles por substituição in vivo cryofixation-freeze para examinar os efeitos da fixação do glutaraldeído.
Consideração pelo meio ambiente e aumento da eficiência experimental
Usamos tubos plásticos de 2 mL para a substituição da resina. Um mL de resina diluída é suficiente para cada etapa de substituição. Os tubos de plástico usados podem ser descartados após cada experimento. Isso pode economizar tempo e esforço para lavar frascos de vidro quando eles são usados para substituição de resina. Além disso, a solução de acetato de urano pode ser usada repetidamente para coloração de seção32. Após a coloração das seções, a solução de acetato de uranyl pode ser salva e reutilizada. Como o acetato de urano é uma substância radioativa, seu reutilizar ajuda a evitar a geração de resíduos e contribui para a proteção do meio ambiente.
Filme de naftalina polimerizada a plasma
O filme de naftalina polimerizado de plasma é um filme de carbono polimerizado tridimensionalmente feito de gás naftalina por plasma-polimerização sob descarga de brilho33. O filme é resistente contra bombardeio de elétrons e produtos químicos, muito limpo, transparente contra elétrons, e tem uma superfície plana e estrutura amorfa. Assim, o filme de naftalina polimerizado de plasma, que está comercialmente disponível, é excelente e é recomendado como um filme de apoio.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Nenhum
Materiais
| Name | Company | Catalog Number | Comments |
| Sandwich Freezing Device | Marine works Japan, Ltd, Yokosuka, Japan | MW-SFD-01 | with metal bar, thin metal bar, tweezers, and working bath |
| 10 mL glass vials | - | Scintillation counter vials for fixative | |
| Acetone | - | ||
| Osmium tetroxide | Nisshin EM Co. Ltd., Tokyo | 3004 | 0.1 g |
| Deep freezer | Sanyo Co. Ltd., Osaka | MDF-C8V1 | |
| Copper disk | Nisshin EM Co. Ltd., Tokyo | - | Refer to this paper |
| Slide glass | - | ||
| Double-sided adhesive tape | - | ||
| Single-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FAS-10 |
| Double-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FA-10 |
| Shredded board | Nisshin EM Co. Ltd., Tokyo | 428 | |
| Tweezers | Nisshin EM Co. Ltd., Tokyo | - | Several pairs |
| Tweezers with polystyrene foam | - | One pair | |
| Glutaraldehyde | Nisshin EM Co. Ltd., Tokyo | 3052 | |
| Liquid nitrogen | - | ||
| Propane gas | - | Cryogen | |
| Ion sputter apparatus | Hitachi high technologies, Tokyo | Hitachi E102 | |
| Micropipette | - | For 1 mL, 200 μL, and 2 μL | |
| Microcentrifuge | Tomy digital biology Co. Ltd., Tokyo | Capsulefuge, PMC-060 | |
| Stereomicroscope | Nikon Co. Ltd., Tokyo et al. | - | SMZ 645 |
| LED illumination for stereomicroscope | Nikon Co. Ltd., Tokyo et al. | SM-LW 61 Ji | |
| Disposable plastic container | - | 50 mL and 200 mL | |
| Ethane gas | - | Cryogen | |
| 2 mL Eppendorf tubes | - | For embedding | |
| Disposable plastic syringes | - | 1 mL, 5 mL, 10 mL, and 20 mL | |
| Magnetic stirrer | - | ||
| Epoxy resin | Nisshin EM Co. Ltd., Tokyo | 340 | Quetol 812 set |
| Silicon embedding mold | Nisshin EM Co. Ltd., Tokyo | 4217 | 7 mm in diameter, 13 mm deep |
| Incubater | - | For 37 °C and 60 °C | |
| Trimming stage | Sunmag Co. Ltd., Tokyo | - | Tilting mechanism equipped, Refer to this paper |
| LED illumination for trimming stage | Sunmag Co. Ltd., Tokyo | - | Refer to this paper |
| Ultrasonic Trimming Blade | Nisshin EM Co. Ltd., Tokyo | 5240 | EM-240, Refer to this paper |
| Ultramicrotome | Leica Microsystems, Vienna | Ultracut S | |
| Grids | Nisshin EM Co. Ltd., Tokyo | 2633, 2634 | 300 mesh, 400 mesh |
| 0.5% Neoprene W solution | Nisshin EM Co. Ltd., Tokyo | 605 | |
| Perfect Loop | Nisshin EM Co. Ltd., Tokyo | 2351 | Fot retrieving sections |
| Half Tube for section staining | Nisshin EM Co. Ltd., Tokyo | 463 | Refer to this pape |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Syringe filter | Toyo Roshi Kaisha, Ltd., Tokyo | DISMIC-03CP | Cellulose acetate, 0.45 μm |
| Transmission electron microscope | JEOL Co. Ltd., Tokyo | JEM-1400 |
Referências
- Yamaguchi, M., et al. Good ultrastructural preservation of human tissues and cultured cells by glutaraldehyde fixation, sandwich freezing, and freeze-substitution. Cytologia. 85 (1), 15-26 (2020).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Technique. 3 (2), 177-210 (1986).
- Van Harreveld, A., Crowell, J. Electron microscopy after rapid freezing on a metal surface and substitution fixation. The Anatomical Record. 149, 381-385 (1964).
- Aoki, N., Ito, M., Ejiri, S., Ozawa, H. Ultrastructure of human skin by a rapid freezing technique: structural preservation and antigenicity. Journal of Investigative Dermatology. 102 (3), 354-361 (1994).
- Moor, H., Steinbrecht, R. A., Zierold, K. Theory and practice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. , 175-191 (1987).
- McDonald, K. L., Morphew, M., Vertkade, P., Muller-Reichert, T. Recent advances in high-pressure freezing: Equipment-and specimen-loading methods. Methods in Molecular Biology. 369, 143-173 (2007).
- Sosinsky, G. E., et al. The combination of chemical fixation procedures with high pressure freezing and freeze substitution preserves highly labile tissue ultrastructure for electron tomography applications. Journal of Structural Biology. 161 (3), 359-371 (2008).
- Costello, M. J. Ultra-rapid freezing of the biological samples. Scanning Electron Microscopy. , 361-370 (1980).
- Baba, M., Osumi, M. Transmission and scanning electron microscopic examination of intracellular organelles in freeze-substituted Kloeckera and Saccharomyces cerevisiae yeast cells. Journal of Electron Microscopy Technique. 5 (3), 249-261 (1987).
- Yamaguchi, M., Okada, H., Namiki, Y. Smart specimen preparation for freeze-substitution and serial ultrathin sectioning of yeast cells. Journal of Electron Microscopy. 58 (4), 261-266 (2009).
- Yamaguchi, M., et al. Electron microscopy of hepatitis B virus core antigen expressing yeast cells by freeze-substitution fixation. European Journal of Cell Biology. 47 (1), 138-143 (1988).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. Journal of Cell Biology. 124 (6), 903-913 (1994).
- Yamaguchi, M., et al. The spindle pole body duplicates in early G1 phase in a pathogenic yeast Exophiala dermatitidis: an ultrastructural study. Experimental Cell Research. 279 (1), 71-79 (2002).
- Yamaguchi, M., Biswas, S. K., Ohkusu, M., Takeo, K. Dynamics of the spindle pole body of the pathogenic yeast Cryptococcus neoformans examined by freeze-substitution electron microscopy. FEMS Microbiology Letters. 296 (2), 257-265 (2009).
- Yamaguchi, M., et al. Structome of Saccharomyces cerevisiae determined by freeze-substitution and serial ultrathin sectioning electron microscopy. Journal of Electron Microscopy. 60 (5), 321-335 (2011).
- Yamada, H., et al. Structome analysis of Escherichia coli cells by serial ultrathin sectioning reveals the precise cell profiles and the ribosome density. Microscopy. 66 (4), 283-294 (2017).
- Yamaguchi, M., Ohkusu, M., Sameshima, M., Kawamoto, S. Safe specimen preparation for electron microscopy of pathogenic fungi by freeze-substitution after glutaraldehyde fixation. Japanese Journal of Medical Mycology. 46 (3), 187-192 (2005).
- Yamaguchi, M., et al. Improved preservation of fine structure of deep-sea microorganisms by freeze-substitution after glutaraldehyde fixation. Journal of Electron Microscopy. 60 (4), 283-287 (2011).
- Yamaguchi, M., et al. Prokaryote or eukaryote? A unique microorganism from the deep-sea. Journal of Electron Microscopy. 61 (6), 423-431 (2012).
- Yamada, H., Chikamatsu, K., Aono, A., Mitarai, S. Pre-fixation of virulent Mycobacterium tuberculosis with glutaraldehyde preserves exquisite ultrastructure on transmission electron microscopy through cryofixation and freeze-substitution with osmium-acetone at ultralow temperature. Journal of Microbiological Methods. 96, 50-55 (2014).
- Yamaguchi, M. An electron microscopic study of microorganisms: from influenza virus to deep-sea microorganisms. JSM Mycotoxins. 65 (2), 81-99 (2015).
- Yamaguchi, M., et al. High-voltage electron microscopy tomography and structome analysis of unique spiral bacteria from the deep sea. Microscopy. 65 (4), 363-369 (2016).
- Yamaguchi, M., Yamada, H., Uematsu, K., Horinouchi, Y., Chibana, H. Electron microscopy and structome analysis of unique amorphous bacteria from the deep sea. Cytologia. 83 (3), 337-342 (2018).
- Yamaguchi, M., Yamada, H., Chibana, H. Deep-sea bacteria harboring bacterial endosymbionts in a cytoplasm?: 3D electron microscopy by serial ultrathin sectioning of freeze-substituted specimen. Cytologia. 85 (3), 209-211 (2020).
- Yamaguchi, M., Takahashi-Nakaguchi, A., Aida, Y., Sato-Okamoto, M., Chibana, H. Convenient method for better preservation of fine structures of cultured macrophages and engulfed yeast cells by freeze-substitution fixation. Microscopy. 66 (3), 209-211 (2017).
- Aoki, S., et al. Shift in energy metabolism caused by glucocorticoids enhances the effect of cytotoxic anticancer drugs against acute lymphoblastic leukemia cells. Oncotarget. 8 (55), 94271-94285 (2017).
- Hirao, T., et al. Altered intracellular signaling by imatinib increases the anticancer effects of tyrosine kinase inhibitors in chronic myelogenous leukemia cells. Cancer Science. 109 (1), 121-131 (2018).
- Yamaguchi, M., et al. Sandwich freezing device for rapid freezing of viruses, bacteria, yeast, cultured cells, and animal and human tissues in electron microscopy. Microscopy. 70 (2), 215-223 (2021).
- Yamaguchi, M. Troubleshooting in specimen preparation of microorganisms. Kenbikyo. 42, 26-28 (2007).
- Yamaguchi, M., Aoyama, T., Yamada, N., Chibana, H. Quantitative measurement of hydrophilicity/hydrophobicity of the plasma-polymerized naphthalene film (Super support film) and other support films and grids in electron microscopy. Microscopy. 65 (55), 444-450 (2016).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Yamaguchi, M., Shimizu, M., Yamaguchi, T., Ohkusu, M., Kawamoto, S. Repeated use of uranyl acetate solution for section staining in transmission electron microscopy. Plant Morphology. 17 (1), 57-59 (2005).
- Yamaguchi, M., Tanaka, A., Suzuki, T. A support film of plasma-polymerized naphthalene for electron microscopy: method of preparation and application. Journal of Electron Microscopy. 41 (1), 7-13 (1992).
- Yamaguchi, M., et al. Cryo-electron microscopy of hepatitis B virus core particles produced by transformed yeast: comparison with negative staining and ultrathin sectioning. Journal of Electron Microscopy. 37 (6), 337-341 (1988).
- Yamaguchi, M., et al. Dynamics of hepatitis B virus core antigen in a transformed yeast cell: analysis with an inducible system. Journal of Electron Microscopy. 43 (6), 386-393 (1994).
- Yamaguchi, M., Miyatsu, T., Mizokami, H., Matsuoka, L., Takeo, K. Translocation of hepatitis B virus core particles through nuclear pores in transformed yeast cells. Journal of Electron Microscopy. 45 (4), 321-324 (1996).
- Sipiczki, M., Takeo, K., Yamaguchi, M., Yoshida, S., Miklos, I. Environmentally controlled dimorphic cycle in fission yeast. Microbiology. 144, 1319-1330 (1998).
- Sipiczki, M., et al. Role of cell shape in determination of the division plane in Schizosaccharomyces pombe: random orientation of septa in spherical cells. Journal of Bacteriology. 182 (6), 1693-1701 (2000).
- Encz, i. K., Yamaguchi, M., Sipiczki, M. Morphology transition genes in the dimorphic fission yeast Schizosaccharomyces japonicus. Antonie van Leeuwenhoek. 92 (2), 143-154 (2007).
- Kopecka, M., et al. Microtubules and actin cytoskeleton in Cryptococcus neoformans compared with ascomycetous budding and fission yeasts. European Journal of Cell Biology. 80 (4), 303-311 (2001).
- Yamaguchi, M., Biswas, S. K., Kita, S., Aikawa, E., Takeo, K. Electron microscopy of pathogenic yeasts Cryptococcus neoformans and Exophiala dermatitidis by high-pressure freezing. Journal of Electron Microscopy. 51 (1), 21-27 (2002).
- Ikeda, R., et al. Contribution of the mannan backbone of cryptococcal glucuroxylomannan and a glycolytic enzyme of Staphylococcus aureus to contact-mediated killing of Cryptococcus neoformans. Journal of Bacteriology. 189 (13), 4815-4826 (2007).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Cryptococcus neoformans: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. Journal of Electron Microscopy. 59 (2), 165-172 (2010).
- Kozubowski, L., et al. Ordered kinetochore assembly in the human pathogenic basidiomycetous yeast Cryptococcus neoformans. MBio. 4 (5), 00614 (2013).
- Stepanova, A. A., Yamaguchi, M., Chibana, H., Vasilyeva, N. V. Ultrastructural aspects of cell components migration during budding in the yeast Cryptococcus leurentii. Problems in Medical Mycology. 18 (3), 24-29 (2016).
- Ohkusu, M., et al. Cellular and nuclear characteristics of Exophiala dermatitidis. Studies in Mycology. 43 (43), 143-150 (1999).
- Yamaguchi, M., Biswas, S. K., Suzuki, Y., Furukawa, H., Takeo, K. Three-dimensional reconstruction of a pathogenic yeast Exophiala dermatitidis cell by freeze-substitution and serial sectioning electron microscopy. FEMS Microbiology Letters. 219 (1), 17-21 (2003).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Exophiala dermatitidis: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. European Journal of Cell Biology. 82 (10), 531-538 (2003).
- Biswas, S. K., Yamaguchi, M., Naoe, N., Takashima, T., Takeo, K. Quantitative three-dimensional structural analysis of Exophiala dermatitidis yeast cells by freeze-substitution and serial ultrathin sectioning. Journal of Electron Microscopy. 52 (2), 133-143 (2003).
- Takaya, N., et al. Cytochrome P450nor, a novel class of mitochondrial cytochrome P450 involved in nitrate respiration in the fungus Fusarium oxysporum. Archives of Biochemistry and Biophysics. 372 (2), 340-346 (1999).
- Zhou, Z., et al. Ammonia fermentation, a novel anoxic metabolism of nitrate by fungi. Journal of Biological Chemistry. 277 (3), 1892-1896 (2002).
- Takasaki, K., et al. Fungal ammonia fermentation, a novel metabolic mechanism that couples the dissimilatory and assimilatory pathways of both nitrate and ethanol. Role of acetyl CoA synthetase in anaerobic ATP synthesis. Journal of Biological Chemistry. 279 (13), 12414-12420 (2004).
- Kopecka, M., et al. Analysis of microtubules and F-actin structures in hyphae and conidia development in opportunistic human pathogenic black yeast Aureobasidium pullulans. Microbiology. 149, 865-876 (2003).
- Ueno, K., Namiki, Y., Mitani, H., Yamaguchi, M., Chibana, H. Differential cell wall remodeling of two chitin synthase deletants Δchs3A and Δchs3B in the pathogenic yeast Candida glabrata. FEMS Yeast Research. 11 (5), 398-407 (2011).
- Ikezaki, S., et al. Mild heat stress affects on the cell wall structure in Candida albicans biofilm. Medical Mycology Journal. 60 (2), 29-37 (2019).
- Gabriel, M., et al. The cytoskeleton in the unique cell reproduction by conidiogenesis of the long-neck yeast Fellomyces (Sterigmatomyces) fuzhouensis. Protoplasma. 229 (1), 33-44 (2006).
- Yoshimi, A., et al. Functional analysis of the α-1,3-glucan synthase genes agsA and agsB in Aspergillus nidulans: agsB is the major α-1,3-glucan synthase in this fungus. PLoS One. 8 (1), 54893 (2013).
- Yamada, H., Mitarai, S., Chikamatsu, K., Mizuno, K., Yamaguchi, M. Novel freeze-substitution electron microscopy provides new aspects of virulent Mycobacterium tuberculosis with visualization of the outer membrane and satisfying biosafety requirements. Journal of Microbiological Methods. 80 (1), 14-18 (2010).
- Yamada, H., Yamaguchi, M., Chikamatsu, K., Aono, A., Mitarai, S. Structome analysis of virulent Mycobacterium tuberculosis, which survives with only 700 ribosomes at density per 0.1 fl cytoplasm. PLoS One. 10 (1), 0117109 (2015).
- Shiratori, R., et al. Glycolytic suppression dramatically changes the intracellular metabolic profile of multiple cancer cell lines in a mitochondrial metabolism-dependent manner. Scientfic Reports. 9 (1), 18699 (2019).
- McDonald, K. L. Out with the old and in with the new: rapid specimen preparation procedures for electron microscopy of sectioned biological material. Protoplasma. 251 (2), 429-448 (2014).
- Small, J. V. Organization of actin in the leading edge of cultured cells: influence of osmium tetroxide and dehydration on the ultrastructure of actin meshworks. Journal of Cell Biology. 91 (3), 695-705 (1981).
- Ohno, S., Terada, N., Fujii, Y., Ueda, H., Takayama, I. Dynamic structure of glomerular capillary loop as revealed by an in vivo cryotechnique. Virchows Archiv. 427 (5), 519-527 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados