Method Article
使用夹层冷冻装置快速冷冻,在电子显微镜下对生物标本进行良好的超微结构保存
摘要
在这里,我们将展示如何使用三明治冷冻装置快速冷冻生物标本,包括细菌,酵母,培养细胞,分离细胞,动物和人体组织以及病毒。我们还展示了如何在快速冷冻后为超薄切片制备试样。
摘要
化学固定已用于观察细胞和组织的超微结构。然而,这种方法不能充分保留细胞的超微结构;通常观察到细胞内容物的伪影和提取。快速冷冻是保存细胞结构的更好选择。活酵母或细菌的三明治冷冻,然后冷冻取代已被用于观察细胞的精细天然超微结构。最近,戊二醛固定培养细胞或人体组织的三明治冷冻也被用于揭示细胞和组织的超微结构。
到目前为止,这些研究都是用手工制作的三明治冷冻装置进行的,在其他实验室的研究应用有限。最近制造了一种新的三明治冷冻装置,现已上市。本文介绍了如何使用三明治冷冻装置快速冷冻生物标本,包括细菌、酵母菌、培养细胞、分离细胞、动物和人体组织以及病毒。还显示了快速冷冻后用于超薄切片的试样的制备以及冷冻取代,树脂包埋,块的修剪,超薄切片的切割,切片的回收,染色以及用支撑膜覆盖网格的程序。
引言
电子显微镜是研究细胞超微结构的强大工具。使用常规脱水程序进行化学固定已用于观察细胞和组织的超微结构。然而,这种方法不能充分保存细胞的超微结构,并且通常观察到伪影和细胞内容物的提取。细胞和组织的快速冷冻和冷冻取代是保存细胞结构的更好选择。
快速冷冻细胞主要采用三种方法1:1)通过将标本放入冷却的冷冻剂(如丙烷)中进行骤降冷冻,并且自20世纪50年代初以来一直使用2;2)冷金属块冷冻是通过将细胞和组织快速撞击到用液氮或液氦3,4冷却的金属块上进行的;3)高压冷冻是通过在高压5,6,7下用液氮冷冻细胞和组织来完成的。
三明治冷冻是一种骤停冷冻,通过将薄的生物材料夹在两个铜盘之间,然后通过插入液态丙烷8,9,10来快速冷冻它们。在这种方法中,使用从两侧具有良好导热性的金属用冷冻剂快速冷却非常薄的试样(几微米厚)。因此,这种方法有效地从标本中除去热量,使得可以稳定地冷冻细胞而不会造成冰晶损伤。三明治冷冻,然后冷冻取代活酵母和细菌细胞,揭示了细胞10,11,12,13,14,15,16的天然超微结构。
最近,该方法已被发现可用于保存戊二醛固定微生物17、18、19、20、21、22、23、24、培养细胞25、26、27、以及人类细胞和组织的清晰细胞图像1、28 .虽然这些研究是使用手工制作的三明治冷冻装置29进行的,并且在其他实验室的其他研究中的应用受到限制,但已经制造了一种新的三明治冷冻装置(SFD)28,现在已经商业化。
本文展示了如何使用SFD快速冷冻生物标本,包括细菌,酵母,培养细胞,分离细胞,动物和人体组织以及病毒。图中还显示了快速冷冻后用于超薄切片的试样的制备,以及冷冻置换、树脂包埋、块修剪、超薄切片切割、切片回收、染色和用支撑膜覆盖网格的程序。
研究方案
注:该研究的人类样本方案已获得千叶大学研究生院生物医学研究伦理委员会(3085)的批准。四氧化锇是一种危险的化学品;它应该戴着手套在通风橱里处理。图1显示了三明治冷冻装置和必要的工具28。图2显示了进行三明治冷冻实验所需的材料。玻璃小瓶装有含有四氧化锇的丙酮,并保持在-80°C直至使用(图2B)。铜盘直径为3毫米,没有孔,一面有一个字母,市售(图2C)。
1. 快速冷冻细胞悬浮液以进行冷冻替代
注意:整个过程如图 3所示。
- 细胞
- 使用细菌,酵母(图2A),培养细胞和分离的细胞的细胞悬浮液进行三明治冷冻。
注:活细胞和戊二醛固定细胞均可使用28.
- 使用细菌,酵母(图2A),培养细胞和分离的细胞的细胞悬浮液进行三明治冷冻。
- 液态丙烷的制备
注意:处理液氮时使用冷冻手套和护目镜。由于丙烷具有爆炸性,因此应注意不要在同一房间内使用火,并且窗户应保持打开。- 用液氮填充SFD的液氮容器(图4A)。使用细喷嘴引入丙烷气体,用液态丙烷填充液态丙烷容器(图4B,C)。通过使用冷却的金属棒加速丙烷的凝固(图1和图4D,E)。
- 铜盘的制备
- 将铜盘放在载玻片上,无字母面朝上(图2D),并在10 Pa,400伏,1 mA下进行辉光放电处理30秒(图4F,G),使用离子溅射装置使圆盘表面亲水。
- 细胞悬浮液的夹层和深度冷冻
- 将细胞悬浮液转移到2mL离心管(图5A)中,并在室温下以2,900×g离心10秒(图5B,C)。 除去上清液,并悬浮沉淀以获得厚悬浮液(见讨论)。
- 将少量的细胞悬浮液(〜0.02μL)放在铜盘上(图5D-F),用另一个铜盘盖住它(图5G),然后用镊子捡起圆盘(图5H)。
注意:要测量〜0.02μL细胞悬浮液,在立体显微镜下观察0.1μL悬浮液滴,并将它们分成该体积的1/5的 液滴。 - 用薄金属棒在固体丙烷的中心做一个井(图5I)。将镊子设置在SFD中,并通过按下设备的注射按钮快速冻结它们(图5J,K)。
注意:应注意不要干燥试样,也不要将两个圆盘完全放在一起(否则,在下一步中分离它们将变得非常困难)。
- 动物和人体组织的夹层和深度冷冻
- 使用动物和人体组织(〜0.5毫米x 0.5毫米x 1.5毫米)固定在2.5%戊二醛-0.1 M磷酸盐缓冲液(pH 7.4)中(图6A,B)。在立体显微镜下用剃须刀片将它们切成0.1至0.2毫米厚的部分(图6C,D)。
- 将一小滴(〜0.02μL)戊二醛溶液放在铜盘上(图6E,F)。然后,使用镊子将一块组织放入谷氨酰醛中的铜盘上(图6G,H),并用另一个铜盘覆盖(图6I-K)。
- 快速冷冻圆盘,组织在SFD的熔化丙烷中,如第1.4节所述(图5J,K)。
注意:由于戊二醛是一种危险的化学物质,因此应在通风橱中戴上手套进行处理。当放置在铜盘上时,不应用缓冲液洗涤组织,而应浸泡在戊二醛溶液中,因为戊二醛具有抗冻作用1。
- 使用动物和人体组织(〜0.5毫米x 0.5毫米x 1.5毫米)固定在2.5%戊二醛-0.1 M磷酸盐缓冲液(pH 7.4)中(图6A,B)。在立体显微镜下用剃须刀片将它们切成0.1至0.2毫米厚的部分(图6C,D)。
- 用锇丙酮冷冻替代
- 将圆盘转移到工作浴中的液氮中(图7A,B)。使用一对在液氮中冷却的镊子,将圆盘彼此分离以暴露标本(图7C-E)。
- 将带有细胞的圆盘放入玻璃小瓶(图7F),该玻璃小瓶中装满了1毫升含有2%四氧化锇的丙酮(图2B),该丙酮已被置于液氮中并固化(图4H)。
- 将圆盘转移到深冰箱中,并将其保持在-80°C下2-4天,以冷冻置换细胞(图3)。将用过的镊子在室温下浸泡在水中以加热它们(图7G)以冷冻以下标本。
注意:用于处理标本的镊子应温暖(室温),因为冷镊子可能会在快速冻结之前冻结标本,从而导致冰晶的形成。
- 样品升温和包埋
- 逐渐将试样置于室温(-20°C下2小时,4°C下2小时,室温下15分钟,图3和图8A),并将圆盘转移到充满1 mL丙酮的2mL塑料管中(图3和图8B,C)。
- 通过使用搅拌器将试剂混合在一次性塑料容器中来制备环氧树脂(图8D-F)。
- 在步骤1.7.1中,在室温下依次用30%树脂(丙酮)、60%树脂和90%树脂分别交换丙酮1小时。然后,将90%树脂与100%树脂在37°C下交换过夜。最后,将样品嵌入硅包埋模具中的100%树脂(图8G-J),并在60°C下聚合24小时(图3)。
注:在整个过程中,试样应保持附着在铜盘上(以便于切片)。在包埋过程中,不建议使用旋转或振荡装置,因为它们对树脂渗透到细胞中的贡献很小。此外,来自设备的振动有时会导致试样从铜盘上脱落。由于热能,在37°C下孵育过夜会加速树脂向细胞的渗透(树脂不会聚合,因为它不含任何促进剂)。
- 试样块的修剪
- 从硅包埋模具中取出聚合块(图9A)。将试样编号写在块上(图9B)。
- 用剃须刀片(图9C,D)从块中取出铜盘,并使用超声波修剪刀片(图9E)和剃须刀片(图9F-H)在立体显微镜下将嵌入在块表面上的试样修剪至0.7 mm x0.7mm。
- 将块设置在超薄片的试样夹具座中(图9I),然后用钻石修剪刀(图9J,K)平滑地切割块的表面。
- 切割超薄型材
- 从超微旋膜上取下块(图10A)31,将其置于立体显微镜中,然后用剃须刀片将其进一步修剪至0.2 mm x0.3 mm(图10B,C)。
- 在网格上涂上氯丁橡胶以使其具有粘性(图10D)。将块放回超微量组上,用塑料盖覆盖超微量组(图10E)31,并切割50-70-nm厚的部分(图10F-H)。
- 使用环取回部分(图10I),将它们安装在用氯丁橡胶处理的300或400目铜网格上,并干燥它们(图10J)。
- 切片染色和在电子显微镜下观察
- 将网格与切片一起设置在半硅胶管的凹槽中(图11A)31,并在乙酸铀酰溶液和柠檬酸铅中浸泡3分钟以进行染色(图11B-E)32。
- 对于酵母和真菌标本,将网格放在滤纸(4 mm x 4 mm)上,用镊子捡起它们,并在水面上用等离子聚合的萘膜33覆盖它们(图11F,G)。将网格插入电子显微镜并在100 kV下观察(图11H,I)。
2. 病毒和大分子的快速冷冻
- 液体乙烷的制备
注意:处理液氮时使用冷冻手套和护目镜。由于乙烷具有爆炸性,因此应注意不要在同一房间内使用火,窗户应保持打开。使用乙烷是因为它在电子显微镜中蒸发,而丙烷则不会。- 用液氮填充SFD的液氮容器。通过细喷嘴引入乙烷气体,用液体乙烷填充液体乙烷容器。
- 微电网和试样的制备和快速冷冻
- 通过使用离子溅射装置30用辉光放电(10 Pa,400 V,1 mA)处理微电网的两个面,使它们亲水。
- 将微电网置于SFD中,并在微电网上施加2μL病毒或大分子悬浮液(1mg蛋白质/ mL)。使用滤纸去除多余的液体,并通过按下设备的注射按钮快速冻结微电网。
- 在冷冻转移支架中设置冷冻微电网,并在电子显微镜下观察
- 将冷冻的微电网转移到液氮中,设置在冷冻转移支架中,事先在液氮温度下冷却,并在低温下在电子显微镜下观察34。
结果
通过离心收集悬浮微生物的活细胞,夹在两个铜盘之间,用SFD快速冷冻,冷冻取代,包埋在环氧树脂中,超薄切片,染色,并按照上述程序在电子显微镜下观察。图12显示了大肠杆菌(细菌,图12A,B)16和酿酒酵母(酵母,图12C)15的超薄切片。 请注意,图像非常清晰,并显示出自然形态。
收集培养细胞和分离的动物细胞的戊二醛固定细胞悬浮液,并用SFD快速冷冻,冷冻取代,并按照上述程序在电子显微镜下观察。图13显示了培养细胞的超薄切片(图13A-C)1、28和从小鼠腹腔中分离的细胞(图13D)28。图14显示了人体皮肤的超薄部分(图14A-D)和浅黄色的皮毛(图14E)1。请注意,图像也非常清晰,并显示出自然形态。图15显示了乙型肝炎病毒的核心颗粒用SFD快速冷冻并通过冷冻电子显微镜34观察到。与其他细胞一样,图像非常清晰,并显示出自然形态。
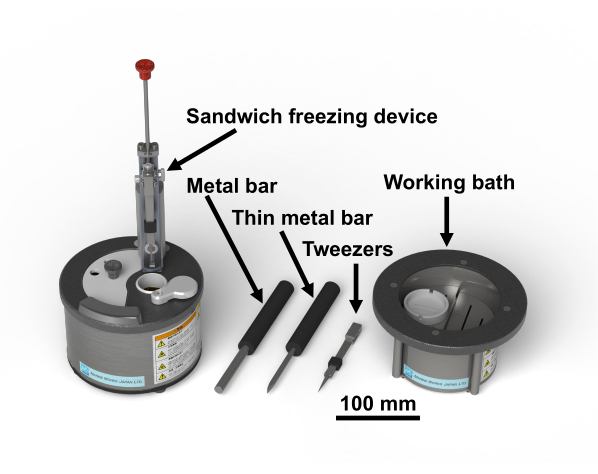
图1:三明治冷冻装置28和必要的工具。请点击这里查看该图的大图。

图2:进行三明治冷冻实验所需的材料(A)标本:酿酒酵母(酵母)的光显微照片。比例尺 = 10 μm. (B) 含有 1 mL 丙酮和 2% 四氧化锇的玻璃小瓶 (10 mL)。(C) 铜盘显示没有字母的表面(左)和有字母的表面(右)。比例尺 = 3 毫米。扫描电子显微镜。(D) 将无字母面朝上的铜盘放在带有双面胶带(*)的载玻片上。比例尺 = 3 mm. (E) 用于切割动物和人体组织的双刃剃须刀和折断的双刃剃须刀,用于修剪块的单刃剃须刀,以及用于切割动物和人体组织的切碎板。(F) 镊子采用挤出聚苯乙烯泡沫,可保护手指免受寒冷。请点击此处查看此图的放大版本。
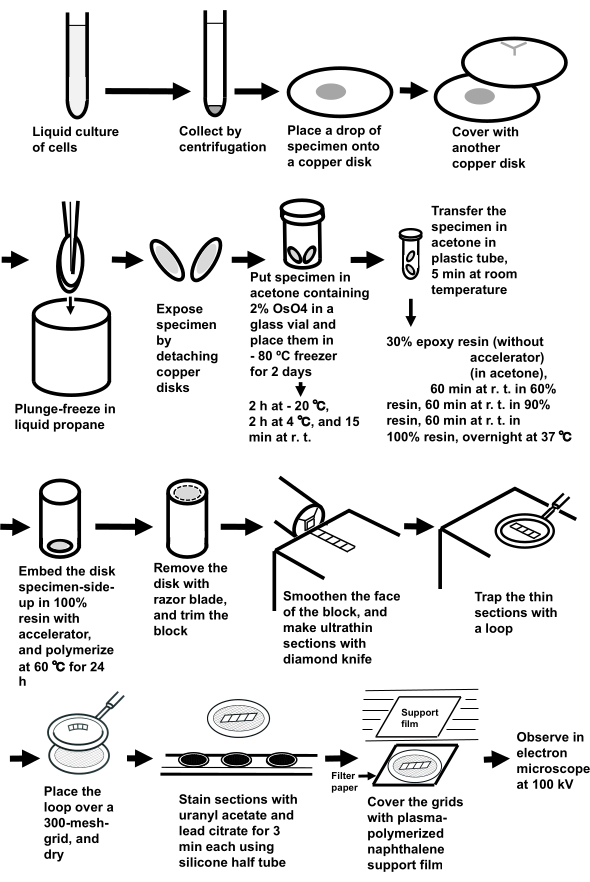
图3:使用三明治冷冻法制备细胞悬浮液的标本。 缩写:r.t. = 室温。 请点击此处查看此图的放大版本。

图4:液态丙烷,铜盘和固定剂的制备(A)将液氮(箭头)倒入三明治冷冻装置的液氮容器中。(B) 丙烷气体通过细喷嘴引入液态丙烷容器中。(C) 液态丙烷(箭头)。(D)使用金属棒(箭头)冷却液态丙烷,以加速液态丙烷的凝固。(E) 固化丙烷(箭头)。(F)离子溅射装置(箭头),用于使铜盘具有辉光放电的亲水性。(G) 辉光放电。(H) 玻璃瓶放置在工作浴中的液氮中。请点击此处查看此图的放大版本。

图5:使用三明治冷冻装置快速冷冻细胞悬浮液(酵母)。 (B) 微量离心机。(C) 酿酒酵母颗粒在离心管(箭头)中。(D) 用微量移液器从离心管中转移试样。(E) 将试样放在铜盘上。(F) 一小滴试样落在铜盘上(箭头)。(G) 用另一个铜盘覆盖试样。(H) 用镊子将两个圆盘捡起来。(I)使用薄金属棒在固体丙烷中做孔。(J) 通过按下注射按钮对试样进行深度冷冻。(K) 冷冻完成。请点击此处查看此图的放大版本。

图6:准备人体组织(皮肤)标本。(A, B)将人体皮肤组织固定在培养皿中的戊二醛中。比例尺 = 5mm.(C,D)组织(箭头)在切碎的板上用两把双刃剃须刀切片。 (E, F)将一小滴戊二醛溶液(箭头)放在铜盘上。(G, H)用镊子将一块皮肤组织放在铜盘上。(I)另一个圆盘被用来用皮肤组织覆盖铜盘。(J) 夹在中间的圆盘是用镊子捡起来的。(K)夹在中间的圆盘用镊子轻轻地固定。注意保持的镊子尖端(箭头)之间的间隙,以避免压碎组织。请点击此处查看此图的放大版本。

图7:将试样转移到液氮中并分离圆盘( A)在工作浴中将圆盘(箭头)转移到液氮中。(B) 液氮中的圆盘(箭头)。(C) 将镊子置于液氮中,以在工作浴中冷却。(D, E)使用镊子分离铜盘(箭头)。(F) 用镊子将圆盘(箭头)转移到玻璃小瓶中。(G) 在水中加热镊子以冷冻下一个标本。 请点击此处查看此图的放大版本。

图8:样品加热和包埋(A)室温下的玻璃瓶中的样品。(B) 将圆盘(箭头)转移到带有镊子的 2 mL 塑料管中。(C)丙酮中的铜盘(箭头)在塑料管中。(D) 用注射管(箭头)测量树脂。(E) 将树脂转移到一次性杯子(箭头)中。(F)使用搅拌器混合树脂。(G)将少量树脂放置在硅胶包埋模具的孔中。(H) 用滤纸去除网格中多余的树脂。(I, J)将带有试样的铜盘放置在嵌入模具孔的底部,试样面朝上。请点击此处查看此图的放大版本。

图9:修剪试样块(A)从包埋模具中取出聚合块。(B) 标本编号写在块上。(C, D)用剃须刀将铜盘从块中取出。(D)=1 mm.(E-G)的比例尺用超声波切割刀片和剃须刀片修剪试样。比例尺(G) = 1 mm.(H)高放大倍率 (G)。单个亮点是一个细胞。细胞被嵌入到单个层10中。比例尺 = 10 μm. (I-K) 用金刚石修剪刀将块的表面切成光滑。比例尺 (K) = 1 mm。请单击此处查看此图的放大图。

图10:切割超薄切片(A)从切片机31中取出试样块。(B, C)用剃须刀片进一步修剪标本。(C)=0.5毫米(D)氯丁橡胶的比例尺被施加在网格上,使它们粘在一起。(E) 超薄切片机被塑料覆盖,以避免超薄切片过程中的气流。(F)钻石刀船装满了水。(G, H)超薄切片被切割成70nm的厚度。(H)= 1 mm.(I, J)的比例尺使用环取回切片,然后干燥。请点击此处查看此图的放大版本。

图11:染色部分(A)网格被放置在半硅胶管的凹槽中。(B)它们被浸泡在乙酸铀酰中染色。(C)将用过的乙酸铀酰酯收集在自密封蜡质薄膜上。(D)用水射流清洗网格,然后(E)浸泡在柠檬酸铅中。(F)等离子聚合的萘薄膜漂浮在水面上,(G)用于覆盖放置在4 mm x 4 mm滤纸上的网格。(H)网格被放置在标本架上,(I)在电子显微镜下观察。请点击此处查看此图的放大版本。
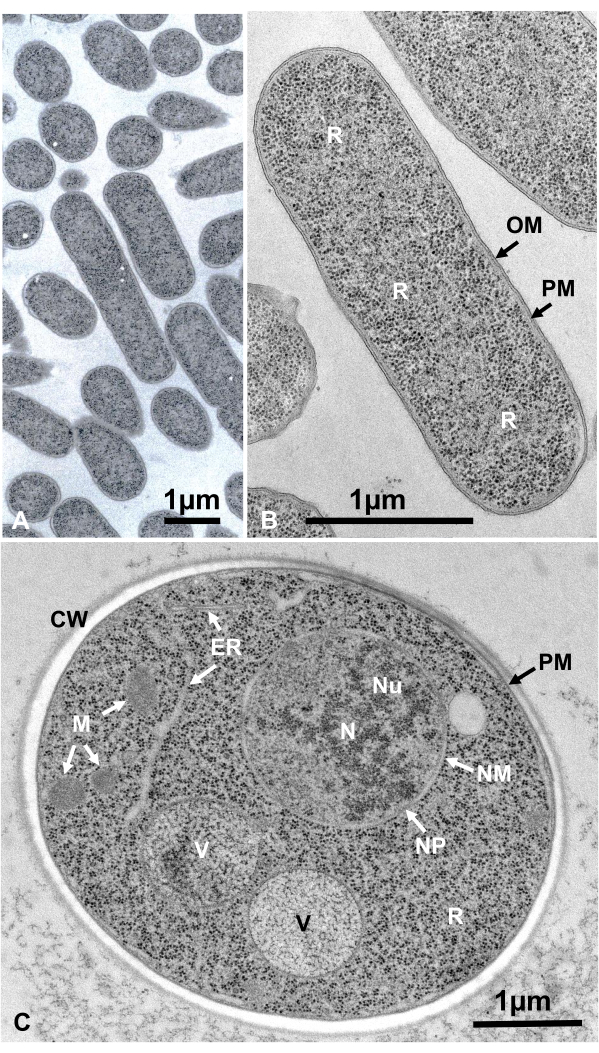
图12:大肠杆菌(细菌,A,B)和酿酒酵母(酵母,C)的超薄切片。(A) 注意试样是密集和均匀嵌入的,没有变形。(B, C)膜结构显示出清晰光滑的形态,核糖体足够清晰,每个颗粒都可以被枚举16。(C)酵母核和液泡显示出真实的圆形,这可能是它们的自然形态。线粒体的基质显示出电子致密的外观,这可能是通过快速冷冻固定的活细胞的特征。比例尺 = 1 μm。缩写: CW = 细胞壁;ER = 内质网;NM = 核膜;NP = 核孔;OM = 外膜;PM = 质膜;R = 核糖体;N = 原子核;M = 线粒体。(B) 经许可转载自 Yamada et al.16。请点击此处查看此图的放大版本。
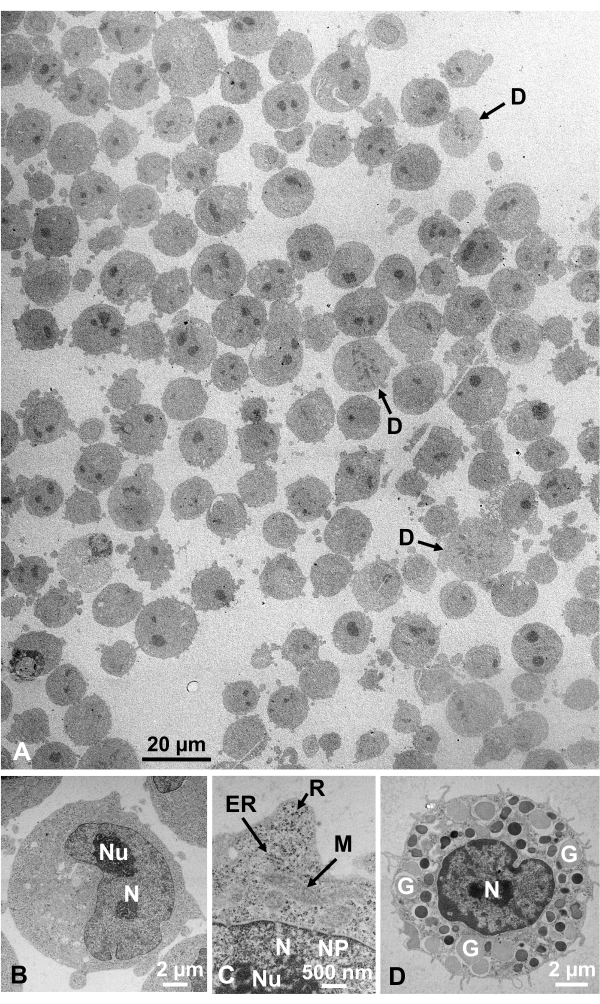
图13:超薄切片(A-C)K562培养的细胞。(D) 来自小鼠的分离肥大细胞。(A) 注意试样是密集和均匀嵌入的,没有变形。比例尺= 20μm.(B-D)在高放大倍率下,可以清楚地观察到细胞核,核仁,核膜,核孔,内质网,线粒体,核糖体和颗粒。比例尺 = 2 μm (B), 500 nm (C), 2 μm (D)。缩写: N = 原子核;核 = 核仁;NM = 核膜,NP = 核孔;ER = 内质网;M = 线粒体;R = 核糖体;G = 颗粒;D = 分割单元格。(A)转载自山口等人1,经许可。(B-D) 摘自 Yamaguchi et al.28,经许可。请点击此处查看此图的放大版本。
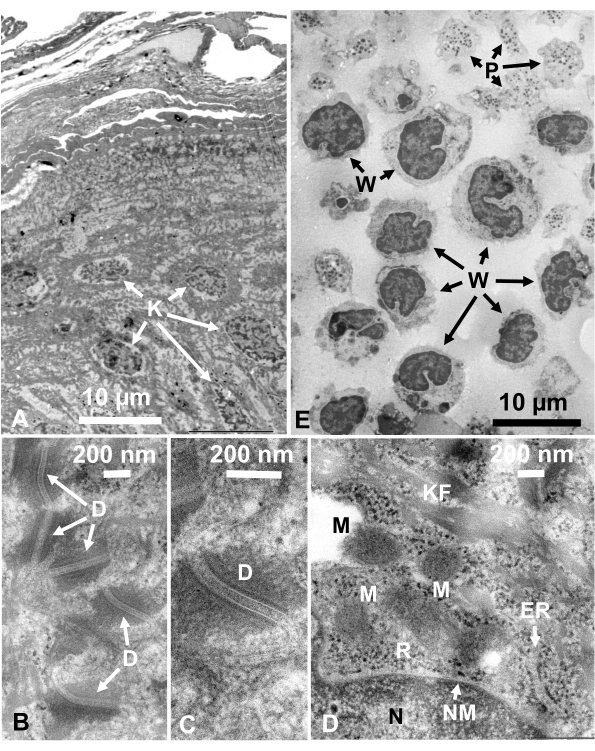
图14:超薄部分(A-D)人体皮肤和(E)浅黄色外套。(A-E)请注意,组织和细胞图像清晰自然,并显示出良好的对比度,尽管切片非常薄(50nm)。线粒体的基质显示出致密的外观,其类似于快速冷冻活细胞(D)的致密线粒体基质。比例尺 = 10 μm (A, E), 200 nm (B-D)。缩写: D = desmosomes;ER = 内质网;K =角质形成细胞;KF = 角蛋白纤维;M = 线粒体;N = 原子核;NM = 核膜;P =血小板;R = 核糖体;W = 白细胞。转载自Yamaguchi等人,经许可后第28页。请点击此处查看此图的放大版本。
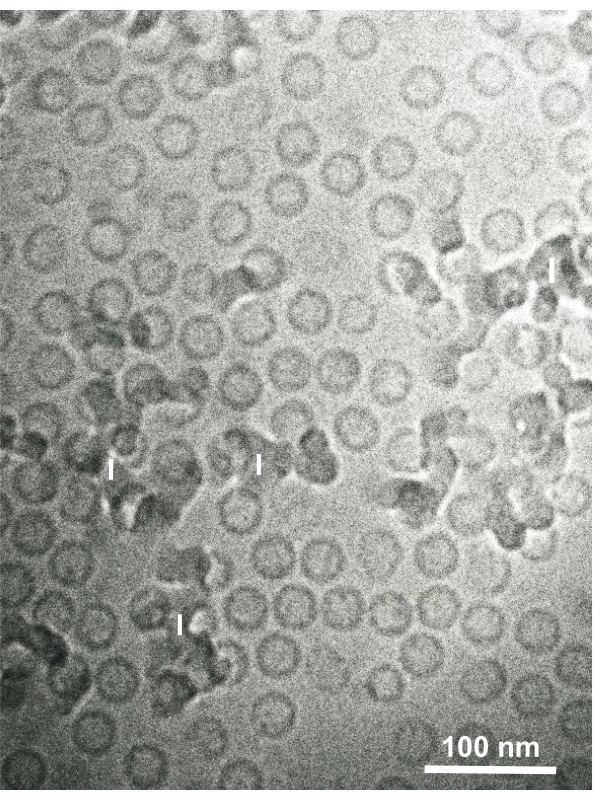
图15:乙型肝炎病毒(HBV)核心颗粒使用三明治冷冻装置用液体乙烷快速冷冻,并通过冷冻电子显微镜观察。 球形空心颗粒是HBV核心颗粒。比例尺 = 100 nm。缩写: HBV = 乙型肝炎病毒;I = 冰。转载自Yamaguchi等人,经许可后第28 页。 请点击此处查看此图的放大版本。
讨论
以下讨论基于对1,000多个样品进行的120多个三明治冷冻 - 冷冻替代实验,以及超过76年来对超过75个样品进行的70多个快速冷冻 - 冷冻 - 冷冻电子显微镜实验。
三明治冷冻良好冷冻的成功率
实现良好冷冻的成功率取决于样品。酿酒酵母(酵母)细胞在YPD培养基(1%酵母提取物,2%蛋白胨,2%葡萄糖)中培养,对良好冷冻而不形成冰晶的成功率接近10,11,15,35,36。其他酵母种类,包括Shizosaccharomyces37,38,39,隐球菌14,40,41,42,43,44,45,Exophiala 13,41,46,47,48, 49、镰刀菌50、51、52、金黄色葡萄球菌53、念珠菌54、55、菌丝菌56、曲霉菌57和毛滴虫孢子菌也显示出良好的冷冻效果。细菌,包括分枝杆菌58、59和大肠杆菌16,也显示出良好的冷冻效果。培养的细胞和分离的动物细胞对活细胞和戊二醛固定细胞1,25,26,27,60均显示出良好的冷冻效果。将戊二醛固定的动物和人体组织切片至0.1~0.2毫米厚度时也显示出良好的冷冻效果1、28。
良好冷冻的条件
仅使用处于适当生长阶段和条件下的细胞。培养中的细胞应处于指数阶段。在铜盘上施用非常少量的浓缩样品的细胞悬浮液(对于 酿酒酵母,〜0.02μL的3-5×109 个细胞/ mL)。戊二醛固定的动物或人体组织切片也应该非常小(优选0.3毫米x 0.3毫米×0.1毫米)。由于切割0.1毫米厚的组织切片很困难,因此要切片许多组织并选择薄片和半透明切片。快速但仔细地工作,不要让样品变干。在用镊子捡起堆叠的铜盘时,不要用力按压圆盘以避免压碎细胞和组织。试样装载是成功冷冻的最重要步骤,所需的条件与高压冷冻的良好冷冻条件相同。读者应该参考麦当劳61的精彩评论。
其他应用
本文介绍了细菌,酵母,培养细胞,分离的动物细胞,人体组织和病毒颗粒的电子显微镜照片。我们观察到戊二醛固定海藻的良好冷冻。然而,活淡水绿藻的细胞结构被冰晶形成破坏。将细胞与20%牛血清白蛋白(BSA)混合,确保超微结构保存完好,没有冰晶损伤。使用20%BSA也有利于保存蘑菇茎细胞的超微结构。通过应用20%BSA冷冻植物细胞和组织的实验正在进行中。尽管尚未尝试对三明治冷冻冷冻取代样品进行扫描电子显微镜检查,但先前已报道过对保存完好的细胞结构的观察9。
关于三明治冷冻方法的注意事项
细胞的接近天然的超微结构最好通过活细胞的快速冷冻和冷冻取代来观察。通过将细胞的厚度限制在≤30μm1,可以避免SFD形成冰晶。用戊二醛固定组织通常可以更好地保存细胞结构以观察悬浮培养的细胞,因为戊二醛固定使细胞结构更加坚硬,并防止在活细胞的收集和离心过程中可能发生的超微结构变化1。戊二醛固定也允许将冷冻深度扩展到0.2 mm1,类似于高压冷冻(HPF)方法。因此,HPF机器可以用SFD代替,用于动物和人体组织的深度冷冻。
由于戊二醛固定组织可以储存2年以上28年,三明治冷冻可以根据用户的方便进行。用戊二醛固定组织也有助于组织切片,因为固定后组织变得更加僵硬。与HPF机器不同,SFD可用于快速冷冻病毒以进行冷冻电子显微镜检查以及细菌和真核细胞。此外,与HPF机器相比,SFD体积小,便于携带,价格便宜,并且可以被更多的实验室购买。我们希望SFD的这些特点能够帮助更多的实验室实现他们的研究目标28.
细胞自然形态的特征
如果细胞结构表现出以下外观,则细胞结构处于自然状态:外膜的膜结构(图12A,B),质膜(图12B,C;图 13A-D;和图14E)、核包膜(图12C、图13B-D和图14D-E)、线粒体(图12C、图13C和图14D)和液泡(图12C)显示平滑的轮廓。细胞核和液泡几乎是圆形的(图12C)。核糖体显示出清晰的电子致密外观,直径约为20nm(图12B,C;图 13C;和图 14D)。细胞质是电子透明的(图12B,C;图 13C;和图 14D)。
戊二醛固定对细胞形态的影响
在三明治冷冻之前对动物或人体组织进行戊二醛固定,以获得无冰晶的超微结构。通过这种方法获得的显微照片显示出与活组织快速冷冻所获得的图像相似的精细清晰的图像(图14)1。对酵母细胞、深海微生物和培养细胞的研究表明,超微结构的变形主要是由于四氧化锇在室温1、17、18、28下被乙醇固定和脱水所致。Small还报道说,尽管戊二醛固定不会破坏培养的成纤维细胞中肌动蛋白的组织,但四氧化锇在室温下通过丙酮或乙醇固定和脱水破坏了肌动蛋白组织62。
因此,应详细研究戊二醛固定对细胞形态的影响。Ohno开发了一种 体内 冷冻固定方法,其中活组织在不停止血液供应的情况下被快速冷冻63。将组织冷冻取代并包埋在环氧树脂中,并观察到超薄切片。电子显微镜图像显示,与通过化学固定 - 常规脱水和新鲜未固定组织快速冷冻获得的超微结构相比,活组织的最接近天然超微结构。因此,比较戊二醛固定-冷冻置换(本方法)和 体内冷冻- 冷冻置换获得的超微结构来检验戊二醛固定的影响,可能会很有趣。
考虑环境和提高实验效率
我们使用2 mL塑料管代替树脂。一毫升稀释的树脂足以满足每个替代步骤。每次实验后,可以使用的塑料管丢弃。当玻璃瓶用于树脂替代时,这可以节省清洗玻璃瓶的时间和精力。此外,乙酸铀酰溶液可重复用于切片染色32。对切片进行染色后,可以保存乙酸铀酰溶液并重复使用。由于乙酸铀酰是一种放射性物质,其再利用有助于避免产生废物,并有助于保护环境。
等离子聚合萘薄膜
等离子体聚合萘薄膜是由萘气体在辉光放电33下通过等离子体聚合而制成的三维聚合碳膜。该薄膜对电子轰击和化学物质具有弹性,非常干净,对电子透明,并且具有平坦的表面和无定形结构。因此,市售的等离子体聚合萘薄膜非常出色,建议将其作为支撑膜。
披露声明
作者声明没有利益冲突。
致谢
没有
材料
| Name | Company | Catalog Number | Comments |
| Sandwich Freezing Device | Marine works Japan, Ltd, Yokosuka, Japan | MW-SFD-01 | with metal bar, thin metal bar, tweezers, and working bath |
| 10 mL glass vials | - | Scintillation counter vials for fixative | |
| Acetone | - | ||
| Osmium tetroxide | Nisshin EM Co. Ltd., Tokyo | 3004 | 0.1 g |
| Deep freezer | Sanyo Co. Ltd., Osaka | MDF-C8V1 | |
| Copper disk | Nisshin EM Co. Ltd., Tokyo | - | Refer to this paper |
| Slide glass | - | ||
| Double-sided adhesive tape | - | ||
| Single-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FAS-10 |
| Double-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FA-10 |
| Shredded board | Nisshin EM Co. Ltd., Tokyo | 428 | |
| Tweezers | Nisshin EM Co. Ltd., Tokyo | - | Several pairs |
| Tweezers with polystyrene foam | - | One pair | |
| Glutaraldehyde | Nisshin EM Co. Ltd., Tokyo | 3052 | |
| Liquid nitrogen | - | ||
| Propane gas | - | Cryogen | |
| Ion sputter apparatus | Hitachi high technologies, Tokyo | Hitachi E102 | |
| Micropipette | - | For 1 mL, 200 μL, and 2 μL | |
| Microcentrifuge | Tomy digital biology Co. Ltd., Tokyo | Capsulefuge, PMC-060 | |
| Stereomicroscope | Nikon Co. Ltd., Tokyo et al. | - | SMZ 645 |
| LED illumination for stereomicroscope | Nikon Co. Ltd., Tokyo et al. | SM-LW 61 Ji | |
| Disposable plastic container | - | 50 mL and 200 mL | |
| Ethane gas | - | Cryogen | |
| 2 mL Eppendorf tubes | - | For embedding | |
| Disposable plastic syringes | - | 1 mL, 5 mL, 10 mL, and 20 mL | |
| Magnetic stirrer | - | ||
| Epoxy resin | Nisshin EM Co. Ltd., Tokyo | 340 | Quetol 812 set |
| Silicon embedding mold | Nisshin EM Co. Ltd., Tokyo | 4217 | 7 mm in diameter, 13 mm deep |
| Incubater | - | For 37 °C and 60 °C | |
| Trimming stage | Sunmag Co. Ltd., Tokyo | - | Tilting mechanism equipped, Refer to this paper |
| LED illumination for trimming stage | Sunmag Co. Ltd., Tokyo | - | Refer to this paper |
| Ultrasonic Trimming Blade | Nisshin EM Co. Ltd., Tokyo | 5240 | EM-240, Refer to this paper |
| Ultramicrotome | Leica Microsystems, Vienna | Ultracut S | |
| Grids | Nisshin EM Co. Ltd., Tokyo | 2633, 2634 | 300 mesh, 400 mesh |
| 0.5% Neoprene W solution | Nisshin EM Co. Ltd., Tokyo | 605 | |
| Perfect Loop | Nisshin EM Co. Ltd., Tokyo | 2351 | Fot retrieving sections |
| Half Tube for section staining | Nisshin EM Co. Ltd., Tokyo | 463 | Refer to this pape |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Syringe filter | Toyo Roshi Kaisha, Ltd., Tokyo | DISMIC-03CP | Cellulose acetate, 0.45 μm |
| Transmission electron microscope | JEOL Co. Ltd., Tokyo | JEM-1400 |
参考文献
- Yamaguchi, M., et al. Good ultrastructural preservation of human tissues and cultured cells by glutaraldehyde fixation, sandwich freezing, and freeze-substitution. Cytologia. 85 (1), 15-26 (2020).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Technique. 3 (2), 177-210 (1986).
- Van Harreveld, A., Crowell, J. Electron microscopy after rapid freezing on a metal surface and substitution fixation. The Anatomical Record. 149, 381-385 (1964).
- Aoki, N., Ito, M., Ejiri, S., Ozawa, H. Ultrastructure of human skin by a rapid freezing technique: structural preservation and antigenicity. Journal of Investigative Dermatology. 102 (3), 354-361 (1994).
- Moor, H., Steinbrecht, R. A., Zierold, K. Theory and practice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. , 175-191 (1987).
- McDonald, K. L., Morphew, M., Vertkade, P., Muller-Reichert, T. Recent advances in high-pressure freezing: Equipment-and specimen-loading methods. Methods in Molecular Biology. 369, 143-173 (2007).
- Sosinsky, G. E., et al. The combination of chemical fixation procedures with high pressure freezing and freeze substitution preserves highly labile tissue ultrastructure for electron tomography applications. Journal of Structural Biology. 161 (3), 359-371 (2008).
- Costello, M. J. Ultra-rapid freezing of the biological samples. Scanning Electron Microscopy. , 361-370 (1980).
- Baba, M., Osumi, M. Transmission and scanning electron microscopic examination of intracellular organelles in freeze-substituted Kloeckera and Saccharomyces cerevisiae yeast cells. Journal of Electron Microscopy Technique. 5 (3), 249-261 (1987).
- Yamaguchi, M., Okada, H., Namiki, Y. Smart specimen preparation for freeze-substitution and serial ultrathin sectioning of yeast cells. Journal of Electron Microscopy. 58 (4), 261-266 (2009).
- Yamaguchi, M., et al. Electron microscopy of hepatitis B virus core antigen expressing yeast cells by freeze-substitution fixation. European Journal of Cell Biology. 47 (1), 138-143 (1988).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. Journal of Cell Biology. 124 (6), 903-913 (1994).
- Yamaguchi, M., et al. The spindle pole body duplicates in early G1 phase in a pathogenic yeast Exophiala dermatitidis: an ultrastructural study. Experimental Cell Research. 279 (1), 71-79 (2002).
- Yamaguchi, M., Biswas, S. K., Ohkusu, M., Takeo, K. Dynamics of the spindle pole body of the pathogenic yeast Cryptococcus neoformans examined by freeze-substitution electron microscopy. FEMS Microbiology Letters. 296 (2), 257-265 (2009).
- Yamaguchi, M., et al. Structome of Saccharomyces cerevisiae determined by freeze-substitution and serial ultrathin sectioning electron microscopy. Journal of Electron Microscopy. 60 (5), 321-335 (2011).
- Yamada, H., et al. Structome analysis of Escherichia coli cells by serial ultrathin sectioning reveals the precise cell profiles and the ribosome density. Microscopy. 66 (4), 283-294 (2017).
- Yamaguchi, M., Ohkusu, M., Sameshima, M., Kawamoto, S. Safe specimen preparation for electron microscopy of pathogenic fungi by freeze-substitution after glutaraldehyde fixation. Japanese Journal of Medical Mycology. 46 (3), 187-192 (2005).
- Yamaguchi, M., et al. Improved preservation of fine structure of deep-sea microorganisms by freeze-substitution after glutaraldehyde fixation. Journal of Electron Microscopy. 60 (4), 283-287 (2011).
- Yamaguchi, M., et al. Prokaryote or eukaryote? A unique microorganism from the deep-sea. Journal of Electron Microscopy. 61 (6), 423-431 (2012).
- Yamada, H., Chikamatsu, K., Aono, A., Mitarai, S. Pre-fixation of virulent Mycobacterium tuberculosis with glutaraldehyde preserves exquisite ultrastructure on transmission electron microscopy through cryofixation and freeze-substitution with osmium-acetone at ultralow temperature. Journal of Microbiological Methods. 96, 50-55 (2014).
- Yamaguchi, M. An electron microscopic study of microorganisms: from influenza virus to deep-sea microorganisms. JSM Mycotoxins. 65 (2), 81-99 (2015).
- Yamaguchi, M., et al. High-voltage electron microscopy tomography and structome analysis of unique spiral bacteria from the deep sea. Microscopy. 65 (4), 363-369 (2016).
- Yamaguchi, M., Yamada, H., Uematsu, K., Horinouchi, Y., Chibana, H. Electron microscopy and structome analysis of unique amorphous bacteria from the deep sea. Cytologia. 83 (3), 337-342 (2018).
- Yamaguchi, M., Yamada, H., Chibana, H. Deep-sea bacteria harboring bacterial endosymbionts in a cytoplasm?: 3D electron microscopy by serial ultrathin sectioning of freeze-substituted specimen. Cytologia. 85 (3), 209-211 (2020).
- Yamaguchi, M., Takahashi-Nakaguchi, A., Aida, Y., Sato-Okamoto, M., Chibana, H. Convenient method for better preservation of fine structures of cultured macrophages and engulfed yeast cells by freeze-substitution fixation. Microscopy. 66 (3), 209-211 (2017).
- Aoki, S., et al. Shift in energy metabolism caused by glucocorticoids enhances the effect of cytotoxic anticancer drugs against acute lymphoblastic leukemia cells. Oncotarget. 8 (55), 94271-94285 (2017).
- Hirao, T., et al. Altered intracellular signaling by imatinib increases the anticancer effects of tyrosine kinase inhibitors in chronic myelogenous leukemia cells. Cancer Science. 109 (1), 121-131 (2018).
- Yamaguchi, M., et al. Sandwich freezing device for rapid freezing of viruses, bacteria, yeast, cultured cells, and animal and human tissues in electron microscopy. Microscopy. 70 (2), 215-223 (2021).
- Yamaguchi, M. Troubleshooting in specimen preparation of microorganisms. Kenbikyo. 42, 26-28 (2007).
- Yamaguchi, M., Aoyama, T., Yamada, N., Chibana, H. Quantitative measurement of hydrophilicity/hydrophobicity of the plasma-polymerized naphthalene film (Super support film) and other support films and grids in electron microscopy. Microscopy. 65 (55), 444-450 (2016).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Yamaguchi, M., Shimizu, M., Yamaguchi, T., Ohkusu, M., Kawamoto, S. Repeated use of uranyl acetate solution for section staining in transmission electron microscopy. Plant Morphology. 17 (1), 57-59 (2005).
- Yamaguchi, M., Tanaka, A., Suzuki, T. A support film of plasma-polymerized naphthalene for electron microscopy: method of preparation and application. Journal of Electron Microscopy. 41 (1), 7-13 (1992).
- Yamaguchi, M., et al. Cryo-electron microscopy of hepatitis B virus core particles produced by transformed yeast: comparison with negative staining and ultrathin sectioning. Journal of Electron Microscopy. 37 (6), 337-341 (1988).
- Yamaguchi, M., et al. Dynamics of hepatitis B virus core antigen in a transformed yeast cell: analysis with an inducible system. Journal of Electron Microscopy. 43 (6), 386-393 (1994).
- Yamaguchi, M., Miyatsu, T., Mizokami, H., Matsuoka, L., Takeo, K. Translocation of hepatitis B virus core particles through nuclear pores in transformed yeast cells. Journal of Electron Microscopy. 45 (4), 321-324 (1996).
- Sipiczki, M., Takeo, K., Yamaguchi, M., Yoshida, S., Miklos, I. Environmentally controlled dimorphic cycle in fission yeast. Microbiology. 144, 1319-1330 (1998).
- Sipiczki, M., et al. Role of cell shape in determination of the division plane in Schizosaccharomyces pombe: random orientation of septa in spherical cells. Journal of Bacteriology. 182 (6), 1693-1701 (2000).
- Encz, i. K., Yamaguchi, M., Sipiczki, M. Morphology transition genes in the dimorphic fission yeast Schizosaccharomyces japonicus. Antonie van Leeuwenhoek. 92 (2), 143-154 (2007).
- Kopecka, M., et al. Microtubules and actin cytoskeleton in Cryptococcus neoformans compared with ascomycetous budding and fission yeasts. European Journal of Cell Biology. 80 (4), 303-311 (2001).
- Yamaguchi, M., Biswas, S. K., Kita, S., Aikawa, E., Takeo, K. Electron microscopy of pathogenic yeasts Cryptococcus neoformans and Exophiala dermatitidis by high-pressure freezing. Journal of Electron Microscopy. 51 (1), 21-27 (2002).
- Ikeda, R., et al. Contribution of the mannan backbone of cryptococcal glucuroxylomannan and a glycolytic enzyme of Staphylococcus aureus to contact-mediated killing of Cryptococcus neoformans. Journal of Bacteriology. 189 (13), 4815-4826 (2007).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Cryptococcus neoformans: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. Journal of Electron Microscopy. 59 (2), 165-172 (2010).
- Kozubowski, L., et al. Ordered kinetochore assembly in the human pathogenic basidiomycetous yeast Cryptococcus neoformans. MBio. 4 (5), 00614 (2013).
- Stepanova, A. A., Yamaguchi, M., Chibana, H., Vasilyeva, N. V. Ultrastructural aspects of cell components migration during budding in the yeast Cryptococcus leurentii. Problems in Medical Mycology. 18 (3), 24-29 (2016).
- Ohkusu, M., et al. Cellular and nuclear characteristics of Exophiala dermatitidis. Studies in Mycology. 43 (43), 143-150 (1999).
- Yamaguchi, M., Biswas, S. K., Suzuki, Y., Furukawa, H., Takeo, K. Three-dimensional reconstruction of a pathogenic yeast Exophiala dermatitidis cell by freeze-substitution and serial sectioning electron microscopy. FEMS Microbiology Letters. 219 (1), 17-21 (2003).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Exophiala dermatitidis: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. European Journal of Cell Biology. 82 (10), 531-538 (2003).
- Biswas, S. K., Yamaguchi, M., Naoe, N., Takashima, T., Takeo, K. Quantitative three-dimensional structural analysis of Exophiala dermatitidis yeast cells by freeze-substitution and serial ultrathin sectioning. Journal of Electron Microscopy. 52 (2), 133-143 (2003).
- Takaya, N., et al. Cytochrome P450nor, a novel class of mitochondrial cytochrome P450 involved in nitrate respiration in the fungus Fusarium oxysporum. Archives of Biochemistry and Biophysics. 372 (2), 340-346 (1999).
- Zhou, Z., et al. Ammonia fermentation, a novel anoxic metabolism of nitrate by fungi. Journal of Biological Chemistry. 277 (3), 1892-1896 (2002).
- Takasaki, K., et al. Fungal ammonia fermentation, a novel metabolic mechanism that couples the dissimilatory and assimilatory pathways of both nitrate and ethanol. Role of acetyl CoA synthetase in anaerobic ATP synthesis. Journal of Biological Chemistry. 279 (13), 12414-12420 (2004).
- Kopecka, M., et al. Analysis of microtubules and F-actin structures in hyphae and conidia development in opportunistic human pathogenic black yeast Aureobasidium pullulans. Microbiology. 149, 865-876 (2003).
- Ueno, K., Namiki, Y., Mitani, H., Yamaguchi, M., Chibana, H. Differential cell wall remodeling of two chitin synthase deletants Δchs3A and Δchs3B in the pathogenic yeast Candida glabrata. FEMS Yeast Research. 11 (5), 398-407 (2011).
- Ikezaki, S., et al. Mild heat stress affects on the cell wall structure in Candida albicans biofilm. Medical Mycology Journal. 60 (2), 29-37 (2019).
- Gabriel, M., et al. The cytoskeleton in the unique cell reproduction by conidiogenesis of the long-neck yeast Fellomyces (Sterigmatomyces) fuzhouensis. Protoplasma. 229 (1), 33-44 (2006).
- Yoshimi, A., et al. Functional analysis of the α-1,3-glucan synthase genes agsA and agsB in Aspergillus nidulans: agsB is the major α-1,3-glucan synthase in this fungus. PLoS One. 8 (1), 54893 (2013).
- Yamada, H., Mitarai, S., Chikamatsu, K., Mizuno, K., Yamaguchi, M. Novel freeze-substitution electron microscopy provides new aspects of virulent Mycobacterium tuberculosis with visualization of the outer membrane and satisfying biosafety requirements. Journal of Microbiological Methods. 80 (1), 14-18 (2010).
- Yamada, H., Yamaguchi, M., Chikamatsu, K., Aono, A., Mitarai, S. Structome analysis of virulent Mycobacterium tuberculosis, which survives with only 700 ribosomes at density per 0.1 fl cytoplasm. PLoS One. 10 (1), 0117109 (2015).
- Shiratori, R., et al. Glycolytic suppression dramatically changes the intracellular metabolic profile of multiple cancer cell lines in a mitochondrial metabolism-dependent manner. Scientfic Reports. 9 (1), 18699 (2019).
- McDonald, K. L. Out with the old and in with the new: rapid specimen preparation procedures for electron microscopy of sectioned biological material. Protoplasma. 251 (2), 429-448 (2014).
- Small, J. V. Organization of actin in the leading edge of cultured cells: influence of osmium tetroxide and dehydration on the ultrastructure of actin meshworks. Journal of Cell Biology. 91 (3), 695-705 (1981).
- Ohno, S., Terada, N., Fujii, Y., Ueda, H., Takayama, I. Dynamic structure of glomerular capillary loop as revealed by an in vivo cryotechnique. Virchows Archiv. 427 (5), 519-527 (1996).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。