Method Article
Congelación rápida utilizando un dispositivo de congelación sándwich para una buena preservación ultraestructural de especímenes biológicos en microscopía electrónica
En este artículo
Resumen
Aquí mostramos cómo usar el dispositivo de congelación sándwich para la congelación rápida de especímenes biológicos, incluidas bacterias, levaduras, células cultivadas, células aisladas, tejidos animales y humanos y virus. También mostramos cómo preparar especímenes para la sección ultrafina después de una congelación rápida.
Resumen
La fijación química se ha utilizado para observar la ultraestructura de células y tejidos. Sin embargo, este método no preserva adecuadamente la ultraestructura de las células; generalmente se observan artefactos y extracción del contenido celular. La congelación rápida es una mejor alternativa para la preservación de la estructura celular. La congelación sándwich de levaduras o bacterias vivas seguida de la sustitución por congelación se ha utilizado para observar la exquisita ultraestructura natural de las células. Recientemente, la congelación en sándwich de células cultivadas fijas en glutaraldehído o tejidos humanos también se ha utilizado para revelar la ultraestructura de células y tejidos.
Estos estudios se han llevado a cabo hasta ahora con un dispositivo de congelación sándwich hecho a mano, y las aplicaciones a estudios en otros laboratorios han sido limitadas. Recientemente se ha fabricado un nuevo dispositivo de congelación sándwich que ahora está disponible comercialmente. El presente documento muestra cómo utilizar el dispositivo de congelación sándwich para la congelación rápida de especímenes biológicos, incluidas bacterias, levaduras, células cultivadas, células aisladas, tejidos animales y humanos y virus. También se muestra la preparación de especímenes para seccionamiento ultrafino después de congelación rápida y procedimientos para la sustitución por congelación, incrustación de resina, recorte de bloques, corte de secciones ultradelgadas, recuperación de secciones, tinción y recubrimiento de rejillas con películas de soporte.
Introducción
La microscopía electrónica es una herramienta poderosa para estudiar la ultraestructura celular. La fijación química con procedimientos convencionales de deshidratación se ha utilizado para observar la ultraestructura de células y tejidos. Sin embargo, este método no preserva adecuadamente la ultraestructura de las células, y generalmente se observan artefactos y la extracción del contenido celular. La congelación rápida y la sustitución por congelación de células y tejidos son mejores alternativas para la preservación de la estructura celular.
Se han empleado tres métodos principales para congelar células rápidamente1: 1) la congelación por inmersión se realiza sumergiendo especímenes en un criógeno enfriado, como el propano, y se utilizó desde principios de la década de 19502; 2) la congelación de bloques metálicos fríos se realiza golpeando rápidamente células y tejidos sobre un bloque de metal enfriado con nitrógeno líquido o helio líquido3,4; y 3) la congelación a alta presión se realiza mediante la congelación de células y tejidos con nitrógeno líquido a alta presión5,6,7.
La congelación en sándwich es un tipo de congelación por inmersión llevada a cabo intercalando materiales biológicos delgados entre dos discos de cobre y congelándolos rápidamente sumergiéndolos en propano líquido8,9,10. En este método, los especímenes muy delgados (unos pocos micrómetros de grosor) se enfrían rápidamente con criógeno utilizando un metal que tiene una buena conductividad térmica de ambos lados. Por lo tanto, este método elimina eficazmente el calor de las muestras, lo que permite congelar de manera estable las células sin daño por cristales de hielo. La congelación sándwich, seguida de la sustitución por congelación de levaduras vivas y células bacterianas, revela la ultraestructura natural de las células10,11, 12,13, 14,15,16.
Recientemente, se ha encontrado que este método es útil para preservar imágenes celulares claras de microorganismos fijados en glutaraldehído17,18,19,20,21,22,23,24,células cultivadas25,26,27y células y tejidos humanos1,28 . Aunque estos estudios se han llevado a cabo utilizando un dispositivo de congelación sándwich hecho a mano29,y las aplicaciones a otros estudios en otros laboratorios han sido limitadas, se ha fabricado un nuevo dispositivo de congelación en sándwich (SFD)28 y ahora está disponible comercialmente.
El presente documento muestra cómo utilizar el SFD para la congelación rápida de especímenes biológicos, incluidas bacterias, levaduras, células cultivadas, células aisladas, tejidos animales y humanos y virus. También se muestra la preparación de especímenes para seccionamiento ultrafino después de una congelación rápida, así como procedimientos para la sustitución por congelación, incrustación de resina, recorte de bloques, corte de secciones ultrafinas, recuperación de secciones, tinción y recubrimiento de rejillas con películas de soporte.
Protocolo
NOTA: El protocolo del estudio para muestras humanas fue aprobado por el Comité de Ética en Investigación Biomédica de la Escuela de Graduados de Medicina de la Universidad de Chiba (3085). El tetróxido de osmio es un químico peligroso; debe manipularse con guantes en la campana de humos. La Figura 1 muestra el dispositivo de congelación sándwich y las herramientas necesarias28. La Figura 2 muestra los materiales necesarios para realizar experimentos de congelación en sándwich. Los viales de vidrio se llenan con acetona que contiene tetróxido de osmio y se mantienen a -80 °C hasta su uso (Figura 2B). Los discos de cobre tienen 3 mm de diámetro, no tienen agujeros, tienen una letra en un lado y están disponibles comercialmente(Figura 2C).
1. Congelación rápida de suspensiones celulares para la sustitución por congelación
NOTA: Todo el procedimiento se muestra en la Figura 3.
- Células
- Utilice suspensiones celulares de bacterias, levaduras(Figura 2A),células cultivadas y células aisladas para la congelación en sándwich.
NOTA: Se pueden utilizar células vivas y fijas en glutaraldehído28.
- Utilice suspensiones celulares de bacterias, levaduras(Figura 2A),células cultivadas y células aisladas para la congelación en sándwich.
- Preparación de propano líquido
NOTA: Use criogloves y gafas cuando manipule nitrógeno líquido. Como el propano es explosivo, se debe tener cuidado de no usar fuegos en la misma habitación, y las ventanas deben mantenerse abiertas.- Llene el recipiente de nitrógeno líquido del SFD con nitrógeno líquido (Figura 4A). Llene el recipiente de propano líquido con propano líquido introduciendo gas propano utilizando una boquilla fina (Figura 4B,C). Acelerar la solidificación del propano mediante el uso de una barra metálica refrigerada(Figura 1 y Figura 4D,E).
- Preparación de discos de cobre
- Coloque los discos de cobre en un vidrio deslizante con el lado sin letra hacia arriba (Figura 2D) y trate con descarga de resplandor a 10 Pa, 400 voltios, 1 mA durante 30 s (Figura 4F,G) para hacer que la superficie del disco sea hidrófila utilizando un aparato de pulverización deiones 30.
- Intercalación y congelación por inmersión de la suspensión celular
- Transfiera la suspensión celular a un tubo centrífugo de 2 ml(Figura 5A)y centrífuga a 2.900 × g durante 10 s a temperatura ambiente(Figura 5B,C). Retire el sobrenadante y suspenda el pellet para obtener una suspensión gruesa (ver discusión).
- Coloque una pequeña cantidad de la suspensión celular (~0.02 μL) en un disco de cobre(Figura 5D-F),cúbralo con otro disco de cobre(Figura 5G)y recoja los discos con pinzas(Figura 5H).
NOTA: Para medir ~ 0.02 μL de la suspensión celular, observe 0.1 μL gotas de la suspensión debajo del estereomicroscopio y divídalas en gotas que son1/5 de este volumen. - Haga un pozo en el centro del propano sólido con la barra delgada de metal(Figura 5I). Coloque las pinzas en un SFD y congélelas rápidamente presionando el botón de inyección del aparato (Figura 5J,K).
NOTA: Se debe tener cuidado de no secar las muestras y no colocar los dos discos completamente uno sobre el otro (de lo contrario, separarlos se volvería muy difícil en el siguiente paso).
- Sandwichización y congelación de tejidos animales y humanos
- Utilizar tejidos animales y humanos (~0,5 mm x 0,5 mm x 1,5 mm) fijados en tampón de fosfato al 2,5%:0,1 M (pH 7,4)(Figura 6A,B). Córtelos en secciones de 0.1 a 0.2 mm de espesor con una cuchilla de afeitar debajo de un estereomicroscopio(Figura 6C,D).
- Coloque una pequeña gota (~0.02 μL) de solución de glutaraldehído en un disco de cobre(Figura 6E,F). Luego, use pinzas para colocar un trozo de tejido en el glutaraldehído en el disco de cobre (Figura 6G,H) y cúbralo con otro disco de cobre ( Figura6I-K).
- Congelar rápidamente los discos con los tejidos en la fusión de propano del SFD, como se describe en la sección 1.4 (Figura 5J,K).
NOTA: Como el glutaraldehído es un químico peligroso, debe manipularse con guantes en la campana de humos. Los tejidos no deben lavarse con tampones cuando se colocan en un disco de cobre, sino que deben mantenerse empapados en solución de glutaraldehído porque el glutaraldehído tiene un efecto anticongelante1.
- Utilizar tejidos animales y humanos (~0,5 mm x 0,5 mm x 1,5 mm) fijados en tampón de fosfato al 2,5%:0,1 M (pH 7,4)(Figura 6A,B). Córtelos en secciones de 0.1 a 0.2 mm de espesor con una cuchilla de afeitar debajo de un estereomicroscopio(Figura 6C,D).
- Sustitución por congelación con acetona de osmio
- Transfiera los discos a nitrógeno líquido en un baño de trabajo(Figura 7A,B). Usando un par de pinzas enfriadas en nitrógeno líquido, separe los discos entre sí para exponer la muestra (Figura 7C-E).
- Coloque los discos con las células en un vial de vidrio (Figura 7F) que esté lleno de 1 ml de acetona que contenga tetróxido de osmio al 2% (Figura 2B) que se ha colocado en nitrógeno líquido y solidificado (Figura 4H).
- Transfiera los discos a un congelador y manténgalos a -80 ° C durante 2-4 días para la sustitución por congelación de las células (Figura 3). Remoje las pinzas usadas en agua a temperatura ambiente para calentarlas (Figura 7G) para la congelación de los siguientes especímenes.
NOTA: Las pinzas para manipular la muestra deben estar calientes (temperatura ambiente) porque las pinzas frías pueden congelar la muestra antes de la congelación rápida, lo que lleva a la formación de cristales de hielo.
- Calentamiento e incrustación de muestras
- Lleve gradualmente las muestras a temperatura ambiente (2 h a -20 ° C, 2 h a 4 ° C y 15 minutos a temperatura ambiente, Figura 3 y Figura 8A),y transfiera los discos a tubos de plástico de 2 ml que se llenan con 1 ml de acetona(Figura 3 y Figura 8B,C).
- Prepare la resina epoxi mezclando los reactivos en un recipiente de plástico desechable con un agitador (Figura 8D-F).
- Intercambie la acetona en el paso 1.7.1 sucesivamente con 30% de resina (en acetona), 60% de resina y 90% de resina a temperatura ambiente durante 1 h cada una. Luego, cambie la resina al 90% con la resina 100% a 37 ° C durante la noche. Finalmente, incrustar las muestras en resina 100%(Figura 8G-J)en el molde de incrustación de silicio, y polimerizarlas a 60°C durante 24 h(Figura 3).
NOTA: Las muestras deben permanecer adheridas a los discos de cobre durante todo el procedimiento (para facilitar la seccionamiento). No se recomienda el uso de un aparato giratorio o agitador durante el proceso de incrustación porque contribuyen poco a la penetración de la resina en la célula. Además, la vibración del aparato a veces hace que las muestras se desprendan de los discos de cobre. La incubación a 37°C durante la noche aceleraría la penetración de la resina en la célula debido a la energía térmica (la resina no polimerizaría porque no contiene ningún acelerador).
- Recorte de bloques de muestras
- Saque los bloques polimerizados de los moldes de incrustación de silicio (Figura 9A). Escriba el número de muestra en el bloque (Figura 9B).
- Retire los discos de cobre del bloque con una cuchilla de afeitar (Figura 9C,D) y recorte las muestras incrustadas en la superficie del bloque a 0,7 mm x 0,7 mm mediante el uso de una cuchilla de recorte ultrasónico ( Figura9E) y cuchillas de afeitar (Figura 9F-H) debajo de un estereomicroscopio31.
- Coloque el bloque en un soporte de muestra de un ultramicrotomo(Figura 9I)y corte la cara del bloque suavemente con un cuchillo de recorte de diamante(Figura 9J,K).
- Corte de secciones ultrafinas
- Retire el bloque del ultramicrotomo(Figura 10A)31,colóquelo en un estereomicroscopio y recórtelo aún más a 0,2 mm x 0,3 mm con una cuchilla de afeitar(Figura 10B,C).
- Aplicar neopreno en las rejillas para hacerlas adhesivas (Figura 10D). Vuelva a colocar el bloque en el ultramicrotomo, cubra el ultramicrotomo con una cubierta de plástico (Figura 10E)31y corte secciones de 50-70 nm de espesor (Figura 10F-H).
- Recupere las secciones utilizando un bucle (Figura 10I), móntelas en rejillas de cobre de malla 300 o 400 tratadas con neopreno y séquelas (Figura 10J).
- Tinción de secciones y observación bajo el microscopio electrónico
- Coloque las rejillas con secciones en la ranura del medio tubo de silicona (Figura 11A)31, y remoje en solución de acetato de uranilo y citrato de plomo durante 3 min cada uno para la tinción (Figura 11B-E)32.
- Para muestras de levadura y hongos, coloque las rejillas en un papel de filtro (4 mm x 4 mm), recójalas con pinzas y cúbralas con una película de naftaleno polimerizada con plasma33 en la superficie del agua(Figura 11F,G). Inserte las rejillas en un microscopio electrónico y observe a 100 kV (Figura 11H, I).
2. Congelación rápida de virus y macromoléculas
- Preparación de etano líquido
NOTA: Use criogloves y gafas cuando manipule nitrógeno líquido. Como el etano es explosivo, se debe tener cuidado de no usar fuegos en la misma habitación, y las ventanas deben mantenerse abiertas. El etano se utiliza porque se evapora en el microscopio electrónico, mientras que el propano no.- Llene el recipiente de nitrógeno líquido del SFD con nitrógeno líquido. Llene el recipiente de etano líquido con etano líquido introduciendo gas etano a través de una boquilla fina.
- Preparación y congelación rápida de microrredes y especímenes
- Hacer que ambas caras de las microrredes sean hidrófilas tratándolas con descarga de resplandor (10 Pa, 400 V, 1 mA) utilizando un aparato de pulverización deiones 30.
- Coloque la microrred en el SFD y aplique 2 μL del virus o suspensión macromolecular (1 mg de proteína/ ml) en las microrredes. Retire el exceso de líquido con papel de filtro y congele rápidamente la microrred presionando el botón de inyección del aparato.
- Colocación de la microrred congelada en un soporte de criotransferencia y observación bajo el microscopio electrónico
- Transfiera las microrredes congeladas en nitrógeno líquido, colocadas en un soporte de criotransferencia enfriado a temperatura de nitrógeno líquido de antemano, y observe bajo un microscopio electrónico a baja temperatura34.
Resultados
Las células vivas de microorganismos en suspensión fueron recolectadas por centrifugación, intercaladas entre dos discos de cobre, congeladas rápidamente con SFD, sustituidas por congelación, incrustadas en resina epoxi, ultrafinas, teñidas y observadas bajo un microscopio electrónico siguiendo los procedimientos descritos anteriormente. La Figura 12 muestra secciones ultrafinas de Escherichia coli (bacterias, Figura 12A,B)16 y Saccharomyces cerevisiae (levadura, Figura 12C)15. Tenga en cuenta que las imágenes son muy claras y muestran una morfología natural.
Las suspensiones celulares fijadas con glutaraldehído de células cultivadas y células animales aisladas se recolectaron y congelaron rápidamente con SFD, se sustituyeron por congelación y se observaron bajo un microscopio electrónico siguiendo los procedimientos descritos anteriormente. La Figura 13 muestra secciones ultrafinas de células cultivadas (Figura 13A-C)1,28 y células aisladas de la cavidad abdominal del ratón ( Figura13D)28. La Figura 14 muestra secciones ultrafinas de piel humana (Figura 14A-D) y pelaje buffy (Figura 14E)1. Tenga en cuenta que las imágenes también son muy claras y muestran una morfología natural. La Figura 15 muestra las partículas del núcleo del virus de la hepatitis B rápidamente congeladas con SFD y observadas por criomicroscopíaelectrónica 34. Al igual que con las otras células, las imágenes son muy claras y muestran una morfología natural.
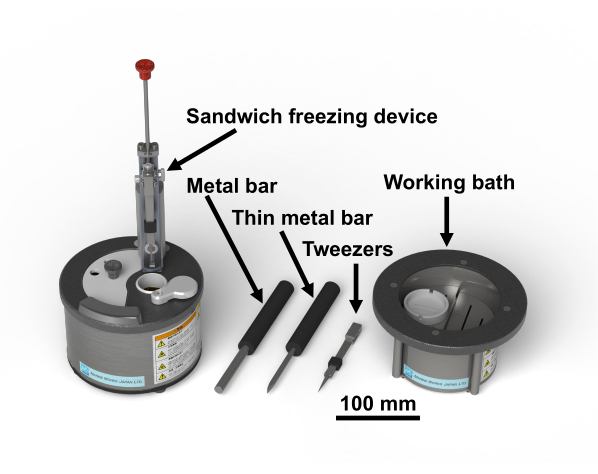
Figura 1: Dispositivo de congelación sándwich28 y las herramientas necesarias. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Materiales necesarios para realizar experimentos de congelación en sándwich. (A) Muestra: Micrografía ligera de Saccharomyces cerevisiae (levadura). Barra de escala = 10 μm. (B) Viales de vidrio (10 ml) que contienen 1 ml de acetona con tetróxido de osmio al 2%. (C) Discos de cobre que muestran una superficie sin letra (izquierda) y una superficie con una letra (derecha). Barra de escala = 3 mm. Microscopía electrónica de barrido. (D) Los discos de cobre sin letra hacia arriba se colocaron en un portaobjetos de vidrio con cinta adhesiva de doble cara (*). Barra de escala = 3 mm. (E) Una maquinilla de afeitar de doble filo y una maquinilla de afeitar de doble filo rota para cortar tejidos animales y humanos, una maquinilla de afeitar de un solo borde para recortar bloques y una tabla triturada para cortar tejidos animales y humanos. (F) Pinzas con espuma de poliestireno extruido para proteger los dedos del frío. Haga clic aquí para ver una versión más grande de esta figura.
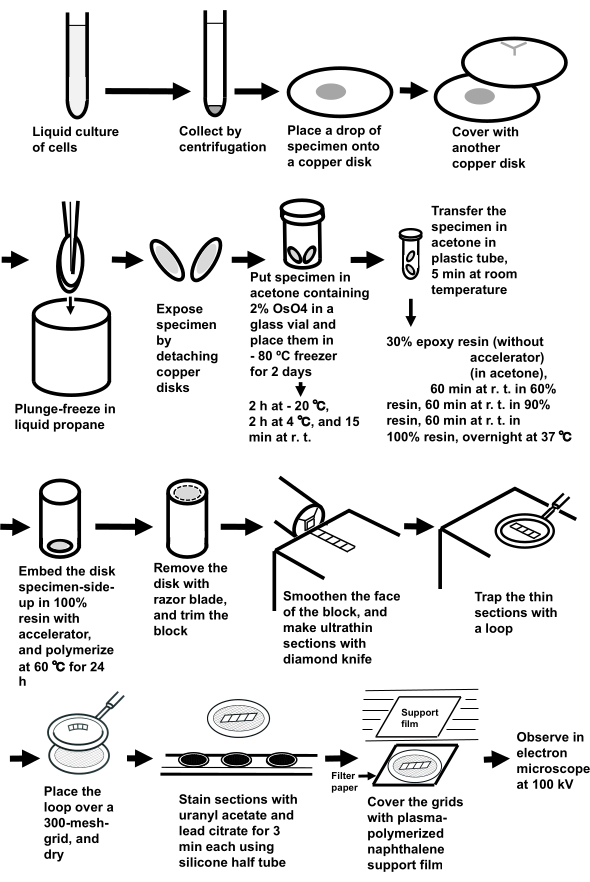
Figura 3: Preparación de muestras de suspensiones celulares utilizando el método de congelación en sándwich. Abreviaturas: r.t. = temperatura ambiente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Preparación de propano líquido, discos de cobre y fijador. (A) Se vertió nitrógeno líquido (flecha) en el recipiente de nitrógeno líquido del dispositivo de congelación sándwich. (B) El gas propano se introdujo en un recipiente de propano líquido a través de una boquilla fina. (C) Propano líquido (flecha). (D) Se utilizó una barra de metal (flecha) para enfriar el propano líquido para acelerar la solidificación del propano líquido. (E) Propano solidificado (flecha). (F) Aparato de pulverización de iones (flecha) para hacer discos de cobre hidrófilos con descarga de resplandor. (G) Descarga de resplandor. (H) Viales de vidrio colocados en nitrógeno líquido en un baño de trabajo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Congelación rápida de la suspensión celular (levadura) utilizando el dispositivo de congelación sándwich. (A) Transferencia del cultivo de levadura al tubo de la centrífuga. B)Microcentrífuga. (C) Pellet de Saccharomyces cerevisiae en el tubo de la centrífuga (flecha). (D) Transferencia de la muestra con una micropipeta del tubo de la centrífuga. (E) Colocación de la muestra en el disco de cobre. (F) Una pequeña gota de una muestra en el disco de cobre (flecha). (G) Cubriendo la muestra con otro disco de cobre. (H) Recoger los dos discos con pinzas. (I) Hacer un pozo en el propano sólido utilizando la barra delgada de metal. (J) Congelación por inmersión de la muestra pulsando el botón de inyección. (K) La congelación ha finalizado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Preparación de una muestra de tejidos humanos (piel). (A, B) Tejido de la piel humana fijado en glutaraldehído en una placa de Petri. Barra de escala = 5 mm. (C, D) Los tejidos (flecha) se cortaron usando dos maquinillas de afeitar de doble filo en una tabla triturada. (E, F) Se colocó una pequeña gota de solución de glutaraldehído (flecha) en un disco de cobre. (G, H) Se colocó un trozo de tejido cutáneo en el disco de cobre con pinzas. (I) Se utilizó otro disco para cubrir el disco de cobre con el tejido de la piel. (J) Los discos intercalados fueron recogidos con pinzas. (K) Los discos intercalados se sujetaron suavemente con pinzas. Tenga en cuenta el espacio entre las puntas de las pinzas (flecha) mantenido para evitar aplastar los tejidos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Transferencia de la muestra a nitrógeno líquido y separación de los discos. (A) Transferencia de los discos (flecha) a nitrógeno líquido en un baño de trabajo. (B) Discos en nitrógeno líquido (flecha). (C) Las pinzas se colocaron en nitrógeno líquido para enfriarlas en el baño de trabajo. (D, E) Separar los discos de cobre (flechas) con pinzas. (F) Transferencia del disco (flecha) al vial de vidrio con pinzas. (G) Calentamiento de las pinzas en agua para congelar el siguiente espécimen. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Calentamiento e incrustación de muestras. (A) Muestras en viales de vidrio a temperatura ambiente. (B) Transferencia de los discos (flecha) en un tubo de plástico de 2 ml con pinzas. (C) Discos de cobre (flecha) en acetona en un tubo de plástico. (D) Resinas de medición con un tubo de inyección (flecha). (E) Transferencia de la resina a un vaso desechable (flecha). (F) Mezclar la resina con un agitador. (G)Se colocó una pequeña cantidad de resina en los orificios del molde de incrustación de silicona. (H) El exceso de resina en las rejillas se eliminó con papel de filtro. (I, J) Se colocaron discos de cobre con especímenes en el fondo de los orificios del molde de incrustación con el lado de la muestra hacia arriba. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Recorte del bloque de muestra. (A) Extracción de bloques polimerizados de los moldes de incrustación. (B) El número de muestra se escribió en el bloque. (C, D) El disco de cobre fue retirado del bloque con una maquinilla de afeitar. Barra de escala para (D) = 1 mm. (E-G) La muestra se recortó con una cuchilla de corte ultrasónica y una cuchilla de afeitar. Barra de escala para (G) = 1 mm. (H) Aumento alto de (G). Un punto brillante individual es una célula. Las células se incrustaron en una sola capa10. Barra de escala = 10 μm. (I-K) La superficie del bloque se cortó lisa con un cuchillo de recorte de diamante. Barra de escala para (K) = 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 10: Corte de secciones ultrafinas. (A) El bloque de muestra se eliminó del microtomo31. (B, C) El espécimen fue recortado aún más con una hoja de afeitar. Barra de escala para (C) = 0,5 mm. (D) Se aplicó neopreno en las rejillas para hacerlas pegar. (E) El ultramicrotomo se cubrió con plástico para evitar el flujo de aire durante la sección ultradelgada. (F) El bote de cuchillos de diamantes estaba lleno de agua. (G, H) Las secciones ultrafinas se cortaron a un grosor de 70 nm. Barra de escala para (H) = 1 mm. (I, J) Las secciones se recuperaron utilizando un bucle y luego se secaron. Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Secciones de tinción. (A) Las rejillas se colocaron en la ranura del medio tubo de silicona. (B) Se empaparon en acetato de uranilo para teñir. (C) El acetato de uranilo utilizado se recogió en una película cerosa autosellante. (D) Las rejillas se lavaron con un chorro de agua y (E) se remojaron en citrato de plomo. (F) La película de naftaleno polimerizada por plasma se flotó sobre el agua y (G) se utilizó para cubrir una rejilla colocada sobre papel de filtro de 4 mm x 4 mm. (H) La rejilla se colocó en un soporte de muestra y (I) se observó en un microscopio electrónico. Haga clic aquí para ver una versión más grande de esta figura.
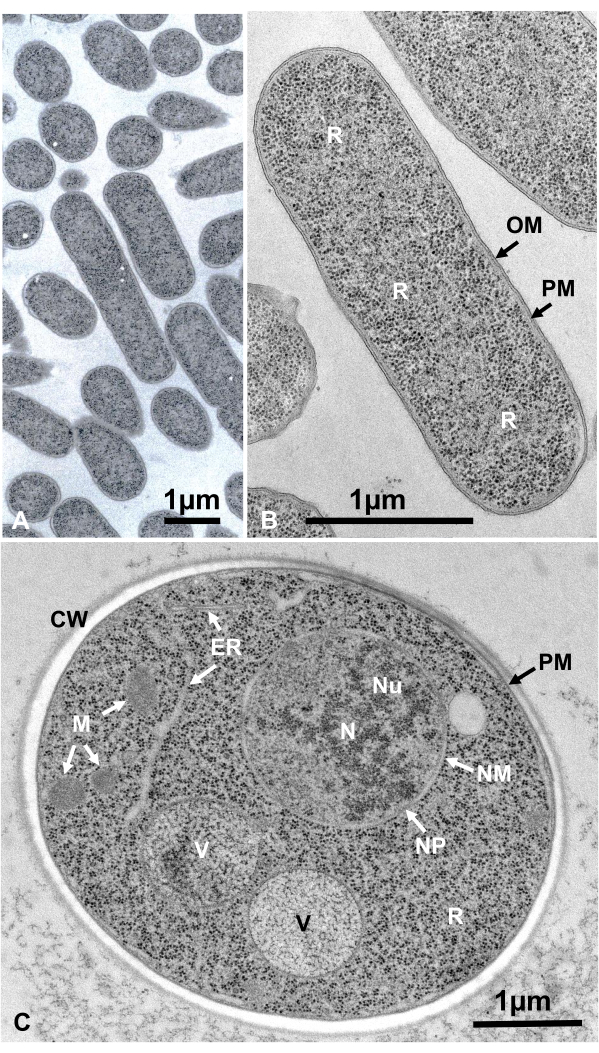
Figura 12: Secciones ultrafinas de Escherichia coli (bacterias, A, B) y Saccharomyces cerevisiae (levadura, C). (A) Nótese que los especímenes están incrustados densa y homogéneamente y no muestran deformación. (B, C) Las estructuras de membrana muestran una morfología clara y lisa, y los ribosomas son lo suficientemente claros como para que cada partícula pueda ser enumerada16. (C) El núcleo y las vacuolas de levadura muestran una verdadera forma de círculo, que puede ser su morfología natural. La matriz de las mitocondrias muestra una apariencia densa en electrones, que puede ser una característica de las células vivas que se fijan mediante congelación rápida. Barras de escala = 1 μm. Abreviaturas: CW = pared celular; ER = retículo endoplásmico; NM = membrana nuclear; NP = poros nucleares; OM = membrana externa; PM = membranas plasmáticas; R = ribosomas; N = núcleo; M = mitocondrias. (B) se reproduce de Yamada et al.16 con permiso. Haga clic aquí para ver una versión más grande de esta figura.
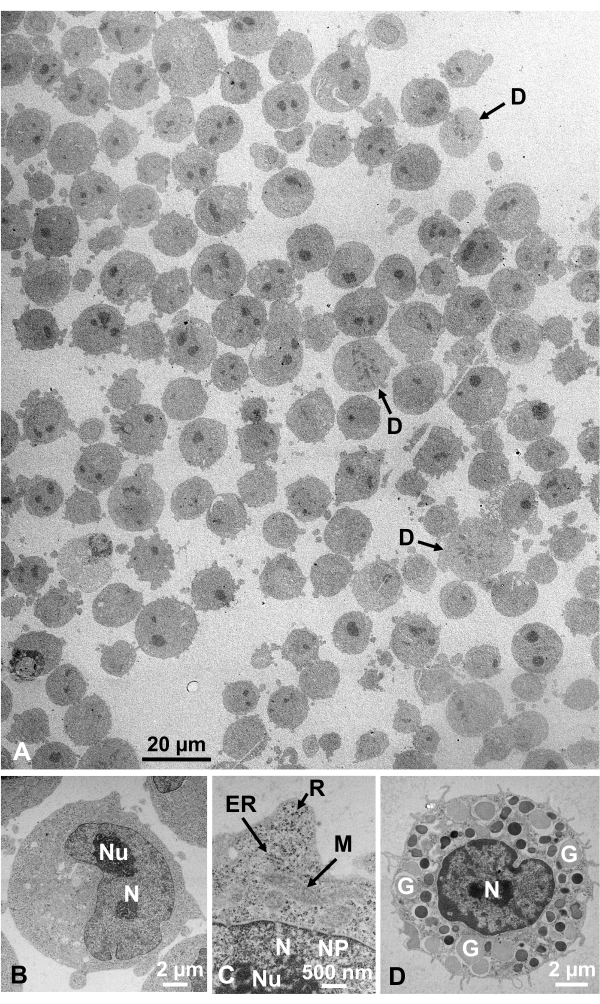
Figura 13: Secciones ultrafinas. (A-C) Células cultivadas K562. (D) Un mastocito aislado del ratón. (A) Nótese que los especímenes están incrustados densa y homogéneamente y no muestran deformación. Barra de escala = 20 μm. (B-D) A gran aumento, se observan claramente núcleos, nucléolos, membrana nuclear, poros nucleares, retículo endoplásmico, mitocondrias, ribosomas y gránulos. Barras de escala = 2 μm (B), 500 nm (C), 2 μm (D). Abreviaturas: N = núcleo; Nu = nucléolo; NM = membrana nuclear, NP = poros nucleares; ER = retículo endoplásmico; M = mitocondrias; R = ribosomas; G = gránulos; D = células en división. (A) se reproduce de Yamaguchi et al.1 con permiso. (B-D) se reproducen de Yamaguchi et al.28 con permiso. Haga clic aquí para ver una versión más grande de esta figura.
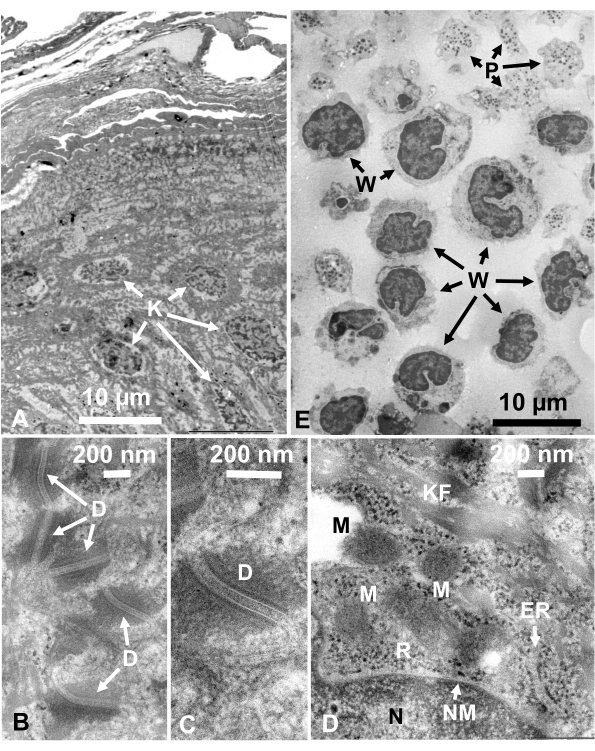
Figura 14: Secciones ultrafinas. (A-D) piel humana y (E) pelaje buffy. (A-E) Tenga en cuenta que las imágenes de tejidos y células son claras y naturales y muestran un buen contraste, aunque las secciones son muy delgadas (50 nm). La matriz de las mitocondrias muestra una apariencia densa, que es similar a las de las matrices mitocondriales densas de células vivas rápidamente congeladas (D). Barras de escala = 10 μm (A, E), 200 nm (B-D). Abreviaturas: D = desmosomas; ER = retículo endoplásmico; K = queratinocitos; KF = fibras de queratina; M = mitocondrias; N = núcleo; NM = membrana nuclear; P = plaqueta; R = ribosomas; W = glóbulos blancos. Reproducido de Yamaguchi et al.28 con permiso. Haga clic aquí para ver una versión más grande de esta figura.
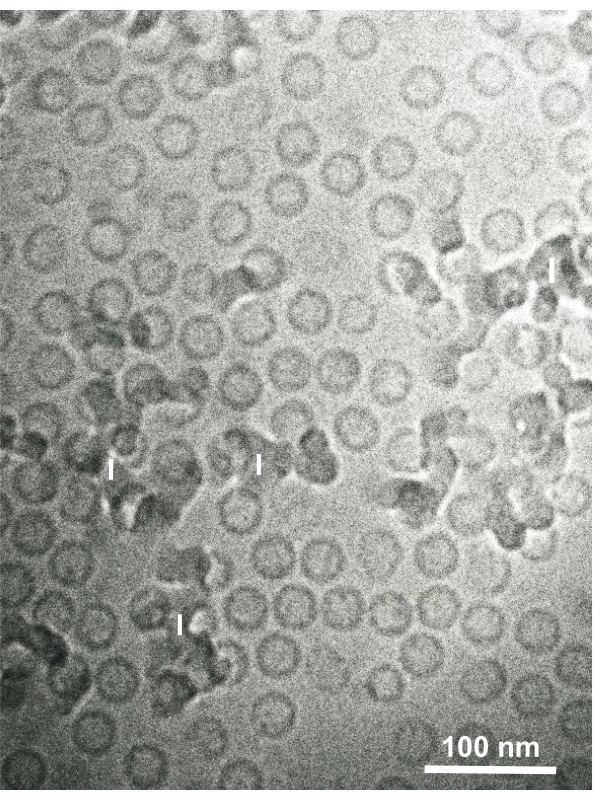
Figura 15:Partículas del núcleo del virus de la hepatitis B (VHB) congeladas rápidamente con etano líquido utilizando el dispositivo de congelación sándwich y observadas por criomicroscopía electrónica. Las partículas huecas esféricas son partículas del núcleo del VHB. Barra de escala = 100 nm. Abreviaturas: VHB = virus de la hepatitis B; I = hielo. Reproducido de Yamaguchi et al.28 con permiso. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La siguiente discusión se basa en más de 120 experimentos sándwich de sustitución de congelación-congelación en más de 1,000 muestras y más de 70 experimentos de microscopía de crioelectrónica de congelación por inmersión en más de 75 muestras realizadas durante 36 años.
Tasa de éxito para una buena congelación por congelación en sándwich
La tasa de éxito en lograr una buena congelación depende de las muestras. Las células de Saccharomyces cerevisiae (levadura) cultivadas en medio YPD (1% de extracto de levadura, 2% de peptona, 2% de dextrosa) dieron casi un 100% de éxito para una buena congelación sin formación de cristales de hielo10,11,15,35,36. Otras especies de levaduras, incluyendo Shizosaccharomyces37,38,39, Cryptococcus14,40,41,42,43,44,45, Exophiala13,41,46,47,48, 49, Fusarium50,51,52, Aureobasidium53, Candida54,55, Fellomyces56, Aspergillus57y Trichosporon, también mostraron una buena congelación. Las bacterias, incluyendo Mycobacterium58,59 y E. coli16,también mostraron una buena congelación. Las células cultivadas y las células animales aisladas mostraron una buena congelación tanto para las células vivas como para las fijas en glutaraldehído1,25, 26,27,60. Los tejidos animales y humanos fijados con glutaraldehído cortados a un grosor de 0,1 a 0,2 mm también mostraron una buena congelación la mayor parte del tiempo1,28.
Condiciones para una buena congelación
Use solo células en la etapa y condición de crecimiento apropiadas. Las células en cultivo deben estar en fase exponencial. Aplicar cantidades muy pequeñas de suspensiones celulares de muestras concentradas (para S. cerevisiae,~0.02 μL de 3-5 × 109 celdas/mL) en el disco de cobre. Las rebanadas fijadas de glutaraldehído de tejidos animales o humanos también deben ser muy pequeñas (preferiblemente 0,3 mm x 0,3 mm x 0,1 mm). Debido a que cortar rodajas de tejido de 0,1 mm de grosor es difícil, corte muchos tejidos y seleccione rodajas delgadas y medio transparentes. Trabaje rápidamente pero con cuidado, y no deje que las muestras se sequen. Al recoger los discos de cobre apilados con pinzas, no presione los discos con demasiada fuerza para evitar aplastar las células y los tejidos. La carga de muestras es el paso más importante para una congelación exitosa, y las condiciones requeridas son las mismas que las condiciones para una buena congelación para la congelación a alta presión. Los lectores deben consultar la excelente reseña de McDonald61.
Otras aplicaciones
Este artículo presenta micrografías electrónicas de una bacteria, levadura, células cultivadas, células animales aisladas, tejidos humanos y partículas de virus. Observamos una buena congelación de algas marinas fijadas con glutaraldehído. Sin embargo, las estructuras celulares de las algas verdes de agua dulce vivas fueron destruidas por la formación de cristales de hielo. La mezcla de células con albúmina sérica bovina (BSA) al 20% aseguró que la ultraestructura estuviera bien conservada sin daños en los cristales de hielo. El uso de 20% de BSA también fue beneficioso para preservar la ultraestructura de las células del tallo de un hongo. Los experimentos sobre la congelación de células y tejidos vegetales mediante la aplicación de 20% de BSA están en curso. Aunque no se ha intentado la microscopía electrónica de barrido de muestras sándwich de congelación-congelación-sustitución, la observación de estructuras celulares bien conservadas se ha reportado previamente9.
Notas sobre el método de congelación en sándwich
La ultraestructura cercana a la nativa de las células se observa mejor mediante la congelación rápida y la sustitución por congelación de las células vivas. La formación de cristales de hielo con el SFD se puede evitar limitando el grosor de las células a ≤30 μm1. La fijación de tejidos con glutaraldehído a menudo produce una mejor preservación de la estructura celular para observar las células cultivadas en suspensión porque la fijación de glutaraldehído hace que la estructura celular sea más rígida y previene los posibles cambios ultraestructurales durante la recolección y centrifugación de células vivas1. La fijación de glutaraldehído también permite la extensión de la profundidad de congelación hasta 0,2 mm1,similar a la lograda por el método de congelación a alta presión (HPF). Por lo tanto, la máquina HPF se puede reemplazar con la SFD para la congelación profunda de tejidos animales y humanos.
Debido a que los tejidos fijos con glutaraldehído se pueden almacenar durante más de 2 años28,la congelación en sándwich se puede realizar de acuerdo con la conveniencia del usuario. La fijación de tejidos con glutaraldehído también facilita la sección de tejidos porque los tejidos se vuelven más rígidos con la fijación. A diferencia de la máquina HPF, el SFD se puede utilizar para la congelación rápida de virus para microscopía crioelectrónica y para bacterias y células eucariotas. Además, en comparación con la máquina HPF, la SFD es pequeña, portátil, menos costosa y puede ser adquirida por más laboratorios. Esperamos que estas características del SFD ayuden a más laboratorios a alcanzar sus objetivos de investigación28.
Características de la morfología natural de las células.
Las estructuras celulares están en su estado natural si muestran la siguiente apariencia: Estructuras de membrana de la membrana externa (Figura 12A, B), membrana plasmática ( Figura12B,C; Figura 13A-D; y Figura 14E),envoltura nuclear(Figura 12C, Figura 13B-Dy Figura 14D-E),mitocondrias(Figura 12C, Figura 13Cy Figura 14D)y vacuolas(Figura 12C)muestran contornos suaves. El núcleo y las vacuolas son casi circulares (Figura 12C). Los ribosomas muestran una apariencia claramente densa en electrones con un diámetro de ~ 20 nm (Figura 12B,C; Figura 13C; y Figura 14D). El citoplasma es electron-lúcido (Figura 12B,C; Figura 13C; y Figura 14D).
Efecto de la fijación de glutaraldehído en la morfología celular
La fijación de glutaraldehído se realizó para tejidos animales o humanos antes de la congelación en sándwich para obtener una ultraestructura libre de cristales de hielo. Las micrografías obtenidas por este método muestran imágenes exquisitamente claras similares a las obtenidas por la congelación rápida de tejidos vivos (Figura 14)1. Los estudios sobre células de levadura, microorganismos de aguas profundas y células cultivadas muestran que la deformación de la ultraestructura se debe principalmente a la fijación y deshidratación de tetróxido de osmio por etanol a temperatura ambiente1,17,18,28. Small también informó que aunque la fijación de glutaraldehído no destruye la organización de la actina en fibroblastos cultivados, la fijación y deshidratación de tetróxido de osmio por acetona o etanol a temperatura ambiente destruyen la organización de actina62.
Por lo tanto, se debe realizar un estudio detallado sobre los efectos de la fijación de glutaraldehído en la morfología celular. Ohno desarrolló un método de criofijación in vivo en el que los tejidos vivos se congelan rápidamente sin detener el suministro de sangre63. Los tejidos fueron sustituidos por congelación e incrustados en resina epoxi, y se observaron secciones ultrafinas. Las imágenes microscópicas electrónicas mostraron la ultraestructura más cercana a la nativa de los tejidos vivos en comparación con las obtenidas por fijación química-deshidratación convencional y por la rápida congelación de tejidos frescos no fijos. Por lo tanto, puede ser interesante comparar la ultraestructura obtenida por la sustitución de fijación-congelación de glutaraldehído (el método actual) y las de la sustitución in vivo de criofijación-congelación para examinar los efectos de la fijación de glutaraldehído.
Consideración por el medio ambiente y aumento de la eficiencia experimental
Utilizamos tubos de plástico de 2 ml para la sustitución de la resina. Un ml de resina diluida es suficiente para cada paso de sustitución. Los tubos de plástico usados pueden desecharse después de cada experimento. Esto puede ahorrar tiempo y esfuerzo para lavar los viales de vidrio cuando se utilizan para la sustitución de resina. Además, la solución de acetato de uranilo se puede utilizar repetidamente para la tinción de la sección32. Después de teñir las secciones, la solución de acetato de uranilo se puede guardar y reutilizar. Como el acetato de uranilo es una sustancia radiactiva, su reutilización ayuda a evitar la generación de residuos y contribuye a la protección del medio ambiente.
Película de naftaleno polimerizada por plasma
La película de naftaleno polimerizada por plasma es una película de carbono polimerizada tridimensionalmente hecha de gas naftaleno por polimerización por plasma bajo descarga de resplandor33. La película es resistente contra el bombardeo de electrones y productos químicos, muy limpia, transparente contra los electrones, y tiene una superficie plana y una estructura amorfa. Por lo tanto, la película de naftaleno polimerizada con plasma, que está disponible comercialmente, es excelente y se recomienda como película de soporte.
Divulgaciones
Los autores declaran no tener conflicto de intereses.
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| Sandwich Freezing Device | Marine works Japan, Ltd, Yokosuka, Japan | MW-SFD-01 | with metal bar, thin metal bar, tweezers, and working bath |
| 10 mL glass vials | - | Scintillation counter vials for fixative | |
| Acetone | - | ||
| Osmium tetroxide | Nisshin EM Co. Ltd., Tokyo | 3004 | 0.1 g |
| Deep freezer | Sanyo Co. Ltd., Osaka | MDF-C8V1 | |
| Copper disk | Nisshin EM Co. Ltd., Tokyo | - | Refer to this paper |
| Slide glass | - | ||
| Double-sided adhesive tape | - | ||
| Single-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FAS-10 |
| Double-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FA-10 |
| Shredded board | Nisshin EM Co. Ltd., Tokyo | 428 | |
| Tweezers | Nisshin EM Co. Ltd., Tokyo | - | Several pairs |
| Tweezers with polystyrene foam | - | One pair | |
| Glutaraldehyde | Nisshin EM Co. Ltd., Tokyo | 3052 | |
| Liquid nitrogen | - | ||
| Propane gas | - | Cryogen | |
| Ion sputter apparatus | Hitachi high technologies, Tokyo | Hitachi E102 | |
| Micropipette | - | For 1 mL, 200 μL, and 2 μL | |
| Microcentrifuge | Tomy digital biology Co. Ltd., Tokyo | Capsulefuge, PMC-060 | |
| Stereomicroscope | Nikon Co. Ltd., Tokyo et al. | - | SMZ 645 |
| LED illumination for stereomicroscope | Nikon Co. Ltd., Tokyo et al. | SM-LW 61 Ji | |
| Disposable plastic container | - | 50 mL and 200 mL | |
| Ethane gas | - | Cryogen | |
| 2 mL Eppendorf tubes | - | For embedding | |
| Disposable plastic syringes | - | 1 mL, 5 mL, 10 mL, and 20 mL | |
| Magnetic stirrer | - | ||
| Epoxy resin | Nisshin EM Co. Ltd., Tokyo | 340 | Quetol 812 set |
| Silicon embedding mold | Nisshin EM Co. Ltd., Tokyo | 4217 | 7 mm in diameter, 13 mm deep |
| Incubater | - | For 37 °C and 60 °C | |
| Trimming stage | Sunmag Co. Ltd., Tokyo | - | Tilting mechanism equipped, Refer to this paper |
| LED illumination for trimming stage | Sunmag Co. Ltd., Tokyo | - | Refer to this paper |
| Ultrasonic Trimming Blade | Nisshin EM Co. Ltd., Tokyo | 5240 | EM-240, Refer to this paper |
| Ultramicrotome | Leica Microsystems, Vienna | Ultracut S | |
| Grids | Nisshin EM Co. Ltd., Tokyo | 2633, 2634 | 300 mesh, 400 mesh |
| 0.5% Neoprene W solution | Nisshin EM Co. Ltd., Tokyo | 605 | |
| Perfect Loop | Nisshin EM Co. Ltd., Tokyo | 2351 | Fot retrieving sections |
| Half Tube for section staining | Nisshin EM Co. Ltd., Tokyo | 463 | Refer to this pape |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Syringe filter | Toyo Roshi Kaisha, Ltd., Tokyo | DISMIC-03CP | Cellulose acetate, 0.45 μm |
| Transmission electron microscope | JEOL Co. Ltd., Tokyo | JEM-1400 |
Referencias
- Yamaguchi, M., et al. Good ultrastructural preservation of human tissues and cultured cells by glutaraldehyde fixation, sandwich freezing, and freeze-substitution. Cytologia. 85 (1), 15-26 (2020).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Technique. 3 (2), 177-210 (1986).
- Van Harreveld, A., Crowell, J. Electron microscopy after rapid freezing on a metal surface and substitution fixation. The Anatomical Record. 149, 381-385 (1964).
- Aoki, N., Ito, M., Ejiri, S., Ozawa, H. Ultrastructure of human skin by a rapid freezing technique: structural preservation and antigenicity. Journal of Investigative Dermatology. 102 (3), 354-361 (1994).
- Moor, H., Steinbrecht, R. A., Zierold, K. Theory and practice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. , 175-191 (1987).
- McDonald, K. L., Morphew, M., Vertkade, P., Muller-Reichert, T. Recent advances in high-pressure freezing: Equipment-and specimen-loading methods. Methods in Molecular Biology. 369, 143-173 (2007).
- Sosinsky, G. E., et al. The combination of chemical fixation procedures with high pressure freezing and freeze substitution preserves highly labile tissue ultrastructure for electron tomography applications. Journal of Structural Biology. 161 (3), 359-371 (2008).
- Costello, M. J. Ultra-rapid freezing of the biological samples. Scanning Electron Microscopy. , 361-370 (1980).
- Baba, M., Osumi, M. Transmission and scanning electron microscopic examination of intracellular organelles in freeze-substituted Kloeckera and Saccharomyces cerevisiae yeast cells. Journal of Electron Microscopy Technique. 5 (3), 249-261 (1987).
- Yamaguchi, M., Okada, H., Namiki, Y. Smart specimen preparation for freeze-substitution and serial ultrathin sectioning of yeast cells. Journal of Electron Microscopy. 58 (4), 261-266 (2009).
- Yamaguchi, M., et al. Electron microscopy of hepatitis B virus core antigen expressing yeast cells by freeze-substitution fixation. European Journal of Cell Biology. 47 (1), 138-143 (1988).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. Journal of Cell Biology. 124 (6), 903-913 (1994).
- Yamaguchi, M., et al. The spindle pole body duplicates in early G1 phase in a pathogenic yeast Exophiala dermatitidis: an ultrastructural study. Experimental Cell Research. 279 (1), 71-79 (2002).
- Yamaguchi, M., Biswas, S. K., Ohkusu, M., Takeo, K. Dynamics of the spindle pole body of the pathogenic yeast Cryptococcus neoformans examined by freeze-substitution electron microscopy. FEMS Microbiology Letters. 296 (2), 257-265 (2009).
- Yamaguchi, M., et al. Structome of Saccharomyces cerevisiae determined by freeze-substitution and serial ultrathin sectioning electron microscopy. Journal of Electron Microscopy. 60 (5), 321-335 (2011).
- Yamada, H., et al. Structome analysis of Escherichia coli cells by serial ultrathin sectioning reveals the precise cell profiles and the ribosome density. Microscopy. 66 (4), 283-294 (2017).
- Yamaguchi, M., Ohkusu, M., Sameshima, M., Kawamoto, S. Safe specimen preparation for electron microscopy of pathogenic fungi by freeze-substitution after glutaraldehyde fixation. Japanese Journal of Medical Mycology. 46 (3), 187-192 (2005).
- Yamaguchi, M., et al. Improved preservation of fine structure of deep-sea microorganisms by freeze-substitution after glutaraldehyde fixation. Journal of Electron Microscopy. 60 (4), 283-287 (2011).
- Yamaguchi, M., et al. Prokaryote or eukaryote? A unique microorganism from the deep-sea. Journal of Electron Microscopy. 61 (6), 423-431 (2012).
- Yamada, H., Chikamatsu, K., Aono, A., Mitarai, S. Pre-fixation of virulent Mycobacterium tuberculosis with glutaraldehyde preserves exquisite ultrastructure on transmission electron microscopy through cryofixation and freeze-substitution with osmium-acetone at ultralow temperature. Journal of Microbiological Methods. 96, 50-55 (2014).
- Yamaguchi, M. An electron microscopic study of microorganisms: from influenza virus to deep-sea microorganisms. JSM Mycotoxins. 65 (2), 81-99 (2015).
- Yamaguchi, M., et al. High-voltage electron microscopy tomography and structome analysis of unique spiral bacteria from the deep sea. Microscopy. 65 (4), 363-369 (2016).
- Yamaguchi, M., Yamada, H., Uematsu, K., Horinouchi, Y., Chibana, H. Electron microscopy and structome analysis of unique amorphous bacteria from the deep sea. Cytologia. 83 (3), 337-342 (2018).
- Yamaguchi, M., Yamada, H., Chibana, H. Deep-sea bacteria harboring bacterial endosymbionts in a cytoplasm?: 3D electron microscopy by serial ultrathin sectioning of freeze-substituted specimen. Cytologia. 85 (3), 209-211 (2020).
- Yamaguchi, M., Takahashi-Nakaguchi, A., Aida, Y., Sato-Okamoto, M., Chibana, H. Convenient method for better preservation of fine structures of cultured macrophages and engulfed yeast cells by freeze-substitution fixation. Microscopy. 66 (3), 209-211 (2017).
- Aoki, S., et al. Shift in energy metabolism caused by glucocorticoids enhances the effect of cytotoxic anticancer drugs against acute lymphoblastic leukemia cells. Oncotarget. 8 (55), 94271-94285 (2017).
- Hirao, T., et al. Altered intracellular signaling by imatinib increases the anticancer effects of tyrosine kinase inhibitors in chronic myelogenous leukemia cells. Cancer Science. 109 (1), 121-131 (2018).
- Yamaguchi, M., et al. Sandwich freezing device for rapid freezing of viruses, bacteria, yeast, cultured cells, and animal and human tissues in electron microscopy. Microscopy. 70 (2), 215-223 (2021).
- Yamaguchi, M. Troubleshooting in specimen preparation of microorganisms. Kenbikyo. 42, 26-28 (2007).
- Yamaguchi, M., Aoyama, T., Yamada, N., Chibana, H. Quantitative measurement of hydrophilicity/hydrophobicity of the plasma-polymerized naphthalene film (Super support film) and other support films and grids in electron microscopy. Microscopy. 65 (55), 444-450 (2016).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Yamaguchi, M., Shimizu, M., Yamaguchi, T., Ohkusu, M., Kawamoto, S. Repeated use of uranyl acetate solution for section staining in transmission electron microscopy. Plant Morphology. 17 (1), 57-59 (2005).
- Yamaguchi, M., Tanaka, A., Suzuki, T. A support film of plasma-polymerized naphthalene for electron microscopy: method of preparation and application. Journal of Electron Microscopy. 41 (1), 7-13 (1992).
- Yamaguchi, M., et al. Cryo-electron microscopy of hepatitis B virus core particles produced by transformed yeast: comparison with negative staining and ultrathin sectioning. Journal of Electron Microscopy. 37 (6), 337-341 (1988).
- Yamaguchi, M., et al. Dynamics of hepatitis B virus core antigen in a transformed yeast cell: analysis with an inducible system. Journal of Electron Microscopy. 43 (6), 386-393 (1994).
- Yamaguchi, M., Miyatsu, T., Mizokami, H., Matsuoka, L., Takeo, K. Translocation of hepatitis B virus core particles through nuclear pores in transformed yeast cells. Journal of Electron Microscopy. 45 (4), 321-324 (1996).
- Sipiczki, M., Takeo, K., Yamaguchi, M., Yoshida, S., Miklos, I. Environmentally controlled dimorphic cycle in fission yeast. Microbiology. 144, 1319-1330 (1998).
- Sipiczki, M., et al. Role of cell shape in determination of the division plane in Schizosaccharomyces pombe: random orientation of septa in spherical cells. Journal of Bacteriology. 182 (6), 1693-1701 (2000).
- Encz, i. K., Yamaguchi, M., Sipiczki, M. Morphology transition genes in the dimorphic fission yeast Schizosaccharomyces japonicus. Antonie van Leeuwenhoek. 92 (2), 143-154 (2007).
- Kopecka, M., et al. Microtubules and actin cytoskeleton in Cryptococcus neoformans compared with ascomycetous budding and fission yeasts. European Journal of Cell Biology. 80 (4), 303-311 (2001).
- Yamaguchi, M., Biswas, S. K., Kita, S., Aikawa, E., Takeo, K. Electron microscopy of pathogenic yeasts Cryptococcus neoformans and Exophiala dermatitidis by high-pressure freezing. Journal of Electron Microscopy. 51 (1), 21-27 (2002).
- Ikeda, R., et al. Contribution of the mannan backbone of cryptococcal glucuroxylomannan and a glycolytic enzyme of Staphylococcus aureus to contact-mediated killing of Cryptococcus neoformans. Journal of Bacteriology. 189 (13), 4815-4826 (2007).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Cryptococcus neoformans: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. Journal of Electron Microscopy. 59 (2), 165-172 (2010).
- Kozubowski, L., et al. Ordered kinetochore assembly in the human pathogenic basidiomycetous yeast Cryptococcus neoformans. MBio. 4 (5), 00614 (2013).
- Stepanova, A. A., Yamaguchi, M., Chibana, H., Vasilyeva, N. V. Ultrastructural aspects of cell components migration during budding in the yeast Cryptococcus leurentii. Problems in Medical Mycology. 18 (3), 24-29 (2016).
- Ohkusu, M., et al. Cellular and nuclear characteristics of Exophiala dermatitidis. Studies in Mycology. 43 (43), 143-150 (1999).
- Yamaguchi, M., Biswas, S. K., Suzuki, Y., Furukawa, H., Takeo, K. Three-dimensional reconstruction of a pathogenic yeast Exophiala dermatitidis cell by freeze-substitution and serial sectioning electron microscopy. FEMS Microbiology Letters. 219 (1), 17-21 (2003).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Exophiala dermatitidis: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. European Journal of Cell Biology. 82 (10), 531-538 (2003).
- Biswas, S. K., Yamaguchi, M., Naoe, N., Takashima, T., Takeo, K. Quantitative three-dimensional structural analysis of Exophiala dermatitidis yeast cells by freeze-substitution and serial ultrathin sectioning. Journal of Electron Microscopy. 52 (2), 133-143 (2003).
- Takaya, N., et al. Cytochrome P450nor, a novel class of mitochondrial cytochrome P450 involved in nitrate respiration in the fungus Fusarium oxysporum. Archives of Biochemistry and Biophysics. 372 (2), 340-346 (1999).
- Zhou, Z., et al. Ammonia fermentation, a novel anoxic metabolism of nitrate by fungi. Journal of Biological Chemistry. 277 (3), 1892-1896 (2002).
- Takasaki, K., et al. Fungal ammonia fermentation, a novel metabolic mechanism that couples the dissimilatory and assimilatory pathways of both nitrate and ethanol. Role of acetyl CoA synthetase in anaerobic ATP synthesis. Journal of Biological Chemistry. 279 (13), 12414-12420 (2004).
- Kopecka, M., et al. Analysis of microtubules and F-actin structures in hyphae and conidia development in opportunistic human pathogenic black yeast Aureobasidium pullulans. Microbiology. 149, 865-876 (2003).
- Ueno, K., Namiki, Y., Mitani, H., Yamaguchi, M., Chibana, H. Differential cell wall remodeling of two chitin synthase deletants Δchs3A and Δchs3B in the pathogenic yeast Candida glabrata. FEMS Yeast Research. 11 (5), 398-407 (2011).
- Ikezaki, S., et al. Mild heat stress affects on the cell wall structure in Candida albicans biofilm. Medical Mycology Journal. 60 (2), 29-37 (2019).
- Gabriel, M., et al. The cytoskeleton in the unique cell reproduction by conidiogenesis of the long-neck yeast Fellomyces (Sterigmatomyces) fuzhouensis. Protoplasma. 229 (1), 33-44 (2006).
- Yoshimi, A., et al. Functional analysis of the α-1,3-glucan synthase genes agsA and agsB in Aspergillus nidulans: agsB is the major α-1,3-glucan synthase in this fungus. PLoS One. 8 (1), 54893 (2013).
- Yamada, H., Mitarai, S., Chikamatsu, K., Mizuno, K., Yamaguchi, M. Novel freeze-substitution electron microscopy provides new aspects of virulent Mycobacterium tuberculosis with visualization of the outer membrane and satisfying biosafety requirements. Journal of Microbiological Methods. 80 (1), 14-18 (2010).
- Yamada, H., Yamaguchi, M., Chikamatsu, K., Aono, A., Mitarai, S. Structome analysis of virulent Mycobacterium tuberculosis, which survives with only 700 ribosomes at density per 0.1 fl cytoplasm. PLoS One. 10 (1), 0117109 (2015).
- Shiratori, R., et al. Glycolytic suppression dramatically changes the intracellular metabolic profile of multiple cancer cell lines in a mitochondrial metabolism-dependent manner. Scientfic Reports. 9 (1), 18699 (2019).
- McDonald, K. L. Out with the old and in with the new: rapid specimen preparation procedures for electron microscopy of sectioned biological material. Protoplasma. 251 (2), 429-448 (2014).
- Small, J. V. Organization of actin in the leading edge of cultured cells: influence of osmium tetroxide and dehydration on the ultrastructure of actin meshworks. Journal of Cell Biology. 91 (3), 695-705 (1981).
- Ohno, S., Terada, N., Fujii, Y., Ueda, H., Takayama, I. Dynamic structure of glomerular capillary loop as revealed by an in vivo cryotechnique. Virchows Archiv. 427 (5), 519-527 (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados