Method Article
Congelamento rapido con dispositivo di congelamento a sandwich per una buona conservazione ultrastrutturale di campioni biologici in microscopia elettronica
In questo articolo
Riepilogo
Qui mostriamo come utilizzare il dispositivo di congelamento a sandwich per il congelamento rapido di campioni biologici, inclusi batteri, lieviti, cellule coltivate, cellule isolate, tessuti animali e umani e virus. Mostriamo anche come preparare i campioni per il sezionamento ultrasottile dopo un rapido congelamento.
Abstract
La fissazione chimica è stata utilizzata per osservare l'ultrastruttura di cellule e tessuti. Tuttavia, questo metodo non preserva adeguatamente l'ultrastruttura delle cellule; di solito si osservano artefatti ed estrazione del contenuto cellulare. Il congelamento rapido è un'alternativa migliore per la conservazione della struttura cellulare. Il congelamento a sandwich di lieviti o batteri viventi seguito dalla sostituzione del congelamento è stato utilizzato per osservare la squisita ultrastruttura naturale delle cellule. Recentemente, il congelamento a sandwich di cellule in coltura fissate alla glutaraldeide o tessuti umani è stato utilizzato anche per rivelare l'ultrastruttura di cellule e tessuti.
Questi studi sono stati finora condotti con un dispositivo di congelamento a sandwich fatto a mano e le applicazioni agli studi in altri laboratori sono state limitate. Un nuovo dispositivo di congelamento a sandwich è stato recentemente fabbricato ed è ora disponibile in commercio. Il presente documento mostra come utilizzare il dispositivo di congelamento a sandwich per il congelamento rapido di campioni biologici, inclusi batteri, lieviti, cellule coltivate, cellule isolate, tessuti animali e umani e virus. Viene inoltre mostrata la preparazione di campioni per il sezionamento ultrasottile dopo congelamento rapido e le procedure per la sostituzione del congelamento, l'incorporamento della resina, il taglio dei blocchi, il taglio di sezioni ultrasottili, il recupero delle sezioni, la colorazione e la copertura delle griglie con film di supporto.
Introduzione
La microscopia elettronica è un potente strumento per studiare l'ultrastruttura cellulare. La fissazione chimica con procedure convenzionali di disidratazione è stata utilizzata per osservare l'ultrastruttura di cellule e tessuti. Tuttavia, questo metodo non preserva adeguatamente l'ultrastruttura delle cellule e di solito si osservano artefatti e l'estrazione del contenuto cellulare. Il congelamento rapido e la sostituzione del congelamento di cellule e tessuti sono alternative migliori per la conservazione della struttura cellulare.
Tre metodi principali sono stati impiegati per congelare rapidamente le cellule1: 1) il congelamento a tuffo viene eseguito immergendo i campioni in un criogeno raffreddato, come il propano, ed è stato utilizzato fin dai primi anni 19502; 2) il congelamento a freddo del blocco metallico viene eseguito sbattendo rapidamente cellule e tessuti su un blocco metallico raffreddato con azoto liquido o elio liquido3,4; e 3) il congelamento ad alta pressione viene effettuato congelando cellule e tessuti con azoto liquido ad altapressione 5,6,7.
Il congelamento a sandwich è un tipo di congelamento a tuffo effettuato inserendo materiali biologici sottili tra due dischi di rame e congelandoli rapidamente immergendoli nel propano liquido8,9,10. In questo metodo, campioni molto sottili (pochi micrometri di spessore) vengono rapidamente raffreddati con criogeno utilizzando un metallo che ha una buona conduttività termica da entrambi i lati. Pertanto, questo metodo rimuove efficacemente il calore dai campioni, rendendo possibile congelare stabilmente le cellule senza danni ai cristalli di ghiaccio. Il congelamento a sandwich, seguito dalla sostituzione congelante di lieviti viventi e cellule batteriche, rivela l'ultrastruttura naturale delle cellule10,11, 12,13,14,15,16.
Recentemente, questo metodo è stato trovato utile per preservare immagini cellulari chiare di microrganismi fissati alla glutaraldeide17,18,19,20,21,22,23,24,cellulecoltivate 25,26,27e cellule e tessuti umani1,28 . Sebbene questi studi siano stati condotti utilizzando un dispositivo di congelamento a sandwich fatto a mano29e le applicazioni ad altri studi in altri laboratori siano state limitate, un nuovo dispositivo di congelamento a sandwich (SFD) è stato fabbricato28 ed è ora disponibile in commercio.
Il presente documento mostra come utilizzare la SFD per il congelamento rapido di campioni biologici, inclusi batteri, lieviti, cellule coltivate, cellule isolate, tessuti animali e umani e virus. Viene inoltre mostrata la preparazione di campioni per il sezionamento ultrasottile dopo un rapido congelamento, nonché le procedure per la sostituzione del congelamento, l'incorporamento della resina, il taglio dei blocchi, il taglio di sezioni ultrasottili, il recupero delle sezioni, la colorazione e la copertura delle griglie con film di supporto.
Protocollo
NOTA: Il protocollo dello studio per i campioni umani è stato approvato dal Comitato etico della ricerca biomedica della Graduate School of Medicine, Chiba University (3085). Il tetrossido di osmio è una sostanza chimica pericolosa; deve essere maneggiato indossando i guanti nel cappuccio dei fumi. La Figura 1 mostra il dispositivo di congelamento sandwich e gli strumenti necessari28. La Figura 2 mostra i materiali necessari per eseguire esperimenti di congelamento a sandwich. I flaconcini di vetro sono riempiti con acetone contenente tetrossido di osmio e mantenuti a -80°C fino all'uso (Figura 2B). I dischi di rame hanno un diametro di 3 mm, senza fori, hanno una lettera su un lato e sono disponibili in commercio (Figura 2C).
1. Congelamento rapido delle sospensioni cellulari per la sostituzione del congelamento
NOTA: l'intera procedura è illustrata nella Figura 3.
- Cellule
- Utilizzare sospensioni cellulari di batteri, lieviti (Figura 2A), cellule coltivate e cellule isolate per il congelamento a sandwich.
NOTA: Sia le cellule viventi che quelle fissate alla glutaraldeide possono essere utilizzate28.
- Utilizzare sospensioni cellulari di batteri, lieviti (Figura 2A), cellule coltivate e cellule isolate per il congelamento a sandwich.
- Preparazione di propano liquido
NOTA: utilizzare crioglovi e occhiali quando si maneggia azoto liquido. Poiché il propano è esplosivo, bisogna fare attenzione a non usare fuochi nella stessa stanza e le finestre devono essere tenute aperte.- Riempire il contenitore di azoto liquido della SFD con azoto liquido (Figura 4A). Riempire il contenitore di propano liquido con propano liquido introducendo gas propano utilizzando un ugello fine (Figura 4B,C). Accelerare la solidificazione del propano utilizzando una barra metallica raffreddata (Figura 1 e Figura 4D,E).
- Preparazione di dischi di rame
- Posizionare i dischi di rame su un vetro scorrevole con il lato no-letter-side verso l'alto (Figura 2D) e trattare con scarico a bagliore a 10 Pa, 400 volt, 1 mA per 30 s (Figura 4F, G) per rendere la superficie del disco idrofila utilizzando un apparato sputter ionico30.
- Sandwiching e congelamento a tuffo della sospensione cellulare
- Trasferire la sospensione cellulare in un tubo centrifuga da 2 mL (Figura 5A) e centrifugare a 2.900 × g per 10 s a temperatura ambiente (Figura 5B,C). Rimuovere il surnatante e sospendere il pellet per ottenere una sospensione spessa (vedi discussione).
- Posizionare una piccola quantità di sospensione cellulare (~0,02 μL) su un disco di rame (Figura 5D-F), coprirlo con un altro disco di rame (Figura 5G) e prelevare i dischi con una pinzetta (Figura 5H).
NOTA: Per misurare ~0,02 μL della sospensione cellulare, osservare 0,1 μL di gocce della sospensione sotto lo stereomicroscopio e dividerle in goccioline che sono1/5 ° di questo volume. - Fare un pozzo al centro del propano solido con la sottile barra di metallo (Figura 5I). Impostare le pinzette in una SFD e congelarle rapidamente premendo il pulsante di iniezione dell'apparecchio (Figura 5J,K).
NOTA: Bisogna fare attenzione a non asciugare i campioni e non appoggiare completamente i due dischi l'uno sull'altro (altrimenti, staccarli diventerebbe molto difficile nella fase successiva).
- Sandwiching e plunge-freezing di tessuti animali e umani
- Utilizzare tessuti animali e umani (~0,5 mm x 0,5 mm x 1,5 mm) fissati in tampone fosfato 2,5% glutaraldeide-0,1 M (pH 7,4) (Figura 6A,B). Tagliali in sezioni spesse da 0,1 a 0,2 mm con una lama di rasoio sotto uno stereomicroscopio (Figura 6C, D).
- Posizionare una piccola goccia (~0,02 μL) di soluzione di glutaraldeide su un disco di rame (Figura 6E, F). Quindi, utilizzare una pinzetta per posizionare un pezzo di tessuto nella glutaraldeide sul disco di rame (Figura 6G, H) e coprirlo con un altro disco di rame ( Figura6I-K).
- Congelare rapidamente i dischi con i tessuti nel propano fondente della SFD, come descritto al paragrafo 1.4 (Figura 5J,K).
NOTA: Poiché la glutaraldeide è una sostanza chimica pericolosa, deve essere maneggiata indossando guanti nel cappuccio dei fumi. I tessuti non devono essere lavati con tamponi quando posti su un disco di rame ma tenuti imbevuti di soluzione di glutaraldeide perché la glutaraldeide ha un effetto antigelo1.
- Utilizzare tessuti animali e umani (~0,5 mm x 0,5 mm x 1,5 mm) fissati in tampone fosfato 2,5% glutaraldeide-0,1 M (pH 7,4) (Figura 6A,B). Tagliali in sezioni spesse da 0,1 a 0,2 mm con una lama di rasoio sotto uno stereomicroscopio (Figura 6C, D).
- Sostituzione del congelamento con acetone di osmio
- Trasferire i dischi in azoto liquido in un bagno di lavoro (Figura 7A,B). Utilizzando una coppia di pinzette raffreddate in azoto liquido, staccare i dischi l'uno dall'altro per esporre il campione (Figura 7C-E).
- Posizionare i dischi con le cellule in un flaconcino di vetro (Figura 7F) che è riempito con 1 mL di acetone contenente il 2% di tetrossido di osmio (Figura 2B) che è stato posto in azoto liquido e solidificato (Figura 4H).
- Trasferire i dischi in un congelatore e tenerli a -80°C per 2-4 giorni per la sostituzione congelante delle celle (Figura 3). Immergere le pinzette usate in acqua a temperatura ambiente per riscaldarle (Figura 7G) per il congelamento dei seguenti campioni.
NOTA: Le pinzette per la manipolazione del campione devono essere calde (temperatura ambiente) perché le pinzette fredde possono congelare il campione prima del congelamento rapido, portando alla formazione di cristalli di ghiaccio.
- Riscaldamento e incorporamento dei campioni
- Portare gradualmente i campioni a temperatura ambiente (2 h a -20°C, 2 h a 4°C e 15 min a temperatura ambiente, Figura 3 e Figura 8A)e trasferire i dischi in tubi di plastica da 2 mL riempiti con 1 mL di acetone (Figura 3 e Figura 8B,C).
- Preparare la resina epossidica mescolando i reagenti in un contenitore di plastica monouso utilizzando un agitatore (Figura 8D-F).
- Sostituire l'acetone nella fase 1.7.1 successivamente con il 30% di resina (in acetone), il 60% di resina e il 90% di resina a temperatura ambiente per 1 ora ciascuno. Quindi, sostituire la resina al 90% con la resina al 100% a 37 ° C durante la notte. Infine, incorporare i campioni in resina al 100% (Figura 8G-J) nello stampo di incorporamento del silicio e polimerizzarli a 60 ° C per 24 ore (Figura 3).
NOTA: I campioni devono rimanere attaccati ai dischi di rame durante l'intera procedura (per facilitare il sezionamento). L'uso di un apparato rotante o vibrante non è raccomandato durante il processo di incorporamento perché contribuiscono poco alla penetrazione della resina nella cella. Inoltre, la vibrazione dell'apparato a volte fa sì che i campioni si stacchino dai dischi di rame. L'incubazione a 37°C durante la notte accelererebbe la penetrazione della resina nella cella a causa dell'energia termica (la resina non polimerizzerebbe perché non contiene alcun acceleratore).
- Taglio di blocchi di campioni
- Estrarre i blocchi polimerizzati dagli stampi di incorporamento del silicio (Figura 9A). Scrivere il numero del campione sul blocco (Figura 9B).
- Rimuovere i dischi di rame dal blocco con una lama di rasoio (Figura 9C, D) e tagliare i campioni incorporati sulla superficie del blocco a 0,7 mm x 0,7 mm utilizzando una lama di rifilatura ad ultrasuoni ( Figura9E) e lame di rasoio (Figura 9F-H) sotto uno stereomicroscopio31.
- Impostare il blocco in un portacampione di un ultramicrotomo (Figura 9I) e tagliare la faccia del blocco senza intoppi con un coltello da taglio a diamante (Figura 9J,K).
- Taglio di sezioni ultrasottili
- Rimuovere il blocco dall'ultramicrotomo (Figura 10A)31, impostarlo in uno stereomicroscopio e tagliarlo ulteriormente a 0,2 mm x 0,3 mm con una lama di rasoio (Figura 10B,C).
- Applicare il neoprene sulle griglie per renderle adesive (Figura 10D). Riposizionare il blocco sull'ultramicrotomo, coprire l'ultramicrotomo con un coperchio di plastica (Figura 10E)31e tagliare sezioni spesse 50-70 nm (Figura 10F-H).
- Recuperare le sezioni utilizzando un loop (Figura 10I), montarle su griglie di rame a 300 o 400 maglie trattate con neoprene e asciugarle (Figura 10J).
- Colorazione di sezioni e osservazione al microscopio elettronico
- Impostare le griglie con sezioni nella scanalatura del mezzo tubo di silicone (Figura 11A)31, e immergere in soluzione di acetato di uranile e citrato di piombo per 3 minuti ciascuno per la colorazione (Figura 11B-E)32.
- Per i lieviti e i campioni di funghi, posizionare le griglie su una carta da filtro (4 mm x 4 mm), raccoglierle con una pinzetta e coprirle con pellicola di naftalene polimerizzato al plasma33 sulla superficie dell'acqua (Figura 11F, G). Inserire le griglie in un microscopio elettronico e osservare a 100 kV (Figura 11H,I).
2. Congelamento rapido di virus e macromolecole
- Preparazione di etano liquido
NOTA: utilizzare crioglovi e occhiali quando si maneggia azoto liquido. Poiché l'etano è esplosivo, bisogna fare attenzione a non usare fuochi nella stessa stanza e le finestre dovrebbero essere tenute aperte. L'etano è usato perché evapora nel microscopio elettronico mentre il propano no.- Riempire il contenitore di azoto liquido della SFD con azoto liquido. Riempire il contenitore di etano liquido con etano liquido introducendo gas etano attraverso un ugello sottile.
- Preparazione e congelamento rapido di microgriglie e campioni
- Rendere idrofile entrambe le facce delle microgriglie trattandole con scarico a bagliore (10 Pa, 400 V, 1 mA) utilizzando un apparato di sputter ionico30.
- Impostare la microgriglia nella SFD e applicare 2 μL del virus o della sospensione macromolecolare (1 mg di proteina/mL) sulle microgriglie. Rimuovere il liquido in eccesso utilizzando carta da filtro e congelare rapidamente la microgriglia premendo il pulsante di iniezione dell'apparecchio.
- Impostazione della microgriglia congelata in un supporto di criotrasferimento e osservazione al microscopio elettronico
- Trasferire le microgriglie congelate in azoto liquido, inserite in un supporto di criotrasferimento raffreddato in anticipo alla temperatura dell'azoto liquido, e osservare al microscopio elettronico a bassa temperatura34.
Risultati
Le cellule viventi di microrganismi in sospensione sono state raccolte per centrifugazione, inserite tra due dischi di rame, rapidamente congelate con SFD, congelate, sostituite dal congelamento, incorporate in resina epossidica, sezionate ultrasottili, colorate e osservate al microscopio elettronico seguendo le procedure sopra descritte. La Figura 12 mostra sezioni ultrasottili di Escherichia coli (batteri, Figura 12A,B)16 e Saccharomyces cerevisiae (lievito, Figura 12C)15. Si noti che le immagini sono molto chiare e mostrano una morfologia naturale.
Le sospensioni cellulari fissate alla glutaraldeide di cellule coltivate e cellule animali isolate sono state raccolte e rapidamente congelate con SFD, sostituite dal congelamento e osservate al microscopio elettronico seguendo le procedure sopra descritte. La Figura 13 mostra sezioni ultrasottili di cellule in coltura (Figura 13A-C)1,28 e cellule isolate dalla cavità addominale del topo ( Figura13D)28. La Figura 14 mostra sezioni ultrasottili della pelle umana (Figura 14A-D) e del pelo buffy (Figura 14E)1. Si noti che le immagini sono anche molto chiare e mostrano una morfologia naturale. La Figura 15 mostra le particelle del nucleo del virus dell'epatite B rapidamente congelate con SFD e osservate dalla crioelettronica34. Come per le altre cellule, le immagini sono molto chiare e mostrano una morfologia naturale.
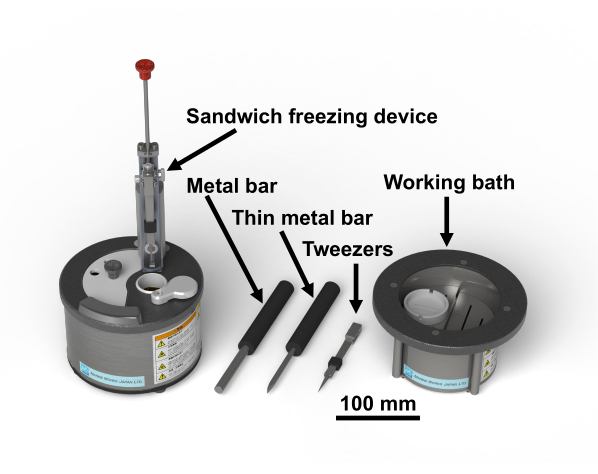
Figura 1: Dispositivo di congelamento a sandwich28 e gli strumenti necessari. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Materiali necessari per eseguire esperimenti di congelamento a sandwich. (A) Campione: Micrografia leggera di Saccharomyces cerevisiae (lievito). Scala bar = 10 μm. (B) Flaconcini di vetro (10 mL) contenenti 1 mL di acetone con tetrossido di osmio al 2%. (C) Dischi di rame che mostrano una superficie senza una lettera (a sinistra) e una superficie con una lettera (a destra). Barra scala = 3 mm. Microscopia elettronica a scansione. (D) Dischi di rame senza lato lettera verso l'alto sono stati collocati su un vetrino con nastro biadesivo (*). Barra della scala = 3 mm. (E) Un rasoio a doppio taglio e un rasoio a doppio taglio rotto per affettare tessuti animali e umani, un rasoio a taglio singolo per tagliare i blocchi e una tavola triturata per affettare tessuti animali e umani. (F) Pinzette con polistirene espanso estruso per proteggere le dita dal freddo. Fare clic qui per visualizzare una versione più grande di questa figura.
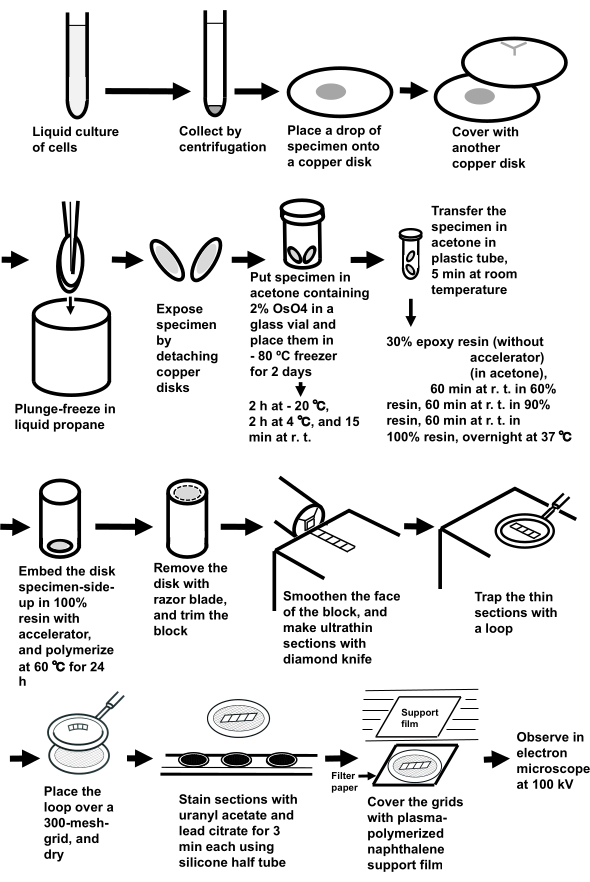
Figura 3: Preparazione del campione di sospensioni cellulari utilizzando il metodo di congelamento a sandwich. Abbreviazioni: r.t. = temperatura ambiente. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Preparazione di propano liquido, dischi di rame e fissativo. (A) L'azoto liquido (freccia) è stato versato nel contenitore di azoto liquido del dispositivo di congelamento a sandwich. (B) Il gas propano è stato introdotto in un contenitore di propano liquido attraverso un ugello sottile. (C) Propano liquido (freccia). (D) Una barra metallica (freccia) è stata utilizzata per raffreddare il propano liquido per accelerare la solidificazione del propano liquido. (E) Propano solidificato (freccia). (F) Apparecchio di sputter ionico (freccia) per rendere idrofili i dischi di rame con scarico a bagliore. (G) Scarico luminoso. H)Flaconcini di vetro posti in azoto liquido in un bagno di lavoro. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Congelamento rapido della sospensione cellulare (lievito) mediante il dispositivo di congelamento a sandwich. (A) Trasferimento della coltura di lievito nel tubo della centrifuga. (B) Microcentrifuga. (C) Pellet di Saccharomyces cerevisiae nel tubo della centrifuga (freccia). (D) Trasferimento del campione con una micropipetta dal tubo della centrifuga. (E) Posizionamento del campione sul disco di rame. (F) Una piccola goccia di un campione sul disco di rame (freccia). (G) Coprire il campione con un altro disco di rame. (H) Raccogliendo i due dischi con una pinzetta. (I) Fare un pozzo nel propano solido usando la sottile barra di metallo. (J) Congelamento a tuffo del campione premendo il pulsante di iniezione. (K) Il congelamento è completo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Preparazione di un campione di tessuti umani (pelle). (A, B) Tessuto cutaneo umano fissato in glutaraldeide in una capsula di Petri. Barra della scala = 5 mm. (C, D) I tessuti (freccia) sono stati affettati usando due rasoi a doppio taglio su una tavola triturata. (E, F) Una piccola goccia di soluzione di glutaraldeide (freccia) è stata posta su un disco di rame. (G, H) Un pezzo di tessuto cutaneo è stato posto sul disco di rame usando una pinzetta. (I) Un altro disco è stato usato per coprire il disco di rame con il tessuto cutaneo. (J) I dischi a sandwich sono stati raccolti con una pinzetta. (K) I dischi a sandwich sono stati delicatamente tenuti con una pinzetta. Si noti lo spazio tra le punte della pinzetta (freccia) mantenuto per evitare di schiacciare i tessuti. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Trasferimento del campione in azoto liquido e distacco dei dischi. (A) Trasferimento dei dischi (freccia) in azoto liquido in un bagno di lavoro. (B) Dischi in azoto liquido (freccia). (C) Le pinzette sono state poste in azoto liquido per raffreddarle nel bagno di lavoro. (D, E) Staccare i dischi di rame (frecce) usando una pinzetta. (F) Trasferimento del disco (freccia) nel flaconcino di vetro con una pinzetta. (G) Riscaldare le pinzette in acqua per congelare il campione successivo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Riscaldamento e incorporamento dei campioni. (A) Campioni in flaconcini di vetro a temperatura ambiente. (B) Trasferimento dei dischi (freccia) in un tubo di plastica da 2 ml con pinzette. (C) Dischi di rame (freccia) in acetone in un tubo di plastica. (D) Resine di misura con un tubo di iniezione (freccia). (E) Trasferimento della resina in una tazza monouso (freccia). (F) Miscelazione della resina con un agitatore. (G) Una piccola quantità di resina è stata posta nei fori dello stampo di incorporamento del silicone. (H) La resina in eccesso nelle griglie è stata rimossa con carta da filtro. (I, J) Dischi di rame con campioni sono stati posizionati nella parte inferiore dei fori dello stampo di incorporamento con il campione rivolto verso l'alto. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9: Rifilatura del blocco del campione. (A) Estrazione di blocchi polimerizzati dagli stampi di incorporamento. (B) Il numero del campione è stato scritto sul blocco. (C, D) Il disco di rame è stato rimosso dal blocco con un rasoio. Barra della scala per (D) = 1 mm. (E-G) Il campione è stato tagliato con una lama da taglio ad ultrasuoni e una lama di rasoio. Barra di scala per (G) = 1 mm. (H) Elevato ingrandimento di (G). Un singolo punto luminoso è una cellula. Le celle sono state incorporate in un singolo strato10. Barra della scala = 10 μm. (I-K) La superficie del blocco è stata tagliata liscia con un coltello per la rifilatura del diamante. Barra della scala per (K) = 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 10: Taglio di sezioni ultrasottili. (A) Il blocco del campione è stato rimosso dal microtomo31. (B, C) L'esemplare è stato ulteriormente rifinito con una lama di rasoio. Barra della scala per (C) = 0,5 mm. (D) Il neoprene è stato applicato sulle griglie per farle aderire. (E) L'ultramicrotomo è stato ricoperto di plastica per evitare il flusso d'aria durante il sezionamento ultrasottile. (F) La barca con coltello di diamante era piena d'acqua. (G, H) Le sezioni ultrasottili sono state tagliate ad uno spessore di 70 nm. Barra della scala per (H) = 1 mm. (I, J) Le sezioni sono state recuperate usando un anello e quindi asciugate. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 11: Sezioni di colorazione. (A) Le griglie sono state collocate nella scanalatura del mezzo tubo di silicone. (B) Sono stati imbevuti di acetato di uranile per la colorazione. (C) L'acetato di uranile usato è stato raccolto su pellicola cerosa autosigillante. (D) Le griglie sono state lavate con un getto d'acqua e (E) poi imbevute di citrato di piombo. (F) Il film di naftalene polimerizzato al plasma è stato fatto galleggiare sull'acqua e (G) utilizzato per coprire una griglia posta su carta da filtro di 4 mm x 4 mm. (H) La griglia è stata collocata in un supporto per campioni e (I) osservata al microscopio elettronico. Fare clic qui per visualizzare una versione più grande di questa figura.
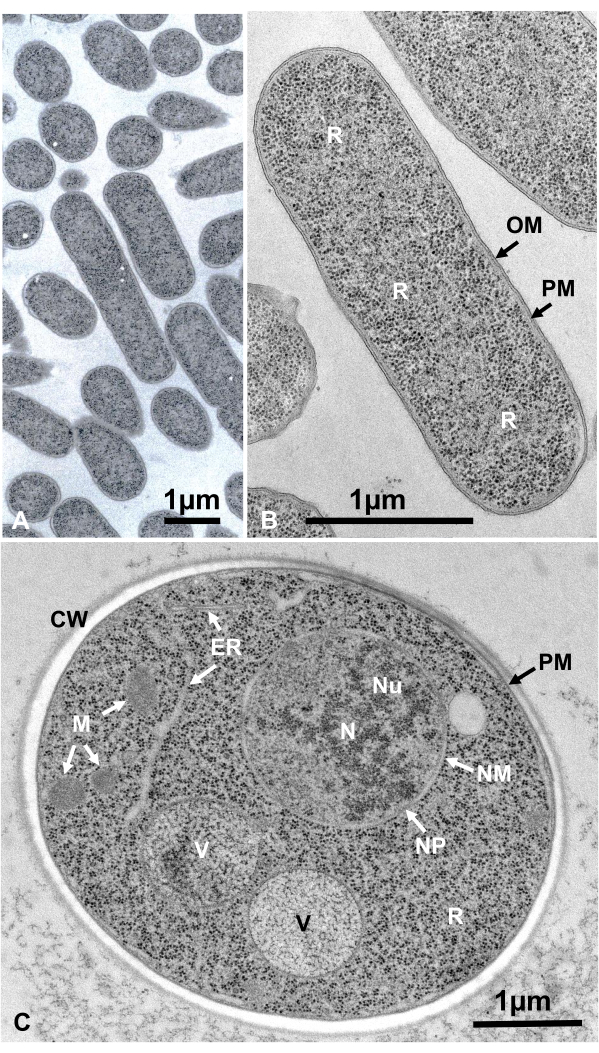
Figura 12: Sezioni ultrasottili di Escherichia coli (batteri, A, B) e Saccharomyces cerevisiae (lievito, C). (A) Si noti che i campioni sono incorporati densamente e in modo omogeneo e non mostrano deformazioni. (B, C) Le strutture della membrana mostrano una morfologia chiara e liscia e i ribosomi sono abbastanza chiari da poter enumerare ogni particella16. (C) Il nucleo di lievito e i vacuoli mostrano una vera forma circolare, che può essere la loro morfologia naturale. La matrice dei mitocondri mostra un aspetto denso di elettroni, che può essere una caratteristica delle cellule vive che sono fissate dal congelamento rapido. Barre di scala = 1 μm. Abbreviazioni: CW = parete cellulare; ER = reticolo endoplasmatico; NM = membrana nucleare; NP = pori nucleari; OM = membrana esterna; PM = membrane plasmatiche; R = ribosomi; N = nucleo; M = mitocondri. (B) è riprodotto da Yamada et al.16 con il permesso. Fare clic qui per visualizzare una versione più grande di questa figura.
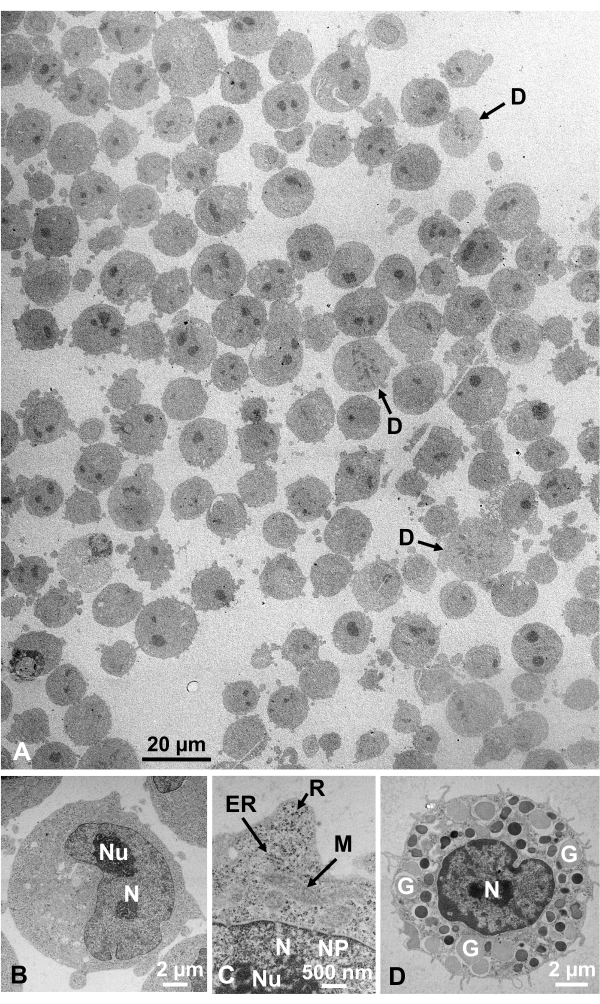
Figura 13: Sezioni ultrasottili. (A-C) Cellule coltivate K562. (D) Un mastocita isolato dal topo. (A) Si noti che i campioni sono incorporati densamente e in modo omogeneo e non mostrano deformazioni. Barra di scala = 20 μm. (B-D) Ad alto ingrandimento, nucleo, nucleolo, membrana nucleare, pori nucleari, reticolo endoplasmatico, mitocondri, ribosomi e granuli sono chiaramente osservati. Barre di scala = 2 μm (B), 500 nm (C), 2 μm (D). Abbreviazioni: N = nucleo; Nu = nucleolo; NM = membrana nucleare, NP = pori nucleari; ER = reticolo endoplasmatico; M = mitocondri; R = ribosomi; G = granuli; D = dividere le cellule. (A) è riprodotto da Yamaguchi et al.1 con il permesso. (B-D) sono riprodotti da Yamaguchi et al.28 con il permesso. Fare clic qui per visualizzare una versione più grande di questa figura.
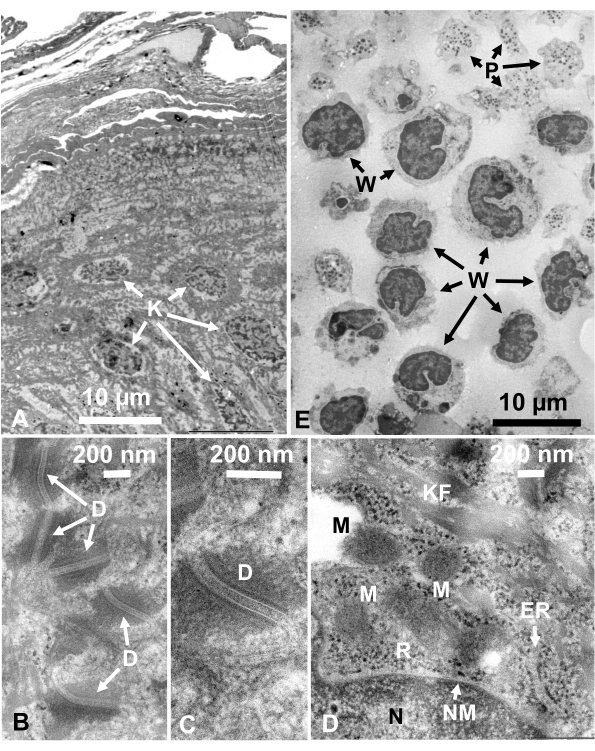
Figura 14: Sezioni ultrasottili. (A-D) pelle umana e (E) buffy coat. (A-E) Si noti che le immagini dei tessuti e delle cellule sono chiare e naturali e mostrano un buon contrasto, sebbene le sezioni siano molto sottili (50 nm). La matrice dei mitocondri mostra un aspetto denso, che è simile a quelli delle matrici mitocondriali dense di cellule viventi rapidamente congelate (D). Barre di scala = 10 μm (A, E), 200 nm (B-D). Abbreviazioni: D = desmosomi; ER = reticolo endoplasmatico; K = cheratinociti; KF = fibre di cheratina; M = mitocondri; N = nucleo; NM = membrana nucleare; P = piastrina; R = ribosomi; W = globuli bianchi. Riprodotto da Yamaguchi et al.28 con il permesso. Fare clic qui per visualizzare una versione più grande di questa figura.
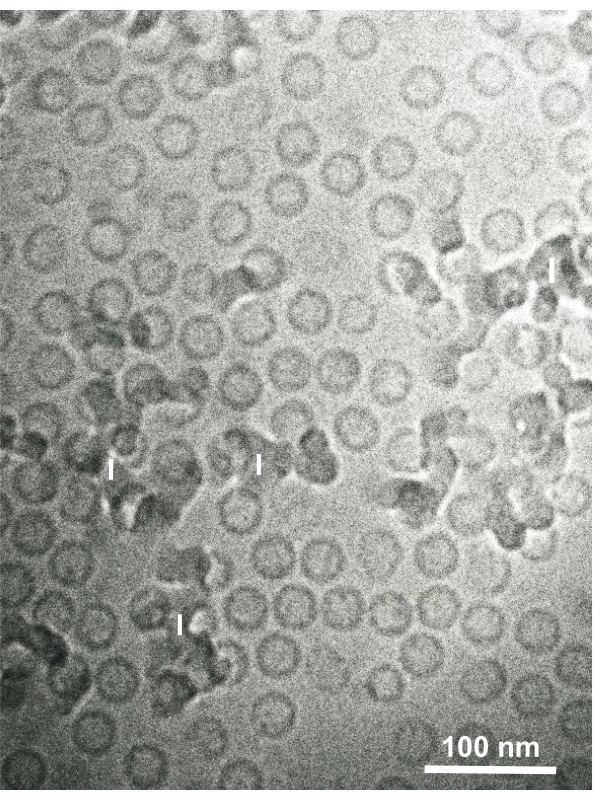
Figura 15: Particelle del nucleo del virus dell'epatite B (HBV) rapidamente congelate con etano liquido utilizzando il dispositivo di congelamento a sandwich e osservate mediante crioelettronica. Le particelle cave sferiche sono particelle del nucleo HBV. Barra della scala = 100 nm. Abbreviazioni: HBV = virus dell'epatite B; I = ghiaccio. Riprodotto da Yamaguchi et al.28 con il permesso. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La seguente discussione si basa su oltre 120 esperimenti di sostituzione sandwich congelamento-congelamento su oltre 1.000 campioni e più di 70 esperimenti di microscopia crioelettronica con congelamento a tuffo su oltre 75 campioni condotti in 36 anni.
Tasso di successo per un buon congelamento con congelamento a sandwich
Il tasso di successo nel raggiungimento di un buon congelamento dipende dai campioni. Le cellule di Saccharomyces cerevisiae (lievito) coltivate in mezzo YPD (1% estratto di lievito, 2% peptone, 2% destrosio) hanno dato quasi il 100% di successo per un buon congelamento senza formazione di cristalli di ghiaccio10,11,15,35,36. Altre specie di lievito, tra cui Shizosaccharomyces37,38,39,Cryptococcus14,40,41,42,43,44,45, Exophiala13,41,46,47,48, 49, Fusarium50,51,52, Aureobasidium53, Candida54,55, Fellomyces56, Aspergillus57e Trichosporon, hanno anche mostrato un buon congelamento. Anche i batteri, tra cui Mycobacterium58,59 ed E. coli16,hanno mostrato un buon congelamento. Le cellule coltivate e le cellule animali isolate hanno mostrato un buon congelamento sia per le cellule viventi che per quelle fissate alla glutaraldeide1,25,26,27,60. Anche i tessuti animali e umani fissati alla glutaraldeide tagliati a uno spessore compreso tra 0,1 e 0,2 mm hanno mostrato un buon congelamento per la maggior parte del tempo1,28.
Condizioni per un buon congelamento
Utilizzare solo cellule nella fase e condizione di crescita appropriata. Le cellule in coltura dovrebbero essere in fase esponenziale. Applicare quantità molto piccole di sospensioni cellulari di campioni concentrati (per S. cerevisiae, ~ 0,02 μL di 3-5 × 109 celle / mL) sul disco di rame. Anche le fette fissate alla glutaraldeide di tessuti animali o umani dovrebbero essere molto piccole (preferibilmente 0,3 mm x 0,3 mm x 0,1 mm). Poiché tagliare fette di tessuto spesse 0,1 mm è difficile, affettare molti tessuti e selezionare fette sottili e semitrasparenti. Lavorare rapidamente ma con attenzione e non lasciare asciugare i campioni. Nel raccogliere i dischi di rame impilati con una pinzetta, non premere i dischi troppo forte per evitare di schiacciare le cellule e i tessuti. Il caricamento del campione è il passo più importante per il congelamento di successo e le condizioni richieste sono le stesse delle condizioni per un buon congelamento per il congelamento ad alta pressione. I lettori dovrebbero fare riferimento all'eccellente recensione di McDonald61.
Altre applicazioni
Questo documento presenta micrografie elettroniche di un batterio, lievito, cellule coltivate, cellule animali isolate, tessuti umani e particelle virali. Abbiamo osservato un buon congelamento delle alghe marine fissate alla glutaraldeide. Tuttavia, le strutture cellulari delle alghe verdi d'acqua dolce viventi sono state distrutte dalla formazione di cristalli di ghiaccio. La miscelazione di cellule con il 20% di albumina sierica bovina (BSA) ha assicurato che l'ultrastruttura fosse ben conservata senza danni ai cristalli di ghiaccio. L'uso del 20% di BSA è stato anche utile per preservare l'ultrastruttura delle cellule del gambo di un fungo. Sono in corso esperimenti sul congelamento di cellule e tessuti vegetali applicando il 20% di BSA. Sebbene la microscopia elettronica a scansione di campioni sandwich congelati-congelati non sia stata tentata, l'osservazione di strutture cellulari ben conservate è stata riportata in precedenza9.
Note sul metodo di congelamento dei sandwich
L'ultrastruttura delle cellule vicino alla nativa è meglio osservata dal congelamento rapido e dalla sostituzione del congelamento delle cellule viventi. La formazione di cristalli di ghiaccio con l'SFD può essere evitata limitando lo spessore delle cellule a ≤30 μm1. Fissare i tessuti con glutaraldeide spesso produce una migliore conservazione della struttura cellulare per l'osservazione delle cellule in sospensione perché la fissazione della glutaraldeide rende la struttura cellulare più rigida e previene i possibili cambiamenti ultrastrutturali durante la raccolta e la centrifugazione delle cellule viventi1. La fissazione della glutaraldeide consente anche l'estensione della profondità di congelamento fino a 0,2 mm1, simile a quella ottenuta con il metodo del congelamento ad alta pressione (HPF). Pertanto, la macchina HPF può essere sostituita con la SFD per il congelamento profondo di tessuti animali e umani.
Poiché i tessuti fissati alla glutaraldeide possono essere conservati per più di 2 anni28,il congelamento del sandwich può essere eseguito in base alla comodità dell'utente. Fissare i tessuti con glutaraldeide facilita anche il sezionamento dei tessuti perché i tessuti diventano più rigidi con la fissazione. A differenza della macchina HPF, la SFD può essere utilizzata per il congelamento rapido di virus per la microscopia crioelettronica e per batteri e cellule eucariotiche. Inoltre, rispetto alla macchina HPF, la SFD è piccola, portatile, meno costosa e può essere acquisita da più laboratori. Speriamo che queste caratteristiche della SFD aiutino più laboratori a raggiungere i loro obiettivi di ricerca28.
Caratteristiche della morfologia naturale delle cellule
Le strutture cellulari sono nel loro stato naturale se mostrano il seguente aspetto: Strutture a membrana della membrana esterna (Figura 12A, B), membrana plasmatica ( Figura12B,C; Figura 13A-D; e Figura 14E),l'involucro nucleare (Figura 12C, Figura 13B-De Figura 14D-E), i mitocondri ( Figura12C, Figura 13Ce Figura 14D) e i vacuoli ( Figura12C) mostrano contorni lisci. Il nucleo e i vacuoli sono quasi circolari (Figura 12C). I ribosomi mostrano un chiaro aspetto denso di elettroni con un diametro di ~20 nm (Figura 12B,C; Figura 13C; e Figura 14D). Il citoplasma è elettrone-lucente (Figura 12B,C; Figura 13C; e Figura 14D).
Effetto della fissazione della glutaraldeide sulla morfologia cellulare
La fissazione della glutaraldeide è stata eseguita per tessuti animali o umani prima del congelamento del sandwich per ottenere un'ultrastruttura priva di cristalli di ghiaccio. Le micrografie ottenute con questo metodo mostrano immagini squisitamente chiare simili a quelle ottenute dal rapido congelamento dei tessuti viventi (Figura 14)1. Gli studi su cellule di lievito, microrganismi di acque profonde e cellule coltivate mostrano che la deformazione dell'ultrastruttura è dovuta principalmente alla fissazione del tetrossido di osmio e alla disidratazione da etanolo a temperatura ambiente1,17,18,28. Small ha anche riferito che sebbene la fissazione della glutaraldeide non distrugga l'organizzazione dell'actina nei fibroblasti in coltura, la fissazione del tetrossido di osmio e la disidratazione da acetone o etanolo a temperatura ambiente distruggono l'organizzazione dell'actina62.
Quindi, dovrebbe essere effettuato uno studio dettagliato sugli effetti della fissazione della glutaraldeide sulla morfologia cellulare. Ohno ha sviluppato un metodo di criofissazione in vivo in cui i tessuti viventi vengono rapidamente congelati senza interrompere l'afflusso di sangue63. I tessuti sono stati congelati e incorporati in resina epossidica e sono state osservate sezioni ultrasottili. Le immagini al microscopio elettronico hanno mostrato l'ultrastruttura più vicina alla nativa dei tessuti viventi rispetto a quelle ottenute dalla fissazione chimica-disidratazione convenzionale e dal rapido congelamento di tessuti freschi non fissi. Pertanto, può essere interessante confrontare l'ultrastruttura ottenuta dalla sostituzione della fissazione-congelamento della glutaraldeide (il metodo attuale) e quelle della sostituzione criofissazione-congelamento in vivo per esaminare gli effetti della fissazione della glutaraldeide.
Considerazione per l'ambiente e maggiore efficienza sperimentale
Utilizziamo tubi di plastica da 2 ml per la sostituzione della resina. Un mL di resina diluita è sufficiente per ogni fase di sostituzione. I tubi di plastica usati possono essere scartati dopo ogni esperimento. Ciò può far risparmiare tempo e fatica per il lavaggio delle fiale di vetro quando vengono utilizzate per la sostituzione della resina. Inoltre, la soluzione di acetato di uranile può essere utilizzata ripetutamente per la colorazione della sezione32. Dopo aver colorato le sezioni, la soluzione di acetato di uranile può essere salvata e riutilizzata. Poiché l'acetato di uranile è una sostanza radioattiva, il suo riutilizzo aiuta a evitare la produzione di rifiuti e contribuisce alla protezione dell'ambiente.
Film di naftalene polimerizzato al plasma
Il film di naftalene polimerizzato al plasma è un film di carbonio polimerizzato tridimensionalmente costituito da gas naftalene mediante polimerizzazione al plasma sotto scarico di bagliore33. Il film è resistente al bombardamento di elettroni e sostanze chimiche, molto pulito, trasparente contro gli elettroni e ha una superficie piana e una struttura amorfa. Pertanto, il film di naftalene polimerizzato al plasma, disponibile in commercio, è eccellente ed è raccomandato come film di supporto.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Nessuno
Materiali
| Name | Company | Catalog Number | Comments |
| Sandwich Freezing Device | Marine works Japan, Ltd, Yokosuka, Japan | MW-SFD-01 | with metal bar, thin metal bar, tweezers, and working bath |
| 10 mL glass vials | - | Scintillation counter vials for fixative | |
| Acetone | - | ||
| Osmium tetroxide | Nisshin EM Co. Ltd., Tokyo | 3004 | 0.1 g |
| Deep freezer | Sanyo Co. Ltd., Osaka | MDF-C8V1 | |
| Copper disk | Nisshin EM Co. Ltd., Tokyo | - | Refer to this paper |
| Slide glass | - | ||
| Double-sided adhesive tape | - | ||
| Single-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FAS-10 |
| Double-edged razor blade | Nisshin EM Co. Ltd., Tokyo | - | Feather, FA-10 |
| Shredded board | Nisshin EM Co. Ltd., Tokyo | 428 | |
| Tweezers | Nisshin EM Co. Ltd., Tokyo | - | Several pairs |
| Tweezers with polystyrene foam | - | One pair | |
| Glutaraldehyde | Nisshin EM Co. Ltd., Tokyo | 3052 | |
| Liquid nitrogen | - | ||
| Propane gas | - | Cryogen | |
| Ion sputter apparatus | Hitachi high technologies, Tokyo | Hitachi E102 | |
| Micropipette | - | For 1 mL, 200 μL, and 2 μL | |
| Microcentrifuge | Tomy digital biology Co. Ltd., Tokyo | Capsulefuge, PMC-060 | |
| Stereomicroscope | Nikon Co. Ltd., Tokyo et al. | - | SMZ 645 |
| LED illumination for stereomicroscope | Nikon Co. Ltd., Tokyo et al. | SM-LW 61 Ji | |
| Disposable plastic container | - | 50 mL and 200 mL | |
| Ethane gas | - | Cryogen | |
| 2 mL Eppendorf tubes | - | For embedding | |
| Disposable plastic syringes | - | 1 mL, 5 mL, 10 mL, and 20 mL | |
| Magnetic stirrer | - | ||
| Epoxy resin | Nisshin EM Co. Ltd., Tokyo | 340 | Quetol 812 set |
| Silicon embedding mold | Nisshin EM Co. Ltd., Tokyo | 4217 | 7 mm in diameter, 13 mm deep |
| Incubater | - | For 37 °C and 60 °C | |
| Trimming stage | Sunmag Co. Ltd., Tokyo | - | Tilting mechanism equipped, Refer to this paper |
| LED illumination for trimming stage | Sunmag Co. Ltd., Tokyo | - | Refer to this paper |
| Ultrasonic Trimming Blade | Nisshin EM Co. Ltd., Tokyo | 5240 | EM-240, Refer to this paper |
| Ultramicrotome | Leica Microsystems, Vienna | Ultracut S | |
| Grids | Nisshin EM Co. Ltd., Tokyo | 2633, 2634 | 300 mesh, 400 mesh |
| 0.5% Neoprene W solution | Nisshin EM Co. Ltd., Tokyo | 605 | |
| Perfect Loop | Nisshin EM Co. Ltd., Tokyo | 2351 | Fot retrieving sections |
| Half Tube for section staining | Nisshin EM Co. Ltd., Tokyo | 463 | Refer to this pape |
| Super Support Film | Nisshin EM Co. Ltd, Tokyo | 647 | |
| Syringe filter | Toyo Roshi Kaisha, Ltd., Tokyo | DISMIC-03CP | Cellulose acetate, 0.45 μm |
| Transmission electron microscope | JEOL Co. Ltd., Tokyo | JEM-1400 |
Riferimenti
- Yamaguchi, M., et al. Good ultrastructural preservation of human tissues and cultured cells by glutaraldehyde fixation, sandwich freezing, and freeze-substitution. Cytologia. 85 (1), 15-26 (2020).
- Gilkey, J. C., Staehelin, L. A. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. Journal of Electron Microscopy Technique. 3 (2), 177-210 (1986).
- Van Harreveld, A., Crowell, J. Electron microscopy after rapid freezing on a metal surface and substitution fixation. The Anatomical Record. 149, 381-385 (1964).
- Aoki, N., Ito, M., Ejiri, S., Ozawa, H. Ultrastructure of human skin by a rapid freezing technique: structural preservation and antigenicity. Journal of Investigative Dermatology. 102 (3), 354-361 (1994).
- Moor, H., Steinbrecht, R. A., Zierold, K. Theory and practice of high pressure freezing. Cryotechniques in Biological Electron Microscopy. , 175-191 (1987).
- McDonald, K. L., Morphew, M., Vertkade, P., Muller-Reichert, T. Recent advances in high-pressure freezing: Equipment-and specimen-loading methods. Methods in Molecular Biology. 369, 143-173 (2007).
- Sosinsky, G. E., et al. The combination of chemical fixation procedures with high pressure freezing and freeze substitution preserves highly labile tissue ultrastructure for electron tomography applications. Journal of Structural Biology. 161 (3), 359-371 (2008).
- Costello, M. J. Ultra-rapid freezing of the biological samples. Scanning Electron Microscopy. , 361-370 (1980).
- Baba, M., Osumi, M. Transmission and scanning electron microscopic examination of intracellular organelles in freeze-substituted Kloeckera and Saccharomyces cerevisiae yeast cells. Journal of Electron Microscopy Technique. 5 (3), 249-261 (1987).
- Yamaguchi, M., Okada, H., Namiki, Y. Smart specimen preparation for freeze-substitution and serial ultrathin sectioning of yeast cells. Journal of Electron Microscopy. 58 (4), 261-266 (2009).
- Yamaguchi, M., et al. Electron microscopy of hepatitis B virus core antigen expressing yeast cells by freeze-substitution fixation. European Journal of Cell Biology. 47 (1), 138-143 (1988).
- Baba, M., Takeshige, K., Baba, N., Ohsumi, Y. Ultrastructural analysis of the autophagic process in yeast: detection of autophagosomes and their characterization. Journal of Cell Biology. 124 (6), 903-913 (1994).
- Yamaguchi, M., et al. The spindle pole body duplicates in early G1 phase in a pathogenic yeast Exophiala dermatitidis: an ultrastructural study. Experimental Cell Research. 279 (1), 71-79 (2002).
- Yamaguchi, M., Biswas, S. K., Ohkusu, M., Takeo, K. Dynamics of the spindle pole body of the pathogenic yeast Cryptococcus neoformans examined by freeze-substitution electron microscopy. FEMS Microbiology Letters. 296 (2), 257-265 (2009).
- Yamaguchi, M., et al. Structome of Saccharomyces cerevisiae determined by freeze-substitution and serial ultrathin sectioning electron microscopy. Journal of Electron Microscopy. 60 (5), 321-335 (2011).
- Yamada, H., et al. Structome analysis of Escherichia coli cells by serial ultrathin sectioning reveals the precise cell profiles and the ribosome density. Microscopy. 66 (4), 283-294 (2017).
- Yamaguchi, M., Ohkusu, M., Sameshima, M., Kawamoto, S. Safe specimen preparation for electron microscopy of pathogenic fungi by freeze-substitution after glutaraldehyde fixation. Japanese Journal of Medical Mycology. 46 (3), 187-192 (2005).
- Yamaguchi, M., et al. Improved preservation of fine structure of deep-sea microorganisms by freeze-substitution after glutaraldehyde fixation. Journal of Electron Microscopy. 60 (4), 283-287 (2011).
- Yamaguchi, M., et al. Prokaryote or eukaryote? A unique microorganism from the deep-sea. Journal of Electron Microscopy. 61 (6), 423-431 (2012).
- Yamada, H., Chikamatsu, K., Aono, A., Mitarai, S. Pre-fixation of virulent Mycobacterium tuberculosis with glutaraldehyde preserves exquisite ultrastructure on transmission electron microscopy through cryofixation and freeze-substitution with osmium-acetone at ultralow temperature. Journal of Microbiological Methods. 96, 50-55 (2014).
- Yamaguchi, M. An electron microscopic study of microorganisms: from influenza virus to deep-sea microorganisms. JSM Mycotoxins. 65 (2), 81-99 (2015).
- Yamaguchi, M., et al. High-voltage electron microscopy tomography and structome analysis of unique spiral bacteria from the deep sea. Microscopy. 65 (4), 363-369 (2016).
- Yamaguchi, M., Yamada, H., Uematsu, K., Horinouchi, Y., Chibana, H. Electron microscopy and structome analysis of unique amorphous bacteria from the deep sea. Cytologia. 83 (3), 337-342 (2018).
- Yamaguchi, M., Yamada, H., Chibana, H. Deep-sea bacteria harboring bacterial endosymbionts in a cytoplasm?: 3D electron microscopy by serial ultrathin sectioning of freeze-substituted specimen. Cytologia. 85 (3), 209-211 (2020).
- Yamaguchi, M., Takahashi-Nakaguchi, A., Aida, Y., Sato-Okamoto, M., Chibana, H. Convenient method for better preservation of fine structures of cultured macrophages and engulfed yeast cells by freeze-substitution fixation. Microscopy. 66 (3), 209-211 (2017).
- Aoki, S., et al. Shift in energy metabolism caused by glucocorticoids enhances the effect of cytotoxic anticancer drugs against acute lymphoblastic leukemia cells. Oncotarget. 8 (55), 94271-94285 (2017).
- Hirao, T., et al. Altered intracellular signaling by imatinib increases the anticancer effects of tyrosine kinase inhibitors in chronic myelogenous leukemia cells. Cancer Science. 109 (1), 121-131 (2018).
- Yamaguchi, M., et al. Sandwich freezing device for rapid freezing of viruses, bacteria, yeast, cultured cells, and animal and human tissues in electron microscopy. Microscopy. 70 (2), 215-223 (2021).
- Yamaguchi, M. Troubleshooting in specimen preparation of microorganisms. Kenbikyo. 42, 26-28 (2007).
- Yamaguchi, M., Aoyama, T., Yamada, N., Chibana, H. Quantitative measurement of hydrophilicity/hydrophobicity of the plasma-polymerized naphthalene film (Super support film) and other support films and grids in electron microscopy. Microscopy. 65 (55), 444-450 (2016).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. Journal of Visualized Experiments: JoVE. (131), e56235 (2018).
- Yamaguchi, M., Shimizu, M., Yamaguchi, T., Ohkusu, M., Kawamoto, S. Repeated use of uranyl acetate solution for section staining in transmission electron microscopy. Plant Morphology. 17 (1), 57-59 (2005).
- Yamaguchi, M., Tanaka, A., Suzuki, T. A support film of plasma-polymerized naphthalene for electron microscopy: method of preparation and application. Journal of Electron Microscopy. 41 (1), 7-13 (1992).
- Yamaguchi, M., et al. Cryo-electron microscopy of hepatitis B virus core particles produced by transformed yeast: comparison with negative staining and ultrathin sectioning. Journal of Electron Microscopy. 37 (6), 337-341 (1988).
- Yamaguchi, M., et al. Dynamics of hepatitis B virus core antigen in a transformed yeast cell: analysis with an inducible system. Journal of Electron Microscopy. 43 (6), 386-393 (1994).
- Yamaguchi, M., Miyatsu, T., Mizokami, H., Matsuoka, L., Takeo, K. Translocation of hepatitis B virus core particles through nuclear pores in transformed yeast cells. Journal of Electron Microscopy. 45 (4), 321-324 (1996).
- Sipiczki, M., Takeo, K., Yamaguchi, M., Yoshida, S., Miklos, I. Environmentally controlled dimorphic cycle in fission yeast. Microbiology. 144, 1319-1330 (1998).
- Sipiczki, M., et al. Role of cell shape in determination of the division plane in Schizosaccharomyces pombe: random orientation of septa in spherical cells. Journal of Bacteriology. 182 (6), 1693-1701 (2000).
- Encz, i. K., Yamaguchi, M., Sipiczki, M. Morphology transition genes in the dimorphic fission yeast Schizosaccharomyces japonicus. Antonie van Leeuwenhoek. 92 (2), 143-154 (2007).
- Kopecka, M., et al. Microtubules and actin cytoskeleton in Cryptococcus neoformans compared with ascomycetous budding and fission yeasts. European Journal of Cell Biology. 80 (4), 303-311 (2001).
- Yamaguchi, M., Biswas, S. K., Kita, S., Aikawa, E., Takeo, K. Electron microscopy of pathogenic yeasts Cryptococcus neoformans and Exophiala dermatitidis by high-pressure freezing. Journal of Electron Microscopy. 51 (1), 21-27 (2002).
- Ikeda, R., et al. Contribution of the mannan backbone of cryptococcal glucuroxylomannan and a glycolytic enzyme of Staphylococcus aureus to contact-mediated killing of Cryptococcus neoformans. Journal of Bacteriology. 189 (13), 4815-4826 (2007).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Cryptococcus neoformans: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. Journal of Electron Microscopy. 59 (2), 165-172 (2010).
- Kozubowski, L., et al. Ordered kinetochore assembly in the human pathogenic basidiomycetous yeast Cryptococcus neoformans. MBio. 4 (5), 00614 (2013).
- Stepanova, A. A., Yamaguchi, M., Chibana, H., Vasilyeva, N. V. Ultrastructural aspects of cell components migration during budding in the yeast Cryptococcus leurentii. Problems in Medical Mycology. 18 (3), 24-29 (2016).
- Ohkusu, M., et al. Cellular and nuclear characteristics of Exophiala dermatitidis. Studies in Mycology. 43 (43), 143-150 (1999).
- Yamaguchi, M., Biswas, S. K., Suzuki, Y., Furukawa, H., Takeo, K. Three-dimensional reconstruction of a pathogenic yeast Exophiala dermatitidis cell by freeze-substitution and serial sectioning electron microscopy. FEMS Microbiology Letters. 219 (1), 17-21 (2003).
- Yamaguchi, M., et al. The spindle pole body of the pathogenic yeast Exophiala dermatitidis: variation in morphology and positional relationship to the nucleolus and the bud in interphase cells. European Journal of Cell Biology. 82 (10), 531-538 (2003).
- Biswas, S. K., Yamaguchi, M., Naoe, N., Takashima, T., Takeo, K. Quantitative three-dimensional structural analysis of Exophiala dermatitidis yeast cells by freeze-substitution and serial ultrathin sectioning. Journal of Electron Microscopy. 52 (2), 133-143 (2003).
- Takaya, N., et al. Cytochrome P450nor, a novel class of mitochondrial cytochrome P450 involved in nitrate respiration in the fungus Fusarium oxysporum. Archives of Biochemistry and Biophysics. 372 (2), 340-346 (1999).
- Zhou, Z., et al. Ammonia fermentation, a novel anoxic metabolism of nitrate by fungi. Journal of Biological Chemistry. 277 (3), 1892-1896 (2002).
- Takasaki, K., et al. Fungal ammonia fermentation, a novel metabolic mechanism that couples the dissimilatory and assimilatory pathways of both nitrate and ethanol. Role of acetyl CoA synthetase in anaerobic ATP synthesis. Journal of Biological Chemistry. 279 (13), 12414-12420 (2004).
- Kopecka, M., et al. Analysis of microtubules and F-actin structures in hyphae and conidia development in opportunistic human pathogenic black yeast Aureobasidium pullulans. Microbiology. 149, 865-876 (2003).
- Ueno, K., Namiki, Y., Mitani, H., Yamaguchi, M., Chibana, H. Differential cell wall remodeling of two chitin synthase deletants Δchs3A and Δchs3B in the pathogenic yeast Candida glabrata. FEMS Yeast Research. 11 (5), 398-407 (2011).
- Ikezaki, S., et al. Mild heat stress affects on the cell wall structure in Candida albicans biofilm. Medical Mycology Journal. 60 (2), 29-37 (2019).
- Gabriel, M., et al. The cytoskeleton in the unique cell reproduction by conidiogenesis of the long-neck yeast Fellomyces (Sterigmatomyces) fuzhouensis. Protoplasma. 229 (1), 33-44 (2006).
- Yoshimi, A., et al. Functional analysis of the α-1,3-glucan synthase genes agsA and agsB in Aspergillus nidulans: agsB is the major α-1,3-glucan synthase in this fungus. PLoS One. 8 (1), 54893 (2013).
- Yamada, H., Mitarai, S., Chikamatsu, K., Mizuno, K., Yamaguchi, M. Novel freeze-substitution electron microscopy provides new aspects of virulent Mycobacterium tuberculosis with visualization of the outer membrane and satisfying biosafety requirements. Journal of Microbiological Methods. 80 (1), 14-18 (2010).
- Yamada, H., Yamaguchi, M., Chikamatsu, K., Aono, A., Mitarai, S. Structome analysis of virulent Mycobacterium tuberculosis, which survives with only 700 ribosomes at density per 0.1 fl cytoplasm. PLoS One. 10 (1), 0117109 (2015).
- Shiratori, R., et al. Glycolytic suppression dramatically changes the intracellular metabolic profile of multiple cancer cell lines in a mitochondrial metabolism-dependent manner. Scientfic Reports. 9 (1), 18699 (2019).
- McDonald, K. L. Out with the old and in with the new: rapid specimen preparation procedures for electron microscopy of sectioned biological material. Protoplasma. 251 (2), 429-448 (2014).
- Small, J. V. Organization of actin in the leading edge of cultured cells: influence of osmium tetroxide and dehydration on the ultrastructure of actin meshworks. Journal of Cell Biology. 91 (3), 695-705 (1981).
- Ohno, S., Terada, N., Fujii, Y., Ueda, H., Takayama, I. Dynamic structure of glomerular capillary loop as revealed by an in vivo cryotechnique. Virchows Archiv. 427 (5), 519-527 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon