A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التقييم الوظيفي لحاجز الوصلة الضيق المعوي ونفاذية الأيونات في الأنسجة الأصلية باستخدام تقنية الغرفة
In This Article
Summary
الظهارة المعوية لا تمنح امتصاص العناصر الغذائية فحسب ، بل الحماية من المواد الضارة. ينظم التقاطع بين الخلايا القمي الأكثر ظهارة ، أي التقاطع الضيق ، المذاب شبه الخلوي ونفاذية الأيونات. هنا ، يتم وصف بروتوكول لإعداد صفائح الغشاء المخاطي وتقييم انتقائية الأيونات للتقاطعات الضيقة باستخدام تقنية غرفة Ussing.
Abstract
تم اختراع تقنية غرفة Ussing لأول مرة من قبل العالم الدنماركي Hans Ussing في عام 1951 لدراسة النقل عبر الخلايا للصوديوم عبر جلد الضفادع. منذ ذلك الحين ، تم تطبيق هذه التقنية على العديد من الأنسجة المختلفة لدراسة المعلمات الفسيولوجية للنقل عبر الأغشية. طريقة غرفة Ussing أفضل من الطرق الأخرى لأنه يمكن استخدام الأنسجة الأصلية ، مما يجعلها أكثر قابلية للتطبيق على ما يحدث في الجسم الحي. ومع ذلك ، نظرا لاستخدام الأنسجة الأصلية ، فإن الإنتاجية منخفضة ، والوقت محدود ، ويتطلب إعداد الأنسجة مهارة وتدريبا. وقد استخدمت هذه الغرف لدراسة بروتينات ناقلة محددة في الأنسجة المختلفة ، وفهم الفيزيولوجيا المرضية للأمراض كما هو الحال في التليف الكيسي ، ودراسة نقل الأدوية وامتصاصها ، وساهمت بشكل خاص في فهم نقل المغذيات في الأمعاء. بالنظر إلى عملية النقل الظهاري الكاملة للنسيج ، ليس فقط المسارات عبر الظهارية ، ولكن أيضا المسارات شبه الخلوية مهمة. التقاطعات الضيقة هي المحدد الرئيسي لنفاذية الأنسجة شبه الخلوية المحددة عبر الأمعاء. في هذه المقالة ، سيتم استخدام تقنية غرفة Ussing لتقييم الانتقائية شبه الخلوية للأيونات عن طريق قياس التوصيل عبر الظهارة وإمكانات التخفيف.
Introduction
تم تطوير طريقة غرفة Ussing لأول مرة من قبل العالم الدنماركي هانز أوسينغ. استخدمه المستخدم لأول مرة لقياس تيار الدائرة القصيرة لنقل الصوديوم عبر جلد الضفدع بعد أن لوحظ أن كلوريد الصوديوم يمكن نقله عبر الجلد ضد تدرج تركيز حاد1. يتكون نظامه من جلد الضفدع المثبت بين غرفتين مع إمكانية الوصول إلى جانبي الجلد. احتوت كل غرفة على حل رينجر الذي تم تعميمه وتهويته. قام جسران ضيقان للرنين الضيق يقعان بالقرب من الجلد ومتصلين بأقطاب KCl-calomel المشبعة بقياس فرق الجهد كما يقرأه المقوي. تم وضع زوج ثان من جسور الرنين أجار في الطرف الآخر من كل غرفة متصلة بأكواب مع KCl مشبعة مشبعة ب AgCl لتطبيق قوة دافعة كهربائية توفرها البطارية. تم استخدام مقسم جهد لضبط الجهد بحيث يظل فرق الجهد عبر الجلد صفرا ، وبالتالي خلق ظروف ماس كهربائى. كما تم توصيل مقياس ميكروأمبير لقراءة التيار الذي يمر عبر الجلد (انظر الشكل الوارد في المرجع 1 للحصول على تصميم الغرفة الأصلي).
على مدى السنوات ال 70 الماضية ، تم تطبيق هذه التقنية على العديد من الأنسجة المختلفة ، وخاصة الأنسجة المعوية ، لدراسة نقل المغذيات والأيونات. على سبيل المثال ، تمت دراسة آلية الإسهال الناجم عن الكوليرا عن طريق تركيب دقاق الأرانب في هذه الغرف ، ووجد أن الإسهال الناجم عن سموم الكوليرا يتم بوساطة cAMP2. بالإضافة إلى ذلك ، تم استخدام هذه الغرف أيضا لدراسة الآلية الكامنة وراء نقل الجلوكوز عبر الناقل المشترك Na + - Glucose 1 (SGLT1)3. يركز مختبرنا على النقل عبر الخلايا وشبه الخلوية في الخلايا الظهارية المعوية. باستخدام طريقة غرفة Ussing ، تم تقييم نقل الببتيد في Claudin 15 من الفئران بالضربة القاضية ، والتي أضعفت نقل الصوديوم شبه الخلوي ، باستخدام غرف Ussing لقياس امتصاص ثنائي الببتيد glycylsarcosine غير القابل للتحلل. وقد وجد أن التوازن المضيء Na+ مهم لنقل الببتيد المقترن بالبروتون4. بالإضافة إلى ذلك ، تم استخدام هذه الغرف أيضا للتحقيق في إفراز الأنيون في أعور الفئران استجابة للتنشيط تحت المخاطي لمستقبل تنشيط البروتين المنشط 1 بواسطة التربسين البروتياز البروتيني سيرين 5.
كما تم مؤخرا استخدام غرف الاستخدام لتقييم المسارات شبه الخلوية في الأنسجة الظهارية. يتم تنظيم المسارات شبه الخلوية بواسطة تقاطعات ضيقة ، وهي عبارة عن مجمعات من البروتينات التي تتشكل عند النقطة التي تلتقي فيها خليتان أو أكثر 6. يتم تحديد وظيفة الحاجز والانتقائية الأيونية (سواء كانت الأنيونات أو الكاتيونات قادرة بشكل انتقائي على المرور عبر التقاطع الضيق) من خلال وجود بروتينات عائلة كلودين. بعضها بمثابة حواجز (كلودين 3 و 7) ، مسام أنيون (كلودين 10 أ) ، أو مسام كاتيون (كلودين 2 و 10 ب و 15)7. وقد استخدمت طرق أخرى لتقييم المسار شبه الخلوي، مثل الانحراف الفموي ل FITC مصحوبا بتركيز FITC في بلازما الدم8، أو EDTA-Cr9؛ ومع ذلك ، فإن هذه التقنيات ذات دقة أقل ولا يمكنها تقييم انتقائية الأيونات أو قسم معين من أقسام الأمعاء. ومع ذلك ، يمكن استخدام غرف الاستخدام لتقييم إمكانات التخفيف للأيونات المستهدفة ، وبالتالي تحديد انتقائية الأيونات للتقاطعات الضيقة. على سبيل المثال ، مع كلوريد الصوديوم ، يمكن حساب انتقائية التقاطعات الضيقة ل Na + و Cl- عن طريق تخفيف جانب واحد من الغشاء (عادة الجانب المخاطي) وقياس التغير في فرق الجهد عبر الظهارة. يمكن تقدير النفاذية النسبية ل Na+ و Cl- بواسطة معادلة Goldman-Hodgkin-Katz10 ويمكن تقدير انتقائية التقاطع الضيق باستخدام معادلة Kimizuka-Koketsu 11. وبالتالي ، تتمتع هذه الغرف بميزة قياس المعلمات الكهروفسيولوجية للأنسجة ، ونتيجة لذلك توفر المزيد من المعلومات حول مرور الأيونات عبر التقاطعات الضيقة أكثر من الطرق الأخرى الأقل دقة.
لا تقتصر طريقة غرفة Ussing على الأمعاء فحسب ، على الرغم من أنها تستخدم على نطاق واسع في الدراسات المتعلقة بالأمعاء ، إلا أن لها العديد من التطبيقات الأخرى أيضا. على سبيل المثال ، تم استخدام هذه الغرف لدراسة التليف الكيسي ، وعلى وجه التحديد منظم التوصيل عبر الغشاء عبر الغشاء لقناة الكلوريد (CFTR)12. يحدث التليف الكيسي بسبب طفرة في CFTR13 ، مما يؤدي إلى ضعف إفراز الكلوريد ونقل السوائل بواسطة الخلايا الظهارية التنفسية ، وما ينتج عن ذلك من طبقة مخاطية أكثر سمكا وجفافا14. تم إجراء دراسة CFTR الظهارية في مجرى الهواء مع هذه الغرف ليس فقط لفهم المرض ، ولكن لاكتشاف طرق لعلاج المرض. على سبيل المثال، في المرضى الذين يعانون من طفرات نادرة تسبب التليف الكيسي، تم استخدام تحليل الخلايا الظهارية التنفسية للمريض لاختبار العلاجات مثل Orkambi والعلاج المشترك مكبر للصوت15.
كما تم استخدام غرف لدراسة طرق توصيل الأدوية، مثل أنسجة الخزعة البشرية لدراسة امتصاص الأدوية والحرائك الدوائية16. امتصاص الأمعاء ليس هو الطريق الوحيد لتوصيل الدواء. كما استخدمت هذه الغرف لدراسة أنظمة توصيل الأدوية الأنفية17. كما تم إجراء دراسات توصيل الدواء مع غرف Ussing للعين. في قرنية الأرانب ، أجريت دراسات النفاذية والامتصاص مع Labrasol ، وهو دواء مصمم لزيادة امتصاص الأدوية عبر الأنسجة 18. فحصت دراسة أخرى تأثير كلوريد البنزيلالكونيوم على توصيل الدواء عبر الصلبة في صلب الأرنب 19.
طريقة غرفة الاستخدام مفيدة لأنه يمكن استخدام الأنسجة الأصلية. على هذا النحو ، فمن الأفضل على النماذج في المختبر مثل خطوط الخلايا Caco-2. ومع ذلك ، تتطلب هذه التقنية مهارة ووقتا لإعداد العينات ، لذلك فهي ليست مناسبة للتطبيقات عالية الإنتاجية. يمكن دراسة الخصائص الكهروفسيولوجية للطبقات الأحادية للخلية باستخدام إدراج زراعة الخلايا في هذه الغرف. وقد سمحت الاكتشافات الحديثة بزراعة المواد العضوية وهي أعضاء صغيرة تزرع في الثقافة من حصاد الخلايا الجذعية الظهارية أو البطانية20. يمكن التلاعب بالثقافة العضوية لزراعتها في طبقة أحادية ، مما يجعل من الممكن تركيب المواد العضوية في غرفة Ussing 21. يمكن دراسة المواد العضوية لمختلف الأنسجة الظهارية والبطانية ، مما يقلل من عدد الحيوانات المطلوبة ، حيث يمكن الحفاظ على الثقافة العضوية على المدى الطويل. سيؤدي ذلك أيضا إلى زيادة الإنتاجية نظرا لعدم الحاجة إلى خطوات تشريح الأنسجة وإعدادها المستهلكة للوقت والشاقة. في المستقبل ، ستظل دراسات غرفة Ussing مفيدة جدا لدراسة نقل الأنسجة وستكون مهمة بشكل خاص في مجال الطب الشخصي.
يوضح البروتوكول التالي تطبيق طريقة غرفة Ussing لتقييم وظيفة الانتقائية والحاجز للتقاطعات الضيقة في الأمعاء الدقيقة لفئران Claudin 15 بالضربة القاضية (Cldn15-/-) وضوابط النوع البري (WT) عن طريق قياس إمكانات التخفيف من كلوريد الصوديوم. تتشكل التقاطعات الضيقة (TJ) عند النقطة التي تلتقي فيها خليتان أو أكثر في الأنسجة الظهارية والبطانية. يعتقد أن التقاطعات الضيقة ثنائية الخلية (bTJ) ، وخاصة بروتينات عائلة كلودين الموجودة داخل bTJ ، تحدد وظيفة الحاجز واستمرارية TJ7. Cldn15-/- الفئران لديها الأمعاء الدقيقة الضخمة22 وانخفاض القدرة على امتصاص المغذيات بسبب فقدان إعادة تدوير Na+ المعوية التي تحدث عن طريق كلودين 154،23،24. لقد أضعفت الفئران Cldn15-/- الفئران توازن Na + ، مما يجعلها نموذجا مثيرا للاهتمام لدراسة الانتقائية الدائمة ل TJ. يقيم البروتوكول التالي نفاذية TJ إلى كلوريد الصوديوم عن طريق قياس إمكانات التخفيف من كلوريد الصوديوم (PNa / PCl) في الأمعاء الدقيقة الوسطى. باختصار ، يمكن استخدام التغير في فرق جهد الغشاء الذي يحدث عن طريق تخفيف جانب واحد من الغشاء (الجانب M أو الجانب S ، وكلاهما يقاس في البروتوكول أدناه) لحساب نفاذية Na + (PNa) و Cl- (PCl) ، وسيظهر جهد التخفيف (PNa / PCl) ما إذا كان التقاطع الضيق له انتقائية كاتيونية أو أنيونية.
أجريت التجارب في هذا البروتوكول باستخدام غرفة Ussing مخصصة (الشكل 1A) ، والتي تتكون من نصفين ، يتم تركيب المستحضر المعوي بينهما عموديا ، ومكبر صوت مشبك الجهد ، والمسجل الكهربائي ، والأقطاب الكهربائية ، والجسور الملحية ، ومحلول Ringer ، ومخزن HEPES المؤقت (150 mM NaCl) ، والمخزن المؤقت HEPES المخفف (75 mM NaCl) ، والتحضير المعوي (للحصول على تفاصيل حول المعدات انظر جدول المواد).
Access restricted. Please log in or start a trial to view this content.
Protocol
تم الحفاظ على جميع الحيوانات المستخدمة في هذه التجارب في مرفق رعاية الحيوانات في جامعة شيزوكا وأجريت التجارب وفقا للمبادئ التوجيهية للبحوث الحيوانية التي وضعتها جامعة شيزوكا. تم إجراء جميع التجارب بموافقة لجنة رعاية واستخدام الحيوانات في جامعة شيزوكا (التصاريح رقم 205272 و # 656-2303).
1. إعداد أقطاب كلوريد الصوديوم
ملاحظة: تتكون الأقطاب الكهربائية المستخدمة في هذه التجارب من كلوريد الصوديوم المركز أو KCl. يتم شراء أقطاب KCl / calomel كهربائيا تجاريا. قبل البدء في التجربة ، تأكد من ملء جميع الأقطاب الكهربائية إلى الأعلى بمحلول كلوريد الصوديوم أو KCl المركز.
- تحضير الجرار الزجاجية الصغيرة مع أغطية بلاستيكية (حجم 20 مل).
- حفر ثقبين في الأغطية البلاستيكية ، أحدهما لجسر الملح كلوريد الصوديوم (قطره 2.5 مم) ، والآخر للسلك الفضي (قطر 1 مم ؛ الشكل 1C، قطب كلوريد الصوديوم).
- املأ الجرة الزجاجية بمحلول كلوريد الصوديوم المشبع (حوالي 15 مل ، حتى ممتلئ).
- أدخل سلك فضي (قطره 0.8 مم ، طوله 7 سم) في الجرة ، ولكن تأكد من أن جزء السلك خارج الجرة يمكن توصيله عبر مشابك التمساح (صغيرة الحجم) بنظام مكبر الصوت.
- عندما لا تكون قيد الاستخدام ، قم بلف الأقطاب الكهربائية وتأكد من تغطية الثقوب ، باستخدام parafilm لمنع التجفيف.
2. إعداد الجسور الملحية
ملاحظة: قم بإعداد جسور الملح قبل يوم واحد على الأقل من التجربة لتوفير الوقت الكافي للتصلب. يمكن استخدام جسور الملح بشكل متكرر ولكن لا ينصح باستخدامها بعد 2 أشهر.
- جسور الملح كلوريد الصوديوم
- قم بإعداد أنابيب البولي إيثيل رقم 7 (القطر الخارجي 2.3 مم ، القطر الداخلي 1.3 مم) ، إبرة 19 جم ومحقنة من نوع القفل ، 200 مل من محلول كلوريد الصوديوم 1 م ، 2 جم أجار ، حاوية بلاستيكية قابلة للإغلاق لتخزين جسر الملح.
- قم بإعداد عدد مناسب من جسور الملح عن طريق قطع الأنابيب إلى الحجم اللازم لإعداد غرفة Ussing (تتطلب كل غرفة جسرين ملحيين).
- قبل حقن الأجار ، قم بعمل شكل U مع الأنابيب وضعها في كوب من الماء الدافئ (لإنشاء شكل سهل لإنشاء جسور الملح).
- اصنع 200 مل من 1 مليون كلوريد الصوديوم عن طريق إذابة 11.688 جم من كلوريد الصوديوم في 200 مل في ماء منزوع الأيونات.
- قسم 1 م كلوريد الصوديوم إلى أجزاء 100 مل: اصنع 100 مل من 2٪ أجار في 1 م كلوريد الصوديوم (امزج 2 جم أجار في كلوريد الصوديوم ، سخني في الميكروويف حتى يذوب).
- باستخدام إبرة 19 G ومحقنة قفل ، املأ المحقنة بمحلول 1 M NaCl / agar. ابدأ بلطف في طرد المحلول قطرة قطرة وأثناء القيام بذلك ، أدخل الإبرة في أحد طرفي الأنبوب واملأها حتى يخرج الخليط من الجانب الآخر.
- اسحب الإبرة ببطء مع الاستمرار في التعبير عن المحلول وكرر حتى يتم إنشاء جميع جسور الملح المطلوبة. (إذا تصلب المحلول في المحقنة أو الإبرة ، فقم بتسخينه لفترة وجيزة في الماء الساخن حتى يمكن التعبير عن المحلول مرة أخرى.)
- تحقق من جسور الملح للتأكد من عدم وجود فقاعات وتخزينها في محلول كلوريد الصوديوم 1 M المتبقي في حاوية قابلة للإغلاق.
- جسور الملح KCl
ملاحظة: يتم استخدام أنابيب أرق لجسور KCl agar لتجنب زيادة تركيز K + في المخزن المؤقت ، حيث يمكن أن تذوب أطراف جسر الملح ويمكن أن يتسرب K + إلى المخزن المؤقت.- قم بإعداد أنابيب البولي إيثيل رقم 3 (القطر الخارجي 1.0 مم ، القطر الداخلي 0.5 مم) ، حقنة من نوع الإبرة والقفل 23 جم ، 200 مل من محلول 1 M KCl ، 2 جم أجار ، حاوية بلاستيكية قابلة للإغلاق لتخزين جسر الملح.
- قم بإعداد العدد المناسب من جسور الملح عن طريق قطع الأنابيب إلى الحجم اللازم لإعداد غرفة Ussing (تتطلب كل غرفة جسرين ملحيين).
- اصنع 200 مل من 1 م KCl عن طريق إذابة 14.91 جم من KCl في 200 مل من الماء منزوع الأيونات.
- تنقسم إلى قسمين 100 مل: اصنع 100 مل من 2٪ أجار في 1 M KCl (امزج 2 جم أجار في KCl ، سخني في الميكروويف حتى تذوب).
- باستخدام إبرة 23 جم ومحقنة قفل ، قم بحقن الأنابيب بخليط 2٪ agar 1 M KCl (تأكد من أن الأنابيب مملوءة بالكامل ولا توجد فقاعات) بنفس الطريقة كما هو الحال مع جسور الملح NaCl.
- تحقق من جسور الملح للتأكد من عدم وجود فقاعات وتخزينها في محلول 1 M KCl المتبقي في حاوية قابلة للإغلاق.
3. إعداد حل Ringer والمخزن المؤقت HEPES
ملاحظة: اعتمادا على الأنسجة المثبتة في غرفة Ussing ، قد تختلف مكونات محلول Ringer. الوصفات المعروضة هنا خاصة بالأمعاء الدقيقة والغليظة.
- اجعل حل Ringer طازجا في يوم التجارب كما هو موضح في الجدول 1.
- فقاعة الحل مع 95٪ O2 / 5٪ CO2 لتوفير O2 للأنسجة وقدرة التخزين المؤقت.
| محلول رينجر (الأمعاء الدقيقة) | محلول رينجر (الأمعاء الغليظة) |
| NaHCO3 – 21.0 مللي متر | NaHCO3 – 21.0 مللي متر |
| K2HPO4 – 2.4 مللي متر | K2HPO4 – 2.4 مللي متر |
| KH2PO4 – 0.6 مللي متر | KH2PO4 – 0.6 مللي متر |
| كلوريد الصوديوم – 119.0 مللي متر | كلوريد الصوديوم – 119.0 مللي متر |
| MgCl2 – 1.2 ملليمتر | MgCl2 – 1.2 ملليمتر |
| CaCl2 – 1.2 ملليمتر | CaCl2 – 1.2 ملليمتر |
| الإندوميتاسين – 10 ميكرومتر (اصنع مخزونا 1 مللي متر في 21 ملليمتر NaHCO3 ، أضف 10 مل من المخزون ل 1 لتر من محلول رينجر) | الإندوميتاسين – 10 ميكرومتر (اصنع مخزونا 1 مللي متر في 21 ملليمتر NaHCO3 ، أضف 10 مل من المخزون ل 1 لتر من محلول رينجر) |
| 1 ملليمتر جلوتامين (0.146 جم/لتر) | 10 ملليمتر جلوكوز |
الجدول 1: وصفة حل رينجر. لصنع محلول Ringer ، امزج جميع المكونات مع الماء غير المتأين. من الأفضل أن يكون حل رينجر طازجا قبل التجارب. يحفظ في الثلاجة أو على الثلج حتى الاستخدام. قبل الاستخدام ، الغاز مع 95 ٪ O2 / 5 ٪ CO2.
- اجعل HEPES عازلا طازجا في يوم التجربة كما هو موضح في الجدول 2 عن طريق خلط المكونات في الماء غير المؤين.
- لا تتكيف مع الحجم النهائي للمخزن المؤقت إلا بعد ضبط الرقم الهيدروجيني.
- قم بتخزين HEPES الدافئ إلى 37 درجة مئوية واضبط الرقم الهيدروجيني على 7.4 عن طريق إضافة قطرات من محلول 1 M Tris ببطء أثناء التحريك.
- اضبط الحجم النهائي عن طريق إضافة الكمية المناسبة من الماء منزوع الأيونات.
| هيبس العازلة | تخفيف HEPES المخزن المؤقت |
| HEPES – 10 مللي متر | HEPES – 10 مللي متر |
| الجلوكوز – 10 ملليمتر (الأمعاء الغليظة) | الجلوكوز – 10 ملليمتر (الأمعاء الغليظة) |
| 1 ملليمتر جلوتامين (0.146 جم / لتر) (الأمعاء الدقيقة) | 1 ملليمتر جلوتامين (0.146 جم / لتر) (الأمعاء الدقيقة) |
| كلوريد الصوديوم – 150 مللي متر | كلوريد الصوديوم – 75 mM + 150 mM مانيتول (لضبط الاختلافات الأسمولية) |
| MgCl2 – 1 ملليمتر | MgCl2 – 1 ملليمتر |
| CaCl2 – 2 ملليمتر | CaCl2 – 2 ملليمتر |
| الإندوميتاسين – 10 ميكرومتر (اصنع مخزونا 1 مللي متر في 21 ملليمتر NaHCO3 ، أضف 10 مل من المخزون مقابل 1 لتر من محلول رينجر) | الإندوميتاسين – 10 ميكرومتر (اصنع مخزونا 1 مللي متر في 21 ملليمتر NaHCO3 ، أضف 10 مل من المخزون مقابل 1 لتر من محلول رينجر) |
| اضبط على درجة الحموضة 7.40 (37 درجة مئوية) باستخدام 1 M Tris | |
الجدول 2: وصفة HEPES العازلة. لجعل HEPES عازلا وعازلا للتخفيف ، قم بإذابة جميع المكونات في الماء غير المؤين. يجب تعديل درجة الحموضة في المحاليل باستخدام محلول 1 M Tris ، لذلك لا تضيف الحجم الكامل من الماء (على سبيل المثال ، عند صنع 1 لتر ، قم بإذابة جميع المكونات في حوالي 800 مل من الماء). ثم سخن المحلول إلى 37 درجة مئوية ، واضبط الرقم الهيدروجيني إلى 7.4 ثم اضبط الحجم النهائي.
4. استخدام إعداد الغرفة
ملاحظة: غرف الاستخدام المستخدمة في هذا البروتوكول هي غرف تروية مستمرة مصنوعة خصيصا. لتقييم وظيفة الحاجز المعوي للفأر أو امتصاص المغذيات، يوصى باستخدام غرف ذات فتحة قطرها 4 أو 5 مم25 (الشكل 1A-C).
- لتقليل تأثير الحافة26 والمساعدة في إغلاق الحجرات، قم بتوصيل فيلم بارافين مثقوب بثقوب 4 أو 5 مم (حوالي 4 سم2) قبل الإعداد (الشكل 1B).
- الإعداد في ظروف الدائرة المفتوحة لقياس جهد التخفيف. تعيين في وضع المشبك الحالي. اضبط الإخراج على أنه تيار واضبط نبضة التيار على ±20 μA.
- عند الإعداد في ظروف ماس كهربائى لقياس تيار الدائرة القصيرة ومقاومة الغشاء المخاطي ، يتم ضبطه في وضع المشبك الجهد. اضبط الناتج على أنه جهد واضبط نبض الجهد على ±5 مللي فولت.
- تأكد من دوران الماء على درجة حرارة 37 درجة مئوية في سترة المياه.
- املأ كل غرفة بمحلول Ringer أو المخزن المؤقت HEPES (يعتمد المبلغ على النظام المستخدم ، وتتطلب الغرف المستخدمة هنا 5 مل لكل جانب) وتأكد من عدم وجود تسرب.
- قم بتوصيل جسور الملح والأقطاب الكهربائية.
- تأكد من أن الجهد هو 0 ومستقر ، تيار نبضي لضمان إعداد جسور الملح والأقطاب الكهربائية بشكل صحيح.
- اسمح بتوازن درجة حرارة النظام ومحلول Ringer لمدة 20 دقيقة على الأقل.
- بعد التوازن ، قم بتصحيح فرق الجهد غير المتماثل بين أقطاب KCl الكهربائية والتعويض عن مقاومة السوائل عن طريق تغييرها إلى الصفر (راجع دليل نظام غرفة Ussing المستخدم لتحديد الطريقة الصحيحة).
5. تشريح الأنسجة المعوية
ملاحظة: يجب إجراء جميع التجارب على الحيوانات ضمن اللوائح التي وضعتها الدولة والجامعة.
- قبل تناول الأنسجة المعوية ، قم بإعداد محلول Ringer الطازج والبارد والفقاعة مع 95٪ O2 و 5٪ CO2 لمدة 15 دقيقة (الخطوة 3).
- تخدير الفئران وفقا للمبادئ التوجيهية التي تحكم استخدام الحيوانات في البحوث. في هذه التجربة ، تم تخدير الفئران بنسبة 2٪ -3٪ من الأيزوفلوران التي يديرها مخدر. تحقق من التخدير المناسب عن طريق قرص أصابع القدم والتأكد من عدم وجود استجابة للألم.
- إجراء شق في البطن مع مقص من الحوض إلى الحجاب الحاجز. تحديد موقع المعدة وقطع نهاية البواب من المعدة.
- أمسك بجزء المعدة المرتبط بالأمعاء الدقيقة بالملقط واسحب الأمعاء الدقيقة بلطف مع قطع المرفقات المساريقية. احرص على عدم قطع أو إتلاف الأنسجة المعوية بأي شكل من الأشكال.
- استمر في تشريح الأمعاء على طول الطريق إلى فتحة الشرج. لإزالة الأمعاء الغليظة بالكامل ، قم بقطع عظام الحوض للكشف عن الجزء البعيد من الأمعاء الغليظة وإزالة بقية الأمعاء بعناية عن طريق قطع المرفقات.
- قياس طول الأمعاء وتقسيمها إلى الأجزاء المطلوبة. في هذه التجربة ، قسم الأمعاء الدقيقة إلى ثلاثة أجزاء واستخدم الجزء الأوسط.
- ضع الأجزاء المطلوبة في محلول Ringer البارد والفقاعات ؛ ثم افتح كل جزء طوليا عن طريق قطع المرفقات المساريقية. تقليم الدهون والأنسجة الضامة.
- أعد الأجزاء إلى محلول Ringer البارد المثلج واغسلها جيدا (حتى في محلول الثلج البارد ، فإن أكسجة الظهارة المضيئة مهمة للحفاظ على الوظيفة الظهارية).
6. تجريد طبقة العضلات وإعداد ورقة الأمعاء
ملاحظة: إزالة المصل (طبقة العضلات) مهم لدراسات النقل باستخدام الأمعاء. إذا بقيت المصل ، يمكن أن تخضع الأنسجة المعوية لانقباضات عضلية عشوائية من شأنها تشويه البيانات الكهروفسيولوجية ، وقد يتم تثبيط النقل. تتدهور الأنسجة غير المجردة بسرعة عند تركيبها في غرف Ussing ، لأن المصل هو حاجز انتشار كبير للركيزة والأكسجين. في بعض الحالات الخاصة ، قد يكون من الضروري الحفاظ على طبقة العضلات ، وبالتالي فإن القرار متروك للباحث والتصميم التجريبي. يمكن تحضير صفائح الأمعاء بطريقتين اعتمادا على الطبقة التي تتم إزالتها (الشكل 2). لهذه التجربة ، هناك حاجة إلى الغشاء المخاطي والاستعدادات تحت المخاطية (الشكل 2 ، اللوحة الثانية ).
- قم بإعداد ألواح تشريح (قطرها 10 سم) مغطاة بمطاط السيليكون والدبابيس (إبر الوخز بالإبر الصغيرة) وورق ترشيح مثقوب 5 مم ومربعات بارافيلم (2 سم × 2 سم ؛ قد لا تكون ضرورية للأنظمة الأخرى).
- صب محلول رينجر الطازج والبارد والفقاعي في لوحة التشريح (يكفي لتغطية الأنسجة ، حوالي 2-3 مل).
- تحت المجهر المجسم، قم بتثبيت نهايات الأنسجة المعوية (الغشاء المخاطي لأسفل).
- باستخدام ملقط ناعم ، قم بتشريح طبقة العضلات بصراحة من الغشاء المخاطي الأساسي.
- احرص على عدم تمزيق أو إدخال أي ثقوب في الأنسجة.
- بمجرد إزالة طبقة العضلات ، قم بقطع قطعة كبيرة بما يكفي لفتحة قطرها 5 مم. عند تحضير الأمعاء الدقيقة ، يجب أن تتم إزالة طبقة العضلات المصلية في غضون 10 دقائق ، لأن الأوكسجين المضيء صعب في ظل هذه الظروف.
- قم بترطيب مربع ورق الترشيح المثقوب 5 مم في محلول Ringer ووضع الأنسجة المعوية عليه مع الجانب المخاطي لأسفل ، لأن المستحضرات تحت المخاطية تلتف تلقائيا مع الجانب المخاطي في الخارج.
- تأكد من أن الفتحة مغطاة بالكامل بالأنسجة المعوية وعدم وجود تجاعيد. استخدم لوحة سوداء أسفل التحضير لفحص ما إذا كانت الفتحة مغطاة بالكامل.
- كرر هذا الإجراء للعدد المطلوب من مستحضرات الغشاء المخاطي (في هذه التجربة ، هناك حاجة إلى تحضيرين: سيتم استخدام أحد المستحضرات لقياس إمكانات التخفيف ، وسيتم استخدام الآخر لقياس المعلمات الكهربائية الأساسية).
7. تصاعد الاستعدادات المعوية في غرف Ussing
ملاحظة: يعتمد الإعداد على نوع نظام غرفة Ussing ونظام التسجيل المستخدم.
- شفط حل Ringer / المخزن المؤقت HEPES من غرفة Ussing.
- قم بتفكيك غرفة Ussing ووضع ورقة الترشيح مع جانب الغشاء المخاطي المعوي المستحضر لأسفل على الغرفة الجانبية المخاطية وضبطها بحيث تتماشى نافذة الغرفة مع ثقب ورقة الترشيح (الشكل 1A ، العلامة السوداء حول نافذة الغرفة مفيدة لمحاذاة المستحضرات).
- ضع الغرفة الجانبية المصلية بعناية على الغرفة الجانبية المخاطية وأغلقها بإحكام ولكن تأكد من أن الورقة المعوية لم تتحرك أثناء الاتصال.
- أعد ملء كلتا الغرفتين بسرعة بمحلول Ringer أو المخزن المؤقت HEPES ، وضع عصي الفقاعات (حل Ringer: 95٪ O2 / 5٪ CO2; HEPES العازلة: 100٪ O2) في الطرف الآخر من الغرف ، بعيدا عن الغشاء (يمكن أن يكون للفقاعات القريبة جدا من التحضير تأثير على القياسات).
- أعد توصيل جسور الملح وتحقق مما إذا كان الجهد مستقرا وتيار النبض للتأكد من أن التوصيلات على ما يرام (الشكل 1C).
- كرر لكل إعداد معوي.
- دع النظام يتوازن لمدة 15 دقيقة تقريبا. إذا كنت تستخدم نظام تسجيل ، فدع فرق التوصيل وفرق جهد ICC / الغشاء يستقر قبل بدء التجارب.
8. تجربة جهد التخفيف (ظروف الدائرة المفتوحة)
- اغسل جانبي الغرفة عن طريق شفط المخزن المؤقت HEPES وإضافة 5 مل من المخزن المؤقت HEPES الطازج الذي تم تسخينه مسبقا إلى كل جانب.
- قم بتشغيل نظام التسجيل. اضبط النطاق على 250 mV ، (النظام المستخدم هنا يضخم جهد الإخراج 10x) ، وتعيين مواضع العلامات ، وتعيين نظام التسجيل للقياس.
- حول أنظمة غرفة Ussing إلى وضع المشبك وابدأ القياس. بمجرد استقرار إمكانات الغشاء (~ 15-20 دقيقة) ، يمكن أن يبدأ التقييم.
- شفط المخزن المؤقت HEPES من الجانب المخاطي واستبداله بسرعة مع 5 مل من المخزن المؤقت HEPES المخفف الدافئ الذي يحتوي على 75 mM NaCl.
- بمجرد أن يصل جهد الغشاء إلى ذروته (5-10 دقائق) ، قم بإزالة المخزن المؤقت للتخفيف من الجانب "المخاطي" واستبدله بمخزن HEPES المؤقت.
- إذا لزم الأمر، كرر الخطوة 3 للجانب المصلي، مع إضافة مخزن مؤقت HEPES للتخفيف إلى الجانب المصلي.
- للتأكد من أن الأنسجة قابلة للحياة ، أضف منشط سيكلاز الأدينيلات Forskolin (التركيز النهائي 10 ميكرومتر) إلى الجانب المصلي.
- بمجرد أن يصل فرق جهد الغشاء إلى ذروته ويبدأ في الانخفاض ، تنتهي التجربة.
9. قياس التوصيل الكهربائي عبر الظهارة وخط الأساس ISC (ظروف الدائرة القصيرة)
- اغسل جانبي الغرفة عن طريق شفط محلول Ringer وإضافة 5 مل من محلول Ringer الفقاعي الطازج إلى كل جانب.
- قم بتشغيل نظام التسجيل. اضبط النطاق على 2.5 فولت (النظام المستخدم هنا يضخم جهد الإخراج 10x) ، وتعيين مواضع العلامات ، وتعيين نظام التسجيل للقياس.
- قم بتشغيل أنظمة غرفة Ussing إلى وضع المشبك وابدأ في القياس ؛ بمجرد استقرار Isc والتوصيل (~ 15-20 دقيقة) ، يمكن الحصول على قياسات خط الأساس.
- للتأكد من أن الأنسجة قابلة للحياة ، أضف منشط سيكلاز الأدينيلات Forskolin (التركيز النهائي 10 ميكرومتر) إلى الجانب المصلي.
- بمجرد أن يصل فرق جهد الغشاء إلى ذروته ويبدأ في الانخفاض ، تتم التجربة.
10. تحليل النتائج
- في ظل ظروف الدائرة المفتوحة ، احسب التوصيل عبر الغشاء المخاطي من تغير الجهد استجابة للنبضات الحالية وفقا لقانون أوم. أوجد تيار الدائرة القصيرة المكافئ (Isc) من الجهد والتوصيل عبر الغشاء المخاطي بتطبيق قانون أوم.
- استخدم إمكانات التخفيف لكلوريد الصوديوم لحساب الانتقائية الأيونية النسبية (PNa/PCl) باستخدام معادلة غولدمان-هودجكين-كاتس10.
- قدر الانتقائية المطلقة للوصلة الضيقة لكل أيون باستخدام معادلة كيميزوكا-كوكيتسو11.
- احسب PNa/PCl باستخدام معادلة غولدمان-هودجكين-كاتز من إمكانات التخفيف، وأوجد النفاذيات المطلقة PNa وPCl من معادلة كيميزوكا-كوكيتسو كما وصفها يو وآخرون.10 على النحو التالي:
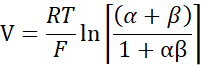

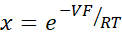

حيث، V: إمكانات التخفيف (mV)؛ α: نسبة النشاط. النشاط المحسوب لكلوريد الصوديوم في المخزن المؤقت HEPES مقسوما على النشاط المحسوب ل NaCl في المخزن المؤقت HEPES المخفف (بالنسبة لهذه التجربة تم حسابه على أنه 1.8966) ؛ ه: ثابت رياضي ، 2.71828 ؛ GM: التوصيل عبر الغشاء المخاطي (mS / cm2) ؛ F: ثابت فاراداي (96,485.3329 C/mol)؛ R: ثابت الغاز (8.314 J/mol K)؛ T: درجة الحرارة (310.15 K)
Access restricted. Please log in or start a trial to view this content.
النتائج
النتائج المعروضة في هذه الورقة هي نتائج كانت جزءا من مشروع أكبر تم الانتهاء منه (انظر المرجع 4،23،24).
يتم تقليل التوصيل الكهربائي عبر الظهارة للأمعاء الدقيقة في الفئران Cldn15-/- ....
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذه التجربة ، تم استخدام غرف Ussing لقياس المعلمات الكهربائية الأساسية وإمكانات التخفيف من كلوريد الصوديوم في الأمعاء الدقيقة لفئران Cldn15-/- و WT. من المهم جدا عند إجراء تجارب غرفة Ussing التحقق من أن إعداد الغشاء المستخدم في التجارب قابل للتطبيق. وعادة ما يتم ذلك عن طريق إضافة الجلوك...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين تضارب محتمل في المصالح للإفصاح عنه.
Acknowledgements
يتم دعم هذا العمل بواسطة 17K00860 (إلى HH) و 19K20152 (إلى NI). تود WH أن تعرب عن تقديرها لمؤسسة Otsuka Toshimi للمنح الدراسية لدعمها المالي من 2018-2021.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
References
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907(2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032(2018).
- Schoultz, I., Keita, ÅV. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, John Wiley & Sons, Inc. 1-19 (2017).
- Östh, K. The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , Uppsala University. Dissertation thesis (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703(2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376(2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved