É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação funcional da barreira de junção apertada intestinal e permeabilidade de íons em tecido nativo pela técnica da câmara de ussing
Neste Artigo
Resumo
O epitélio intestinal confere não apenas absorção de nutrientes, mas proteção contra substâncias nocivas. A junção intercelular mais epitelial apical, ou seja, a junção apertada, regula soluto paracelular e permeabilidade de íons. Aqui, é descrito um protocolo para a preparação de folhas mucosas e avaliação da seletividade de íons de junções apertadas usando a técnica da câmara de Ussing.
Resumo
A técnica da câmara de Ussing foi inventada pela primeira vez pelo cientista dinamarquês Hans Ussing em 1951 para estudar o transporte transcelular de sódio através da pele de sapo. Desde então, essa técnica tem sido aplicada a muitos tecidos diferentes para estudar os parâmetros fisiológicos do transporte através de membranas. O método de câmara de Ussing é preferível a outros métodos porque o tecido nativo pode ser usado, tornando-o mais aplicável ao que está acontecendo in vivo. No entanto, como o tecido nativo é usado, o rendimento é baixo, o tempo é limitado, e a preparação do tecido requer habilidade e treinamento. Essas câmaras têm sido utilizadas para estudar proteínas específicas de transporte em diversos tecidos, entender a fisiopatologia da doença, como na Fibrose Cística, estudar o transporte e a absorção de medicamentos, e especialmente contribuír para a compreensão do transporte de nutrientes no intestino. Dado todo o processo de transporte epitelial de um tecido, não apenas vias transepiteliais, mas também caminhos paracelulares são importantes. Junções apertadas são um determinante chave da permeabilidade paracelular específica do tecido em todo o intestino. Neste artigo, a técnica da câmara de Ussing será usada para avaliar a permseletividade paracelular dos íons, medindo os potenciais de condução transeptelial e diluição.
Introdução
O método da câmara de Ussing foi desenvolvido pela primeira vez pelo cientista dinamarquês Hans Ussing. Ussing primeiro o usou para medir a corrente de curto-circuito do transporte de sódio através da pele de sapo depois que foi observado que NaCl poderia ser transportado através da pele contra um gradiente de concentração íngreme1. Seu sistema consistia na pele do sapo montada entre duas câmaras com acesso a ambos os lados da pele. Cada câmara continha a solução de Ringer que foi circulada e arejada. Duas pontes estreitas de ágar anéis situadas perto da pele e conectadas a eletrodos Saturados KCl-calomel mediram a diferença potencial como lido por um potencializador. Um segundo par de pontes de ágar ringer estavam situadas na extremidade oposta de cada câmara conectada a béquers com KCl saturado com AgCl para aplicar uma força eletromotiva fornecida por uma bateria. Um divisor potencial foi usado para ajustar a tensão de modo que a diferença potencial entre a pele permaneceu zero, criando assim condições de curto-circuito. Um medidor de microampere também foi conectado para ler a corrente que passa pela pele (ver a figura no ref.1 para o desenho original da câmara).
Ao longo dos últimos 70 anos, essa técnica tem sido aplicada a muitos tecidos diferentes, particularmente o tecido intestinal, para estudar o transporte de nutrientes e íons. Por exemplo, o mecanismo de diarreia induzida pela cólera foi estudado pela montagem de íleo de coelho nessas câmaras, e descobriu-se que a diarreia induzida por toxina de cólera é mediada por cAMP2. Além disso, essas câmaras também foram utilizadas para estudar o mecanismo subjacente ao transporte de glicose via cotransportador Na+-Glicose 1 (SGLT1)3. Nosso laboratório se concentra no transporte transcelular e paracelular em células epiteliais intestinais. Utilizando o método da câmara de Ussing, o transporte de peptídeos foi avaliado em Claudin 15 camundongos nocauteados, que têm prejudicado o transporte paracelular de sódio, usando câmaras de Ussing para medir a absorção da glicitsarcosina de dipeptídeo não-higidivelmente. Descobriu-se que a homeostase Luminal Na+ é importante para o transporte de peptídeos acoplado a prótons4. Além disso, essas câmaras também foram usadas para investigar a secreção de ânion no ceco murino em resposta à ativação submucosal do receptor ativado proteinase 1 pelo serino protease trypsin5.
Câmaras de ussing também foram usadas recentemente para avaliar as vias paracelulares no tecido epitelial. As vias paracelulares são reguladas por junções apertadas, que são complexos de proteínas que se formam no ponto onde duas ou mais células se encontram6. A função de barreira e seletividade de íons (se os ânions ou cáations são seletivamente capazes de passar pela junção apertada) é determinada pela presença de proteínas da família Claudin; alguns dos quais atuam como barreiras (claudin 3 e 7), poros de anion (claudin 10a), ou poros de cáção (claudin 2, 10b e 15)7. Outros métodos têm sido utilizados para avaliar a via paracelular, como gavage oral do FITC acompanhado de concentração FITC de plasma de sangue8, ou EDTA-Cr9; no entanto, essas técnicas são de menor resolução e não podem avaliar a seletividade de íons ou uma seção específica das seções do trato intestinal. As câmaras de ussing, no entanto, podem ser usadas para avaliar o potencial de diluição dos íons-alvo e, portanto, determinar a seletividade de íons das junções apertadas. Por exemplo, com NaCl, a seletividade das junções apertadas para Na+ e Cl- pode ser calculada diluindo um lado da membrana (geralmente o lado mucosal) e medindo a mudança na diferença potencial transepitetelial. As permeabilidades relativas de Na+ e Cl- podem ser estimadas pela equação Goldman-Hodgkin-Katz10 e a seletividade da junção apertada pode ser estimada usando a equação Kimizuka-Koketsu11. Essas câmaras, portanto, têm a vantagem de medir os parâmetros eletrofisiológicos do tecido e, como resultado, fornecem mais informações sobre a passagem de íons através das junções apertadas do que outros métodos de resolução mais baixa.
O método da câmara de Ussing não se limita apenas ao trato intestinal, embora seja amplamente utilizado em estudos relativos ao intestino, ele tem muitas outras aplicações também. Por exemplo, essas câmaras têm sido usadas para estudar fibrose cística, e especificamente o regulador de condutância de fibrose transmembrana de fibrose cisticida do canal cloreto (CFTR)12. A Fibrose Cística é causada por uma mutação no CFTR13, que resulta em secreção de cloreto prejudicada e transporte de fluidos por células epiteliais respiratórias, e uma camada mucosa mais espessa e seca14. Estudo da CFTR epitelial das vias aéreas tem sido realizado com essas câmaras para não só entender a doença, mas para descobrir formas de tratar a doença. Por exemplo, em pacientes com mutações raras que causam fibrose cística, a análise de células epiteliais respiratórias do paciente tem sido usada para testar terapias como Orkambi e uma coterapia amplificadora15.
Câmaras ussing também têm sido usadas para estudar rotas de entrega de medicamentos, como com tecido de biópsia humana para estudar a absorção de drogas e farmacocinética16. A absorção intestinal não é a única rota de entrega de drogas. Essas câmaras também têm sido usadas para estudar sistemas de entrega de drogas nasais17. Estudos de entrega de drogas com câmaras de Ussing também foram realizados para o olho. Na córnea do coelho, foram realizados estudos de permeabilidade e absorção com Labrasol, uma droga projetada para aumentar a absorção de drogas entre tecidos18. Outro estudo analisou o efeito do cloreto de benzilaalkonium na entrega de drogas transesclerais na esclera do coelho19.
O método de câmara de Ussing é útil porque o tecido nativo pode ser usado. Como tal, é preferível sobre modelos in vitro, como linhas celulares Caco-2. No entanto, a técnica requer habilidade e tempo para preparar espécimes, por isso não é adequada para aplicações de alto rendimento. As propriedades eletrofisiológicas das monocamadas celulares podem ser estudadas usando pastilhas de cultura celular nessas câmaras. Descobertas recentes permitiram a cultura de organoides que são mini-órgãos cultivados na cultura a partir da colheita de células-tronco epiteliais ou endoteliais20. A cultura organoide pode ser manipulada para ser cultivada em uma monocamadas, tornando possível montar organoides em uma câmara de Ussing21. Organoides de vários tecidos epiteliais e endoteliais podem ser estudados, diminuindo o número de animais necessários, pois a cultura organoide pode ser mantida a longo prazo. Isso também aumentará o rendimento, uma vez que não serão necessárias etapas de dissecção e preparação de tecidos demorados e trabalhosos. No futuro, os estudos de câmara de Ussing continuarão a ser muito úteis para estudar o transporte de tecidos e serão especialmente importantes no campo da medicina personalizada.
O protocolo a seguir demonstra a aplicação do método de câmara de Ussing para avaliar a permseletividade e a função de barreira das junções apertadas no intestino delgado de Claudin 15 knockout (Cldn15-/-) ratos e controles do tipo selvagem (WT) medindo o potencial de diluição de NaCl. Junções apertadas (TJ) são formadas no ponto onde duas ou mais células se encontram em tecido epitelial e endotelial. Acredita-se que as junções apertadas bicelulares (bTJ), particularmente as proteínas da família Claudin encontradas dentro do bTJ, determinem a função da barreira e a permseletividade do TJ7. Os camundongos têm um mega intestino delgado22 e capacidade reduzida de absorção de nutrientes devido à perda da reciclagem intestinal na+ que ocorre através de claudin 154,23,24. Cldn15-/- camundongos têm prejudicado a homeostase Na+, o que os torna um modelo interessante para estudar a permeseletividade do TJ. O protocolo a seguir avalia a permeabilidade do TJ para a LCA medindo o potencial de diluição de NaCl (PNa/PCl) no intestino delgado médio. Resumidamente, a mudança na diferença potencial da membrana que ocorre diluindo um lado da membrana (lado M ou lado S, ambos são medidos no protocolo abaixo) pode ser usada para calcular a permeabilidade de Na+ (PNa) e Cl- (PCl), e o potencial de diluição (PNa/PCl) mostrará se a junção apertada tem uma seletividade cônica ou aniônica.
Os experimentos neste protocolo foram realizados utilizando uma câmara ussing personalizada (Figura 1A), que consiste em duas metades, entre as quais a preparação intestinal é montada verticalmente, amplificador de grampo de tensão, gravador elétrico, eletrodos, pontes de sal, solução de Ringer, tampão HEPES (150 mM NaCl), tampão HEPES diluído (75 mM NaCl), preparação intestinal (para detalhes sobre o equipamento ver a Tabela de Materiais).
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os animais utilizados nesses experimentos foram mantidos na unidade de cuidados com animais da Universidade de Shizuoka e os experimentos foram realizados de acordo com as diretrizes para pesquisas em animais estabelecidas pela Universidade de Shizuoka. Todos os experimentos foram realizados com aprovação do Comitê de Cuidados e Uso de Animais da Universidade de Shizuoka (Licenças #205272 e #656-2303).
1. Preparação de eletrodos NaCl
NOTA: Os eletrodos utilizados nestes experimentos consistem em NaCl concentrado ou KCl. Os eletrodos KCl/calomel são comprados comercialmente. Antes de iniciar o experimento, certifique-se de que todos os eletrodos sejam preenchidos até o topo com solução concentrada de NaCl ou KCl.
- Prepare pequenos frascos de vidro com tampas plásticas (volume de 20 mL).
- Faça dois furos nas tampas plásticas, um para a ponte de sal NaCl (diâmetro de 2,5 mm) e outro para fio de prata (1 mm de diâmetro; Figura 1C, Eletrodo NaCl).
- Encha o frasco de vidro com solução nacl saturada (cerca de 15 mL, até ficar cheio).
- Insira fio prateado (0,8 mm de diâmetro, 7 cm de comprimento) no frasco, mas certifique-se de que a porção de arame fora do frasco pode ser conectada através de clipes de jacaré (tamanho pequeno) ao sistema do amplificador.
- Quando não estiver em uso, enrole os eletrodos e certifique-se de que os orifícios estejam cobertos, com parafilme para evitar a secagem.
2. Preparação de pontes de sal
NOTA: Prepare pontes de sal pelo menos um dia antes do experimento para fornecer tempo adequado para solidificar. Pontes de sal podem ser usadas repetidamente, mas o uso após 2 meses não é recomendado.
- Pontes de sal NaCl
- Prepare a tubulação de polietil #7 (diâmetro externo 2,3 mm, diâmetro interno 1,3 mm), agulha de 19 G e seringa tipo bloqueio, 200 mL de solução de 1 M NaCl, ágar de 2 g, recipiente plástico vedado para armazenamento de ponte salgada.
- Prepare o número adequado de pontes de sal cortando tubos para o tamanho necessário para a câmara de Ussing criada (cada câmara requer duas pontes de sal).
- Antes da injeção de ágar, faça uma forma de U com os tubos e coloque-os em um béquer de água morna (para criar uma forma fácil para a instalação de pontes de sal).
- Faça 200 mL de 1 M NaCl dissolvendo 11.688 g de NaCl em 200 mL em água deionizada.
- Divida 1 M NaCl em porções de 100 mL: Faça 100 mL de 2% de ágar em 1 M NaCl (misture 2 g de ágar em NaCl, calor no micro-ondas para dissolver).
- Usando uma agulha de 19 G e seringa de bloqueio, encha a seringa com solução de 1 M NaCl/ágar. Comece suavemente a expelir a solução gota a gota e ao fazê-lo insira a agulha em uma extremidade do tubo e encha até que a mistura saia do outro lado.
- Retire lentamente a agulha enquanto ainda expressa a solução e repita até que todas as pontes de sal necessárias tenham sido feitas. (Se a solução se solidificar na seringa ou agulha, aqueça-a brevemente em água quente até que a solução possa ser expressa novamente.)
- Verifique as pontes de sal para garantir que não haja bolhas e armazene a solução restante de 1 M NaCl em um recipiente vedado.
- Pontes de sal KCl
NOTA: A tubulação mais fina é usada para as pontes de ágar KCl para evitar o incremento da concentração de K+ no buffer, pois as pontas da ponte salgada podem se dissolver e K+ pode vazar no buffer.- Prepare a tubulação de polietil #3 (diâmetro externo 1,0 mm, diâmetro interno 0,5 mm), agulha de 23 G e seringa tipo bloqueio, 200 mL de solução de 1 M KCl, ágar de 2 g, recipiente de plástico vedado para armazenamento de ponte salgada.
- Prepare o número adequado de pontes de sal cortando o tubo para o tamanho necessário para a câmara de Ussing montada (cada câmara requer duas pontes de sal).
- Faça 200 mL de 1 M KCl dissolvendo 14,91 g de KCl em 200 mL de água desionizada.
- Divida em duas porções de 100 mL: Faça 100 mL de 2% de ágar em 1 M KCl (misture 2 g de ágar em KCl, aqueça em um micro-ondas para dissolver).
- Usando uma agulha de 23 G e seringa de bloqueio, injete tubos com 2% de mistura de ágar 1 M KCl (certifique-se de que os tubos estão completamente cheios e não há bolhas) da mesma forma que com as pontes de sal NaCl.
- Verifique pontes de sal para garantir que não haja bolhas e armazene a solução restante de 1 M KCl em um recipiente vedado.
3. Preparação da solução de Ringer e do buffer HEPES
NOTA: Dependendo do tecido montado na câmara de Ussing, os componentes da solução de Ringer podem diferir. As receitas aqui apresentadas são específicas para o intestino delgado e grosso.
- Faça a solução de Ringer fresca no dia dos experimentos, conforme descrito na Tabela 1.
- Bolha a solução com 95% de CO2 O2/5% para fornecer O2 ao tecido e uma capacidade de tampão.
| Solução de Ringer (intestino delgado) | Solução de Ringer (intestino grosso) |
| NaHCO3 – 21,0 mM | NaHCO3 – 21,0 mM |
| K2HPO4 – 2,4 mM | K2HPO4 – 2,4 mM |
| KH2PO4 – 0,6 mM | KH2PO4 – 0,6 mM |
| NaCl – 119,0 mM | NaCl – 119,0 mM |
| MgCl2 – 1,2 mM | MgCl2 – 1,2 mM |
| CaCl2 – 1,2 mM | CaCl2 – 1,2 mM |
| Indomethacina – 10 μM (Faça 1 mM de estoque em 21 mM NaHCO3, adicione 10 mL de estoque para 1 L da solução de Ringer) | Indomethacina – 10 μM (Faça 1 mM de estoque em 21 mM NaHCO3, adicione 10 mL de estoque para 1 L da solução de Ringer) |
| 1 mM Glutamina (0,146 g/L) | Glicose de 10 mM |
Tabela 1: Receita de Solução de Ringer. Para fazer a solução de Ringer, misture todos os componentes com água desografada. A solução de Ringer é melhor feita fresca antes de experimentos. Mantenha na geladeira ou no gelo até usar. Antes de usar, gás com 95% de CO2/5% de O2/ 5%.
- Faça o tampão HEPES fresco no dia do experimento, conforme descrito na Tabela 2 , misturando ingredientes em água desionizada.
- Não se ajuste ao volume final do buffer até após o ajuste do pH.
- Tampão HEPES quente a 37 °C e ajuste o pH para 7,4 adicionando lentamente gotas de solução de 1 M Tris enquanto mexe.
- Ajuste ao volume final adicionando a quantidade apropriada de água deionizada.
| Tampão hepes | Tampão HEPES de diluição |
| HEPES – 10 mM | HEPES – 10 mM |
| Glicose – 10 mM (intestino grosso) | Glicose – 10 mM (intestino grosso) |
| 1 mM Glutamina (0,146 g/L) (intestino delgado) | 1 mM Glutamina (0,146 g/L) (intestino delgado) |
| NaCl – 150 mM | NaCl – 75 mM + 150 mM mannitol (para ajustar para diferenças de osmolalidade) |
| MgCl2 – 1 mM | MgCl2 – 1 mM |
| CaCl2 – 2 mM | CaCl2 – 2 mM |
| Indomethacina – 10 μM (Faça 1 mM de estoque em 21 mM NaHCO3, adicione 10 mL de estoque para 1 L da Solução de Ringer) | Indomethacina – 10 μM (Faça 1 mM de estoque em 21 mM NaHCO3, adicione 10 mL de estoque para 1 L da Solução de Ringer) |
| Ajuste ao pH 7.40 (37°C) usando 1 M Tris | |
Tabela 2: Receita de tampão hepes. Para fazer tampão hepes e diluição hepes tampão, dissolva todos os ingredientes em água desionizada. As soluções devem ser ajustadas com solução de 1 M Tris, por isso não adicione volume total de água (por exemplo, ao fazer 1 L, dissolva todos os ingredientes em cerca de 800 mL de água). Em seguida, aqueça a solução para 37 °C, ajuste o pH para 7,4 e depois ajuste o volume final.
4. Configuração da câmara de Ussing
NOTA: As câmaras ussing usadas neste protocolo são câmaras de perfusão contínua feitas sob medida. Para avaliar a função da barreira intestinal do camundongo ou a absorção de nutrientes, recomenda-se câmaras com abertura de 4 ou 5 mm de diâmetro25 (Figura 1A-C).
- Para reduzir o efeito de borda26 e ajudar a selar as câmaras, conecte o filme de parafina perfurado de 4 ou 5 mm (cerca de 4 cm2) antes de configurar (Figura 1B).
- Configurado em condições de circuito aberto para medição potencial de diluição. Coloque no modo de fixação atual. Defina a saída como corrente e defina o pulso de corrente para ±20 μA.
- Ao configurar em condições de curto-circuito para a medição da corrente de curto-circuito e resistência transmucosal, coloque no modo de fixação de tensão. Defina a saída como tensão e coloque o pulso de tensão em ±5 mV.
- Certifique-se de que a água de 37 °C esteja circulando na capa de água.
- Encha cada câmara com a solução do Ringer ou tampão HEPES (quantidade depende do sistema utilizado, as câmaras utilizadas aqui requerem 5 mL para cada lado) e certifique-se de que não há vazamentos.
- Conecte pontes de sal e eletrodos.
- Certifique-se de que a tensão é 0 e estável, corrente de pulso para garantir que pontes de sal e eletrodos estejam devidamente configurados.
- Permitir que a temperatura da solução do sistema e do Ringer se equilibre por pelo menos 20 minutos.
- Após o equilíbrio, corrija a diferença de tensão assimétrica entre os eletrodos KCl e compense a resistência do fluido alterando-a para zero (verifique o manual do sistema de câmara ussing usado para determinar a maneira correta).
5. Dissecção do tecido intestinal
NOTA: Toda a experimentação animal deve ser realizada dentro dos regulamentos estabelecidos pelo país e pela universidade.
- Antes de tomar o tecido intestinal, prepare a solução fresca e gelada de Ringer e a bolha com 95% de O2 e 5% de CO2 por 15 minutos (passo 3).
- Anestesiar camundongos de acordo com as diretrizes que regem o uso de animais em pesquisas. Para este experimento, os camundongos foram anestesiados com 2%-3% de isoflurane administrado por um anesthetizador. Verifique a anestesia adequada beliscando os dedo dos dedo dos pé e garantindo que não haja resposta à dor.
- Faça uma incisão no abdômen com uma tesoura da pélvis até o diafragma; localizar o estômago e cortar a extremidade pitrórica do estômago.
- Segure a porção estomacal presa ao intestino delgado com fórceps e puxe suavemente o intestino delgado enquanto corta os acessórios mesentéricos. Tenha cuidado para não cortar ou danificar o tecido intestinal de forma alguma.
- Continue dissecando o intestino até o ânus. Para a remoção completa do intestino grosso, corte os ossos pélvicos para revelar a porção distal do intestino grosso e remova cuidadosamente o resto do intestino cortando os acessórios.
- Meça o comprimento do intestino e divida em segmentos desejados. Para este experimento, divida o intestino delgado em três segmentos e utilize o segmento médio.
- Coloque os segmentos desejados em solução gelada e borbulhada de Ringer; em seguida, abra cada segmento longitudinalmente cortando ao longo dos anexos mesentéricos. Corte a gordura e o tecido conjuntivo.
- Retorne os segmentos à solução do Ringer gelado e lave bem (mesmo na solução gelada, a oxigenação do epitélio luminal é importante para manter a função epitelial).
6. Descascando a camada muscular e a preparação da folha intestinal
NOTA: A remoção da serosa (camada muscular) é importante para os estudos de transporte que utilizam o intestino. Se a serosa permanecer, o tecido intestinal pode estar sujeito a contrações musculares aleatórias que distorcerão os dados eletrofisiológicos, e o transporte pode ser inibido. O tecido destripado se deteriora rapidamente quando montado em câmaras de Ussing, uma vez que o serosa é uma barreira de difusão significativa para substrato e oxigênio. Em alguns casos especiais, pode ser necessário manter a camada muscular, de modo que a decisão cabe ao pesquisador e ao projeto experimental. As folhas intestinais podem ser preparadas de duas maneiras, dependendo de qual camada é removida (Figura 2). Para este experimento, são necessárias preparações mucosas e submucosais (Figura 2, 2º painel).
- Prepare placas de dissecção (10 cm de diâmetro) cobertas com borracha de silicone, pinos (pequenas agulhas de acupuntura), papel filtro perfurado de 5 mm e quadrados de parafilm (2 cm x 2cm; pode não ser necessário para outros sistemas).
- Despeje a solução de Ringer fresca, gelada e borbulhada na placa de dissecção (o suficiente para cobrir o tecido, cerca de 2-3 mL).
- Sob um estereótipo, fixar as extremidades do tecido intestinal (lado mucosal para baixo).
- Usando fórceps finos, disseca sem rodeios a camada muscular da mucosa subjacente.
- Tenha cuidado para não rasgar ou introduzir quaisquer buracos no tecido.
- Uma vez que a camada muscular é removida, corte uma peça grande o suficiente para uma abertura de 5 mm de diâmetro. Ao preparar o intestino delgado, a remoção da camada serosa-muscular deve ser feita dentro de 10 minutos, uma vez que a oxigenação luminal é difícil nessas condições.
- Quadrado de papel filtro perfurado de 5 mm na solução de Ringer e coloque o tecido intestinal sobre ele com o lado mucosal para baixo, uma vez que preparações submucosais espontaneamente envolvem com lado mucosal do lado de fora.
- Certifique-se de que a abertura está completamente coberta pelo tecido intestinal e não há rugas presentes. Use uma placa preta sob a preparação para examinar se a abertura está completamente coberta.
- Repita este procedimento para o número necessário de preparações mucosas (neste experimento são necessárias duas preparações: uma preparação será usada para medir o potencial de diluição, e a outra será usada para medir parâmetros elétricos de linha de base).
7. Montagem de preparações intestinais em câmaras de Ussing
NOTA: A configuração dependerá do tipo de sistema de câmara ussing e sistema de gravação utilizado.
- Sucção da solução de Ringer/hepes tampão da câmara de Ussing.
- Desmonte a câmara de Ussing e coloque o papel filtro com o lado mucosal de preparação intestinal para baixo na câmara lateral mucosa e ajuste para que a janela da câmara se alinhe com o orifício do papel filtro (Figura 1A, a marcação preta ao redor da janela da câmara é útil para o alinhamento das preparações).
- Coloque cuidadosamente a câmara lateral serosal na câmara lateral mucosa e feche firmemente, mas certifique-se de que a folha intestinal não se moveu durante a conexão.
- Reabasteca rapidamente ambas as câmaras com a solução do Ringer ou tampão HEPES, e coloque varinhas borbulhantes (solução de Ringer: 95% CO2 O2/5%; Tampão HEPES: 100% O2) na extremidade oposta das câmaras, longe da membrana (borbulhar muito perto da preparação pode ter um efeito sobre as medidas).
- Reconecte pontes salgadas e verifique se a tensão está estável e a corrente de pulso para garantir que as conexões estejam bem (Figura 1C).
- Repita para cada preparação intestinal.
- Deixe o sistema equilibrar por cerca de 15 minutos. Se usar um sistema de gravação, deixe que a diferença de potencial conduance e Isc/membrana se estabilize antes de iniciar os experimentos.
8. Experimento potencial de diluição (condições de circuito aberto)
- Lave ambos os lados da câmara aspirando o tampão HEPES e adicionando 5 mL de tampão HEPES pré-aquecido fresco para cada lado.
- Ligue o sistema de gravação. Alcance definido para 250 mV, (o sistema usado aqui amplifica a tensão de saída 10x), definir posições de marcador e definir sistema de gravação para medir.
- Gire os sistemas de câmara de Ussing para o modo de fixação e comece a medir. Uma vez que o potencial da membrana tenha estabilizado (~15-20 min), a avaliação pode começar.
- Sucção do tampão HEPES do lado mucosal e substitua rapidamente por 5 mL de tampão HEPES de diluição aquecida contendo 75 mM NaCl.
- Uma vez que o potencial da membrana tenha atingido o pico (5-10 min), remova o tampão de diluição do lado "Mucosal" e substitua pelo buffer HEPES.
- Se necessário, repita o passo 3 para o lado serosal, adicionando tampão HEPES de diluição ao lado serosal.
- Para garantir que o tecido seja viável, adicione o ativador de cyclase adenilato Forskolin (concentração final de 10 μM) ao lado serosal.
- Uma vez que a diferença potencial da membrana atingiu um pico e começou a diminuir, o experimento acabou.
9. Medição da condutância elétrica transepitenelial e Isc de linha de base (condições de curto-circuito)
- Lave ambos os lados da câmara aspirando a solução do Ringer e adicionando 5 mL de solução de Ringer bolhas frescas para cada lado.
- Ligue o sistema de gravação. Alcance definido para 2,5 V (o sistema usado aqui amplifica a tensão de saída 10x), definir posições de marcador e definir o sistema de gravação para medir.
- Gire os sistemas de câmara de Ussing para o modo de fixação e comece a medir; uma vez que isc e conduance tenham estabilizado (~15-20 min), as medidas de linha de base podem ser obtidas.
- Para garantir que o tecido seja viável, adicione o ativador de cíclase adenílato Forskolin (concentração final de 10 μM) ao lado serosal.
- Uma vez que a diferença potencial da membrana atingiu um pico e começou a diminuir, o experimento é feito.
10. Análise de resultados
- Em condições de circuito aberto, calcule a condutância transmucosal a partir da mudança de tensão em resposta aos pulsos atuais de acordo com a lei de Ohm. Determine a corrente de curto-circuito equivalente (Isc) da tensão transmucosal e condutância aplicando a lei de Ohm.
- Use o potencial de diluição de NaCl para calcular a seletividade relativa iônica (PNa/PCl) com a equação Goldman-Hodgkin-Katz10.
- Estime a seletividade absoluta da junção apertada para cada íon usando a equação Kimizuka-Koketsu11.
- Calcule pna/PCl usando a equação Goldman-Hodgkin-Katz a partir de potenciais de diluição, e determine permeabiliidades absolutas PNa e PCl da equação kimizuka-koketsu como descrito por Yu et al.10 da seguinte forma:
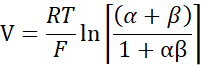

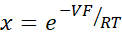

onde, V: Potencial de diluição (mV); α: Relação de atividade. A atividade calculada de NaCl no buffer HEPES dividido pela atividade calculada de NaCl no buffer HEPES de diluição (Para este experimento foi calculada como 1,8966); e: Constante matemática, 2,71828; GM: Condutância transmucosal (mS/cm2); F: Faraday constante (96.485.3329 C/mol); R: Constante de gás (8.314 J/mol K); T: Temperatura (310,15 K)
Access restricted. Please log in or start a trial to view this content.
Resultados
Os resultados apresentados neste artigo são resultados que fizeram parte de um projeto maior que foi concluído (ver ref.4,23,24).
A condutância elétrica transeptelial do intestino delgado é diminuída em cldn15-/- camundongos.
A condutância transmucosal da linha de base (sob condições de curto-circuito) ...
Access restricted. Please log in or start a trial to view this content.
Discussão
Neste experimento, as câmaras de Ussing foram usadas para medir os parâmetros elétricos da linha de base e o potencial de diluição de NaCl no intestino delgado de camundongos Cldn15-/- e WT. É muito importante ao fazer experimentos de câmara de Ussing para verificar se a preparação da membrana usada nos experimentos é viável. Isso geralmente é feito adicionando glicose ou o ativador de cíclase adenílato forskolin e vendo se há um aumento apropriado no Isc (100-300 μ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm potenciais conflitos de interesse para divulgar.
Agradecimentos
Este trabalho é suportado por 17K00860 (para HH) e 19K20152 (para NI). A WH gostaria de reconhecer a Fundação bolsa Otsuka Toshimi por seu apoio financeiro de 2018-2021.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
Referências
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907(2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032(2018).
- Schoultz, I., Keita, ÅV. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, John Wiley & Sons, Inc. 1-19 (2017).
- Östh, K. The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , Uppsala University. Dissertation thesis (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703(2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376(2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados