JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
챔버 기술을 사용하여 기본 조직의 장 타이트 접합 장벽 및 이온 투과성의 기능 평가
요약
장 상피는 영양 흡수뿐만 아니라 유해 물질에 대한 보호를 제공합니다. 정점-대부분의 상피 세포간 접합, 즉 타이트한 접합은 부세포 용질 및 이온 투과성을 조절한다. 여기에서, 점막 시트의 제조 및 어싱 챔버 기술을 사용하여 타이트한 접합부의 이온 선택성의 평가를 위한 프로토콜이 기재되어 있다.
초록
Ussing 챔버 기술은 개구리 피부를 가로 지르는 나트륨의 세포 간 수송을 연구하기 위해 1951 년 덴마크 과학자 Hans Ussing에 의해 처음 발명되었습니다. 그 이후로,이 기술은 멤브레인을 가로 지르는 수송의 생리적 매개 변수를 연구하기 위해 많은 다른 조직에 적용되었습니다. Ussing chamber 방법은 네이티브 조직을 사용할 수 있기 때문에 다른 방법보다 바람직하므로 생체 내에서 일어나는 일에보다 적용 할 수 있습니다. 그러나 네이티브 조직이 사용되기 때문에 처리량이 낮고 시간이 제한되며 조직 준비에는 기술과 훈련이 필요합니다. 이 챔버는 다양한 조직에서 특정 수송체 단백질을 연구하고, 낭포성 섬유증과 같은 질병 병리 생리학을 이해하고, 약물 수송 및 섭취를 연구하고, 특히 장내 영양 수송에 대한 이해에 기여했습니다. 조직의 전체 상피 수송 과정을 감안할 때, 경상피 경로뿐만 아니라 부세포 경로도 중요합니다. 단단한 접합부는 장 전체에 걸친 조직 특이적 부세포 투과성의 핵심 결정 요인입니다. 이 기사에서, Ussing 챔버 기술은 경상피 전도도 및 희석 전위를 측정하여 이온의 부세포 투과성을 평가하는 데 사용됩니다.
서문
Ussing 챔버 방법은 덴마크 과학자 Hans Ussing에 의해 처음 개발되었습니다. Ussing은 NaCl이 가파른 농도 구배에 대해 피부를 가로 질러 수송 될 수 있다는 것을 관찰 한 후 개구리 피부를 가로 질러 나트륨 수송의 단락 전류를 측정하기 위해 처음 사용했습니다1. 그의 시스템은 피부의 양쪽에 접근 할 수있는 두 개의 챔버 사이에 장착 된 개구리 피부로 구성되었습니다. 각 챔버에는 순환되고 폭기된 링거의 용액이 들어 있었다. 피부 근처에 위치하여 포화 KCl-calomel 전극에 연결된 두 개의 좁은 한천 링거 브릿지는 포텐셔너에 의해 판독된 전위차를 측정하였다. 두 번째 한 쌍의 한천 링거 브리지는 배터리에 의해 제공되는 기전력을 인가하기 위해 AgCl로 포화된 KCl을 갖는 비커에 연결된 각 챔버의 반대쪽 끝에 위치하였다. 전위 분배기를 사용하여 전압을 조정하여 피부 전체의 전위차가 제로로 유지되어 단락 조건을 만들었습니다. 마이크로암페어 미터는 또한 피부를 통과하는 전류를 판독하기 위해 연결되었다(원래의 챔버 설계에 대해서는 ref.1 의 그림 참조).
지난 70 년 동안이 기술은 영양소와 이온 수송을 연구하기 위해 많은 다른 조직, 특히 장 조직에 적용되었습니다. 예를 들어, 콜레라-유도된 설사의 메카니즘은 이들 챔버에 토끼 장폐색을 장착함으로써 연구되었고, 콜레라 독소-유도된 설사가 cAMP2에 의해 매개된다는 것이 발견되었다. 또한, 이들 챔버는 또한 Na+-글루코스 공수송체 1 (SGLT1)3을 통한 글루코스 수송의 기초가 되는 메카니즘을 연구하는데 사용되었다. 우리 실험실은 장 상피 세포에서 세포 횡단 및 부세포 수송에 중점을 둡니다. Ussing 챔버 방법을 사용하여, 펩티드 수송을 부세포 나트륨 수송에 장애가 있는 클라우딘 15 녹아웃 마우스에서, 비가수분해성 디펩티드 글리실사르코신의 흡수를 측정하기 위해 어싱 챔버를 사용하여 평가하였다. 발광 Na+ 항상성이 양성자 결합 펩티드 수송에 중요하다는 것이 밝혀졌다4. 또한, 이들 챔버는 또한 세린 프로테아제 트립신5에 의한 프로테이나제 활성화 수용체 1의 점막하 활성화에 반응하여 뮤린 맹장에서의 음이온 분비를 조사하기 위해 사용되었다.
Ussing chambers는 또한 최근에 상피 조직에서 부세포 경로를 평가하기 위해 사용되었습니다. 부세포 경로는 두 개 이상의 세포가 만나는 지점에서 형성되는 단백질의 복합체인 타이트한 접합부에 의해 조절됩니다6. 장벽 기능 및 이온 선택성 (음이온 또는 양이온이 선택적으로 타이트 접합부를 통과 할 수 있는지 여부)은 클라우딘 패밀리 단백질의 존재에 의해 결정됩니다. 이들 중 일부는 장벽 (클로딘 3 및 7), 음이온 기공 (클로딘 10a) 또는 양이온 기공 (클로딘 2, 10b 및 15)7로 작용한다. 다른 방법들이 혈장 FITC 농도8을 수반하는 FITC의 경구 위관과 같은 부세포 경로를 평가하기 위해 사용되었다8, 또는 EDTA-Cr9; 그러나 이러한 기술은 분해능이 낮으며 이온 선택성 또는 장 부분의 특정 부분을 평가할 수 없습니다. 그러나 어싱 챔버는 표적 이온의 희석 전위를 평가하고, 따라서 타이트한 접합부의 이온 선택성을 결정하는 데 사용될 수 있다. 예를 들어, NaCl을 사용하는 경우, Na+ 및 Cl-에 대한 타이트한 접합부의 선택성은 막의 한쪽(보통 점막측)을 희석하고 경상피 전위차의 변화를 측정함으로써 계산할 수 있다. Na+ 및 Cl-의 상대적 투과도는 Goldman-Hodgkin-Katz 방정식10에 의해 추정될 수 있으며, 타이트한 접합부의 선택성은 Kimizuka-Koketsu 방정식 11을 사용하여 추정될 수 있다. 따라서, 이들 챔버는 조직의 전기생리학적 파라미터를 측정하는 이점을 가지며, 그 결과 다른 낮은 분해능 방법보다 타이트한 접합부를 통한 이온의 통과에 대한 더 많은 정보를 제공한다.
Ussing 챔버 방법은 장에 국한 될뿐만 아니라 장에 관한 연구에서 널리 사용되지만 다른 많은 응용 프로그램도 있습니다. 예를 들어, 이들 챔버는 낭포성 섬유증, 및 구체적으로 염화물 채널 낭포성 섬유증 막횡단 전도도 조절기 (CFTR)12를 연구하는데 사용되어 왔다. 낭포성 섬유증은 CFTR13의 돌연변이에 의해 발생하며, 이는 호흡기 상피 세포에 의한 염화물 분비 및 유체 수송 장애를 초래하고, 결과적으로 더 두껍고 건조한 점액층14을 초래한다. 기도 상피 CFTR에 대한 연구는 질병을 이해할뿐만 아니라 질병을 치료하는 방법을 발견하기 위해이 챔버로 수행되었습니다. 예를 들어, 낭포성 섬유증을 일으키는 희귀 돌연변이를 가진 환자에서, 환자 호흡 상피 세포의 분석은 오르캄비 및 증폭기 공동요법15와 같은 치료법을 시험하는데 사용되어 왔다.
Ussing chambers는 또한 약물 섭취 및 약물 동태학을 연구하기 위해 인간 생검 조직과 같은 약물 전달 경로를 연구하는 데 사용되었습니다16. 장 흡수가 약물 전달의 유일한 경로는 아닙니다. 이들 챔버는 또한 비강 약물 전달 시스템을 연구하는데 사용되었다17. Ussing 챔버를 이용한 약물 전달 연구도 눈에 대해 수행되었습니다. 토끼 각막에서 투과성 및 흡수 연구는 조직 전반에 걸쳐 약물의 흡수를 증가시키기 위해 고안된 약물 인 Labrasol을 사용하여 수행되었습니다18. 또 다른 연구는 토끼 공막에서 경공막 약물 전달에 대한 벤질 알코늄 클로라이드의 효과를 조사했다19.
Ussing 챔버 방법은 네이티브 조직을 사용할 수 있기 때문에 유용합니다. 이와 같이, Caco-2 세포주와 같은 시험관내 모델보다 바람직하다. 그러나이 기술은 시편을 준비하는 데 기술과 시간이 필요하므로 높은 처리량 응용 분야에는 적합하지 않습니다. 세포 단일층의 전기생리학적 특성은 이들 챔버 내의 세포 배양 삽입물을 사용하여 연구될 수 있다. 최근의 발견은 상피 또는 내피 줄기 세포의 수확으로부터 배양물에서 성장한 미니 기관인 오가노이드의 배양을 허용하였다20. 오가노이드 배양은 단층에서 성장하도록 조작될 수 있고, 이로써 오가노이드를 Ussing 챔버21에 장착할 수 있게 한다. 다양한 상피 및 내피 조직의 오가노이드를 연구 할 수 있으며, 오가노이드 배양이 장기간 유지 될 수 있으므로 필요한 동물의 수를 줄입니다. 이것은 또한 시간이 많이 걸리고 힘든 조직 해부 및 준비 단계가 필요하지 않기 때문에 처리량을 증가시킵니다. 앞으로, Ussing 챔버 연구는 조직 수송을 연구하는 데 매우 유용 할 것이며 개인화 된 의학 분야에서 특히 중요 할 것입니다.
다음 프로토콜은 NaCl의 희석 전위를 측정함으로써 클라우딘 15 녹아웃 (Cldn15-/-) 마우스 및 야생형 (WT) 대조군의 소장에서 팽팽한 접합부의 permselectivity 및 장벽 기능을 평가하기 위한 어싱 챔버 방법의 적용을 입증한다. 타이트한 접합부(TJ)는 둘 이상의 세포가 상피 및 내피 조직에서 만나는 지점에서 형성된다. 이세포 타이트 접합 (bTJ), 특히 bTJ 내에서 발견되는 클라우딘 패밀리 단백질은 TJ7의 장벽 기능 및 투과성을 결정하는 것으로 생각된다. Cldn15-/- 마우스는 메가 소장22 및 클라우딘 154,23,24를 통해 발생하는 장 Na+ 재활용의 손실로 인해 감소된 영양 섭취 능력을 갖는다. Cldn15-/- 마우스는 Na+ 항상성을 손상시켰으며, 이는 TJ의 permselectivity를 연구하는 흥미로운 모델이 된다. 다음 프로토콜은 중간 소장에서 NaCl (PNa / PCl)의 희석 전위를 측정하여 NaCl에 대한 TJ의 투과성을 평가합니다. 간략하게, 멤브레인의 한쪽을 희석함으로써 발생하는 막 전위차의 변화 (M면 또는 S측, 둘 다 아래 프로토콜에서 측정됨)는 Na+ (PNa) 및 Cl-(PCl)의 투과성을 계산하는데 사용될 수 있고, 희석 전위 (PNa/PCl)는 타이트한 접합이 양이온성 또는 음이온성 선택성을 갖는지 여부를 보여줄 것이다.
이 프로토콜의 실험은 장 준비가 수직으로 장착되는 두 개의 반쪽으로 구성된 맞춤형 어싱 챔버 (그림 1A)를 사용하여 수행되었으며, 전압 클램프 증폭기, 전기 레코더, 전극, 소금 다리, 링거 용액, HEPES 버퍼 (150 mM NaCl), 희석 된 HEPES 버퍼 (75 mM NaCl), 장 준비 (장비에 대한 자세한 내용은 재료 표 참조).
프로토콜
이 실험에 사용된 모든 동물은 시즈오카 대학의 동물 보호 시설에서 유지되었으며, 실험은 시즈오카 대학이 정한 동물 연구 지침에 따라 수행되었다. 모든 실험은 시즈오카 대학의 동물 관리 및 사용위원회 (허가 #205272 및 #656-2303)의 승인을 받아 수행되었습니다.
1. NaCl 전극의 제조
참고: 이 실험에 사용된 전극은 농축된 NaCl 또는 KCl로 구성된다. KCl/calomel 전극은 상업적으로 구입합니다. 실험을 시작하기 전에 모든 전극이 농축된 NaCl 또는 KCl 용액으로 상부에 채워져 있는지 확인하십시오.
- 플라스틱 뚜껑이 달린 작은 유리 병을 준비하십시오 (부피 20 mL).
- 플라스틱 뚜껑에 두 개의 구멍을 뚫고, 하나는 NaCl 소금 다리 (직경 2.5mm)이고 다른 하나는 은선 (직경 1mm; 도 1C, NaCl 전극).
- 유리 병을 포화 NaCl 용액으로 채 웁니다 (약 15 mL, 가득 찰 때까지).
- 항아리에 은선(직경 0.8mm, 길이 7cm)을 넣하되 항아리 외부의 와이어 부분을 악어 클립(작은 크기)을 통해 앰프 시스템에 연결할 수 있는지 확인합니다.
- 사용하지 않을 때는 전극을 감싸고 구멍이 건조를 방지하기 위해 파라 필름으로 덮여 있는지 확인하십시오.
2. 소금교량의 제조
참고 : 응고시키기에 충분한 시간을 제공하기 위해 실험 최소 하루 전에 소금 다리를 준비하십시오. 소금 다리는 반복적으로 사용할 수 있지만 2 개월 후에는 사용하지 않는 것이 좋습니다.
- NaCl 소금 다리
- #7 폴리에틸 튜브(외경 2.3 mm, 내경 1.3 mm), 19 G 바늘 및 락형 주사기, 200 mL의 1 M NaCl 용액, 2 g 한천, 소금 브릿지 보관용 밀봉 가능한 플라스틱 용기를 준비한다.
- Ussing 챔버 설치에 필요한 크기로 튜브를 절단하여 적절한 수의 소금 다리를 준비하십시오 (각 챔버에는 두 개의 소금 다리가 필요합니다).
- 한천을 주입하기 전에 튜브로 U 모양을 만들고 따뜻한 물의 비커에 놓습니다 (소금 다리를 설치하기위한 쉬운 모양을 만들기 위해).
- 11.688 g의 NaCl을 탈이온수에 용해시켜 200 mL의 1 M NaCl을 만든다.
- 1 M NaCl을 100 mL 부분으로 분할하십시오: 1 M NaCl에 2% 한천 100 mL를 만듭니다 (NaCl에 2 g 한천을 섞고, 마이크로파로 가열하여 용해시킨다).
- 19G 바늘과 잠금 주사기를 사용하여 주사기를 1 M NaCl / 한천 용액으로 채 웁니다. 부드럽게 방울로 용액을 떨어 뜨리기 시작하고 그렇게하는 동안 바늘을 튜브의 한쪽 끝에 넣고 혼합물이 다른쪽에서 나올 때까지 채 웁니다.
- 용액을 여전히 표현하면서 바늘을 천천히 꺼내고 필요한 모든 소금 다리가 만들어 질 때까지 반복하십시오. (용액이 주사기 또는 바늘에서 응고되면 용액이 다시 발현 될 때까지 뜨거운 물에 잠깐 데우십시오.)
- 소금 브릿지를 점검하여 거품이 없는지 확인하고 밀봉 가능한 용기에 남아있는 1M NaCl 용액에 보관하십시오.
- KCl 소금 다리
참고: 더 얇은 튜브는 KCl 아가 브리지에 사용되어 솔트 브리지 팁이 용해되고 K+가 버퍼로 누출될 수 있으므로 버퍼의 K+ 농도 증가를 방지합니다.- #3 폴리에틸 튜브 (외경 1.0 mm, 내경 0.5 mm), 23 G 바늘 및 잠금 형 주사기, 200 mL의 1 M KCl 용액, 2 g 한천, 소금 브릿지 보관을위한 밀봉 가능한 플라스틱 용기를 준비하십시오.
- Ussing 챔버 설치에 필요한 크기로 튜브를 절단하여 적절한 수의 소금 다리를 준비하십시오 (각 챔버에는 두 개의 소금 다리가 필요합니다).
- 14.91 g의 KCl을 200 mL의 탈이온수에 용해시켜 1 M KCl 200 mL를 만든다.
- 두 개의 100 mL 부분으로 나눕니다 : 1 M KCl에 2 % 한천 100 mL를 만드십시오 (KCl에 2 g 한천을 섞고 전자 레인지에서 가열하여 용해시킵니다).
- 23 G 바늘 및 잠금 주사기를 사용하여, NaCl 염 브릿지와 동일한 방식으로 2% 한천 1 M KCl 혼합물(튜브가 완전히 채워지고 기포가 없는지 확인)으로 튜브를 주입한다.
- 소금 브릿지를 점검하여 거품이 없는지 확인하고 밀봉 가능한 용기에 나머지 1M KCl 용액에 보관하십시오.
3. 링거 용액 및 HEPES 버퍼의 제조
참고: Ussing 챔버에 장착된 조직에 따라 링거 용액의 구성 요소가 다를 수 있습니다. 여기에 제시된 조리법은 소장과 대장에 특정합니다.
- 표 1에 설명된 대로 실험 당일에 링거의 용액을 신선하게 만든다.
- 용액을 95% O2/5% CO2로 버블링하여 조직에 O2를 제공하고 완충 용량을 제공합니다.
| 링거의 용액 (소장) | 링거 용액 (대장) |
| NaHCO3 – 21.0 mM | NaHCO3 – 21.0 mM |
| K2HPO4 – 2.4 밀리세가바이트 | K2HPO4 – 2.4 밀리세가바이트 |
| KH2PO4 – 0.6 밀리세컨드 | KH2PO4 – 0.6 밀리세컨드 |
| NaCl – 119.0 mM | NaCl – 119.0 mM |
| MgCl2 – 1.2 mM | MgCl2 – 1.2 mM |
| CaCl2 – 1.2 mM | CaCl2 – 1.2 mM |
| 인도메타신 – 10 μM (21 mM NaHCO3에 1 mM 스톡을 만들고, 링거 용액 1 L에 10 mL의 스톡을 첨가) | 인도메타신 – 10 μM (21 mM NaHCO3에 1 mM 스톡을 만들고, 링거 용액 1 L에 10 mL의 스톡을 첨가) |
| 1 mM 글루타민 (0.146 g/L) | 10 mM 포도당 |
표 1 : 링거의 솔루션 레시피. 링거의 솔루션을 만들려면 모든 구성 요소를 탈 이온수와 혼합하십시오. 링거의 솔루션은 실험 전에 신선하게 만드는 것이 가장 좋습니다. 사용할 때까지 냉장고 또는 얼음 위에 보관하십시오. 사용하기 전에, 95% O2/5% CO2를 가진 가스.
- 탈이온수에 성분을 혼합하여 표 2 에 기재된 바와 같이 실험 당일에 HEPES 버퍼를 신선하게 만든다.
- pH 조정 후까지 완충액의 최종 부피로 조정하지 마십시오.
- HEPES 완충액을 37°C로 가온하고, 교반하면서 1 M 트리스 용액의 방울을 천천히 첨가하여 pH를 7.4로 조정하였다.
- 적절한 양의 탈이온수를 첨가하여 최종 부피로 조정한다.
| 헤페스 버퍼 | 희석 HEPES 버퍼 |
| 헤페스 – 10 mM | 헤페스 – 10 mM |
| 포도당 – 10 mM (대장) | 포도당 – 10 mM (대장) |
| 1 mM 글루타민 (0.146 g/L) (소장) | 1 mM 글루타민 (0.146 g/L) (소장) |
| NaCl – 150 mM | NaCl – 75 mM + 150 mM 만니톨 (삼투압 차이를 조정하기 위해) |
| MgCl2 – 1 mM | MgCl2 – 1 mM |
| CaCl2 – 2 mM | CaCl2 – 2 mM |
| 인도메타신 – 10 μM (21 mM NaHCO3에 1 mM 스톡을 만들고, 링거 용액 1 L에 10 mL의 스톡을 첨가) | 인도메타신 – 10 μM (21 mM NaHCO3에 1 mM 스톡을 만들고, 링거 용액 1 L에 10 mL의 스톡을 첨가) |
| 1 M 트리스를 사용하여 pH 7.40 (37°C)로 조정 | |
표 2: HEPES 버퍼 레시피. HEPES 버퍼 및 희석 HEPES 버퍼를 만들려면 모든 성분을 탈이온수에 녹입니다. 용액은 1 M Tris 용액으로 pH를 조정해야하므로 전체 부피의 물을 첨가하지 마십시오 (예 : 1L를 만들 때 모든 성분을 약 800mL의 물에 녹입니다). 그 다음 용액을 37°C로 가열하고, pH를 7.4로 조정한 다음, 최종 부피를 조정한다.
4. 어싱 챔버 설정
참고: 이 프로토콜에 사용되는 Ussing 챔버는 맞춤형 연속 관류 챔버입니다. 마우스 장 장벽 기능 또는 영양 섭취를 평가하려면 직경이 4 또는 5mm 개구인 챔버를 권장합니다25(그림 1A-C).
- 가장자리 효과26 을 줄이고 챔버를 밀봉하려면 설치하기 전에 4mm 또는 5mm 구멍 펀치된 파라핀 필름(약 4cm2)을 부착합니다(그림 1B).
- 희석 전위 측정을 위해 개방 회로 조건에서 설정합니다. 현재 클램프 모드로 설정합니다. 출력을 전류로 설정하고 전류 펄스를 ±20μA로 설정합니다.
- 단락 전류 및 경점막 저항의 측정을 위해 단락 조건에서 설정할 때, 전압 클램프 모드로 설정. 출력을 전압으로 설정하고 전압 펄스를 ±5mV로 설정합니다.
- 37°C의 물이 워터 재킷에서 순환하고 있는지 확인하십시오.
- 각 챔버를 링거 용액 또는 HEPES 버퍼로 채우고 (양은 사용 된 시스템에 따라 다르며 여기에 사용 된 챔버는 각 측면에 대해 5 mL가 필요합니다) 누출이 없는지 확인하십시오.
- 소금 다리와 전극을 연결하십시오.
- 전압이 0이고 안정적인 펄스 전류인지 확인하여 염 브리지와 전극이 올바르게 설정되었는지 확인하십시오.
- 시스템 및 링거의 용액 온도가 최소 20분 동안 평형을 이루도록 합니다.
- 평형 후 KCl 전극 간의 비대칭 전압 차이를 수정하고 0으로 변경하여 유체 저항을 보상합니다 (올바른 방법을 결정하는 데 사용되는 Ussing 챔버 시스템의 설명서를 확인하십시오).
5. 장 조직의 해부
참고 : 모든 동물 실험은 국가와 대학이 정한 규정 내에서 수행되어야합니다.
- 장 조직을 복용하기 전에 신선하고 얼음처럼 차가운 링거 용액을 준비하고 95 % O2 및 5 % CO2 로 거품을 15 분 동안 준비하십시오 (3 단계).
- 연구에서 동물의 사용을 규율하는 지침에 따라 마우스를 마취하십시오. 이 실험을 위해, 마우스는 마취제에 의해 투여된 2%-3% 이소플루란으로 마취되었다. 발가락을 꼬집고 통증 반응이 없는지 확인하여 적절한 마취를 확인하십시오.
- 골반에서 횡격막까지 가위로 복부를 절개하십시오. 위를 찾아 위장의 유문 끝을 자릅니다.
- 포셉으로 소장에 부착 된 위 부분을 잡고 장간막 부착물을 자르면서 소장을 부드럽게 당깁니다. 어떤 식 으로든 장 조직을 자르거나 손상시키지 않도록주의하십시오.
- 항문까지 장을 계속 해부하십시오. 대장을 완전히 제거하려면 골반 뼈를 잘라 대장의 원위 부분을 드러내고 부착물을 잘라 장의 나머지 부분을 조심스럽게 제거하십시오.
- 장의 길이를 측정하고 원하는 세그먼트로 나눕니다. 이 실험을 위해 소장을 세 부분으로 나누고 중간 세그먼트를 사용하십시오.
- 원하는 세그먼트를 얼음처럼 차갑고 거품이 많은 링거의 용액에 넣으십시오. 그런 다음 장간막 부착물을 따라 절단하여 각 세그먼트를 세로로 엽니 다. 지방과 결합 조직을 잘라냅니다.
- 세그먼트를 얼음처럼 차가운 링거 용액으로 되돌리고 철저히 씻으십시오 (얼음처럼 차가운 용액에서도 발광 상피의 산소화는 상피 기능을 유지하는 데 중요합니다).
6. 근육층을 벗기고 장내 시트의 준비
참고 : 세로사 (근육층)의 제거는 장을 이용한 수송 연구에 중요합니다. 혈청사가 남아 있는 경우, 장 조직은 전기생리학적 데이터를 왜곡시킬 임의의 근육 수축의 대상이 될 수 있고, 수송이 억제될 수 있다. 제거되지 않은 조직은 Ussing 챔버에 장착 될 때 빠르게 악화되는데, 이는 세로사가 기질과 산소에 대한 중요한 확산 장벽이기 때문입니다. 어떤 특별한 경우에는 근육층을 유지해야 할 수도 있으므로 결정은 연구자와 실험 설계에 달려 있습니다. 장 시트는 어떤 층이 제거되는지에 따라 두 가지 방법으로 준비 할 수 있습니다 (그림 2). 이 실험을 위해서는 점막 및 점막하 제제가 필요합니다 (그림 2, 2 번째 패널).
- 실리콘 고무, 핀(작은 침술 바늘), 5mm 펀치 여과지 및 파라필름 사각형(2cm x 2cm, 다른 시스템에는 필요하지 않을 수 있음)으로 덮인 해부 플레이트(직경 10cm)를 준비합니다.
- 신선하고 얼음처럼 차갑고 거품이 난 링거의 용액을 해부 플레이트에 붓습니다 (조직을 덮기에 충분함, 약 2-3 mL).
- 입체 현미경으로 장 조직의 끝을 고정하십시오 (점막 측면 아래).
- 미세한 포셉을 사용하여 근육층을 하부 점막에서 무뚝뚝하게 해부합니다.
- 찢어지거나 조직에 구멍이 생기지 않도록주의하십시오.
- 근육층이 제거되면 직경 5mm의 개구부를 위해 충분히 큰 조각을 자릅니다. 소장을 준비 할 때, 세로사 - 근육 층의 제거는 이러한 조건 하에서 발광 산소화가 어렵 기 때문에 10 분 이내에 이루어져야합니다.
- 링거 (Ringer)의 용액에 5mm 펀치 된 여과지 사각형을 적시고 점막 하부 제제가 점막 측면으로 자연스럽게 감싸기 때문에 점막 측면을 아래로 향하게하여 장 조직을 놓습니다.
- 개구부가 장 조직으로 완전히 덮여 있고 주름이 없는지 확인하십시오. 준비 아래에 검은 색 보드를 사용하여 개구부가 완전히 덮여 있는지 검사하십시오.
- 필요한 수의 점막 제제에 대해이 절차를 반복하십시오 (이 실험에서는 두 가지 준비가 필요합니다 : 한 가지 제제는 희석 전위를 측정하는 데 사용되고 다른 제제는 기준선 전기 매개 변수를 측정하는 데 사용됩니다).
7. Ussing 챔버에 장 준비 장착
참고: 설정은 Ussing 챔버 시스템 및 사용되는 레코딩 시스템의 유형에 따라 다릅니다.
- Ussing 챔버에서 링거의 용액/HEPES 버퍼를 흡입합니다.
- Ussing 챔버를 분해하고 장내 준비 점막 측면이있는 여과지를 점막 측면 챔버에 내려 놓고 챔버의 창이 여과지의 구멍과 정렬되도록 조정하십시오 (그림 1A, 챔버 창 주위의 검은 색 표시는 준비물의 정렬에 유용합니다).
- 조심스럽게 Serosal 측면 챔버를 점막 측면 챔버에 놓고 단단히 닫지 만 연결 중에 장 시트가 움직이지 않았는지 확인하십시오.
- 링거의 용액 또는 HEPES 버퍼로 두 챔버를 신속하게 리필하고 버블링 지팡이를 배치하십시오 (링거의 솔루션 : 95 % O2 / 5 % CO2; HEPES 버퍼 : 100 % O2) 챔버의 반대쪽 끝에서, 멤브레인으로부터 멀리 떨어져 있습니다 (준비에 너무 가깝게 버블링하면 측정에 영향을 줄 수 있음).
- 솔트 브리지를 다시 연결하고 전압이 안정적인지 펄스 전류인지 확인하여 연결이 정상인지 확인합니다(그림 1C).
- 각 장 준비에 대해 반복하십시오.
- 시스템이 약 15 분 동안 평형을 이루도록하십시오. 기록 시스템을 사용하는 경우 실험을 시작하기 전에 컨덕턴스와 Isc/멤브레인 전위차를 안정화시키십시오.
8. 희석 전위 실험 (개방 회로 조건)
- HEPES 버퍼를 흡입하고 5 mL의 신선한 미리 가온된 HEPES 버퍼를 양쪽에 첨가하여 챔버의 양면을 세척하십시오.
- 녹화 시스템을 켭니다. 범위를 250mV로 설정하고(여기에 사용된 시스템은 출력 전압 10x를 증폭), 마커 위치를 설정하고, 측정할 레코딩 시스템을 설정합니다.
- Ussing 챔버 시스템을 클램프 모드로 전환하고 측정을 시작합니다. 막 전위가 안정화되면 (~ 15-20 분), 평가를 시작할 수 있습니다.
- 점막 측으로부터 HEPES 완충액을 흡입하고, 75 mM NaCl을 함유하는 5 mL의 가온 희석 HEPES 완충액으로 신속하게 교체한다.
- 막 전위가 최고조에 달하면 (5-10 분), "점막"측면에서 희석 완충액을 제거하고 HEPES 버퍼로 교체하십시오.
- 필요한 경우 혈청 측에 대해 3 단계를 반복하고 희석 HEPES 버퍼를 혈청 측에 첨가하십시오.
- 조직이 생존 가능한지 확인하기 위해, 아데닐레이트 사이클라제 활성화제 포스콜린 (최종 농도 10 μM)을 혈청 측에 첨가한다.
- 멤브레인 전위차가 최고점에 도달하고 감소하기 시작하면 실험은 끝났습니다.
9. 경상피 전기 전도도 및 기준선 Isc의 측정 (단락 조건)
- 링거 용액을 흡입하고 신선한 버블 링거 용액 5 mL를 양쪽에 첨가하여 챔버의 양쪽을 씻으십시오.
- 녹화 시스템을 켭니다. 범위를 2.5V로 설정하고(여기에 사용된 시스템은 출력 전압 10x를 증폭), 마커 위치를 설정하고, 측정할 기록 시스템을 설정합니다.
- Ussing 챔버 시스템을 클램프 모드로 전환하고 측정을 시작하십시오. 일단 Isc 와 컨덕턴스가 안정화되면(~15-20분), 기준선 측정이 얻어질 수 있다.
- 조직이 생존 가능한지 확인하기 위해, 아데닐레이트 사이클라제 활성화제 포스콜린 (최종 농도 10 μM)을 혈청 측에 첨가한다.
- 멤브레인 전위차가 최고점에 도달하고 감소하기 시작하면 실험이 완료됩니다.
10. 결과 분석
- 개방 회로 조건에서 옴의 법칙에 따라 전류 펄스에 대한 응답으로 전압의 변화로부터 경점막 전도도를 계산하십시오. 옴의 법칙을 적용하는 경점막 전압과 컨덕턴스로부터 등가 단락 전류(Isc)를 결정한다.
- Goldman-Hodgkin-Katz 방정식 10을 사용하여 상대 이온 선택도(PNa/PCl)를 계산하기 위해 NaCl의 희석 전위를 사용하십시오.
- Kimizuka-Koketsu equation11을 사용하여 각 이온에 대한 타이트한 접합부의 절대 선택도를 추정한다.
- 희석 전위로부터 Goldman-Hodgkin-Katz 방정식을 사용하여 PNa / PCl을 계산하고 Yu et al.10에 의해 설명 된 Kimizuka-Koketsu 방정식에서 절대 투과도 PNa 및 PCl을 다음과 같이 결정하십시오.
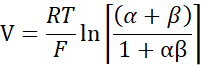

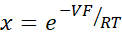

여기서, V: 희석전위(mV); α : 활동 비율. HEPES 완충액에서 NaCl의 계산된 활성을 희석된 HEPES 완충액에서의 NaCl의 계산된 활성으로 나눈 값(본 실험의 경우 1.8966으로 계산됨); e: 수학 상수, 2.71828; GM : 경점막 전도도 (mS / cm2); F: 패러데이 상수 (96,485.3329 C/mol); R: 가스 상수 (8.314 J/mol K); T: 온도 (310.15 K)
결과
이 백서에 표시된 결과는 완료된 더 큰 프로젝트의 일부인 결과입니다(ref.4,23,24 참조).
소장의 경상피 전기 전도도는 Cldn15-/- 마우스에서 감소된다.
Cldn15-/- 마우스에서 중간 소장 세그먼트의 기준선 경점막 전도도(단락 조?...
토론
이 실험에서, Ussing 챔버는 Cldn15-/- 및 WT 마우스의 소장에서 NaCl의 기준선 전기 파라미터 및 희석 전위를 측정하기 위해 사용되었다. Ussing 챔버 실험을 수행 할 때 실험에 사용 된 멤브레인 준비가 실행 가능한지 확인하는 것이 매우 중요합니다. 이것은 일반적으로 포도당 또는 아데닐레이트 사이클라제 활성화제 포스콜린을 첨가하고 Isc (마우스에서 100-300 μA / cm2
공개
저자는 공개 할 잠재적 인 이해 상충이 없습니다.
감사의 말
이 작업은 17K00860(HH로) 및 19K20152(NI로)에서 지원됩니다. WH는 오츠카 도시미 장학금 재단이 2018-2021 년의 재정 지원을 인정하고자합니다.
자료
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
참고문헌
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907 (2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032 (2018).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. V. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, 1-19 (2017).
- Östh, K. . The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703 (2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376 (2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유