Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Doğal Dokuda İntestinal Sıkı Bileşke Bariyeri ve İyon Geçirgenliğinin Ussing Oda Tekniği ile Fonksiyonel Olarak Değerlendirilmesi
Bu Makalede
Özet
Bağırsak epiteli sadece besin emilimini değil, aynı zamanda zararlı maddelere karşı koruma sağlar. Apikal-en epitelyal hücreler arası bileşke, yani sıkı bileşke, parasellüler çözünen ve iyon geçirgenliğini düzenler. Burada, mukozal tabakaların hazırlanması ve Ussing oda tekniği kullanılarak sıkı bağlantıların iyon seçiciliğinin değerlendirilmesi için bir protokol açıklanmaktadır.
Özet
Ussing oda tekniği ilk olarak 1951 yılında Danimarkalı bilim adamı Hans Ussing tarafından sodyumun kurbağa derisi boyunca hücre ötesi taşınmasını incelemek için icat edildi. O zamandan beri, bu teknik, membranlar arasında taşımanın fizyolojik parametrelerini incelemek için birçok farklı dokuya uygulanmıştır. Ussing odası yöntemi diğer yöntemlere göre tercih edilir, çünkü doğal doku kullanılabilir, bu da onu in vivo olanlara daha uygulanabilir hale getirir. Bununla birlikte, doğal doku kullanıldığından, verim düşüktür, zaman sınırlıdır ve doku hazırlığı beceri ve eğitim gerektirir. Bu odalar, çeşitli dokulardaki spesifik taşıyıcı proteinleri incelemek, Kistik Fibrozis gibi hastalık patofizyolojisini anlamak, ilaç taşınmasını ve alımını incelemek ve özellikle bağırsakta besin taşınmasının anlaşılmasına katkıda bulunmak için kullanılmıştır. Bir dokunun tüm epitel taşıma süreci göz önüne alındığında, sadece transepitelyal yollar değil, aynı zamanda parasellüler yollar da önemlidir. Sıkı kavşaklar, bağırsak boyunca dokuya özgü parasellüler geçirgenliğin önemli bir belirleyicisidir. Bu makalede, transepitelyal iletkenlik ve seyreltme potansiyellerini ölçerek iyonların parasellüler geçirgenliğini değerlendirmek için Ussing odası tekniği kullanılacaktır.
Giriş
Ussing odası yöntemi ilk olarak Danimarkalı bilim adamı Hans Ussing tarafından geliştirilmiştir. Ussing, NaCl'nin dik bir konsantrasyon gradyanına karşı cilt boyunca taşınabileceği gözlemlendikten sonra kurbağa derisi boyunca sodyum taşınmasının kısa devre akımını ölçmek için ilk kez kullandı1. Sistemi, cildin her iki tarafına erişimi olan iki oda arasına monte edilmiş kurbağa derisinden oluşuyordu. Her oda, dolaşıma sokulan ve havalandırılan Ringer çözeltisini içeriyordu. Cildin yakınında bulunan ve doymuş KCl-calomel elektrotlarına bağlı iki dar agar zil köprüsü, bir potansiyelleştirici tarafından okunduğu gibi potansiyel farkı ölçtü. İkinci bir çift agar zil köprüsü, bir batarya tarafından sağlanan bir elektromotor kuvveti uygulamak için AgCl ile doymuş KCl'ye sahip beherlere bağlı her odanın karşı ucuna yerleştirildi. Voltajı ayarlamak için potansiyel bir bölücü kullanıldı, böylece cilt boyunca potansiyel fark sıfır kaldı ve böylece kısa devre koşulları yaratıldı. Deriden geçen akımı okumak için bir mikroamper metre de bağlandı (orijinal oda tasarımı için ref.1'deki şekle bakın).
Son 70 yılda, bu teknik, besin ve iyon taşınımını incelemek için birçok farklı dokuya, özellikle bağırsak dokusuna uygulanmıştır. Örneğin, kolera kaynaklı ishalin mekanizması bu odalara tavşan ileum monte edilerek incelenmiş ve kolera toksinine bağlı ishale cAMP2 aracılık ettiği bulunmuştur. Ek olarak, bu odalar ayrıca Na +-Glikoz kotransporter 1 (SGLT1) 3 aracılığıyla glikoz taşınmasının altında yatan mekanizmayı incelemek için de kullanılmıştır. Laboratuvarımız intestinal epitel hücrelerinde transsellüler ve parasellüler transporta odaklanmaktadır. Ussing odası yöntemi kullanılarak, hidrolize edilemeyen dipeptid glisilsarkozinin emilimini ölçmek için Ussing odaları kullanılarak, parasellüler sodyum taşınımını bozan Claudin 15 nakavt farelerinde peptid taşınması değerlendirildi. Luminal Na+ homeostazının proton kuplajlı peptid transportu için önemli olduğu bulunmuştur4. Ek olarak, bu odalar ayrıca serin proteaz tripsin5 tarafından proteinaz aktive edilmiş reseptör 1'in submukozal aktivasyonuna yanıt olarak murin çekumdaki anyon sekresyonunu araştırmak için de kullanılmıştır.
Ussing odaları son zamanlarda epitel dokusundaki parasellüler yolları değerlendirmek için de kullanılmaktadır. Parasellüler yollar, iki veya daha fazla hücrenin buluştuğu noktada oluşan protein kompleksleri olan sıkı kavşaklarla düzenlenir6. Bariyer fonksiyonu ve iyon seçiciliği (anyonların veya katyonların seçici olarak sıkı kavşaktan geçip geçemeyeceği), claudin ailesi proteinlerinin varlığı ile belirlenir; bazıları bariyer görevi görür (claudin 3 ve 7), anyon gözenekleri (claudin 10a) veya katyon gözenekleri (claudin 2, 10b ve 15)7. Parasellüler yolu değerlendirmek için, kan plazması FITC konsantrasyonu8 veya EDTA-Cr9 eşliğinde FITC'nin oral gavajı gibi diğer yöntemler kullanılmıştır; Bununla birlikte, bu teknikler daha düşük çözünürlüktedir ve iyon seçiciliğini veya bağırsak sistemi bölümlerinin belirli bir bölümünü değerlendiremez. Bununla birlikte, ussing odaları, hedef iyonların seyreltme potansiyelini değerlendirmek ve bu nedenle sıkı bağlantıların iyon seçiciliğini belirlemek için kullanılabilir. Örneğin, NaCl ile, Na + ve Cl- için sıkı bağlantıların seçiciliği, membranın bir tarafının (genellikle mukozal taraf) seyreltilmesi ve transepitelyal potansiyel farkındaki değişimin ölçülmesiyle hesaplanabilir. Na+ ve Cl- bağıl geçirgenlikleri Goldman-Hodgkin-Katz denklemi10 ile tahmin edilebilir ve sıkı bağlantının seçiciliği Kimizuka-Koketsu denklemi11 kullanılarak tahmin edilebilir. Bu nedenle, bu odalar, dokunun elektrofizyolojik parametrelerini ölçme avantajına sahiptir ve sonuç olarak, iyonların sıkı bağlantılardan geçişi hakkında diğer düşük çözünürlüklü yöntemlerden daha fazla bilgi sağlar.
Ussing odası yöntemi sadece bağırsak sistemi ile sınırlı değildir, bağırsakla ilgili çalışmalarda yaygın olarak kullanılmasına rağmen, başka birçok uygulaması da vardır. Örneğin, bu odalar Kistik Fibrozis'i ve özellikle klorür kanalı kistik fibroz transmembran iletkenlik regülatörünü (CFTR) incelemek için kullanılmıştır12. Kistik Fibrozis, CFTR13'teki bir mutasyondan kaynaklanır, bu da bozulmuş klorür sekresyonu ve solunum epitel hücreleri tarafından sıvı taşınması ve bunun sonucunda daha kalın, daha kuru bir mukoza tabakası ile sonuçlanır14. Hava yolu epitelyal CFTR'nin incelenmesi, sadece hastalığı anlamak için değil, aynı zamanda hastalığı tedavi etmenin yollarını keşfetmek için bu odalarla gerçekleştirilmiştir. Örneğin, Kistik Fibrozise neden olan nadir mutasyonları olan hastalarda, Orkambi ve bir amplifikatör ko-terapisi gibi tedavileri test etmek için hasta solunum epitel hücrelerinin analizi kullanılmıştır15.
Ussing odaları, ilaç alımını ve farmakokinetiği incelemek için insan biyopsi dokusu gibi ilaç dağıtım yollarını incelemek için de kullanılmıştır16. Bağırsak alımı, ilaç dağıtımının tek yolu değildir. Bu odalar ayrıca nazal ilaç dağıtım sistemlerini incelemek için de kullanılmıştır17. Göz için Ussing odaları ile ilaç dağıtım çalışmaları da yapılmıştır. Tavşan korneasında, ilaçların dokular arasında emilimini artırmak için tasarlanmış bir ilaç olan Labrasol ile geçirgenlik ve alım çalışmaları yapılmıştır18. Başka bir çalışmada, benzilalkonyum klorürün tavşan sklerasında transskleral ilaç dağıtımı üzerindeki etkisi incelenmiştir19.
Ussing odası yöntemi yararlıdır çünkü doğal doku kullanılabilir. Bu nedenle, Caco-2 hücre hatları gibi in vitro modellere göre tercih edilir. Bununla birlikte, teknik numuneleri hazırlamak için beceri ve zaman gerektirir, bu nedenle yüksek verimli uygulamalar için uygun değildir. Hücre monokatmanlarının elektrofizyolojik özellikleri, bu odalardaki hücre kültürü ekleri kullanılarak incelenebilir. Son keşifler, epitel veya endotel kök hücrelerinin toplanmasından kültürde yetiştirilen mini organlar olan organoidlerin kültürüne izin vermiştir20. Organoid kültürü, tek katmanlı olarak yetiştirilmek üzere manipüle edilebilir, böylece organoidlerin bir Ussing odasına monte edilmesini mümkün kılar21. Çeşitli epitel ve endotel dokularının organoidleri incelenebilir, bu da organoid kültür uzun vadede korunabileceğinden, gerekli hayvan sayısını azaltır. Bu aynı zamanda zaman alıcı ve zahmetli doku diseksiyonu ve hazırlık adımlarına ihtiyaç duyulmayacağından verimi de artıracaktır. Gelecekte, Ussing odası çalışmaları doku naklini incelemek için çok yararlı olmaya devam edecek ve özellikle kişiselleştirilmiş tıp alanında önemli olacaktır.
Aşağıdaki protokol, NaCl'nin seyreltme potansiyelini ölçerek Claudin 15 nakavt (Cldn15-/-) farelerinin ve vahşi tip (WT) kontrollerin ince bağırsağındaki sıkı bağlantıların geçirgenlik ve bariyer fonksiyonunu değerlendirmek için Ussing odası yönteminin uygulanmasını göstermektedir. Epitel ve endotel dokusunda iki veya daha fazla hücrenin buluştuğu noktada sıkı kavşaklar (TJ) oluşur. İki hücreli sıkı kavşakların (bTJ), özellikle bTJ içinde bulunan claudin ailesi proteinlerinin, TJ7'nin bariyer fonksiyonunu ve permselectivity'sini belirlediği düşünülmektedir. Cldn15-/- fareler mega ince bağırsağa22 sahiptir ve claudin 154,23,24 yoluyla meydana gelen bağırsak Na + geri dönüşümünün kaybı nedeniyle besin alım kabiliyeti azalır. Cldn15-/- fareler Na + homeostazını bozmuştur, bu da onları TJ'nin geçirgenliğini incelemek için ilginç bir model haline getirmektedir. Aşağıdaki protokol, orta ince bağırsaktaki NaCl'nin (PNa / PCl) seyreltme potansiyelini ölçerek TJ'nin NaCl'ye geçirgenliğini değerlendirir. Kısaca, membranın bir tarafının seyreltilmesiyle ortaya çıkan membran potansiyel farkındaki değişim (M tarafı veya S tarafı, her ikisi de aşağıdaki protokolde ölçülmüştür), Na + (PNa) ve Cl- (PCl) geçirgenliğini hesaplamak için kullanılabilir ve seyreltme potansiyeli (PNa / PCl), sıkı bağlantının katyonik veya anyonik bir seçiciliğe sahip olup olmadığını gösterecektir.
Bu protokoldeki deneyler, bağırsak preparatının dikey olarak monte edildiği iki yarıdan oluşan özelleştirilmiş bir Ussing odası (Şekil 1A), voltaj kelepçesi amplifikatörü, elektrik kaydedici, elektrotlar, tuz köprüleri, Ringer çözeltisi, HEPES tamponu (150 mM NaCl), seyreltilmiş HEPES tamponu (75 mM NaCl), bağırsak hazırlığı (ekipman hakkında ayrıntılar için Malzeme Tablosuna bakınız) kullanılarak gerçekleştirilmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu deneylerde kullanılan tüm hayvanlar Shizuoka Üniversitesi'ndeki hayvan bakım tesisinde tutuldu ve deneyler Shizuoka Üniversitesi tarafından belirlenen hayvan araştırmaları kılavuzlarına göre gerçekleştirildi. Tüm deneyler, Shizuoka Üniversitesi'ndeki Hayvan Bakım ve Kullanım Komitesi'nin onayıyla gerçekleştirildi (İzinler #205272 ve #656-2303).
1. NaCl elektrotlarının hazırlanması
NOT: Bu deneylerde kullanılan elektrotlar konsantre NaCl veya KCl'den oluşur. KCl/calomel elektrotları ticari olarak satın alınmaktadır. Deneye başlamadan önce, tüm elektrotların konsantre NaCl veya KCl çözeltisi ile en üste kadar doldurulduğundan emin olun.
- Plastik kapaklı küçük cam kavanozlar hazırlayın (hacim 20 mL).
- Plastik kapaklarda, biri NaCl tuz köprüsü (2,5 mm çaplı), diğeri gümüş tel (1 mm çap; Şekil 1C, NaCl elektrodu).
- Cam kavanozu doymuş NaCl çözeltisi ile doldurun (dolana kadar yaklaşık 15 mL).
- Kavanozun içine gümüş tel (0,8 mm çaplı, 7 cm uzunluğunda) yerleştirin, ancak kavanozun dışındaki tel kısmının timsah klipsleri (küçük boyutlu) aracılığıyla amplifikatör sistemine bağlanabildiğinden emin olun.
- Kullanılmadığında, elektrotları sarın ve kurumayı önlemek için deliklerin parafilm ile kaplandığından emin olun.
2. Tuz köprülerinin hazırlanması
NOT: Katılaşmak için yeterli zaman sağlamak üzere deneyden en az bir gün önce tuz köprüleri hazırlayın. Tuz köprüleri tekrar tekrar kullanılabilir ancak 2 ay sonra kullanılması önerilmez.
- NaCl tuz köprüleri
- #7 polietil boru (dış çap 2,3 mm, iç çap 1,3 mm), 19 G iğne ve kilit tipi şırınga, 200 mL 1 M NaCl çözeltisi, 2 g agar, tuz köprüsü depolaması için kapatılabilir plastik kap hazırlayın.
- Ussing odası kurulumu için gerekli boyuta kadar boruyu keserek uygun sayıda tuz köprüsü hazırlayın (her oda iki tuz köprüsü gerektirir).
- Agar enjeksiyonundan önce, tüplerle bir U şekli yapın ve bunları ılık su kabına yerleştirin (tuz köprüleri kurmak için kolay bir şekil oluşturmak için).
- 11.688 g NaCl'yi 200 mL'de deiyonize suda çözerek 200 mL 1 M NaCl yapın.
- 1 M NaCl'yi 100 mL'lik porsiyonlara bölün: 1 M NaCl'de 100 mL'lik %2 agar yapın (NaCl'de 2 g agar karıştırın, çözünmesi için mikrodalgada ısıtın).
- 19 G'lık bir iğne ve kilitleme şırıngası kullanarak, şırıngayı 1 M NaCl / agar çözeltisi ile doldurun. Çözeltiyi damla damla atmaya yavaşça başlayın ve bunu yaparken iğneyi tüpün bir ucuna yerleştirin ve karışım diğer taraftan çıkana kadar doldurun.
- Çözeltiyi ifade ederken iğneyi yavaşça geri çekin ve gerekli tüm tuz köprüleri yapılana kadar tekrarlayın. (Çözelti şırıngada veya iğnede katılaşırsa, çözelti tekrar ifade edilene kadar sıcak suda kısaca ısıtın.)
- Kabarcık olmadığından emin olmak için tuz köprülerini kontrol edin ve kalan 1 M NaCl çözeltisini kapatılabilir bir kapta saklayın.
- KCl tuz köprüleri
NOT: Tuz köprüsü uçları çözülebildiğinden ve K+ tampona sızabildiğinden, tampondaki K+ konsantrasyonunun artmasını önlemek için KCl agar köprüleri için daha ince borular kullanılır.- #3 polietil boru (dış çap 1.0 mm, iç çap 0.5 mm), 23 G iğne ve kilit tipi şırınga, 200 mL 1 M KCl çözeltisi, 2 g agar, tuz köprüsü depolaması için kapatılabilir plastik kap hazırlayın.
- Boruyu Ussing odası kurulumu için gerekli boyuta kadar keserek uygun sayıda tuz köprüsü hazırlayın (her oda iki tuz köprüsü gerektirir).
- 200 mL deiyonize suda 14.91 g KCl'yi çözerek 200 mL 1 M KCl yapın.
- İki 100 mL porsiyona bölün: 1 M KCl'de 100 mL% 2 agar yapın (KCl'de 2 g agar karıştırın, çözünmesi için bir mikrodalgada ısıtın).
- 23 G'lik bir iğne ve kilitleme şırıngası kullanarak, NaCl tuz köprülerinde olduğu gibi% 2 agar 1 M KCl karışımı (tüplerin tamamen dolu olduğundan ve kabarcık olmadığından emin olun) ile boru enjekte edin.
- Kabarcık olmadığından emin olmak için tuz köprülerini kontrol edin ve kalan 1 M KCl çözeltisinde kapatılabilir bir kapta saklayın.
3. Ringer çözeltisinin ve HEPES tamponunun hazırlanması
NOT: Ussing odasına monte edilen dokuya bağlı olarak, Ringer çözeltisinin bileşenleri farklı olabilir. Burada sunulan tarifler ince ve kalın bağırsaklara özgüdür.
- Ringer'ın çözeltisini Tablo 1'de açıklandığı gibi deneylerin yapıldığı gün taze yapın.
- Dokuya O2 ve tamponlama kapasitesi sağlamak için çözeltiyi %95 O2/%5 CO2 ile kabarcıklayın.
| Ringer çözeltisi (ince Bağırsak) | Ringer çözeltisi (kalın bağırsak) |
| NaHCO3 – 21,0 mM | NaHCO3 – 21,0 mM |
| K2HPO4 – 2,4 mM | K2HPO4 – 2,4 mM |
| KH2PO4 – 0,6 mM | KH2PO4 – 0,6 mM |
| NaCl – 119.0 mM | NaCl – 119.0 mM |
| MgCl2 – 1.2 mM | MgCl2 – 1.2 mM |
| CaCl2 – 1,2 mM | CaCl2 – 1,2 mM |
| Indometazin – 10 μM (21 mM NaHCO3'te 1 mM stok yapın, 1 L Ringer çözeltisi için 10 mL stok ekleyin) | Indometazin – 10 μM (21 mM NaHCO3'te 1 mM stok yapın, 1 L Ringer çözeltisi için 10 mL stok ekleyin) |
| 1 mM Glutamin (0,146 g/L) | 10 mM Glikoz |
Tablo 1: Ringer'ın Çözüm Tarifi. Ringer çözeltisini yapmak için, tüm bileşenleri deiyonize su ile karıştırın. Ringer'ın çözümü en iyi deneylerden önce taze yapılır. Kullanana kadar buzdolabında veya buzda saklayın. Kullanmadan önce,% 95 O2 / % 5 CO2 ile gaz.
- HEPES tamponunu, deney gününde, Tablo 2'de açıklandığı gibi, bileşenleri deiyonize suda karıştırarak taze yapın.
- pH ayarından sonraya kadar tamponun son hacmine ayarlamayın.
- HEPES tamponunu 37 °C'ye ısıtın ve karıştırırken yavaşça 1 M Tris çözeltisi damlaları ekleyerek pH'ı 7,4'e ayarlayın.
- Uygun miktarda deiyonize su ekleyerek son hacme ayarlayın.
| HEPES Tampon | Seyreltme HEPES Tamponu |
| HEPES – 10 mM | HEPES – 10 mM |
| Glikoz – 10 mM (Kalın bağırsak) | Glikoz – 10 mM (Kalın bağırsak) |
| 1 mM Glutamin (0.146 g/L) (İnce bağırsak) | 1 mM Glutamin (0.146 g/L) (İnce bağırsak) |
| NaCl – 150 mM | NaCl – 75 mM + 150 mM mannitol (ozmolalite farklılıklarını ayarlamak için) |
| MgCl2 – 1 mM | MgCl2 – 1 mM |
| CaCl2 – 2 mM | CaCl2 – 2 mM |
| Indometazin – 10 μM (21 mM NaHCO3'te 1 mM stok yapın, 1 L Zil Çözeltisi için 10 mL stok ekleyin) | Indometazin – 10 μM (21 mM NaHCO3'te 1 mM stok yapın, 1 L Zil Çözeltisi için 10 mL stok ekleyin) |
| 1 M Tris kullanarak pH 7,40'a (37°C) ayarlayın | |
Tablo 2: HEPES Tampon Tarifi. HEPES tamponu ve seyreltme HEPES tamponu yapmak için, tüm bileşenleri deiyonize suda çözün. Çözeltiler 1 M Tris çözeltisi ile pH ayarlı olmalıdır, bu nedenle tam miktarda su eklemeyin (örneğin, 1 L yaparken, tüm bileşenleri yaklaşık 800 mL suda çözün). Daha sonra çözeltiyi 37 ° C'ye ısıtın, pH'ı 7.4'e ayarlayın ve ardından son ses seviyesini ayarlayın.
4. Ussing odası kurulumu
NOT: Bu protokolde kullanılan Ussing odaları, özel yapım sürekli perfüzyon odalarıdır. Fare bağırsak bariyeri fonksiyonunu veya besin alımını değerlendirmek için, 4 veya 5 mm çapında bir açıklığa sahip odalar önerilir25 (Şekil 1A-C).
- Kenar etkisini26 azaltmak ve haznelerin sızdırmazlığına yardımcı olmak için, kurulumdan önce 4 veya 5 mm delik delikli parafin filmi (yaklaşık 4 cm2) takın (Şekil 1B).
- Seyreltme potansiyeli ölçümü için açık devre koşullarında ayarlayın. Geçerli kelepçe modunda ayarlayın. Çıkışı akım olarak ayarlayın ve akım darbesini ±20 μA olarak ayarlayın.
- Kısa devre akımı ve transmukozal direncin ölçülmesi için kısa devre koşullarında kurulum yaparken, voltaj kelepçesi modunda ayarlayın. Çıkışı voltaj olarak ayarlayın ve voltaj darbesini ±5 mV'ye ayarlayın.
- Su ceketinde 37 °C su sirkülasyonu olduğundan emin olun.
- Her odayı Ringer çözeltisi veya HEPES tamponu ile doldurun (miktar kullanılan sisteme bağlıdır, burada kullanılan odalar her iki taraf için 5 mL gerektirir) ve sızıntı olmadığından emin olun.
- Tuz köprülerini ve elektrotları bağlayın.
- Tuz köprülerinin ve elektrotların doğru şekilde ayarlandığından emin olmak için voltajın 0 ve kararlı, darbe akımı olduğundan emin olun.
- Sistem ve Ringer'ın çözelti sıcaklığının en az 20 dakika boyunca dengelenmesine izin verin.
- Dengelemeden sonra, KCl elektrotları arasındaki asimetrik voltaj farkını düzeltin ve sıfıra değiştirerek sıvı direncini telafi edin (doğru yolu belirlemek için kullanılan Ussing oda sisteminin kılavuzunu kontrol edin).
5. Bağırsak dokusunun diseksiyonu
NOT: Tüm hayvan deneyleri, ülke ve üniversite tarafından belirlenen düzenlemeler çerçevesinde gerçekleştirilmelidir.
- Bağırsak dokusunu almadan önce, taze, buz gibi soğuk Ringer çözeltisini hazırlayın ve 15 dakika boyunca% 95 O2 ve% 5 CO2 ile kabarcık hazırlayın (adım 3).
- Fareleri, araştırmada hayvanların kullanımını düzenleyen kılavuzlara göre anestezi yapın. Bu deney için, fareler bir anestezi uzmanı tarafından uygulanan% 2-3 izofluran ile uyuşturuldu. Ayak parmaklarını sıkıştırarak ve ağrı yanıtı olmadığından emin olarak uygun anesteziyi kontrol edin.
- Karında pelvisten diyaframa makasla bir kesi yapın; mideyi bulun ve midenin pilorik ucunu kesin.
- İnce bağırsağa bağlı mide kısmını forseps ile tutun ve mezenterik ekleri keserken ince bağırsağı yavaşça çekin. Bağırsak dokusunu hiçbir şekilde kesmemeye veya zarar vermemeye dikkat edin.
- Bağırsağı anüse kadar diseke etmeye devam edin. Kalın bağırsağın tamamen çıkarılması için, kalın bağırsağın distal kısmını ortaya çıkarmak için pelvik kemikleri kesin ve ekleri keserek bağırsağın geri kalanını dikkatlice çıkarın.
- Bağırsağın uzunluğunu ölçün ve istenen bölümlere bölün. Bu deney için ince bağırsağı üç bölüme ayırın ve orta segmenti kullanın.
- İstenilen segmentleri buz gibi soğuk, kabarcıklı Ringer çözeltisine yerleştirin; daha sonra, mezenterik ataşmanları keserek her bir segmenti uzunlamasına açın. Yağ ve bağ dokusunu kesin.
- Segmentleri buz gibi soğuk Ringer çözeltisine geri döndürün ve iyice yıkayın (buz gibi soğuk çözeltide bile, luminal epitelin oksijenlenmesi epitel fonksiyonunu korumak için önemlidir).
6. Kas tabakasının soyulması ve bağırsak tabakasının hazırlanması
NOT: Serosa'nın (kas tabakası) çıkarılması, bağırsak kullanılarak yapılan taşıma çalışmaları için önemlidir. Serosa kalırsa, bağırsak dokusu elektrofizyolojik verileri bozacak rastgele kas kasılmalarına maruz kalabilir ve taşıma engellenebilir. Soyulmamış doku, Ussing odalarına monte edildiğinde hızla bozulur, çünkü seroza substrat ve oksijen için önemli bir difüzyon bariyeridir. Bazı özel durumlarda, kas tabakasını korumak gerekebilir, bu nedenle karar araştırmacıya ve deneysel tasarıma bağlıdır. Bağırsak tabakaları hangi tabakanın çıkarıldığına bağlı olarak iki şekilde hazırlanabilir (Şekil 2). Bu deney için mukoza ve submukozal preparatlar gereklidir (Şekil 2, 2. panel).
- Silikon kauçuk, pimler (küçük akupunktur iğneleri), 5 mm delikli filtre kağıdı ve parafilm kareleri (2 cm x 2 cm; diğer sistemler için gerekli olmayabilir) ile kaplı diseksiyon plakaları (10 cm çapında) hazırlayın.
- Taze, buz gibi soğuk, kabarcıklı Ringer çözeltisini diseksiyon plakasına dökün (dokuyu örtmek için yeterli, yaklaşık 2-3 mL).
- Bir stereomikroskop altında, bağırsak dokusunun uçlarını sabitleyin (mukozal tarafı aşağı).
- İnce forseps kullanarak, kas tabakasını altta yatan mukozadan açıkça diseke edin.
- Dokuya herhangi bir delik açmamaya veya yırtmamaya dikkat edin.
- Kas tabakası çıkarıldıktan sonra, 5 mm çapında bir açıklık için yeterince büyük bir parça kesin. İnce bağırsağı hazırlarken, serosa-kas tabakasının çıkarılması 10 dakika içinde yapılmalıdır, çünkü bu koşullar altında luminal oksijenasyon zordur.
- Islak 5 mm delikli filtre kağıdı Ringer çözeltisinde kare ve bağırsak dokusunu mukozal tarafı aşağı doğru olacak şekilde üzerine yerleştirin, çünkü submukozal preparatlar kendiliğinden mukozal tarafı dışarıda olacak şekilde sarılır.
- Açıklığın bağırsak dokusu tarafından tamamen kaplandığından ve kırışıklık olmadığından emin olun. Açıklığın tamamen örtülü olup olmadığını incelemek için preparatın altında siyah bir tahta kullanın.
- Gerekli sayıda mukozal preparat için bu prosedürü tekrarlayın (bu deneyde iki preparat gereklidir: bir preparat seyreltme potansiyelini ölçmek için kullanılacak, diğeri ise temel elektriksel parametreleri ölçmek için kullanılacaktır).
7. Ussing odalarına bağırsak preparatlarının monte edilmesi
NOT: Kurulum, Ussing oda sisteminin türüne ve kullanılan kayıt sistemine bağlı olacaktır.
- Ringer'ın solüsyon/HEPES tamponunu Ussing odasından emiş.
- Ussing odasını sökün ve filtre kağıdını bağırsak preparat mukozal tarafı ile mukozal yan odaya yerleştirin ve odanın penceresi filtre kağıdının deliği ile aynı hizada olacak şekilde ayarlayın (Şekil 1A, oda penceresinin etrafındaki siyah işaretleme, preparatların hizalanması için yararlıdır).
- Serosal yan odacığı dikkatlice mukozal yan odaya yerleştirin ve sıkıca kapatın, ancak bağırsak tabakasının bağlantı sırasında hareket etmediğinden emin olun.
- Her iki odayı da Ringer çözeltisi veya HEPES tamponu ile hızlı bir şekilde doldurun ve köpüren değnekleri yerleştirin (Ringer çözeltisi: %95 O2/%5 CO2; HEPES tamponu:% 100 O2) odaların karşı ucunda, membrandan uzakta (preparata çok yakın köpürmenin ölçümler üzerinde bir etkisi olabilir).
- Tuz köprülerini yeniden bağlayın ve bağlantıların iyi olduğundan emin olmak için voltajın kararlı ve darbe akımı olup olmadığını kontrol edin (Şekil 1C).
- Her bağırsak preparatı için tekrarlayın.
- Sistemin yaklaşık 15 dakika boyunca dengelenmesine izin verin. Bir kayıt sistemi kullanıyorsanız, deneylere başlamadan önce iletkenlik ve Issc / membran potansiyel farkının stabilize olmasına izin verin.
8. Seyreltme potansiyeli deneyi (açık devre koşulları)
- HEPES tamponunu emerek ve her iki tarafa 5 mL taze önceden ısıtılmış HEPES tamponu ekleyerek odanın her iki tarafını da yıkayın.
- Kayıt sistemini açın. Aralığı 250 mV'ye ayarlayın (burada kullanılan sistem çıkış voltajını 10x yükseltir), işaretleyici konumlarını ayarlayın ve ölçmek için kayıt sistemini ayarlayın.
- Ussing oda sistemlerini kelepçeleme moduna getirin ve ölçmeye başlayın. Membran potansiyeli stabilize edildikten sonra (~ 15-20 dakika), değerlendirme başlayabilir.
- HEPES tamponunu mukozal taraftan emme ve hızlı bir şekilde 75 mM NaCl içeren 5 mL ısıtılmış seyreltme HEPES tamponu ile değiştirin.
- Membran potansiyeli zirveye ulaştığında (5-10 dakika), seyreltme tamponunu "Mukozal" taraftan çıkarın ve HEPES tamponu ile değiştirin.
- Gerekirse, Serosal taraf için adım 3'ü tekrarlayın ve Serosal tarafa seyreltme HEPES tamponu ekleyin.
- Dokunun canlı olmasını sağlamak için, adenilat siklaz aktivatörü Forskolin'i (son konsantrasyon 10 μM) Serosal tarafa ekleyin.
- Membran potansiyel farkı zirveye ulaştığında ve azalmaya başladığında, deney sona erer.
9. Transepitelyal elektriksel iletkenliğin ve temel Isc'nin ölçülmesi (kısa devre koşulları)
- Zil çözeltisini emerek ve her iki tarafa 5 mL taze kabarcıklı Ringer çözeltisi ekleyerek odanın her iki tarafını da yıkayın.
- Kayıt sistemini açın. Aralığı 2,5 V'a ayarlayın (burada kullanılan sistem çıkış voltajını 10x yükseltir), işaretleyici konumlarını ayarlayın ve ölçmek için kayıt sistemini ayarlayın.
- Ussing oda sistemlerini kelepçe moduna getirin ve ölçmeye başlayın; Isc ve iletkenlik stabilize edildikten sonra (~ 15-20 dakika), taban çizgisi ölçümleri elde edilebilir.
- Dokunun canlı olmasını sağlamak için, adenilat siklaz aktivatörü Forskolin'i (son konsantrasyon 10 μM) Serosal tarafa ekleyin.
- Membran potansiyel farkı zirveye ulaştığında ve azalmaya başladığında, deney yapılır.
10. Sonuçların analiz edilmesi
- Açık devre koşulları altında, Ohm yasasına göre akım darbelerine yanıt olarak voltaj değişiminden transmukozal iletkenliği hesaplayın. Ohm yasasını uygulayarak transmukozal voltaj ve iletkenlikten eşdeğer kısa devre akımını (Isc) belirleyin.
- Goldman-Hodgkin-Katz denklemi10 ile göreceli iyonik seçiciliği (PNa/PCl) hesaplamak için NaCl'nin seyreltme potansiyelini kullanın.
- Kimizuka-Koketsu denklemini kullanarak her iyon için sıkı bağlantının mutlak seçiciliğini tahmin edin11.
- Seyreltme potansiyellerinden Goldman-Hodgkin-Katz denklemini kullanarak PNa / PCl'yi hesaplayın ve Yu ve ark.10 tarafından açıklandığı gibi Kimizuka-Koketsu denkleminden mutlak geçirgenlikler PNa ve PCl'yi belirleyin:
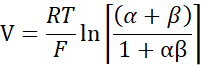

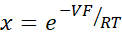

burada, V: Seyreltme potansiyeli (mV); α: Aktivite oranı. NaCl'nin HEPES tamponundaki hesaplanan aktivitesi, seyreltme HEPES tamponundaki hesaplanan NaCl aktivitesine bölünür (Bu deney için 1.8966 olarak hesaplanmıştır); e: Matematiksel sabit, 2.71828; GM: Transmukozal iletkenlik (mS/cm2); F: Faraday sabiti (96.485,3329 C/mol); R: Gaz sabiti (8,314 J/mol K); T: Sıcaklık (310.15 K)
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu makalede gösterilen sonuçlar, tamamlanmış daha büyük bir projenin parçası olan sonuçlardır (bkz. ref.4,23,24).
Cldn15-/- farelerde ince bağırsağın transepitelyal elektriksel iletkenliği azalır .
Cldn15-/- farelerde orta ince bağırsak segmentinin temel transmukozal iletke...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu deneyde, Cldn15-/- ve WT farelerinin ince bağırsağında NaCl'nin temel elektriksel parametrelerini ve seyreltme potansiyelini ölçmek için Ussing odaları kullanıldı. Ussing odası deneyleri yaparken, deneylerde kullanılan membran preparatının uygulanabilir olduğunu doğrulamak çok önemlidir. Bu genellikle glikoz veya adenilat siklaz aktivatörü forskolin eklenerek ve Isc'de uygun bir artış olup olmadığını görerek yapılır (farelerde 100-300 μA / cm2<...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklanacak potansiyel çıkar çatışmaları yoktur.
Teşekkürler
Bu çalışma 17K00860 (HH'ye) ve 19K20152 (NI'ye) tarafından desteklenmektedir. WH, Otsuka Toshimi Burs Vakfı'na 2018-2021 yılları arasındaki finansal destekleri için teşekkür eder.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #3 polyethyl tubing | Hibiki | outer diameter 1.0 mm; inner diameter 0.5 mm | |
| #7 polyethyl tubing | Hibiki | outer diameter 2.3 mm; inner diameter 1.3 mm | |
| 10 mL locking syringe | Terumo | SS-10LZ | Locking syringes are necessary to prevent the needle from dislodging during filling |
| 19 g needle | Terumo | NN-1938R | Please use caution when working with needles and dispose of in sharps container |
| 23 g needle | Terumo | NN-2332R | Please use caution when working with needles and dispose of in sharps container |
| 5 mm punch | NA | NA | Use to punch holes in filter paper and parafilm |
| acupuncture needles | Seirin | NS | Used as dissection pins to pin tissue to dissection plate |
| Agar | Fujifilm Wako | 010-15815 | |
| Alligator clips | NA | NA | Connects the electrode to the amplifier |
| CaCl2 | Fujifilm Wako | 038-00445 | |
| D(-)-Mannitol | Fujifilm Wako | 133-00845 | This is used to correct for the osmolality difference in dilution HEPES buffer |
| D(+)-Glucose | Fujifilm Wako | 049-31165 | |
| Dissection kit | You will need, scissors and curved forceps | ||
| Dissection plates | We used 10 cm cell culture plates and covered with silicon rubber | ||
| DMSO | Sigma | 472301-500ML | For making forskolin stock |
| Electrical recorder | TOA Electronics | PRR-5041 | Other equivalent electrical recorders are available commercially |
| Epithelial voltage clamp amplifier | Nihon Kohden | CEZ9100 | Other equivalent amplifiers are available commerically |
| filter paper, cut into squares | NA | NA | Punched with a 5 mm punch, used to hold intestinal preparation |
| fine forceps | Fast Gene | FG-B50476 | For blunt dissection of the muscle layer |
| Forskolin | Alomone Labs | F-500 | Make 10 mM stock in DMSO, final concentration will be 10 µM |
| HEPES | Sigma | H4034-1KG | |
| Indomethacin | Sigma | I7338-5G | Make a 1 mM stock in 21 mM NaHCO3, final concentration is 10 µM |
| K2HPO4 | Fujifilm Wako | 164-04295 | |
| KCl | Fujifilm Wako | 163-03545 | |
| KCl/calomel electrode | Asch Japan Co. | SCE-100 | |
| KH2PO4 | Kanto chemical | 32379-00 | |
| L(+)-Glutamine | Fujifilm Wako | 074-00522 | |
| MgCl2 | Fujifilm Wako | 135-00165 | |
| Mixed Gas (95% O2/5% CO2) | Shizuoka Oxygen Company | Used for bubbling Ringer solution and chambers when using Ringer solution | |
| NaCl | Fujifilm Wako | 191-01665 | |
| NaCl electrode | NA | NA | Handmade electrodes which require concentrated NaCl and Silver wire |
| NaHCO3 | Fujifilm Wako | 191-01305 | |
| O2 Gas | Shizuoka Oxygen Company | Used for bubbling chambers when using HEPES buffer | |
| parafilm | Bemis | PM-996 | Used to help seal Ussing chambers |
| pH meter | DKK-TOA Corp | HM-305 | HEPES buffer needs to be adjusted to pH 7.4 at 37 °C |
| pH meter electrode | DKK-TOA Corp | GST-5311C | |
| silicone rubber | Shinetsu Chemical | KE-12 | Used to fill dissection plates |
| silver wire | Used for making NaCl electrodes | ||
| Small jars w/ plastic lids | NA | NA | Use for NaCl electrodes |
| stereomicroscope | Zeiss | Stemi 305 | A stereomicroscope allows you to see depth, so you can dissect the tissue more easily |
| Tris (Trizma base) | Sigma | T1503-1KG | Make a 1M solution to adjust pH of HEPES buffers |
| Ussing chambers | Sanki Kagaku Kougei | These chambers are custom made continuous perfusion Ussing chambers with a window diameter of 5 mm | |
| Water pump and heating system | Tokyo Rikakikai Co. Ltd. | NTT-110 |
Referanslar
- Ussing, H. H., Zerahn, K. Active transport of sodium as the source of electric current in the short-circuited isolated frog skin. Acta Physiologica Scandinavica. 23, 110-127 (1951).
- Field, M. Ion transport in rabbit ileal mucosa. II. Effects of cyclic 3', 5'-AMP. American Journal of Physiology - Legacy Content. 221, 992-997 (1971).
- Herrmann, J. R., Turner, J. R. Beyond Ussing's chambers: contemporary thoughts on integration of transepithelial transport. American Journal of Physiology - Cell Physiology. 310, 423-431 (2015).
- Ishizuka, N., et al. Luminal Na + homeostasis has an important role in intestinal peptide absorption in vivo. American Journal of Physiology - Gastorintestinal and Liver Physiology. 315, 799-809 (2018).
- Ikehara, O., et al. Subepithelial trypsin induces enteric nerve-mediated anion secretion by activating proteinase-activated receptor 1 in the mouse cecum. Journal of Physiological Sciences. 62, 211-219 (2012).
- Furuse, M. Molecular basis of the core structure of tight junctions. Cold Spring Harbor Perspectives in Biology. 2, 002907(2010).
- Tsukita, S., Tanaka, H., Tamura, A. The claudins: From tight junctions to biological systems. Trends in Biochemical Sciences. 44, 141-152 (2019).
- Li, B. R., et al. In vitro and in vivo approaches to determine intestinal epithelial cell permeability. Journal of Visual Experiments: JoVE. , e57032(2018).
- Schoultz, I., Keita, ÅV. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9, (2020).
- Yu, A. S. L., et al. Molecular basis for cation selectivity in claudin-2-based paracellular pores: Identifi cation of an electrostatic interaction site. Journal of General Physiology. 133, 111-127 (2009).
- Kimizuka, H., Koketsu, K. Ion transport through cell membrane. Journal of Theoretical Biology. 6, 290-305 (1964).
- Li, H., Sheppard, D. N., Hug, M. J. Transepithelial electrical measurements with the Ussing chamber. Journal of Cystic Fibrosis. 3, 123-126 (2004).
- Riordan, J. R., et al. Identification of the cystic fibrosis gene: Cloning and characterization of complementary DNA. Science. 245, 1066-1073 (1989).
- Smith, J. J., Karp, P. H., Welsh, M. J. Defective fluid transport by cystic fibrosis airway epithelia. Journal of Clinical Investigation. 93, 1307-1311 (1994).
- Molinski, S. V., et al. Orkambi and amplifier co-therapy improves function from a rare CFTR mutation in gene-edited cells and patient tissue. EMBO Molecular Medicine. 9, 1224-1243 (2017).
- Kisser, B., et al. The Ussing chamber assay to study drug metabolism and transport in the human intestine. Current Protocols in Pharmacology. 77, John Wiley & Sons, Inc. 1-19 (2017).
- Östh, K. The horizontal Ussing chamber method in studies of nasal drug delivery - Method Delopment and Applications Using Different Formulations. , Uppsala University. Dissertation thesis (2002).
- Guo, P., et al. Study of penetration mechanism of labrasol on rabbit cornea by Ussing chamber, RT-PCR assay, Western blot and immunohistochemistry. Asian Journal of Pharmaceutical Sciences. 14, 329-339 (2019).
- Okabe, K., et al. Effect of Benzalkonium Chloride on transscleral drug delivery. Investigative Opthalmology & Visual Science. 46, 703(2005).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium. Gastroenterology. 141, 1762-1772 (2011).
- Kozuka, K., et al. Development and characterization of a human and mouse intestinal epithelial cell monolayer platform. Stem Cell Reports. 9, 1976-1990 (2017).
- Tamura, A., et al. Megaintestine in claudin-15-deficient mice. Gastroenterology. 134, 523-534 (2008).
- Nakayama, M., Ishizuka, N., Hempstock, W., Ikari, A., Hayashi, H. Na+-coupled nutrient cotransport induced luminal negative potential and Claudin-15 play an important role in paracellular Na+ recycling in mouse small intestine. International Journal of Molecular Sciences. 21, 376(2020).
- Tamura, A., et al. Loss of claudin-15, but not claudin-2, causes Na+ deficiency and glucose malabsorption in mouse small intestine. Gastroenterology. 140, 913-923 (2011).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American Journal of Physiology - Gastrointestinal and Liver Physiology. 296, (2009).
- Dobson, J. G., Kidder, G. W. Edge damage effect in in vitro frog skin preparations. American Journal of Physiology. 214, 719-724 (1968).
- Corman, B. Streaming potentials and diffusion potentials across rabbit proximal convoluted tubule. Pflügers Archiv: European Journal of Physiology. 403, 156-163 (1985).
- Shen, L., Weber, C. R., Raleigh, D. R., Yu, D., Turner, J. R. Tight junction pore and leak pathways: A dynamic duo. Annual Review of Physiology. 73, 283-309 (2011).
- Frizzell, R. A., Schultz, S. G. Ionic conductances of extracellular shunt pathway in rabbit ileum. Journal of General Physiology. 59, 318-346 (1972).
- Otani, T., et al. Claudins and JAM-A coordinately regulate tight junction formation and epithelial polarity. Journal of Cell Biology. 218, 3372-3396 (2019).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır