Method Article
نموذج جديد لفشل القلب بعد احتشاء عضلة القلب في الفئران
In This Article
Summary
لقد نجحنا في تطوير نموذج موثوق به وقابل للتكرار لفشل القلب بعد احتشاء عضلة القلب في الفئران دون تهوية أو إخراج القلب. هذا يبسط الإجراء ويفيد الدراسات الإضافية حول الآليات المحتملة وراء قصور القلب.
Abstract
تم استخدام ربط الشريان التاجي الأمامي الأيسر (LAD) على نطاق واسع لإنشاء نموذج الفئران لقصور القلب (HF) بعد احتشاء عضلة القلب (MI). ومع ذلك ، فإن عيوب هذا النموذج تشمل ارتفاع معدل الوفيات بعد الربط والاختلافات الأكبر في كل من حجم الاحتشاء ودرجة ضعف وظائف القلب. بالإضافة إلى ذلك ، لا غنى عن جهاز التنفس الصناعي أو الهيكل الخارجي للقلب للنماذج السابقة ، مما يعقد الإجراء أثناء الربط. في هذه الدراسة ، قمنا بتطوير نموذج موثوق به وقابل للتكرار بدون جهاز التنفس الصناعي أو الهيكل الخارجي للقلب عن طريق ربط الشريان التاجي LAD. بعد أربعة أسابيع من الإجراء ، وجدنا أن تركيزات مصل CK-MB و NT-proBNP و Renin ، والتي تم استخدامها للمساعدة في تشخيص MI و HF ، كانت أعلى بشكل ملحوظ في مجموعة MI مقارنة بمجموعة SHOM. في المقابل ، كانت قيمة الكسر القذفي للبطين الأيسر (LVEF) في مجموعة MI أقل من الواضح أنها في المجموعة الوهمية. علاوة على ذلك ، تم تأكيد حجم الاحتشاء ومنطقة التليف القلبي بشكل فردي وتحليلهما كميا عن طريق تلطيخ TTC وتلوين ماسون ثلاثي الألوان. تم العثور على اختلافات أصغر إما في حجم الاحتشاء أو منطقة التليف في مجموعة MI ، مما ساعد على تطوير نموذج موثوق به وقابل للتكرار من HF بعد MI. هذا النموذج الجديد من HF بعد MI في الفئران حيوي لدراسة الآليات المحتملة ل MI و HF. يمكن استخدام هذه الطريقة الجديدة لتطوير الدواء الجديد لعلاج MI و HF في الفئران باستخدام الاستراتيجيات الدوائية.
Introduction
يعتبر قصور القلب (HF) مشكلة صحية عامة عالمية تؤثر على أكثر من 26 مليون مريض ولا يزال انتشاره فيازدياد 1. يعرف HF بأنه عندما لا يضخ القلب الدم كما ينبغي. هناك العديد من عوامل الخطر للإصابة ب HF ، بما في ذلك أمراض القلب الإقفارية والسكري وارتفاع ضغط الدم وتضخم الجهد المنخفض والسمنة والتدخين وما إلى ذلك.2،3،4. احتشاء عضلة القلب (MI) هو أحد الأسباب الأكثر شيوعا لالتهاب القلبHF 5. منذ ما يقرب من 50 عاما ، كان HF بعد MI هو المحرك الرئيسي للمراضة المتأخرة والوفيات وتكلفة الرعاية الصحية6. من أجل فهم أفضل للآلية الفيزيولوجية المرضية للحمض الديكامتري والوقاية من التردد العالي وعلاجه بشكل أكثر فعالية ، تم تطوير أعداد كبيرة من نماذج HF الحيوانية بعد MI للدراسة قبل السريرية. تستخدم الفئران عادة بسبب سهولة الصيانة ، وانخفاض التكاليف ، والقدرة على التحكم ، والتماثل العالي مع البشر7،8،9. يستخدم ربط الشريان التاجي الأيسر (LCA) ، وخاصة ربط الفرع الأمامي الأيسر (LAD) ، على نطاق واسع لتطوير نموذج HF بعد MI في الفئران8.
ومع ذلك ، فإن العمليات الجراحية التي تحفز MI في الفئران غالبا ما تكون صعبة من الناحية الفنية بسبب التباين الكبير والعملية المعقدة وارتفاع معدل الوفيات10،11. على الرغم من الإبلاغ عن عدد غير قليل من الإجراءات ، إلا أن الغالبية العظمى من العمليات الجراحية تتطلب إما التهوية بعد التنبيب الرغامي أو إخراج القلب. زادت هذه الأساليب من تكلفة الجراحة ، وجعلت العملية أكثر صعوبة ، وقللت من سلامة. بالإضافة إلى ذلك ، يعتمد مدى HF على موقع ربط LCA. يؤدي التنوع التشريحي ل LCA في الفئران إلى عدم الاتساق في أحجام الاحتشاء والمعلمات الوظيفية في نموذج الفئران. تتسبب مواقع الربط المختلفة ل LCA في حجم احتشاء خاص ، والذي يحدد درجة HF ومعدل البقاء على قيد الحياة.
في هذه الدراسة ، هدفنا إلى إنشاء نموذج HF موثوق به وقابل للتكرار بعد MI. سمحت النتائج التي توصلنا إليها بإجراء عمليات جراحية للفئران بدون جهاز تنفس صناعي أو إخراج القلب ، مما أدى إلى ارتفاع معدل البقاء على قيد الحياة. أيضا ، أدى الموقع الثابت نسبيا لربط LAD إلى اختلافات أقل في HF بعد 4 أسابيع من الجراحة. علاوة على ذلك ، قمنا بتقييم تأثيرات نموذج HF باستخدام التلوين النسيجي المرضي ، والكشف الكيميائي الحيوي ، وقياس وظائف القلب ، مما ساعد في دراسة الآليات المحتملة وراء المرض وتطوير أدوية جديدة لعلاج HF.
Protocol
تمت الموافقة على البروتوكول من قبل لجنة أبحاث أخلاقيات بجامعة شاندونغ للطب الصيني التقليدي.
ملاحظة: تم تقسيم ذكور فئران Sprague-Dawley البالغة ، التي يبلغ عمرها 10 أسابيع والتي تزن 180-220 جم ، بشكل عشوائي إلى مجموعتين ، وهم (ن = 25) و MI (ن = 35). تم الاحتفاظ بالحيوانات في دورة إضاءة / ظلام 12/12 ساعة وتلقت الماء والطعام حسب الطلب.
1. التخدير والإمداد المستمر بالأكسجين
- ضع الفئران في غرفة الحث وقم بتخديرها باستخدام 3٪ من الأيزوفلوران.
- للتأكد مما إذا كان التخدير جاهزا ، لاحظ منعكس قرصة إصبع القدم. يكون التخدير كافيا عندما يختفي منعكس قرصة إصبع القدم.
- انقل الفئران بشكل فردي إلى لوحة جراحة صغيرة يتم التحكم في درجة حرارتها. ألصق أقدام الفئران على السبورة.
- قم بتوصيل قناع بوجه الفئران يوفر إمدادا ثابتا بنسبة 3٪ من الأيزوفلوران و 1٪ أكسجين.
2. تحريض MI بدون تهوية أو إخراج القلب
- استخدم كريمات إزالة الشعر لإزالة شعر الصدر للتعقيم.
- استخدم ستارة معقمة بفتحة 1 سم × 3 سم في المجال الجراحي للفئران.
- تأكد من عمق التخدير الكافي مع قرصة إصبع القدم قبل العملية.
- افتح الصدر بشق عرضي 2.5 سم بين الفراغ الوربي الثالث والرابع على الحافة اليسرى من القص دون قطع الأضلاع.
- افصل عضلات الصدرية الكبرى والعضلة الصدرية الصغرى باستخدام ملقطين وعملائيين دون قطع الأنسجة أو الأوعية الدموية الصغيرة. ضع ضام Weitlaner ذاتي الاحتفاظ في الصدر لفصل الأضلاع الثالثة والرابعة للحصول على تعرض كاف للقلب مع الحفاظ على سلامة الضلع.
- تشريح التامور بدقة باستخدام ملقطين.
- استخدم خياطة نايلون 6/0 بإبرة منحنية لربط LAD بشكل دائم 2.0-2.5 مم تحت نقطة منتصف المخروط الشرياني ووصلة الزائدة الأذينية اليسرى. يمكن التعرف على LAD بسهولة والعثور عليها في بعض الفئران.
- تأكد من الربط المناسب ل LAD بعد أن أصبح الجدار الأمامي للبطين الأيسر شاحبا.
- في المجموعة الوهمية ، قم بتمرير الخيط فقط تحت LAD ، لكن لا تربط.
- قم بإزالة الضام واضغط على الهواء الموجود في الصدر قبل خياطة العضلات والجلد طبقة تلو الأخرى.
- بعد الجراحة ، ضع الفئران على وسادة تسخين 37 درجة مئوية للتعافي. مراقبة جميع ، وتوفير كيتوبروفين (5 مجم / كجم SC) للتسكين كل 24 ساعة حتى 72 ساعة.
ملاحظة: لأسباب فنية ، يفضل استخدام الفئران ذات أوزان الجسم الأصغر (أقل من 250 جم) لهذه العملية. اقتصر وقت إبقاء الصدر مفتوحا ، من الخطوة 2.4-2.8 ، على 5 دقائق.
3. تقييم وظائف القلب
ملاحظة: للتأكد مما إذا كان HF قد تطور بنجاح ، تم قياس وظيفة القلب بعد 4 أسابيع من الإجراء باستخدام نظام الموجات فوق الصوتية TE7 المجهز بمحول إلكتروني 13 ميجاهرتز. أثناء اختبار تخطيط صدى القلب ، كانت الفئران تخضع لنفس بروتوكول التخدير المستخدم في الإجراء الأولي.
- بعد حلق شعر الصدر الأمامي ، ضع الفئران على السبورة المستخدمة في العملية السابقة.
- ضع المسبار على جدار الصدر الأمامي واحصل على صور من مناظر المحور الطويل للبطين الأيسر (LV) (على مستوى العضلات الحليمة).
- قم بقياس الأبعاد الداخلية للبطين الأيسر عند الانبساط النهائي (LVIDd) والانقباض النهائي (LVIDs) بواسطة الوضع M من ثلاث دورات قلبية متتالية.
- احسب كسر القذف LV (LVEF) والتقصير الجزئي LV (LVFS) بواسطة برنامج الجهاز.
4. مزيد من التحليل لنموذج HF بعد 4 أسابيع من ربط LAD
- سكرافيس الفئران بعد 4 أسابيع من ربط LAD عن طريق إعطاء جرعة زائدة من الأيزوفلوران. قم بقياس تركيزات مصل CK-MB و N-terminal pro-brain natriuretic الببتيد (NT-proBNP) و Renin و Angiotensin (AngII) و Aldosterone (ALD) و TNF-α و VEGF و IL-6 و HIF-1α باستخدام مجموعات ELISA وفقا لبروتوكول الشركة المصنعة.
- لحصاد القلوب لتحليلها النسيجي المرضي ، قم بتنقيب قلوب الفئران بمحلول ملحي فسيولوجي 4 درجات مئوية قبل إزالتها.
- ضع القلوب في 10٪ فورمالين لمدة 24 ساعة ، وقم بتضمينها في البارافين ، وقم بتقطيعها بسمك 5.0 ميكرومتر بشكل عرضي على طول محور البطين الأيسر.
- قم بتركيب جميع أقسام القلب على شرائح زجاجية وصمة عار بشكل فردي باستخدام الهيماتوكسيلين والإيوسين (HE) وثلاثي الألوان من Masson.
- لغرض قياس حجم الاحتشاء ، قم بتلطيخ القلوب بكلوريد 2،3،5-ثلاثي الفينيل تيترازوليوم (TTC).
- قم بتقطيع القلوب بشكل عرضي بسمك 3 مم من القمة إلى القاعدة في حالة شبه مجمدة وتحضنها في محلول TTC 2٪ لمدة 20 دقيقة عند 37 درجة مئوية.
- عندما يتم إنشاء اللون ، قم بتثبيت الشرائح في محلول بارافورمالدهيد بنسبة 4٪ لمدة 15 دقيقة والتقط الصور.
- حدد حجم الاحتشاء واحسب باستخدام ImageJ. عبر عن حجم الاحتشاء كنسبة مئوية من منطقة الاحتشاء مقابل إجمالي مساحة الجهد المنخفض.
- لتحليل محتوى الكولاجين كميا في منتصف المنطقة الاحتشاء من LV ، قم بتلطيخ أقسام أنسجة قلب الفئران بثلاثي الألوان من Masson.
- بعد التلوين ، امسح الصور وقم بتحليلها. قم بتقييم درجة التليف من خلال جزء حجم الكولاجين (CVF) الذي تم التعبير عنه كنسبة مئوية من المنطقة الليفية مقابل إجمالي مساحة الجهد المنخفض.
النتائج
تم تنفيذ الإجراء بمعدل وفيات منخفض. الأدوات الرئيسية المستخدمة في هذه التجربة هي ضام Weitlaner ذاتي الاحتفاظ (13.5 سم) ومبخر الأيزوفلوران الموضح في الشكل 1. تم تطوير نموذج MI بدون تهوية أو إخراج القلب كما هو موضح في البروتوكول. خلال الإجراء بأكمله ، تم الحفاظ على جميع الأضلاع في حالة نزاهة واستغرق الإجراء بأكمله حوالي 10 دقائق. يظهر الرسم التخطيطي لموقع الربط الجراحي في الشكل 2. في هذه الدراسة ، توفي فأران من الرجفان البطيني أثناء إجراء الربط في مجموعة MI ، وتوفي فأر واحد بسبب النزيف بعد أن تم ثقب القلب عن طريق الخطأ بواسطة الإبرة المنحنية في مجموعة الوهم. كان معدل الوفيات حوالي 5٪ طوال التجربة.
انخفضت وظيفة القلب للفئران بشكل كبير في مجموعة MI ، وتم تطوير HF بنجاح. تم الحصول على قياسات تخطيط صدى القلب في الفئران بعد 4 أسابيع من الإجراء لتقييم تأثيرات نماذج HF (الشكل 3). استنادا إلى إرشادات ESC لعام 2016 لتشخيص وعلاج قصور القلب الحاد والمزمن12 ، تعتبر الفئران المصابة ب LVEF أقل من 50٪ نماذج HF ناجحة. تم تلخيص المعلمات الرئيسية المتعلقة بقصور القلب في الجدول 1. عند مقارنة مجموعة MI بالمجموعة الوهمية ، انخفض LVEF في مجموعة MI بشكل ملحوظ (32.7٪ ± 8.0 مقابل 75.3٪ ± 4.9 ، P<0.001). كانت هذه الانخفاضات الكبيرة في FS والزيادات في LVIDd و LVIDs في مجموعة MI علامات جيدة على HF. بالإضافة إلى ذلك ، شوهدت التغييرات في بنية البطين من صور الموجات فوق الصوتية (الشكل 3). أصبحت غرفة LV أكبر ، وأصبح جدار LV أرق وأكثر صلابة في مجموعة MI مقارنة بالوهم.
تقييم المؤشرات الحيوية ل MI و HF بعد MI بواسطة ELISA
كما هو موضح في الشكل 4 والشكل 5 ، ارتفعت تركيزات مصل علامة القلب CK-MB المستخدمة للمساعدة في تشخيص MI بشكل ملحوظ بأكثر من 3 مرات في مجموعة MI. وفي الوقت نفسه ، كانت بعض المعلمات المتعلقة بفشل القلب مثل تركيزات مصل الرينين و AngII و ALD أعلى مقارنة بالمجموعة الوهمية بعد 4 أسابيع من العملية. كانت تركيزات NT-proBNP في مجموعة MI أعلى ب 13 مرة منها في المجموعة الوهمية. أيضا ، زادت تركيزات السيتوكينات المؤيدة للالتهابات في مجموعة MI ، بما في ذلك TNF-α و IL-6 بنسبة 400٪ و 300٪ مقارنة بمجموعة الوهم. وفي الوقت نفسه ، نظرا لأن العوامل التمثيلية المتعلقة بتكوين الأوعية الدموية مثل VEGF و HIF-1α كانت أيضا أعلى بشكل ملحوظ بمقدار 2 و 5 مرات في مجموعة MI مقارنة بالمجموعة الوهمية.
التغيرات المورفولوجية وتحليلات التشريح المرضي
في مجموعة MI ، كشف التحليل المورفولوجي للقلوب عن جدار LV رقيق وشاحب بالإضافة إلى تكوين ندبة ليفية (الشكل 6). بالإضافة إلى ذلك ، تم التحقق من MI أيضا باستخدام تلطيخ TTC وتم اختبار حجم الاحتشاء (الشكل 6). كان حجم الاحتشاء 40.7±4.4٪ بعد 4 أسابيع من الإجراء في مجموعة MI ، مما أظهر موثوقية واستقرار الطريقة الجديدة ل HF post-MI. بالنسبة لتلوين HE ، أظهر التقييم المجهري ترتيبا أنيقا لألياف عضلة القلب دون تغيير التهابي في المجموعة الوهمية. ومع ذلك ، أصبحت ألياف عضلة القلب ترتيبا فضفاضا وغير منتظم مع التسلل الخلوي الالتهابي في مجموعة MI (الشكل 7 أ). بالإضافة إلى ذلك ، كشف تلطيخ ماسون ثلاثي الألوان أن مناطق التليف القلبي قد زادت في مجموعة MI (الشكل 7 أ) ، وكان جزء حجم الكولاجين (CVF) 39.2±6.9٪ في مجموعة MI. كانت نتائج تلطيخ ماسون ثلاثية الألوان متوافقة مع تلطيخ TTC ، مما أكد التطوير الناجح لنماذج MI و HF (الشكل 7 ب ، 7 ج).

الشكل 1. تم استخدام الأدوات الرئيسية لإنشاء نموذج MI. (أ) ضام الاحتجاز الذاتي Weitlaner (13.5 سم) (الثالث من اليسار)؛ (ب) معدات إمداد الأكسجين؛ (ج) مبخر الأيزوفلوران. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
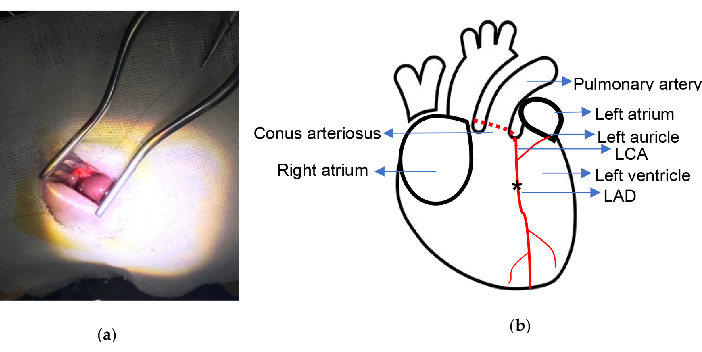
الشكل 2. التخطيطي التجريبي. (أ) تعرض القلب باستخدام ضام Weitlaner ذاتي الاحتفاظ ؛ (ب) يشار إلى مكان الربط. توضح العلامة النجمية وضع الربط. LCA, الشريان التاجي الأيسر; LAD ، اليسار الأمامي الهابط. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
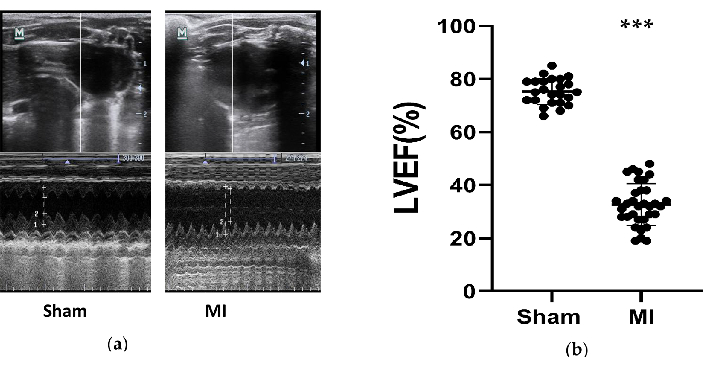
الشكل 3. قياسات تخطيط صدى القلب. (أ) الصور التمثيلية لهياكل البطين الأيسر من مجموعة الوهم وعضلة القلب التي تم اختبارها بواسطة M-Mode خلال 3 دورات قلبية بعد 4 أسابيع من الإجراء؛ (ب) LVEF للفئران بعد 4 أسابيع من الإجراء من مجموعة الوهم (ن = 24) و MI (ن = 33). MI ، احتشاء عضلة القلب. LVEF ، الكسر القذفي للبطين الأيسر. P < 0.001 مقارنة بمجموعة الزائف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
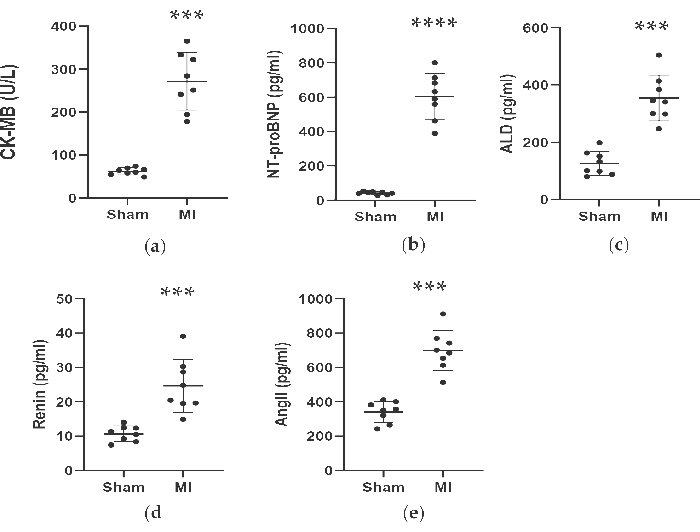
الشكل 4. زادت تركيزات CK-MB ، NT-proBNP ، ALD ، Renin و AngII بعد 4 أسابيع من ربط LAD. تم التعبير عن البيانات كمتوسط ± SD (ن = 8 في كل مجموعة). MI, احتشاء عضلة القلب; LAD ، اليسار الأمامي الهابط. P < 0.001 مقارنة بمجموعة الزائف. P < 0.0001 مقارنة بمجموعة الوهم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
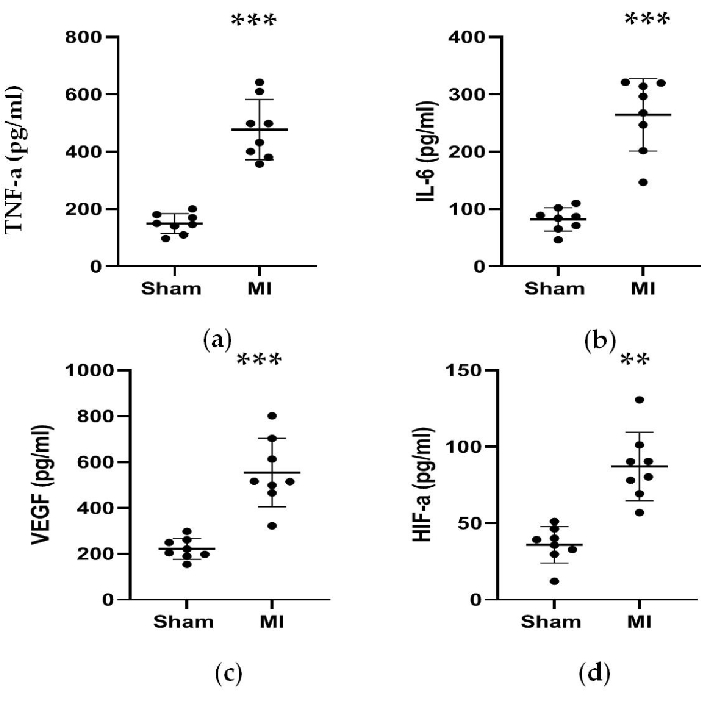
الشكل 5. تمت زيادة تركيزات TNF-α و IL-6 و VEGF و HIF-α بعد 4 أسابيع من ربط LAD. (أ ، ب) زادت تركيزات عامل نخر الورم α و IL-6 المرتبطة بالاستجابة للالتهاب بعد 4 أسابيع من ربط LAD ؛ (ج، د) زادت تركيزات VEGF و HIF-α المرتبطة بتكوين الأوعية بعد 4 أسابيع من ربط LAD. يتم التعبير عن البيانات كمتوسط ± SD (ن = 8 في كل مجموعة). LAD, اليسار الأمامي الهابط; MI ، احتشاء عضلة القلب. ** P < 0.01 مقارنة بمجموعة الوهم. P < 0.001 مقارنة بمجموعة الزائف. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
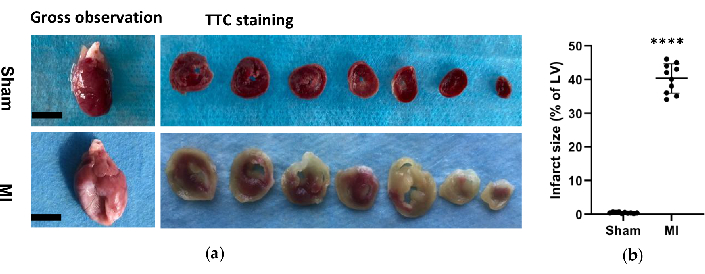
الشكل 6. التحليل المورفولوجي للقلوب. (أ) الملاحظة الإجمالية والأنسجة لقلوب الفئران من مجموعة الوسام والقلب بعد 4 أسابيع من الإجراء. أظهر قلب MI جدار البطين الأيسر أرق وأكبر مقارنة بالوهم. بالنسبة لقلوب تلطيخ TTC لمجموعة shamd و MI ، كانت الأنسجة القابلة للحياة ملطخة باللون الأحمر وكانت منطقة الاحتشاء شاحبة وغير ملطخة. (ب) تم التعبير عن حجم احتشاء MI كنسبة مئوية من منطقة الاحتشاء بالنسبة إلى LV بأكمله. يتم التعبير عن البيانات كمتوسط ± SD (ن = 10 في كل مجموعة).MI ، احتشاء عضلة القلب ؛ TTC ، ثلاثي فينيل تيترازوليوم كلوريد. LV ، البطين الأيسر. شريط المقياس = 5 مم. ****P < 0.0001 مقارنة بالمجموعة الوهمية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
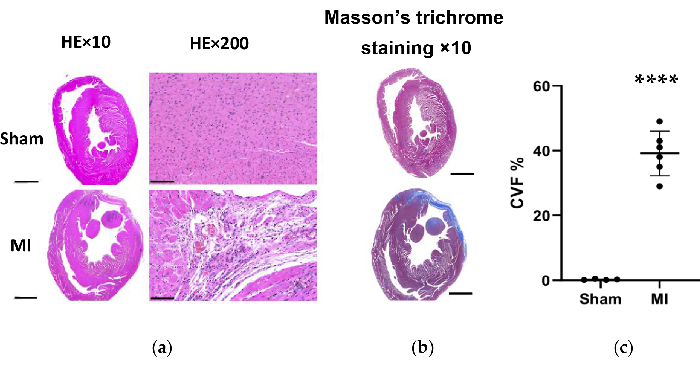
الشكل 7. تلطيخ HE و Masson ثلاثي الألوان لأنسجة قلب الفئران بعد 4 أسابيع من العملية. (أ) أصبح جدار قلب MI LV أرق من المجموعة الوهمية (HE×10 ، شريط المقياس = 2 مم). أظهر التقييم المجهري ترتيبا أنيقا لألياف عضلة القلب دون تغيير التهابي في المجموعة الوهمية وأظهر ترتيبا فضفاضا وغير منتظم مع التسللات الخلوية الالتهابية في مجموعة MI (HE×200 ، شريط المقياس = 100 ميكرومتر) ؛ (ب) يظهر تلطيخ ماسون ثلاثي الألوان لأنسجة القلب أن تليف عضلة القلب باللون الأزرق في مجموعة MI (شريط المقياس = 2 مم). (ج) جزء حجم الكولاجين لتلوين ماسون ثلاثي الألوان في شرائح أنسجة البطين الأيسر من مجموعات الوسام و MI. يتم التعبير عن البيانات كمتوسط ± SD (ن = 6 في مجموعة MI). هو ، الهيماتوكسيلين واليوزين. MI, احتشاء عضلة القلب; LV ، البطين الأيسر. P < 0.0001 مقارنة بمجموعة الوهم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| البارامترات | مجموعة الوسادة (ن = 24) | مجموعة MI (ن = 33) |
| LVIDd (مم) | 8.3±1.3 | 10.1±2.9* |
| LVIDs (مم) | 4.1±0.9 | 7.7±1.5*** |
| FS (٪) | 42.5±7.8 | 22.2±4.4*** |
الجدول 1: بيانات تخطيط صدى القلب للفئران في مجموعة الوسام و MI بعد 4 أسابيع من ربط LAD. تم التعبير عن البيانات كمتوسط ± SD. MI ، احتشاء عضلة القلب. LVIDd ، الأبعاد الداخلية للبطين الأيسر في نهاية الانبساط في نهاية الانبساط. LVIDs, الأبعاد الداخلية للبطين الأيسر في نهاية الانقباض; FS٪ ، نسبة تقصير جزئي. * P < 0.05 ، مقارنة بمجموعة الوهم. P < 0.001 مقارنة بمجموعة الزائف.
Discussion
على الرغم من وجود العديد من النماذج الحالية ل MI أو HF في القوارض13،14،15 ، فقد طورت هذه الدراسة إجراء ربط LAD جديدا وفعالا لتحفيز HF بعد MI في الفئران. ومع ذلك ، في هذا النموذج الجديد للفئران HF ، تم التخلص من احتياجات التنبيب والتهوية أو الإخراج من القلب ، مما زاد بشكل كبير من معدل بقاء الفئران. لتطوير نموذج HF الجديد للفئران ، يعد تحريض MI خطوة حاسمة. بالمقارنة مع البروتوكولات التقليدية التي تنطوي عادة على التنبيب والتهوية أو الإخراج الخارجي للقلب أثناء الربط9،16،17 ، قمنا بتطوير نهج محسن مع عدم تهوية القلب أو إضفاء الطابع الخارجي على القلب لأول مرة مما يسمح بمعدل بقاء أعلى. تجدر الإشارة إلى أن الإجراء المحسن يؤدي إلى تقليل تلف الأنسجة. لذلك ، تتمتع الفئران بتعافي أسرع بكثير بعد الجراحة ومعدل بقاء أعلى. سمحت لنا النقطتان التاليتان بتحقيق هذه النتائج: أولا ، سمح الاستنشاق المستمر للأكسجين أثناء الإجراء بأكمله بالأكسجين الكافي والربط دون تهوية. ثانيا ، تم استخدام ضام Weitlaner ذاتي الاحتفاظ ، وهو أداة جراحية رئيسية ، لاكتساب التعرض الكافي للقلب مع الحفاظ على سلامة الأضلاع ، مما ساعد على تجنب التحول الخارجي للقلب.
من المعروف أن التطوير الناجح ل HF بعد MI في الفئران يعتمد إلى حد كبير على حجم الاحتشاء ، والذي يرتبط بموقع ربط LCA. في وقت مبكر من عام 1979 ، أفاد مارك أ. فيفر وزملاؤه أن انسداد LCA في الفئران يمكن أن يوفر بسهولة احتشاء جدار البطين الأيسر بأحجام مختلفة18. لتقليل تباين أحجام الاحتشاء وتطوير نموذج HF أكثر استقرارا بعد MI ، تم استخدام ربط LAD بشكل شائع في الفئران للحث على احتشاء البطين الأيسر لأغراضالبحث 19. تتمثل الميزة الرئيسية لانسداد LAD في السماح بربط دقيق لهذا الشريان للحث على MI مستقر يمكن أن يسبب HF مع الحفاظ على معدل بقاء أعلى بكثير. في إجراءاتنا ، اخترنا موضع الربط 2.0-2.5 مم تحت نقطة منتصف الاتصال بين المخروط الشرياني والزائدة الأذينية اليسرى ، والتي أثبتت نجاحها واستقرارها مع اختلافات أقل في LVEF بين جميع الفئران في مجموعة MI. بالإضافة إلى ذلك ، حددنا بشكل فردي حجم الاحتشاء عن طريق تلطيخ TTC ودرجة التليف عن طريق تلطيخ ماسون ، وكلاهما تم استخدامه على نطاق واسع لتقييم هذا النوع من النماذج20،21،22. وفي الوقت نفسه ، تم أيضا توضيح الاختلافات الأقل في هذا النموذج من خلال التعديلات المورفولوجية وتحليلات علم الأنسجة المرضية.
درسنا أيضا بعض المعلمات المتعلقة ب MI و HF بعد 4 أسابيع من ربط LAD للمساعدة في تأكيد تطور HF بعد MI. تخطيط صدى القلب لديه القدرة على قياس وظيفة البطين بدقة وغير جراحية وتقييم أسباب أمراض القلب الهيكلية23. كانت LVEFs للفئران في مجموعة MI أقل من 50٪ والتي يمكن اعتبارها HF12. تماشيا مع هذه النتائج ، تم زيادة تركيز NT-proBNP وفقا لذلك والذي كان أيضا مؤشرا مهما على ضعف وظائف القلب. توجد أدلة كثيرة على وجود التهاب وموت الخلايا المبرمج في القلب الإقفاري24 ، 25. الالتهاب وفشل القلب مترابطان بقوة ويعززان بعضهما البعض26. في دراستنا ، قمنا بتقييم الزيادة الكبيرة في عوامل الالتهاب ، IL-6 و TNF-a. يعد نظام الرينين - أنجيوتنسين - الألدوستيرون (RAAS) الذي يتم تنشيطه عن طريق نقص التروية الكلوية والتنشيط الودي سمة مركزية في الفيزيولوجيا المرضية لفشل القلب27. قمنا بتقييم المعلمات المتضمنة في RAAS ووجدنا أن مستوى مصل الرينين كان أعلى بشكل ملحوظ في مجموعة MI مقارنة بمجموعة الوهم، مما أثبت تطور HF.
هناك نقطتان رئيسيتان للتركيز أثناء إجراء ربط LAD. أولا ، أثناء الإجراء بأكمله وحتى تتعافى من التخدير ، قم بتوفير إمدادات مستمرة من الأكسجين للحيوانات مع إبقائها دافئة أيضا. ثانيا ، يلعب موضع الربط على LAD دورا رئيسيا في حجم الاحتشاء ودرجة HF. الموقع 2.0-2.5 مم تحت نقطة منتصف الاتصال بين المخروط الشرياني والزائدة الأذينية اليسرى مناسب لنموذج HF مستقر وناجح بمعدل وفيات أقل. ومع ذلك ، فإن الحد من نموذج HF الجديد في الفئران هو أن الإجراء الجراحي لتطوير MI بدون تهوية يتطلب من الناحية الفنية وصعبا. تتمثل الخطوة الأساسية لتحقيق هذا النموذج في اكتساب تعرض كاف للقلب لتصور القلب بالكامل داخل الصدر والحد من وقت فتح الصدر إلى 5 دقائق ، الأمر الذي يتطلب مزيدا من الممارسة قبل التجربة الرسمية.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم تطوير هذا النموذج بدعم من مركز شاندونغ للابتكار المشترك لصيغة الطب الصيني التقليدي الكلاسيكية ، إدارة التعليم بمقاطعة شاندونغ. نود أن نشكر الدكتور Lianfeng Wu على إجراء تخطيط صدى القلب في هذه الدراسة.
Materials
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
References
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved