Method Article
쥐의 심근 경색 후 심부전의 새로운 모델
요약
우리는 심장의 환기나 외부화가 없는 쥐의 심근경색 후 심부전에 대한 신뢰할 수 있고 재현 가능한 모델을 성공적으로 개발했습니다. 이는 절차를 단순화하고 심부전의 잠재적 메커니즘에 대한 추가 연구에 도움이 됩니다.
초록
좌측 전방 하강(LAD) 관상동맥의 결찰은 심근경색(MI) 후 심부전(HF)의 랫트 모델을 확립하는 데 널리 사용되었습니다. 그러나 이 모델의 단점은 결찰 후 사망률이 높고 경색 크기와 심장 기능 손상 정도의 편차가 더 크다는 것입니다. 또한 이전 모델에서는 인공호흡기 또는 심장 외부화가 필수적이어서 결찰 중 절차가 복잡합니다. 이 연구에서는 LAD 관상동맥을 결찰하여 인공호흡기나 심장 외부화 없이 신뢰할 수 있고 재현 가능한 모델을 개발했습니다. 시술 4주 후, MI 및 HF 진단을 돕기 위해 사용된 CK-MB, NT-proBNP, Renin의 혈청 농도가 MI 그룹에서 가짜 그룹에 비해 유의하게 높았다. 대조적으로, MI 그룹에서 좌심실 박출률(LVEF)의 값은 가짜 그룹보다 명백히 낮았습니다. 또한, 경색 크기와 심장 섬유증 부위를 개별적으로 확인하고 TTC 염색과 Masson의 삼색 염색을 통해 정량 분석하였다. MI 그룹의 경색 크기 또는 섬유증 부위에서 더 작은 변화가 발견되었으며, 이는 MI 후 HF의 신뢰할 수 있고 재현 가능한 모델을 개발하는 데 도움이 되었습니다. 쥐에서 HF post-MI의 이 새로운 모델은 MI와 HF의 잠재적 메커니즘을 연구하는 데 필수적입니다. 이 새로운 방법은 약리학적 전략을 사용하여 쥐의 MI 및 HF 치료를 위한 신약을 개발하는 데 사용할 수 있습니다.
서문
심부전(HF)은 2,600만 명 이상의 환자에게 영향을 미치는 세계적인 공중 보건 문제로 간주되며 유병률은 여전히 증가하고 있습니다1. HF는 심장이 혈액을 제대로 펌프질하지 않는 것으로 정의됩니다. HF에는 허혈성 심장 질환, 당뇨병, 고혈압, 좌심실 비대, 비만, 흡연 등 많은 위험 요인이 있습니다.2,3,4. 심근경색(MI)은 HF5의 가장 흔한 원인 중 하나입니다. 거의 50년 동안 MI에 따른 HF는 후기 이환율, 사망률 및 의료 비용의 주요 원인이었습니다6. HF의 병태생리학적 기전을 더 잘 이해하고 HF를 보다 효과적으로 예방하고 치료하기 위해 전임상 연구를 위해 많은 수의 MI 후 동물 HF 모델이 개발되었습니다. 쥐는 일반적으로 유지 보수가 쉽고, 비용이 저렴하며, 제어 능력이 뛰어나고, 인간과의 높은 상동성으로 인해 사용됩니다 7,8,9. 좌측 관상동맥(LCA) 결찰술, 특히 좌측 전방 하강(LAD) 가지 결찰은 랫트에서 HF post-MI 모델을 개발하기 위해 널리 사용됩니다8.
그러나 쥐에서 MI를 유발하는 수술은 높은 변동성, 복잡한 수술 및 높은 폐사율로 인해 기술적으로 어려운 경우가 많습니다10,11. 꽤 많은 시술이 보고되었지만, 대부분의 수술은 기관 삽관 후 인공호흡이나 심장 외부 삽입이 필요했습니다. 이러한 방법은 수술 비용을 증가시키고, 수술을 더 어렵게 만들며, 동물의 안전성을 떨어뜨렸다. 또한, HF의 정도는 LCA의 결찰 부위에 따라 다릅니다. 쥐에서 LCA의 해부학적 다양성은 쥐 모델에서 경색 크기와 기능적 매개변수의 불일치로 이어집니다. LCA의 다른 결찰 부위는 HF의 정도와 생존율을 결정하는 특별한 경색 크기를 유발합니다.
이 연구에서는 신뢰할 수 있고 재현 가능한 HF post-MI 모델을 만드는 것을 목표로 했습니다. 우리의 발견은 인공호흡기나 심장 외부화 없이 쥐를 수술할 수 있게 하여 높은 생존율을 가져왔습니다. 또한, LAD 결찰 부위가 상대적으로 고정되어 있어 수술 4주 후 HF의 변동이 적었습니다. 또한, 조직병리학적 염색, 생화학적 검출 및 심장 기능 측정을 사용하여 HF 모델의 효과를 평가했으며, 이는 질병의 잠재적 메커니즘을 연구하고 HF를 치료하기 위한 신약을 개발하는 데 도움이 되었습니다.
프로토콜
이 프로토콜은 산둥 전통 중국 의학 대학의 동물 윤리 연구 위원회(Animal Ethics Research Committee)의 승인을 받았습니다.
참고: 180-220g의 생후 10주 된 성체 수컷 Sprague-Dawley 쥐를 가짜(n = 25)와 MI(n = 35)의 2개 그룹으로 무작위로 나누었습니다. 동물들은 12/12시간의 명암 주기로 사육되었으며 물과 음식을 자유자재로 받았습니다.
1. 마취 및 지속적인 산소 공급
- 쥐를 유도 챔버에 넣고 3% 이소플루란으로 마취합니다.
- 마취가 준비되었는지 확인하려면 발가락 꼬집음 반사를 관찰합니다. 마취는 발가락 꼬집음 반사가 사라질 때 충분합니다.
- 쥐를 개별적으로 온도 조절이 가능한 작은 수술 보드로 옮깁니다. 쥐의 발을 보드에 테이프로 붙입니다.
- 3%의 이소플루란과 1%의 산소를 지속적으로 공급하는 마스크를 쥐의 얼굴에 부착합니다.
2. 인공호흡 또는 심장 외부화없이 MI 유도
- 제모 크림을 사용하여 흉부 털을 제거하여 살균하십시오.
- 쥐의 수술 부위에 1cm x 3cm 구멍이 있는 멸균 드레이프를 사용하십시오.
- 수술하기 전에 발가락 꼬집기로 충분한 마취 깊이를 확인하십시오.
- 갈비뼈를 자르지 않고 흉골 왼쪽 가장자리의 세 번째와 네 번째 늑간 공간 사이를 가로 2.5cm 절개하여 가슴을 엽니다.
- 조직이나 작은 혈관을 절단하지 않고 두 개의 혈관 겸자를 사용하여 대흉근과 대흉근 소근육을 분리합니다. Weitlaner 자체 유지 견인기를 흉부에 배치하여 세 번째 및 네 번째 갈비뼈를 분리하여 갈비뼈 무결성을 유지하면서 심장에 충분한 노출을 얻습니다.
- 두 개의 집게로 심낭을 섬세하게 절개합니다.
- 곡선형 바늘이 있는 6/0 나일론 봉합사를 사용하여 원추 동맥 및 좌심방 부속기 연결의 중간 지점 아래 2.0-2.5mm LAD를 영구적으로 결찰합니다. LAD는 일부 쥐에서 쉽게 알아볼 수 있고 발견될 수 있습니다.
- 좌심실의 전벽이 창백하게 변한 후 LAD의 적절한 결찰을 확인합니다.
- 가짜 그룹에서는 LAD 아래의 봉합사만 통과시키되 결속은 하지 마십시오.
- 견인기를 제거하고 근육과 피부를 층별로 봉합하기 전에 흉부의 공기를 짜냅니다.
- 수술 후 회복을 위해 쥐를 37°C 가열 패드에 올려 놓습니다. 모든 동물을 모니터링하고 24시간에서 최대 72시간마다 진통제로 케토프로펜(5mg/kg SC)을 제공합니다.
참고: 기술적인 이유로 체중이 더 작은(250g 미만) 쥐가 이 작업에 선호됩니다. 2.4-2.8 단계에서 가슴을 벌리고 있는 시간은 5분으로 제한되었습니다.
3. 심장 기능 평가
참고: HF가 성공적으로 진행되었는지 확인하기 위해 13MHz 전자 변환기가 장착된 TE7 초음파 시스템을 사용하여 시술 4주 후 심장 기능을 측정했습니다. 심장초음파검사 동안, 쥐들은 초기 시술에 사용된 것과 동일한 마취 프로토콜을 받았다.
- 앞쪽 가슴털을 면도한 후 이전 작업에 사용한 보드에 쥐를 놓습니다.
- 프로브를 전방 흉벽에 놓고 좌심실(LV)의 좌측 흉골 장축(PLAX) 보기(유두 근육 수준에서)에서 이미지를 얻습니다.
- 3회 연속 심장 주기에서 M 모드로 확장기말(LVIDd) 및 수축말(LVID)에서 좌심실 내부 치수를 측정합니다.
- 기계의 소프트웨어로 LV 박출률(LVEF) 및 LV 분획 단축(LVFS)을 계산합니다.
4. LAD 결찰 4주 후 HF 모델의 추가 분석
- LAD 결찰 후 4주 동안 이소플루란을 과다 투여하여 쥐를 Sacrafice합니다. 제조사의 프로토콜에 따라 ELISA 키트를 사용하여 CK-MB, N-말단 전뇌 나트륨 이뇨 펩타이드(NT-proBNP), 레닌, 안지오텐신(AngII), 알도스테론(ALD), TNF-α, VEGF, IL-6 및 HIF-1α의 혈청 농도를 측정합니다.
- 조직병리학적 분석을 위해 심장을 채취하려면 쥐 심장을 제거하기 전에 4°C의 생리식염수로 관류합니다.
- 심장을 10% 포르말린에 24시간 동안 고정하고 파라핀에 삽입한 다음 좌심실 축을 따라 가로로 5.0μm 두께의 절편으로 자릅니다.
- 심장의 모든 부분을 유리 슬라이드에 장착하고 Hematoxylin 및 Eosin(HE) 및 Masson의 트리크롬으로 개별적으로 염색합니다.
- 경색 크기 측정을 위해 2,3,5-트리페닐 테트라졸륨 클로라이드(TTC)로 심장을 염색합니다.
- 반동결 상태에서 정점에서 기저부까지 3mm 두께로 심장을 가로로 자르고 37°C에서 20분 동안 2% TTC 용액에 배양합니다.
- 색이 확정되면 4% 파라포름알데히드 용액에 슬라이스를 15분 동안 고정하고 사진을 찍습니다.
- 경색 크기를 표시하고 ImageJ를 사용하여 계산합니다. 경색 크기를 전체 LV 면적 대비 경색 면적의 백분율로 표시합니다.
- 좌심낭의 경색 부위 중간에 있는 콜라겐 함량을 정량적으로 분석하려면 쥐의 심장 조직 부분을 Masson의 트리크롬으로 염색합니다.
- 염색 후 이미지를 스캔하고 분석합니다. 전체 LV 면적 대비 섬유화 면적의 백분율로 표현된 콜라겐 부피 분율(CVF)에 의한 섬유화 정도를 평가합니다.
결과
이 절차는 낮은 사망률로 수행되었습니다. 이 실험에 사용된 주요 기기는 그림 1에 표시된 Weitlaner Self-Retaining Retractor(13.5cm)와 isoflurane 기화기입니다. MI 모델은 프로토콜에 설명된 대로 심장의 환기 또는 외부화 없이 개발되었습니다. 전체 시술 동안 모든 갈비뼈가 온전하게 유지되었으며 전체 시술은 약 10분이 소요되었습니다. 수술 부위의 개략도는 그림 2에 나와 있습니다. 본 연구에서는 MI군에서 결찰 시술 중 심실세동으로 사망한 쥐 2마리, 가짜 군에서 구부러진 바늘로 심장을 우연히 찔린 후 출혈로 사망한 쥐 1마리가 사망했다. 실험 내내 사망률은 약 5%였다.
MI 그룹에서 쥐의 심장 기능이 현저히 감소하였고, HF가 성공적으로 발달하였다. HF 모델의 효과를 평가하기 위해 시술 후 4주 후에 쥐에서 심초음파를 측정했습니다(그림 3). 2016년 급성 및 만성 심부전의 진단 및 치료를 위한 ESC 가이드라인12에 따르면, LVEF가 50% 미만인 쥐는 성공적인 HF 모델로 간주된다. 심부전과 관련된 주요 매개변수는 표 1에 요약되어 있습니다. MI 그룹과 가짜 그룹을 비교했을 때, MI 그룹의 LVEF는 유의하게 감소했다(32.7% ± 8.0 대 75.3% ± 4.9, P<0.001). MI 그룹에서 FS의 현저한 감소와 LVIDd 및 LVID의 증가는 HF의 좋은 징후였습니다.또한, 초음파 영상에서 심실 구조의 변화를 확인할 수 있었습니다(그림 3). LV의 챔버는 더 커졌고, LV의 벽은 MI 그룹에서 가짜에 비해 더 얇고 뻣뻣해졌습니다.
ELISA에 의한 MI 및 HF post-MI의 바이오마커 평가
그림 4 및 그림 5에서 볼 수 있듯이, MI 진단을 돕기 위해 사용된 심장 마커 CK-MB의 혈청 농도는 MI 그룹에서 3배 이상 유의하게 증가했습니다. 한편, 레닌(renin), AngII, ALD 혈청 농도와 같은 심부전과 관련된 일부 매개변수는 시술 4주 후 가짜 그룹에 비해 더 높았다. MI군의 NT-proBNP 농도는 가짜군보다 13배 높았다. 또한, TNF-α와 IL-6를 포함한 MI 그룹의 전염증성 사이토카인 농도는 가짜 그룹에 비해 400%와 300% 증가했다. 한편, 대표적인 혈관신생 관련 인자인 VEGF, HIF-1α도 MI군이 가짜군에 비해 각각 2배와 5배 유의하게 높았다.
형태학적 변화 및 조직병리학 분석
MI 그룹에서 심장의 형태학적 분석을 통해 얇고 창백한 좌심실 벽과 섬유성 흉터 형성이 밝혀졌습니다(그림 6). 또한 TTC 염색을 사용하여 MI를 확인하고 경색 크기를 테스트했습니다(그림 6). MI군에서 시술 4주 후 경색 크기는 40.7±4.4%로 증가하여 새로운 HF post-MI 방법의 신뢰성과 안정성을 보여주었습니다. HE 염색의 경우, 현미경 검사에서 가짜 그룹에서 염증성 변화 없이 심근 섬유가 깔끔하게 배열되어 있는 것으로 나타났습니다. 그러나 심근 섬유는 MI 그룹에서 염증성 세포 침투와 함께 느슨하고 불규칙한 배열이 되었습니다(그림 7a). 또한, Masson의 트리크롬 염색을 통해 MI군에서 심장 섬유증 부위가 증가했으며(그림 7a), MI군에서 콜라겐 부피 분율(CVF)이 39.2±6.9%로 나타났습니다. Masson의 트리크롬 염색 결과는 TTC 염색과 일치했으며, 이는 MI 및 HF 모델의 성공적인 개발을 더욱 확인했습니다(그림 7b, 7c).

그림 1. MI 모델을 확립하기 위해 핵심 도구가 사용되었습니다. (a) Weitlaner 자체 유지 견인기(13.5cm)(왼쪽에서 세 번째); (b) 산소 공급 장비; (c) 이소플루란 기화기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
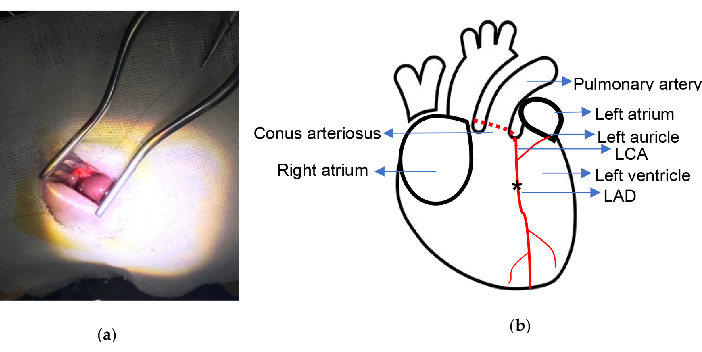
그림 2. 실험적 회로도. (a) Weitlaner Self-Retaining Retractor를 사용한 심장 노출; (b) 결찰 위치가 표시됩니다. 별표는 접합 위치를 나타냅니다. LCA, 좌측 관상동맥; LAD, 왼쪽 전방 하강. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
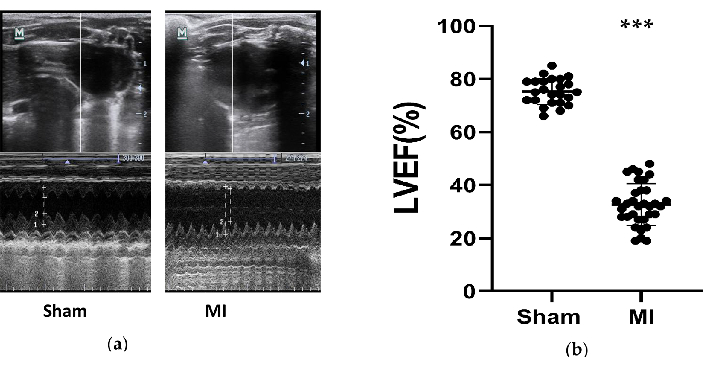
그림 3. 심초음파 측정. (a) 시술 4주 후 3번의 심장 주기 동안 M-Mode로 테스트한 가짜 및 MI 그룹의 좌심실 구조의 대표 이미지; (b) 가짜(n=24) 및 MI(n=33) 그룹의 시술 4주 후 쥐의 LVEF. MI, 심근 경색. LVEF, 좌심실 박출률. P < 0.001을 가짜 그룹과 비교했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
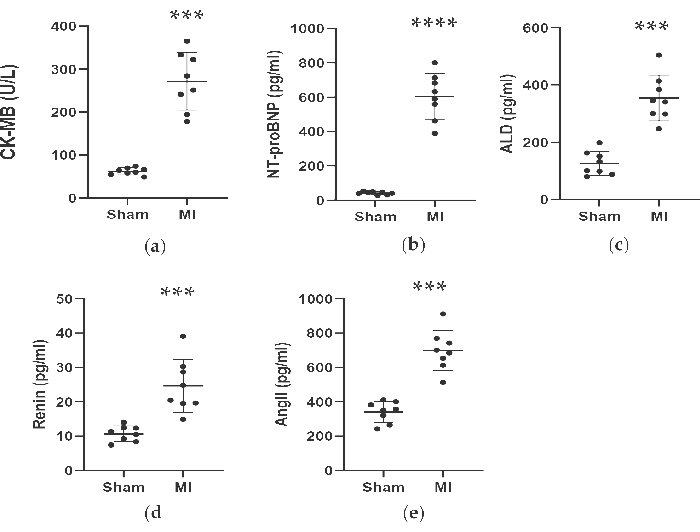
그림 4. CK-MB, NT-proBNP, ALD, Renin 및 AngII의 농도는 LAD 결찰술 4주 후에 증가하였다. 데이터는 평균 ± SD(n = 각 그룹에서 8마리)로 표현되었습니다. MI, 심근 경색; LAD, 왼쪽 전방 하강. P < 0.001을 가짜 그룹과 비교했습니다. P< 0.0001과 가짜 그룹과 비교했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
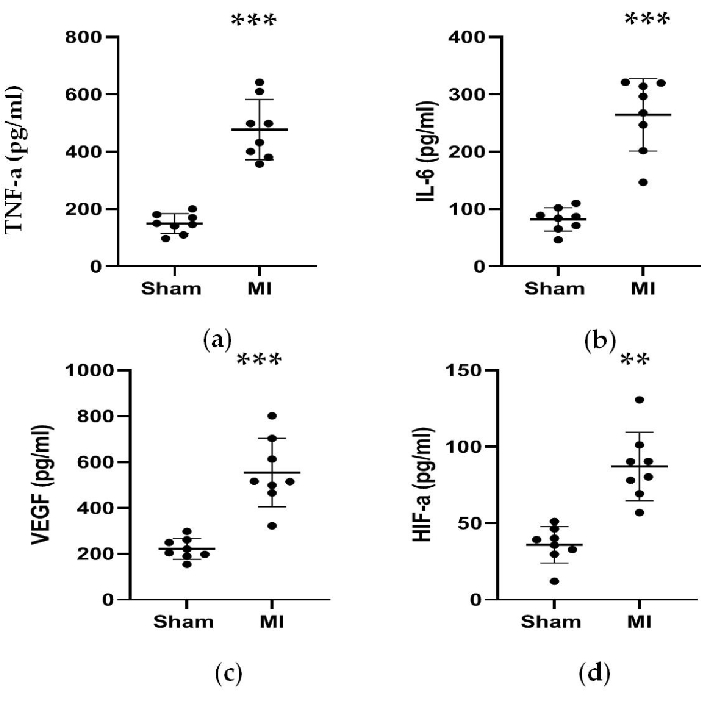
그림 5. TNF-α, IL-6, VEGF 및 HIF-α의 농도는 LAD 결찰술 4주 후에 증가하였다. (a, b) 염증 반응과 관련된 TNF-α 및 IL-6의 농도는 LAD 결찰술 4주 후에 증가하였다; (다, 라) 혈관신생과 관련된 VEGF 및 HIF-α의 농도는 LAD 결찰술 4주 후에 증가하였다. 데이터는 평균 ± SD(n = 각 그룹에 8마리)로 표현됩니다. LAD, 왼쪽 전방 내림차순; MI, 심근 경색. **P < 0.01은 가짜 그룹과 비교한 수치입니다. P < 0.001을 가짜 그룹과 비교했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
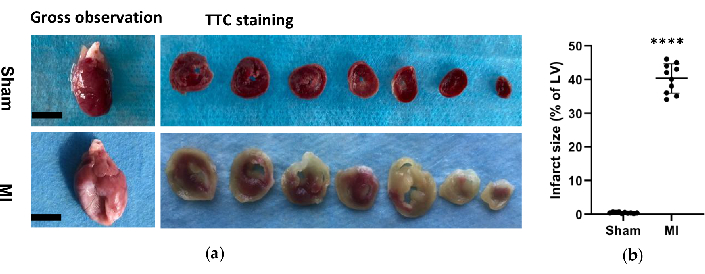
그림 6. 심장의 형태학적 분석. (a) 시술 후 4주 동안 가짜 및 MI 그룹의 쥐 심장에 대한 총체적 관찰 및 조직학. MI 심장은 가짜에 비해 더 얇고 큰 좌심실 벽을 보여주었습니다. 가짜 및 MI 그룹의 TTC 염색 심장의 경우, 생존 가능한 조직은 빨간색으로 염색되었고 경색 부위는 창백하고 염색되지 않았습니다. (b) MI 경색 크기는 전체 LV에 대한 경색 면적의 백분율로 표시되었습니다. 데이터는 평균 ± SD(n = 각 그룹에 10마리)로 표현되었습니다.MI, 심근 경색; TTC, 트리 페닐 테트라 졸륨 클로라이드; LV, 좌심실. 스케일 바 = 5mm. ****P < 0.0001 가짜 그룹과 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
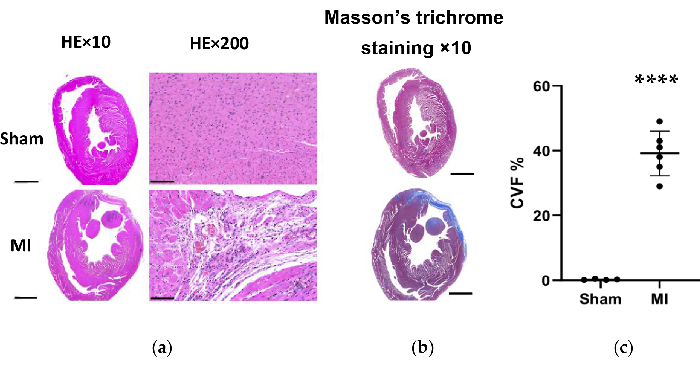
그림 7. HE와 Masson의 시술 4주 후 쥐 심장 조직의 삼색 염색. (a) MI 심장 LV 벽은 가짜 그룹보다 얇아졌습니다(HE×10, 스케일 바 = 2mm). 현미경 검사는 가짜 그룹에서 염증성 변화 없이 심근 섬유의 깔끔한 배열을 나타냈고, MI 그룹에서는 염증성 세포 침윤 물질이 느슨하고 불규칙한 배열을 보였다(HE×200, 스케일 바 = 100 μm). (b) Masson의 심장 조직의 삼색 염색은 MI 그룹에서 심근 섬유증을 파란색으로 보여줍니다(스케일 바 = 2mm). (c) 가짜 및 MI 그룹의 좌심실 조직 절편에서 Masson의 트리크롬 염색에 대한 콜라겐 부피 분율. 데이터는 평균 ± SD(n = MI 그룹의 동물 6마리)로 표현됩니다. HE, 헤마톡실린 및 에오신 ; MI, 심근 경색; LV, 좌심실. P< 0.0001과 가짜 그룹과 비교했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 매개 변수 | 가짜 그룹(n=24) | MI 그룹(n=33) |
| LVIDd (mm) | 8.3±1.3 | 10.1±2.9* |
| LVID (mm) | 4.1±0.9 | 7.7±1.5*** |
| 일천초분의 일초 (%) | 42.5±7.8 | 22.2±4.4*** |
표 1: LAD 결찰술 4주 후 가짜 및 MI 그룹에 속한 쥐의 심초음파 데이터. 데이터는 SD± 평균으로 표현되었다. MI, 심근경색; LVIDd, 이완기 말기에서 이완기 말기의 좌심실 내부 치수; LVID, 수축말부의 좌심실 내부 치수; FS%, 퍼센트 분수 단축. *P < 0.05, 가짜 그룹과 비교. P < 0.001을 가짜 그룹과 비교했습니다.
토론
설치류 13,14,15에서 MI 또는 HF의 기존 모델이 많이 있었지만, 이 연구는 쥐에서 HF post-MI를 유도하기 위한 새롭고 효율적인 LAD 결찰 절차를 개발했습니다. 그러나 이 새로운 쥐 HF 모델에서는 심장의 삽관 및 환기 또는 외부화의 필요성이 제거되어 쥐의 생존율이 크게 증가했습니다. 이 새로운 쥐 HF 모델을 개발하기 위해서는 MI의 유도가 중요한 단계입니다. 결찰 9,16,17 중 일반적으로 삽관과 인공호흡 또는 심장 외부를 포함하는 기존 프로토콜과 비교하여, 우리는 처음으로 심장의 인공호흡이나 외부를 사용하지 않는 개선된 접근법을 개발하여 더 높은 생존율을 허용했습니다. 개선된 절차로 조직 손상이 줄어든다는 점은 주목할 가치가 있습니다. 따라서 쥐는 수술 후 회복이 훨씬 빠르고 생존율이 높습니다. 다음 두 가지 사항을 통해 이러한 결과를 얻을 수 있었습니다.첫째, 전체 시술 동안 지속적으로 산소를 흡입하면 인공호흡 없이 충분한 산소화와 결찰이 가능했습니다. 둘째, 주요 수술 도구인 Weitlaner 자체 유지 견인기를 사용하여 갈비뼈 무결성을 유지하면서 심장에 충분히 노출되도록 하여 심장의 외부화를 방지하는 데 도움이 되었습니다.
쥐에서 HF post-MI의 성공적인 발달은 LCA의 결찰 부위와 관련된 경색 크기에 크게 좌우된다는 것은 잘 알려져 있습니다. 1979년 초에 Marc A. Pfeefer와 그의 동료들은 쥐의 LCA 폐색이 다양한 크기의 좌심실 자유벽 경색을 쉽게 제공할 수 있다고 보고했다18. 경색 크기의 변동을 줄이고 MI 이후 보다 안정적인 HF 모델을 개발하기 위해 LAD 결찰술은 연구 목적으로 좌심실 경색을 유도하기 위해 쥐에서 일반적으로 사용되었습니다19. LAD 폐색의 가장 큰 장점은 이 동맥의 정확한 결찰을 통해 훨씬 더 높은 생존율을 유지하면서 HF를 유발할 수 있는 안정적인 MI를 유도할 수 있다는 것입니다. 본 절차에서는 원추동맥과 좌심방 부속기 사이의 연결 중간점에서 2.0-2.5mm 아래의 결찰 위치를 선택했는데, 이는 MI 그룹의 모든 쥐에서 LVEF의 변동이 적고 성공적이고 안정적인 것으로 입증되었습니다. 또한, TTC 염색에 의한 경색 크기와 Masson의 염색에 의한 섬유화 정도를 개별적으로 측정했으며, 둘 다 이러한 종류의 모델을 평가하는 데 널리 사용되었습니다 20,21,22. 한편, 이 모델의 변동이 적은 것은 형태학적 변화와 조직병리학 분석을 통해서도 설명되었습니다.
또한 MI 후 HF의 발병을 확인하는 데 도움이 되도록 LAD 결찰술 4주 후 MI 및 HF와 관련된 몇 가지 매개변수를 연구했다.심장초음파검사는 심실 기능을 정확하고 비침습적으로 측정하고 구조적 심장 질환의 원인을 평가할 수 있는 능력이 있다23. MI 그룹에서 마우스의 LVEF는 모두 50% 미만이었으며 이는 HF12로 간주될 수 있습니다. 이러한 결과에 따라 NT-proBNP의 농도가 증가하였으며, 이는 심장 기능 장애의 중요한 지표이기도 하였다. 허혈성 심장의 염증과 세포사멸에 대한 충분한 증거가 존재한다24, 25. 염증과 심부전은 서로 밀접하게 연결되어 있으며 서로를 강화한다26. 본 연구에서는 염증 인자인 IL-6 및 TNF-a의 유의미한 증가를 평가했습니다. 신장 저관류 및 교감신경 활성화에 의해 활성화되는 레닌-안지오텐신-알도스테론 시스템(RAAS)은 심부전 병태생리학의 중심 특징이다27. RAAS와 관련된 매개변수를 평가한 결과, MI 그룹에서 레닌의 혈청 수치가 가짜 그룹에 비해 유의하게 높았으며, 이는 HF의 발병을 추가로 검증했습니다.
LAD 결찰 과정에서 강조되는 두 가지 주요 사항이 있습니다. 첫째, 전체 절차 동안 그리고 마취에서 회복될 때까지 동물에게 지속적으로 산소를 공급하는 동시에 따뜻하게 유지하십시오. 둘째, LAD의 결찰 위치는 경색 크기와 HF 정도에 중요한 역할을 합니다. 원추 동맥과 좌심방 부속기 사이의 연결 중간점에서 2.0-2.5mm 아래의 부위는 사망률이 낮은 안정적이고 성공적인 HF 모델에 적합합니다. 그러나 쥐에서 새로운 HF 모델의 한계는 인공호흡 없이 MI를 발병시키는 수술 절차가 기술적으로 까다롭고 어렵다는 것입니다. 이 모델을 달성하기 위한 핵심 단계는 흉부 내부의 심장을 완전히 시각화할 수 있도록 심장을 충분히 노출시키고 가슴이 열리는 시간을 5분으로 제한하는 것인데, 이를 위해서는 공식 실험 전에 더 많은 연습이 필요합니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 모델은 산둥성 교육부 Classic TCM Formula의 Shandong Co-Innovation Center의 지원으로 개발되었습니다. 이 연구에서 심장초음파를 시행해 주신 Lianfeng Wu 박사님께 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
참고문헌
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유