Method Article
Ein neues Modell der Herzinsuffizienz nach Myokardinfarkt bei der Ratte
In diesem Artikel
Zusammenfassung
Es ist uns gelungen, ein zuverlässiges und reproduzierbares Modell der Herzinsuffizienz nach Myokardinfarkt bei Ratten ohne Beatmung oder Exteriorisation des Herzens zu entwickeln. Dies vereinfacht das Verfahren und kommt den weiteren Studien über die möglichen Mechanismen der Herzinsuffizienz zugute.
Zusammenfassung
Die Ligatur der linken vorderen absteigenden Koronararterie (LAD) wurde häufig verwendet, um das Rattenmodell der Herzinsuffizienz (HF) nach Myokardinfarkt (MI) zu etablieren. Zu den Nachteilen dieses Modells gehören jedoch eine hohe Mortalitätsrate nach der Ligatur und größere Schwankungen sowohl in der Infarktgröße als auch im Grad der Beeinträchtigung der Herzfunktion. Darüber hinaus ist bei den Vorgängermodellen ein Beatmungsgerät oder eine Exteriorisation des Herzens unabdingbar, was den Eingriff während der Ligatur erschwert. In dieser Studie haben wir ein zuverlässiges und reproduzierbares Modell ohne Beatmung oder Exteriorisation des Herzens durch Ligatur der LAD-Koronararterie entwickelt. Vier Wochen nach dem Eingriff stellten wir fest, dass die Serumkonzentrationen von CK-MB, NT-proBNP und Renin, die zur Unterstützung der Diagnose von Myokardinfarkt und Herzinsuffizienz verwendet wurden, in der MI-Gruppe im Vergleich zur Scheingruppe signifikant höher waren. Im Gegensatz dazu war der Wert der linksventrikelartigen Ejektionsfraktion (LVEF) in der MI-Gruppe offensichtlich geringer als in der Scheingruppe. Des Weiteren wurden die Infarktgröße und die Herzfibrosefläche individuell bestätigt und quantitativ mittels TTC-Färbung und Masson-Trichrom-Färbung analysiert. Kleinere Variationen wurden entweder in der Infarktgröße oder im Fibrosebereich in der MI-Gruppe gefunden, was dazu beitrug, ein zuverlässiges und reproduzierbares Modell der HF nach MI zu entwickeln. Dieses neue Modell der Herzinsuffizienz nach dem Myokardinfarkt bei der Ratte ist für die Untersuchung der möglichen Mechanismen von Myokardinfarkt und Herzinsuffizienz von entscheidender Bedeutung. Mit dieser neuen Methode kann das neue Medikament zur Behandlung von Myokardinfarkt und Herzinsuffizienz bei Ratten mit pharmakologischen Strategien entwickelt werden.
Einleitung
Herzinsuffizienz (HF) gilt als globales Problem der öffentlichen Gesundheit, von dem über 26 Millionen Patienten betroffen sind, und die Prävalenz nimmt weiter zu1. HF ist definiert, wenn das Herz das Blut nicht so gut pumpt, wie es sollte. Es gibt viele Risikofaktoren für Herzinsuffizienz, darunter ischämische Herzkrankheit, Diabetes, Bluthochdruck, LV-Hypertrophie, Fettleibigkeit, Rauchen usw.2,3,4. Der Myokardinfarkt (MI) ist eine der häufigsten Ursachen für HF5. Seit fast 50 Jahren ist die Herzinsuffizienz nach Myokardinfarkt der Hauptgrund für Spätmorbidität, Mortalität und Gesundheitskosten6. Um den pathophysiologischen Mechanismus der Herzinsuffizienz besser zu verstehen und die Herzinsuffizienz effektiver zu verhindern und zu behandeln, wurde eine große Anzahl von Tiermodellen für die präklinische Studie entwickelt. Ratten werden in der Regel aufgrund der einfachen Wartung, der geringeren Kosten, der Fähigkeit zur Kontrolle und der hohen Homologie mit dem Menschen verwendet 7,8,9. Die Ligatur der linken Koronararterien (LCA), insbesondere die Ligatur des linken anterioren absteigenden Astes (LAD), wird häufig verwendet, um das Modell der HF nach MI bei Rattenzu entwickeln 8.
Operationen, die bei Ratten einen Myokardinfarkt auslösen, sind jedoch aufgrund der hohen Variation, der komplizierten Operation und der hohen Mortalität oft technisch schwierig durchzuführen10,11. Obwohl über eine ganze Reihe von Eingriffen berichtet wurde, erforderte die überwiegende Mehrheit der Operationen entweder eine Beatmung nach einer trachealen Intubation oder eine Extriorisation des Herzens. Diese Methoden erhöhten die Kosten der Operation, erschwerten die Operation und verringerten die Sicherheit des Tieres. Darüber hinaus hängt das Ausmaß der HF von der Stelle ab, an der sich die Ligation der LCA befindet. Die anatomische Diversität der LCA bei Ratten führt zu Inkonsistenzen in der Inkonsistenz der Infarktgrößen und funktionellen Parameter im Rattenmodell. Unterschiedliche Ligationsstellen der LCA verursachen eine besondere Infarktgröße, die den Grad der Herzinsuffizienz und die Überlebensrate bestimmt.
In dieser Studie haben wir uns zum Ziel gesetzt, ein zuverlässiges und reproduzierbares HF-Post-MI-Modell zu erstellen. Unsere Befunde ermöglichten Operationen an Ratten ohne Beatmungsgerät oder Exteriorisation des Herzens, was zu einer hohen Überlebensrate führte. Außerdem führte die relativ fixierte Stelle der Ligatur des LAD zu weniger Schwankungen der HF 4 Wochen nach der Operation. Darüber hinaus haben wir die Auswirkungen des HF-Modells mit Hilfe von histopathologischer Färbung, biochemischer Detektion und Herzfunktionsmessung evaluiert, was dazu beigetragen hat, die potenziellen Mechanismen hinter der Krankheit zu untersuchen und neue Medikamente zur Behandlung von HF zu entwickeln.
Protokoll
Das Protokoll wurde vom Animal Ethics Research Committee der Shandong University of Traditional Chinese Medicine genehmigt.
HINWEIS: Erwachsene männliche Sprague-Dawley-Ratten, 10 Wochen alt und mit einem Gewicht von 180-220 g, wurden nach dem Zufallsprinzip in 2 Gruppen eingeteilt, sham (n = 25) und MI (n = 35). Die Tiere wurden in einem 12/12-stündigen Hell-Dunkel-Zyklus gehalten und erhielten Wasser und Futter ad libitum.
1. Narkose und kontinuierliche Zufuhr von Sauerstoff
- Setzen Sie Ratten in eine Induktionskammer und betäuben Sie sie mit 3% Isofluran.
- Um zu bestätigen, ob die Anästhesie bereit war, beobachten Sie den Zehenkneifreflex. Die Betäubung ist ausreichend, wenn der Zehenklemmreflex verschwindet.
- Bringen Sie die Ratten einzeln auf ein kleines, temperaturkontrolliertes Operationsbrett. Klebe die Pfoten der Ratte an das Brett.
- Befestigen Sie eine Maske am Rattengesicht, die eine konstante Versorgung mit 3 % Isofluran und 1 % Sauerstoff gewährleistet.
2. Induktion des Myokardinfarkts ohne Beatmung oder Exteriorisation des Herzens
- Verwenden Sie Enthaarungscremes, um die Thoraxhaare für die Sterilisation zu entfernen.
- Verwenden Sie ein steriles Abdecktuch mit einem 1 cm x 3 cm großen Loch am Operationsfeld der Ratte.
- Bestätigen Sie vor der Operation eine ausreichende Anästhesietiefe mit einer Zehenklemme.
- Öffnen Sie den Brustkorb mit einem 2,5 cm langen Querschnitt zwischen dem dritten und vierten Interkostalraum am linken Rand des Brustbeins, ohne die Rippen zu schneiden.
- Trennen Sie den Musculus pectoralis major und den Musculus pectoralis minor mit zwei Gefäßzangen, ohne das Gewebe oder die kleinen Blutgefäße zu durchtrennen. Positionieren Sie den selbsthaltenden Weitlaner-Retraktor im Thorax, um die dritte und vierte Rippe zu trennen und so eine ausreichende Freilegung des Herzens zu erreichen, während die Integrität der Rippen erhalten bleibt.
- Präparieren Sie das Perikard vorsichtig mit zwei Pinzetten.
- Verwenden Sie eine Naht aus 6/0 Nylon mit einer gebogenen Nadel, um den LAD 2,0-2,5 mm unterhalb des Mittelpunkts des Conus arteriosus und der Verbindung des linken Vorhofohrs dauerhaft zu ligieren. LAD ist bei einigen Ratten leicht zu erkennen und zu finden.
- Bestätigen Sie die geeignete Ligatur des LAD, nachdem die Vorderwand des linken Ventrikels blass geworden ist.
- In der Scheingruppe wird nur die Naht unter den LAV geführt, aber nicht ligatet.
- Entfernen Sie den Retraktor und drücken Sie die Luft im Brustkorb heraus, bevor Sie den Muskel und die Haut Schicht für Schicht vernähen.
- Legen Sie die Ratten nach der Operation zur Genesung auf ein 37 °C heißes Heizkissen. Überwachen Sie alle Tiere und geben Sie alle 24 Stunden bis zu 72 Stunden Ketoprofen (5 mg/kg SC) zur Analgesie.
HINWEIS: Aus technischen Gründen werden Ratten mit einem geringeren Körpergewicht (weniger als 250 g) für diese Operation bevorzugt. Die Zeit des Offenhaltens des Brustkorbs von Schritt 2.4-2.8 war auf 5 Minuten begrenzt.
3. Beurteilung der Herzfunktion
HINWEIS: Um zu bestätigen, ob sich die Herzinsuffizienz erfolgreich entwickelt hat, wurde die Herzfunktion 4 Wochen nach dem Eingriff mit einem TE7-Ultraschallsystem gemessen, das mit einem elektronischen 13-MHz-Schallkopf ausgestattet war. Während des Echokardiographie-Tests standen die Ratten unter dem gleichen Anästhesieprotokoll, das für den ersten Eingriff verwendet wurde.
- Nachdem Sie die vorderen Brusthaare rasiert haben, positionieren Sie die Ratten auf dem Brett, das für die vorherige Operation verwendet wurde.
- Platzieren Sie die Sonde an der vorderen Brustwand und erhalten Sie Bilder aus der linken parasternalen Langachse (PLAX) des linken Ventrikels (LV) (auf Höhe der Papillarmuskulatur).
- Messen Sie die linksventrikulären Innenmaße an der Enddiastole (LVIDd) und der Endsystole (LVIDs) im M-Modus aus drei aufeinanderfolgenden Herzzyklen.
- Berechnen Sie die LV-Ejektionsfraktion (LVEF) und die LV-Fraktionsverkürzung (LVFS) mit der Software der Maschine.
4. Weitere Analyse des HF-Modells 4 Wochen nach der LAD-Ligation
- Sakrafieren Sie die Ratten 4 Wochen nach der LAD-Ligatur, indem Sie eine Überdosis Isofluran verabreichen. Messen Sie die Serumkonzentrationen von CK-MB, N-terminalem natriuretischem Peptid für das Gehirn (NT-proBNP), Renin, Angiotensin (AngII), Aldosteron (ALD), TNF-α, VEGF, IL-6 und HIF-1α unter Verwendung der ELISA-Kits gemäß dem Protokoll des Herstellers.
- Um die Herzen für die histopathologische Analyse zu entnehmen, perfundieren Sie die Rattenherzen mit physiologischer Kochsalzlösung bei 4 °C, bevor Sie entnommen werden.
- Die Herzen 24 Stunden lang in 10 % Formalin legen, in Paraffin einbetten und in 5,0 μm dicke Abschnitte quer entlang der linksventrikulären Achse schneiden.
- Montieren Sie alle Teile des Herzens auf Objektträger und färben Sie sie einzeln mit Hämatoxylin und Eosin (HE) und Massons Trichrom.
- Für die Messung der Infarktgröße werden die Herzen mit 2,3,5-Triphenyltetrazoliumchlorid (TTC) gefärbt.
- Die Herzen in halbgefrorenem Zustand bei einer Dicke von 3 mm quer von der Spitze bis zur Basis in Scheiben schneiden und 20 Minuten bei 37 °C in 2%iger TTC-Lösung inkubieren.
- Wenn sich die Farbe etabliert hat, die Scheiben 15 Minuten lang in 4%iger Paraformaldehydlösung fixieren und fotografieren.
- Markieren Sie die Infarktgröße und berechnen Sie mit ImageJ. Drücken Sie die Infarktgröße als Prozentsatz der Infarktfläche im Vergleich zur gesamten LV-Fläche aus.
- Um den Kollagengehalt in der Mitte des infarktierten Bereichs von LV quantitativ zu analysieren, färben Sie die Gewebeschnitte des Rattenherzens mit Massons Trichrom.
- Scannen Sie die Bilder nach dem Färben und analysieren Sie. Bewerten Sie den Grad der Fibrose anhand der Kollagenvolumenfraktion (CVF), die als Prozentsatz der fibrotischen Fläche im Vergleich zur gesamten LV-Fläche ausgedrückt wurde.
Ergebnisse
Der Eingriff wurde mit einer niedrigen Sterblichkeitsrate durchgeführt. Die wichtigsten Instrumente, die für dieses Experiment verwendet werden, sind der Weitlaner Self-Retain Retraktor (13,5 cm) und der Isofluran-Verdampfer, der in Abbildung 1 gezeigt ist. Das MI-Modell wurde ohne Beatmung oder Exteriorisation des Herzens entwickelt, wie im Protokoll beschrieben. Während des gesamten Eingriffs wurden alle Rippen in Unversehrtheit gehalten und der gesamte Eingriff dauerte etwa 10 Minuten. Die schematische Darstellung der chirurgischen Ligationsstelle ist in Abbildung 2 dargestellt. In dieser Studie starben 2 Ratten an Kammerflimmern während des Ligaturverfahrens in der MI-Gruppe, und 1 Ratte starb an Blutungen, nachdem das Herz versehentlich von der gebogenen Nadel in der Scheingruppe durchstochen wurde. Die Sterblichkeitsrate lag während des gesamten Experiments bei etwa 5%.
Die Herzfunktion von Ratten war in der MI-Gruppe signifikant reduziert und die Herzinsuffizienz wurde erfolgreich entwickelt. Echokardiographische Messungen wurden 4 Wochen nach dem Eingriff an Ratten durchgeführt, um die Auswirkungen der HF-Modelle zu bewerten (Abbildung 3). Basierend auf den ESC-Leitlinien von 2016 für die Diagnose und Behandlung der akuten und chronischen Herzinsuffizienz12 gelten Ratten mit einer LVEF von weniger als 50 % als erfolgreiche HF-Modelle. Die wichtigsten Parameter im Zusammenhang mit der Herzinsuffizienz wurden in Tabelle 1 zusammengefasst. Beim Vergleich der MI-Gruppe mit der Schein-Gruppe reduzierte sich die LVEF in der MI-Gruppe signifikant (32,7 % ± 8,0 VS 75,3 % ± 4,9, P<0,001). Diese signifikante Abnahme der FS und die Zunahme von LVIDd und LVIDs in der MI-Gruppe waren gute Anzeichen für eine Herzinsuffizienz. Zusätzlich waren die Veränderungen in der ventrikulären Struktur auf den Ultraschallbildern zu sehen (Abbildung 3). Die Kammer von LV wurde größer, und die Wand von LV wurde in der MI-Gruppe im Vergleich zur Scheinkammer dünner und steifer.
Bewertung von Biomarkern für MI und HF nach MI mittels ELISA
Wie in Abbildung 4 und Abbildung 5 gezeigt, stiegen die Serumkonzentrationen des kardialen Markers CK-MB, der zur Unterstützung der Diagnose eines Myokardinfarkts verwendet wurde, in der Myokardinfarktgruppe signifikant um mehr als das 3-fache an. In der Zwischenzeit waren einige Parameter im Zusammenhang mit Herzinsuffizienz wie Renin-, AngII- und ALD-Serumkonzentrationen 4 Wochen nach dem Eingriff im Vergleich zur Scheingruppe höher. Die Konzentrationen von NT-proBNP in der MI-Gruppe waren 13-mal höher als in der Scheingruppe. Auch die Konzentrationen von proinflammatorischen Zytokinen in der MI-Gruppe, einschließlich TNF-α und IL-6, waren im Vergleich zur Scheingruppe um 400% und 300% erhöht. In der Zwischenzeit waren die repräsentativen Angiogenese-bezogenen Faktoren wie VEGF und HIF-1α in der MI-Gruppe im Vergleich zur Scheingruppe ebenfalls um das 2- und 5-fache signifikant höher.
Morphologische Veränderungen und histopathologische Analysen
In der MI-Gruppe ergab die morphologische Analyse der Herzen eine dünne und blasse LV-Wand sowie fibröse Narbenbildung (Abbildung 6). Zusätzlich wurde der Myokardinfarkt auch mittels TTC-Färbung verifiziert und die Infarktgröße getestet (Abbildung 6). Die Infarktgröße betrug 4 Wochen nach dem Eingriff in der MI-Gruppe 40,7±4,4%, was die Zuverlässigkeit und Stabilität der neuen Methode der HF nach MI zeigte. Für die HE-Färbung zeigte die mikroskopische Auswertung eine saubere Anordnung der Myokardfasern ohne entzündliche Veränderung in der Scheingruppe. Die Myokardfasern wurden jedoch in der MI-Gruppe zu einer lockeren und unregelmäßigen Anordnung mit entzündlichen zellulären Infiltraten (Abbildung 7a). Darüber hinaus zeigte die Trichrom-Färbung nach Masson, dass die Bereiche der Herzfibrose in der MI-Gruppe vergrößert waren (Abbildung 7a), und die Kollagenvolumenfraktion (CVF) betrug 39,2±6,9 % in der MI-Gruppe. Die Ergebnisse der Trichrom-Färbung nach Masson stimmten mit der TTC-Färbung überein, was die erfolgreiche Entwicklung von MI- und HF-Modellen weiter bestätigte (Abbildung 7b, 7c).

Abbildung 1. Für die Etablierung des MI-Modells wurden wichtige Instrumente verwendet. (a) Der selbsthaltende Weitlaner-Retraktor (13,5 cm) (Dritter von links); b) die Sauerstoffversorgungsausrüstung; (c) Der Isofluran-Verdampfer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
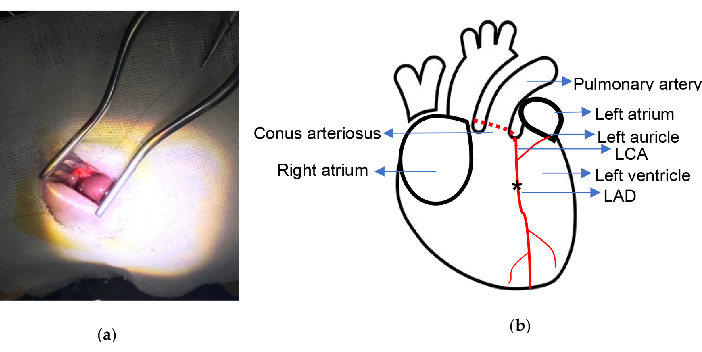
Abbildung 2. Experimenteller Schaltplan. a) Freilegung des Herzens mit selbsthaltendem Weitlaner-Retraktor; b) Die Ligationsstelle ist angegeben. Das Sternchen veranschaulicht die Ligaturposition. LCA, linke Koronararterie; LAD, links anterior absteigend. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
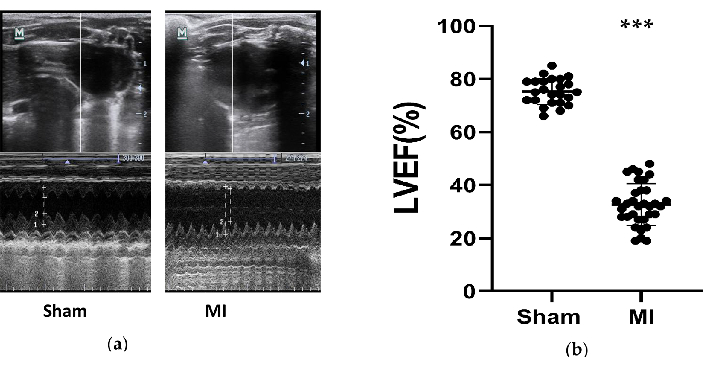
Abbildung 3. Echokardiographische Messungen. a) die repräsentativen Bilder der linken Ventrikelstrukturen aus der Schein- und MI-Gruppe, die mit dem M-Modus während 3 Herzzyklen nach 4 Wochen des Eingriffs getestet wurden; (b) LVEF von Ratten nach 4 Wochen des Eingriffs aus der Schein- (n = 24) und MI-Gruppe (n = 33). MI, Myokardinfarkt. LVEF, Ejektionsfraktion des linken Ventrikels. P < 0,001 im Vergleich zur Scheingruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
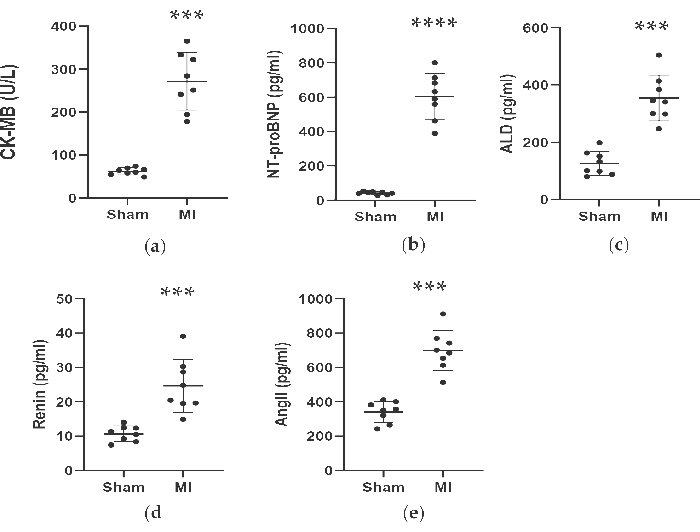
Abbildung 4. Die Konzentrationen von CK-MB, NT-proBNP, ALD, Renin und AngII waren 4 Wochen nach der LAD-Ligation erhöht. Die Daten wurden als Mittelwert ± SD ausgedrückt (n = 8 Tiere in jeder Gruppe). MI, Myokardinfarkt; LAD, links anterior absteigend. P < 0,001 im Vergleich zur Scheingruppe. P < 0,0001 im Vergleich zur Scheingruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
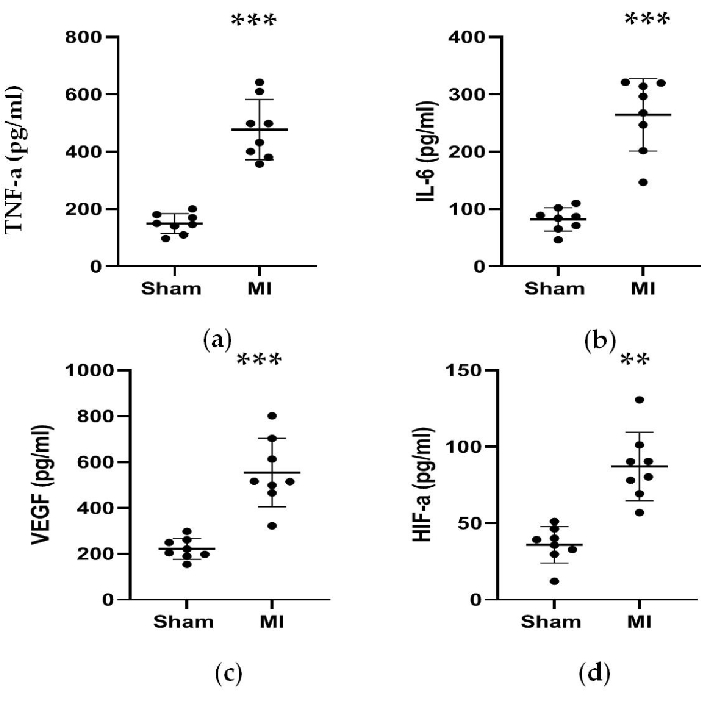
Abbildung 5. Die Konzentrationen von TNF-α, IL-6, VEGF und HIF-α waren 4 Wochen nach der LAD-Ligation erhöht. (a, b) Die Konzentrationen von TNF-α und IL-6, die mit einer Entzündungsreaktion assoziiert sind, waren 4 Wochen nach der LAD-Ligation erhöht; c, d) Die Konzentrationen von VEGF und HIF-α die mit der Angiogenese assoziiert sind, waren 4 Wochen nach der LAD-Ligation erhöht. Die Daten werden als Mittelwert ± SD ausgedrückt (n = 8 Tiere in jeder Gruppe). LAD, links anterior absteigend; MI, Myokardinfarkt. **P < 0,01 im Vergleich zur Scheingruppe. P < 0,001 im Vergleich zur Scheingruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
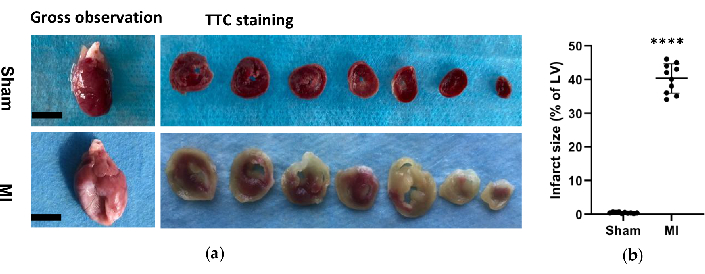
Abbildung 6. Morphologische Analyse der Herzen. (a) Grobbeobachtung und Histologie von Rattenherzen aus der Schein- und MI-Gruppe 4 Wochen nach dem Eingriff. Das MI-Herz zeigte im Vergleich zum Sham-Herz eine dünnere und größere linke Ventrikelwand; Bei den TTC-färbenden Herzen der Schein- und MI-Gruppe wurde lebensfähiges Gewebe rot gefärbt und der Infarktbereich war blass und ungefärbt. (b) Die Größe des Myokardinfarkts wurde als Prozentsatz der Infarktfläche im Verhältnis zur gesamten LV ausgedrückt. Die Daten werden als Mittelwert ± SD ausgedrückt (n = 10 Tiere in jeder Gruppe).MI, Myokardinfarkt; TTC, Triphenyltetrazoliumchlorid; LV, linker Ventrikel. Maßstabsstange = 5 mm. ****P < 0,0001 im Vergleich zur Scheingruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
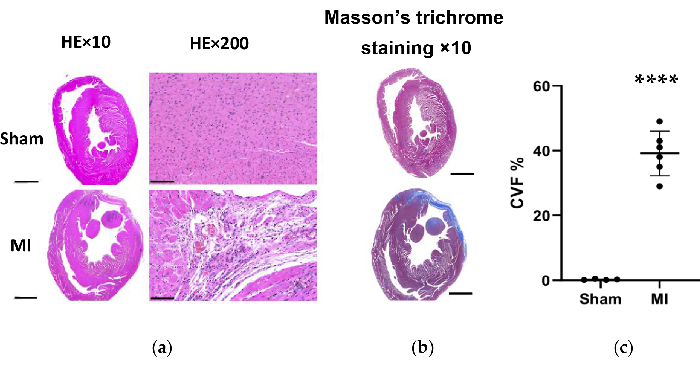
Abbildung 7. HE und Massons Trichrom-Färbung des Herzgewebes der Ratte 4 Wochen nach dem Eingriff. (a) Die LV-Wand des MI-Herzens wurde dünner als die Scheingruppe (HE×10, Skalenbalken = 2 mm). Die mikroskopische Auswertung zeigte eine saubere Anordnung der Myokardfasern ohne entzündliche Veränderung in der Scheingruppe und eine lockere und unregelmäßige Anordnung mit entzündlichen zellulären Infiltraten in der MI-Gruppe (HE×200, Skalenbalken = 100 μm); (b) Die Masson-Trichrom-Färbung von Herzgewebe zeigt die Myokardfibrose in der MI-Gruppe blau (Maßstabsbalken = 2 mm). (c) Kollagenvolumenfraktion für die Masson-Trichrom-Färbung in linksventrikulären Gewebeschnitten der Schein- und MI-Gruppe. Die Daten werden als Mittelwert ± SD ausgedrückt (n = 6 Tiere in der MI-Gruppe). HE, Hämatoxylin und Eosin; MI, Myokardinfarkt; LV, linker Ventrikel. P < 0,0001 im Vergleich zur Scheingruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Parameter | Scheingruppe(n=24) | MI-Gruppe(n=33) |
| LVIDd (mm) | 8.3±1.3 | 10,1±2,9* |
| LVIDs (mm) | 4,1±0,9 | 7,7±1,5*** |
| FS (%) | 42,5±7,8 kg | 22,2±4,4*** |
Tabelle 1: Echokardiographische Daten von Ratten in der Schein- und MI-Gruppe 4 Wochen nach der LAD-Ligatur. Die Daten wurden als Mittelwert ± SD. MI, Myokardinfarkt; LVIDd, linksventrikuläre Innenmaße an der Enddiastole an der Enddiastole; LVIDs, linksventrikuläre Innenmaße an der Endsystole; FS%, prozentuale fraktionelle Verkürzung. *P < 0,05 im Vergleich zur Scheingruppe. P < 0,001 im Vergleich zur Scheingruppe.
Diskussion
Obwohl es viele existierende Modelle von MI oder HF bei Nagetieren gibt 13,14,15, hat diese Studie ein neuartiges und effizientes LAD-Ligaturverfahren zur Induktion von HF nach MI bei Ratten entwickelt. In diesem neuen Ratten-HF-Modell entfiel jedoch der Bedarf an Intubation und Beatmung bzw. Exteriorisation des Herzens, was die Überlebensrate der Ratten signifikant erhöhte. Um dieses neue Ratten-HF-Modell zu entwickeln, ist die Induktion des Myokardinfarkts ein entscheidender Schritt. Im Vergleich zu den konventionellen Protokollen, die in der Regel eine Intubation und Beatmung oder eine Extriorisation des Herzens während der Ligatur beinhalteten 9,16,17, haben wir einen verbesserten Ansatz entwickelt, bei dem das Herz zum ersten Mal weder beatmet noch exteriorisiert wurde, was eine höhere Überlebensrate ermöglichte. Es ist erwähnenswert, dass das verbesserte Verfahren zu weniger Gewebeschäden führt. Daher haben Ratten eine viel schnellere Genesung nach der Operation und eine höhere Überlebensrate. Die folgenden zwei Punkte ermöglichten es uns, diese Ergebnisse zu erzielen: Erstens ermöglichte die kontinuierliche Inhalation von Sauerstoff während des gesamten Eingriffs eine ausreichende Sauerstoffversorgung und Ligatur ohne Beatmung. Zweitens wurde der selbsthaltende Weitlaner-Retraktor, ein wichtiges chirurgisches Instrument, verwendet, um eine ausreichende Exposition des Herzens zu erreichen und gleichzeitig die Integrität der Rippen zu erhalten, was dazu beitrug, eine Exeriorisation des Herzens zu vermeiden.
Es ist allgemein bekannt, dass die erfolgreiche Entwicklung der HF nach dem Myokardinfarkt bei Ratten weitgehend von der Infarktgröße abhängt, die mit der Ligationsstelle der LCA zusammenhängt. Bereits 1979 berichteten Marc A. Pfeefer und seine Kollegen, dass ein LCA-Verschluss bei Ratten leicht zu linksventrikulären Freiwandinfarkten unterschiedlicher Größe führen kann18. Um die Variation der Infarktgrößen zu reduzieren und ein stabileres HF-Modell nach dem Myokardinfarkt zu entwickeln, wurde die LAD-Ligation bei Ratten häufig verwendet, um zu Forschungszwecken einen linksventrikulären Infarkt zu induzieren19. Der Hauptvorteil des LAD-Verschlusses besteht darin, dass er eine genaue Ligatur dieser Arterie ermöglicht, um einen stabilen Myokardinfarkt zu induzieren, der eine Herzinsuffizienz verursachen kann, während eine viel höhere Überlebensrate beibehalten wird. In unserem Verfahren wählten wir die Ligaturposition 2,0-2,5 mm unterhalb des Mittelpunkts der Verbindung zwischen dem Conus arteriosus und dem linken Vorhofohr, was sich als erfolgreich und stabil erwies, mit weniger Schwankungen der LVEF bei allen Ratten der MI-Gruppe. Darüber hinaus haben wir individuell die Infarktgröße durch TTC-Färbung und den Grad der Fibrose durch Masson-Färbung bestimmt, die beide häufig zur Bewertung dieser Art von Modellen verwendet wurden 20,21,22. In der Zwischenzeit wurden die geringeren Variationen dieses Modells auch durch morphologische Veränderungen und histopathologische Analysen veranschaulicht.
Wir untersuchten auch einige Parameter im Zusammenhang mit MI und HF nach 4 Wochen der LAD-Ligatur, um die Entwicklung von HF nach MI zu bestätigen. Die Echokardiographie ist in der Lage, die ventrikuläre Funktion genau und nichtinvasiv zu messen und die Ursachen struktureller Herzerkrankungenzu beurteilen 23. Die LVEFs der Mäuse in der MI-Gruppe lagen alle unter 50%, was als HF12 angesehen werden könnte. In Übereinstimmung mit diesen Ergebnissen wurde die Konzentration von NT-proBNP entsprechend erhöht, was auch ein wichtiger Indikator für eine Beeinträchtigung der Herzfunktion war. Es gibt zahlreiche Belege für Entzündungen und Apoptose im ischämischen Herzen24, 25. Entzündungen und Herzinsuffizienz sind eng miteinander verbunden und verstärken sich gegenseitig26. In unserer Studie untersuchten wir den signifikanten Anstieg der Entzündungsfaktoren IL-6 und TNF-a. Das Renin-Angiotensin-Aldosteron-System (RAAS), das durch renale Hypoperfusion und sympathische Aktivierung aktiviert wird, ist ein zentrales Merkmal in der Pathophysiologie der Herzinsuffizienz27. Wir untersuchten die Parameter, die an der RAAS beteiligt sind, und stellten fest, dass der Serumspiegel von Renin in der MI-Gruppe signifikant höher war als in der Scheingruppe, was die Entwicklung von HF weiter bestätigte.
Bei der LAD-Ligatur gibt es zwei Hauptschwerpunkte. Zunächst müssen die Tiere während des gesamten Eingriffs und bis zur Genesung von der Narkose kontinuierlich mit Sauerstoff versorgt und gleichzeitig warm gehalten werden. Zweitens spielt die Position der Ligatur auf dem LAD eine Schlüsselrolle für die Infarktgröße und den Grad der HF. Die Stelle 2,0-2,5 mm unterhalb des Mittelpunkts der Verbindung zwischen dem Conus arteriosus und dem linken Vorhofohr ist für ein stabiles und erfolgreiches HF-Modell mit geringerer Mortalitätsrate geeignet. Die Einschränkung des neuen HF-Modells bei Ratten besteht jedoch darin, dass das chirurgische Verfahren zur Entwicklung eines Myokardinfarkts ohne Beatmung technisch anspruchsvoll und herausfordernd ist. Der wichtigste Schritt zur Erreichung dieses Modells besteht darin, eine ausreichende Exposition des Herzens zu erhalten, um das Herz im Thorax vollständig sichtbar zu machen und die Zeit, in der der Brustkorb geöffnet ist, auf 5 Minuten zu begrenzen, was vor dem formalen Experiment mehr Übung erfordert.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Dieses Modell wurde mit Unterstützung des Shandong Co-Innovation Center of Classic TCM Formula, Shandong Provincial Education Department, entwickelt. Wir danken Dr. Lianfeng Wu für die Durchführung der Echokardiographie in dieser Studie.
Materialien
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
Referenzen
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten