Method Article
Un nouveau modèle d’insuffisance cardiaque post-infarctus du myocarde chez le rat
Dans cet article
Résumé
Nous avons réussi à développer un modèle fiable et reproductible de l’insuffisance cardiaque post-infarctus du myocarde chez le rat sans ventilation ni extériorisation du cœur. Cela simplifie la procédure et profite aux études ultérieures sur les mécanismes potentiels de l’insuffisance cardiaque.
Résumé
La ligature de l’artère coronaire descendante antérieure gauche (DAL) a été largement utilisée pour établir le modèle rat d’insuffisance cardiaque (IC) après un infarctus du myocarde (IM). Cependant, les inconvénients de ce modèle comprennent un taux de mortalité élevé après la ligature et des variations plus importantes à la fois dans la taille de l’infarctus et le degré d’altération de la fonction cardiaque. De plus, un ventilateur ou une extériorisation du cœur est indispensable pour les modèles précédents, ce qui complique la procédure lors de la ligature. Dans cette étude, nous avons développé un modèle fiable et reproductible sans ventilateur ni extériorisation du cœur par ligature de l’artère coronaire LAD. Quatre semaines après l’intervention, nous avons constaté que les concentrations sériques de CK-MB, NT-proBNP et Renin, qui étaient utilisées pour aider au diagnostic de l’IM et de l’IC, étaient significativement plus élevées dans le groupe IM que dans le groupe simulé. En revanche, la valeur de la fraction d’éjection du ventricule gauche (FEVG) dans le groupe IM était manifestement inférieure à celle du groupe placebo. De plus, la taille de l’infarctus et la zone de fibrose cardiaque ont été confirmées individuellement et analysées quantitativement par coloration TTC et coloration trichrome de Masson. Des variations plus petites ont été observées dans la taille de l’infarctus ou dans la zone de fibrose dans le groupe IM, ce qui a permis de développer un modèle fiable et reproductible de l’IC post-IM. Ce nouveau modèle de HF post-IM chez le rat est essentiel pour étudier les mécanismes potentiels de l’IM et de l’IC. Cette nouvelle méthode peut être utilisée pour développer le nouveau médicament pour le traitement de l’IM et de l’IC chez le rat en utilisant des stratégies pharmacologiques.
Introduction
L’insuffisance cardiaque (IC) est considérée comme un problème de santé publique mondial qui touche plus de 26 millions de patients et dont la prévalence continue d’augmenter1. L’IC est définie comme lorsque le cœur ne pompe pas le sang aussi bien qu’il le devrait. Il existe de nombreux facteurs de risque pour l’IC, notamment les cardiopathies ischémiques, le diabète, l’hypertension, l’hypertrophie VG, l’obésité, le tabagisme, etc.2,3,4. L’infarctus du myocarde (IM) est l’une des causes les plus fréquentes d’IC5. Depuis près de 50 ans, l’IC après l’IM est le principal facteur de morbidité, de mortalité et de coûts des soins de santé6. Pour mieux comprendre le mécanisme physiopathologique de l’IC et pour prévenir et traiter plus efficacement l’IC, un grand nombre de modèles animaux d’IC post-IM ont été développés pour l’étude préclinique. Les rats sont généralement utilisés en raison de leur facilité d’entretien, de leurs coûts réduits, de leur capacité de contrôle et de leur forte homologie avec les humains 7,8,9. La ligature de l’artère coronaire gauche (LCA), en particulier la ligature de la branche descendante antérieure gauche (LAD), est largement utilisée pour développer le modèle de HF post-MI chez le rat8.
Cependant, les chirurgies qui induisent l’IM chez les rats sont souvent techniquement difficiles à réaliser en raison de la grande variation, du fonctionnement compliqué et de la mortalité élevée10,11. Même si un certain nombre d’interventions ont été signalées, la grande majorité des chirurgies nécessitaient soit une ventilation après une intubation trachéale, soit une extériorisation du cœur. Ces méthodes augmentaient le coût de la chirurgie, rendaient l’opération plus difficile et réduisaient la sécurité de l’animal. De plus, l’étendue de l’HF dépend du site de la ligature de l’ACL. La diversité anatomique de l’ACV chez le rat conduit à une incohérence dans les tailles d’infarctus et les paramètres fonctionnels dans le modèle de rat. Différents sites de ligature de l’ACL provoquent une taille d’infarctus spéciale, qui détermine le degré d’IC et le taux de survie.
Dans cette étude, nous avons cherché à créer un modèle HF post-MI fiable et reproductible. Nos résultats ont permis d’opérer des rats sans ventilateur ni extériorisation du cœur, ce qui a entraîné un taux de survie élevé. De plus, le site relativement fixe de la ligature du DAL a entraîné moins de variations de l’IC 4 semaines après la chirurgie. De plus, nous avons évalué les effets du modèle IC en utilisant la coloration histopathologique, la détection biochimique et la mesure de la fonction cardiaque, ce qui a permis d’étudier les mécanismes potentiels de la maladie et de développer de nouveaux médicaments pour traiter l’IC.
Protocole
Le protocole a été approuvé par le Comité de recherche en éthique animale de l’Université de médecine traditionnelle chinoise du Shandong.
REMARQUE : Des rats Sprague-Dawley mâles adultes, âgés de 10 semaines, pesant de 180 à 220 g, ont été divisés au hasard en 2 groupes, placebo (n = 25) et IM (n = 35). Les animaux ont été maintenus selon un cycle lumière/obscurité de 12/12 h et ont reçu de l’eau et de la nourriture à volonté.
1. Anesthésie et apport continu d’oxygène
- Placez les rats dans une chambre d’induction et anesthésez-les avec de l’isoflurane à 3 %.
- Pour confirmer si l’anesthésie était prête, observez le réflexe de pincement des orteils. L’anesthésie est suffisante lorsque le réflexe de pincement de l’orteil disparaît.
- Déplacez individuellement les rats vers une petite planche de chirurgie à température contrôlée. Collez les pattes du rat sur la planche.
- Fixez un masque sur le visage du rat qui fournit un apport constant de 3 % d’isoflurane et de 1 % d’oxygène.
2. Induction de l’IM sans ventilation ni extériorisation du cœur
- Utilisez des crèmes dépilatoires pour enlever les poils du thorax pour la stérilisation.
- Utilisez un champ stérile avec un trou de 1 cm x 3 cm au niveau du champ chirurgical du rat.
- Confirmez une profondeur suffisante de l’anesthésie avec un pincement des orteils avant l’opération.
- Ouvrez la poitrine avec une incision transversale de 2,5 cm entre le troisième et le quatrième espace intercostal sur le bord gauche du sternum sans couper les côtes.
- Séparez les muscles du grand pectoral et du petit pectoral à l’aide de deux pinces vasculaires sans couper les tissus ou les petits vaisseaux sanguins. Positionnez l’écarteur auto-retenant Weitlaner dans le thorax pour séparer la troisième et la quatrième côte afin d’obtenir une exposition suffisante du cœur tout en préservant l’intégrité des côtes.
- Disséquez délicatement le péricarde à l’aide de deux pinces.
- Utilisez une suture en nylon 6/0 avec une aiguille incurvée pour ligaturer de façon permanente le DAL de 2,0 à 2,5 mm sous le point médian du cône artériel et de la connexion de l’appendice auriculaire gauche. Le DAL peut être facilement reconnu et trouvé chez certains rats.
- Confirmer la ligature appropriée du DAL après que la paroi antérieure du ventricule gauche soit devenue pâle.
- Dans le groupe fictif, passez uniquement la suture sous le LAD, mais ne ligatez pas.
- Retirez l’écarteur et évacuez l’air du thorax avant de suturer le muscle et la peau couche par couche.
- Après l’opération, placez les rats sur un coussin chauffant à 37 °C pour les récupérer. Surveiller tous les animaux et fournir du kétoprofène (5 mg/kg SC) pour l’analgésie toutes les 24 heures jusqu’à 72 heures.
REMARQUE : Pour des raisons techniques, les rats ayant un poids corporel plus petit (moins de 250 g) sont préférés pour cette opération. Le temps de maintien de la poitrine ouverte, de l’étape 2.4 à 2.8, a été limité à 5 minutes.
3. Évaluation de la fonction cardiaque
REMARQUE : Pour confirmer si l’IC s’est développée avec succès, la fonction cardiaque a été mesurée 4 semaines après l’intervention à l’aide d’un système d’échographie TE7 équipé d’un transducteur électronique de 13 MHz. Au cours de l’échocardiographie, les rats ont été soumis au même protocole d’anesthésie que celui utilisé pour la procédure initiale.
- Après avoir rasé les poils antérieurs de la poitrine, placez les rats sur la planche utilisée pour l’opération précédente.
- Placez la sonde sur la paroi thoracique antérieure et obtenez des images à partir des vues parasternales gauches du grand axe (PLAX) du ventricule gauche (VG) (au niveau des muscles papillaires).
- Mesurez les dimensions internes du ventricule gauche à la fin de la diastole (LVIDd) et à la fin de la systole (LVIDs) par le mode M à partir de trois cycles cardiaques consécutifs.
- Calculez la fraction d’éjection BT (LVEF) et le raccourcissement fractionnel LV (LVFS) à l’aide du logiciel de la machine.
4. Analyse plus poussée du modèle HF 4 semaines après la ligature LAD
- Sacrafice les rats 4 semaines après la ligature LAD en administrant une surdose d’isoflurane. Mesurez les concentrations sériques de CK-MB, de peptide natriurétique N-terminal pro-cérébral (NT-proBNP), de rénine, d’angiotensine (AngII), d’aldostérone (ALD), de TNF-α, de VEGF, d’IL-6 et de HIF-1α à l’aide des kits ELISA conformément au protocole du fabricant.
- Pour prélever les cœurs pour une analyse histopathologique, perfuser les cœurs de rat avec une solution saline physiologique à 4 °C avant d’être retirés.
- Fixez les cœurs dans du formol à 10 % pendant 24 heures, incorporez-les dans de la paraffine et coupez en sections transversales de 5,0 μm d’épaisseur le long de l’axe ventriculaire gauche.
- Montez toutes les sections du cœur sur des lames de verre et colorez-les individuellement avec de l’hématoxyline et de l’éosine (HE) et du trichrome de Masson.
- Pour mesurer la taille de l’infarctus, colorez les cœurs avec du chlorure de 2,3,5-triphényltétrazolium (TTC).
- Trancher transversalement les cœurs sur 3 mm d’épaisseur de l’apex à la base à l’état semi-congelé et les incuber dans une solution à 2 % TTC pendant 20 minutes à 37 °C.
- Une fois la couleur établie, fixez les tranches dans une solution de paraformaldéhyde à 4 % pendant 15 minutes et prenez des photos.
- Marquez la taille de l’infarctus et calculez à l’aide d’ImageJ. Exprimez la taille de l’infarctus en pourcentage de la surface de l’infarctus par rapport à la surface totale du ventracule bastibulaire.
- Pour analyser quantitativement la teneur en collagène au milieu de la zone infarctus du VG, colorez les sections de tissu cardiaque de rat avec le trichrome de Masson.
- Après la coloration, scannez les images et analysez-les. Évaluez le degré de fibrose par la fraction volumique de collagène (CVF) qui a été exprimée en pourcentage de la zone fibrotique par rapport à la surface VG totale.
Résultats
La procédure a été réalisée avec un faible taux de mortalité. Les principaux instruments utilisés pour cette expérience sont l’écarteur auto-rétentif Weitlaner (13,5 cm) et le vaporisateur d’isoflurane illustrés à la figure 1. Le modèle d’IM a été développé sans ventilation ni extériorisation du cœur, comme décrit dans le protocole. Pendant toute la procédure, toutes les côtes ont été maintenues en intégrité et l’ensemble de la procédure a duré environ 10 minutes. Le schéma du site de ligature chirurgicale est illustré à la figure 2. Dans cette étude, 2 rats sont morts d’une fibrillation ventriculaire pendant la procédure de ligature dans le groupe IM, et 1 rat est mort d’une hémorragie après que le cœur ait été accidentellement percé par l’aiguille incurvée dans le groupe fictif. Le taux de mortalité était d’environ 5 % tout au long de l’expérience.
La fonction cardiaque des rats a été considérablement réduite dans le groupe IM, et l’IC a été développée avec succès. Des mesures échocardiographiques ont été obtenues chez le rat 4 semaines après l’intervention pour évaluer les effets des modèles HF (Figure 3). Sur la base des lignes directrices de l’ESC de 2016 pour le diagnostic et le traitement de l’insuffisance cardiaque aiguë et chronique12, les rats avec une FEVG inférieure à 50 % sont considérés comme des modèles d’IC réussis. Les principaux paramètres liés à l’insuffisance cardiaque ont été résumés dans le tableau 1. En comparant le groupe IM au groupe fictif, la FEVG dans le groupe IM a diminué de manière significative (32,7 % ± 8,0 VS 75,3 % ± 4,9, P<0,001). Ces diminutions significatives du SF et les augmentations des LVIDd et des LVID dans le groupe IM étaient de bons signes d’IC. De plus, les modifications de la structure ventriculaire ont été observées sur les images échographiques (figure 3). La chambre de LV est devenue plus grande, et la paroi de LV est devenue plus mince et plus rigide dans le groupe MI par rapport au simulacre.
Évaluation des biomarqueurs de l’IM et de l’IC post-IM par ELISA
Comme le montrent les figures 4 et 5, les concentrations sériques du marqueur cardiaque CK-MB utilisé pour aider au diagnostic de l’IM ont augmenté de manière significative de plus de 3 fois dans le groupe IM. Pendant ce temps, certains paramètres liés à l’insuffisance cardiaque, tels que les concentrations sériques de rénine, d’AngII et d’ALD, étaient plus élevés par rapport au groupe placebo 4 semaines après l’intervention. Les concentrations de NT-proBNP dans le groupe IM étaient 13 fois plus élevées que dans le groupe placebo. De plus, les concentrations de cytokines pro-inflammatoires dans le groupe IM, y compris le TNF-α et l’IL-6, ont augmenté de 400 % et de 300 % par rapport au groupe placebo. Pendant ce temps, les facteurs représentatifs liés à l’angiogenèse tels que le VEGF et le HIF-1α étaient également significativement plus élevés de 2 et 5 fois dans le groupe IM par rapport au groupe fictif.
Altérations morphologiques et analyses histopathologiques
Dans le groupe IM, l’analyse morphologique des cœurs a révélé une paroi LV fine et pâle ainsi que la formation de cicatrices fibreuses (Figure 6). De plus, l’IM a également été vérifié à l’aide d’une coloration TTC et la taille de l’infarctus a été testée (figure 6). La taille de l’infarctus était de 40,7±4,4 % 4 semaines après l’intervention dans le groupe IM, ce qui a montré la fiabilité et la stabilité de la nouvelle méthode de HF post-IM. Pour la coloration HE, l’évaluation microscopique a montré un arrangement soigné des fibres myocardiques sans changement inflammatoire dans le groupe placebo. Cependant, les fibres myocardiques sont devenues un arrangement lâche et irrégulier avec des infiltrats cellulaires inflammatoires dans le groupe MI (Figure 7a). De plus, la coloration trichrome de Masson a révélé que les zones de fibrose cardiaque étaient augmentées dans le groupe IM (Figure 7a), et que la fraction volumique de collagène (CVF) était de 39,2±6,9 % dans le groupe IM. Les résultats de la coloration trichrome de Masson étaient cohérents avec ceux de la coloration TTC, ce qui a confirmé le développement réussi des modèles MI et HF (figures 7b, 7c).

Graphique 1. Des instruments clés ont été utilisés pour établir le modèle de l’IM. a) L’enrouleur autobloquant Weitlaner (13,5 cm) (troisième à partir de la gauche) ; b) L’équipement d’alimentation en oxygène ; (c) Le vaporisateur d’isoflurane. Veuillez cliquer ici pour voir une version agrandie de cette figure.
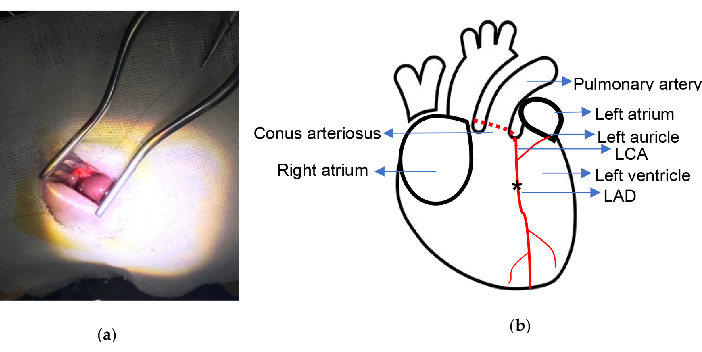
Graphique 2. Schéma expérimental. a) Exposition du cœur à l’aide d’un écarteur autorétracteur Weitlaner ; (b) Le lieu de ligature est indiqué. L’astérisque illustre la position de ligature. ACL, artère coronaire gauche ; LAD, antérieure gauche descendante. Veuillez cliquer ici pour voir une version agrandie de cette figure.
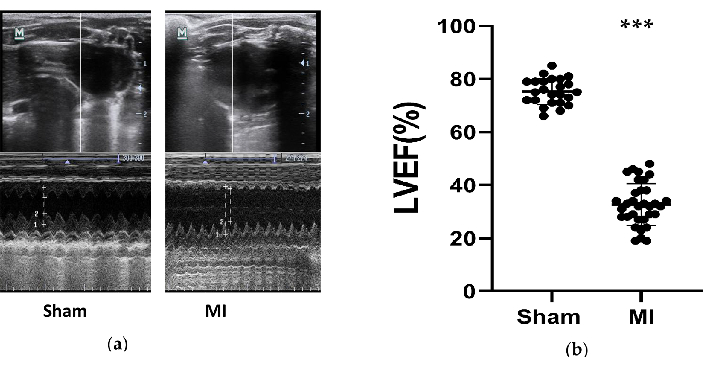
Graphique 3. Mesures échocardiographiques. (a) Les images représentatives des structures du ventricule gauche du groupe simulé et IM testées par M-Mode pendant 3 cycles cardiaques après 4 semaines de l’intervention ; (b) FEVG de rats après 4 semaines de procédure dans le groupe simulé (n = 24) et IM (n = 33). IM, infarctus du myocarde. FEVG, fraction d’éjection du ventricule gauche. P < 0,001 par rapport au groupe fictif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
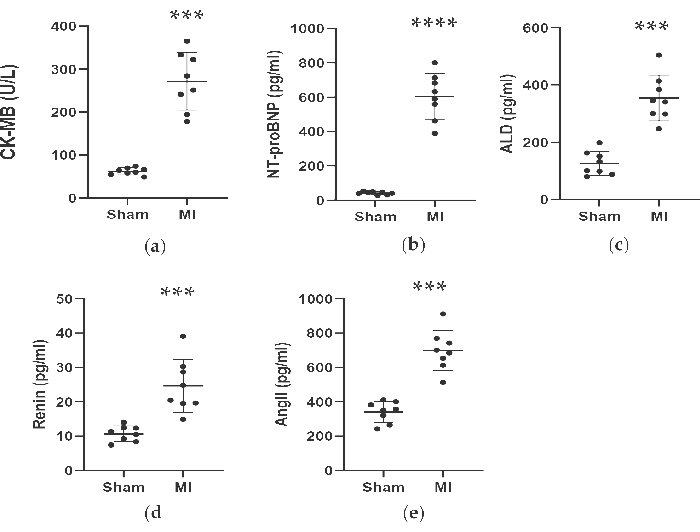
Graphique 4. Les concentrations de CK-MB, NT-proBNP, ALD, Renin et AngII ont été augmentées 4 semaines après la ligature du DAL. Les données ont été exprimées en moyenne ± ET (n = 8 animaux dans chaque groupe). IM, infarctus du myocarde ; LAD, antérieure gauche descendante. P < 0,001 par rapport au groupe fictif. P < 0,0001 par rapport au groupe fictif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
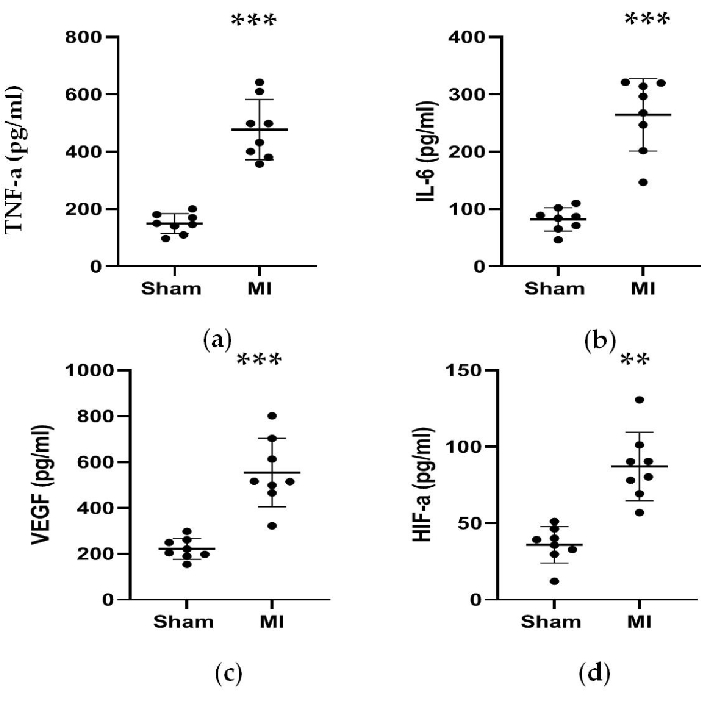
Graphique 5. Les concentrations de TNF-α, d’IL-6, de VEGF et de HIF-α ont augmenté 4 semaines après la ligature LAD. (a, b) Les concentrations de TNF-α et d’IL-6 associées à la réponse inflammatoire ont augmenté 4 semaines après la ligature LAD ; c, d) Les concentrations de VEGF et de HIF-α associées à l’angiogenèse ont augmenté 4 semaines après la ligature du DAL. Les données sont exprimées en moyenne ± ET (n = 8 animaux dans chaque groupe). LAD, descendant antérieur gauche ; IM, infarctus du myocarde. **P < 0,01 par rapport au groupe fictif. P < 0,001 par rapport au groupe fictif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
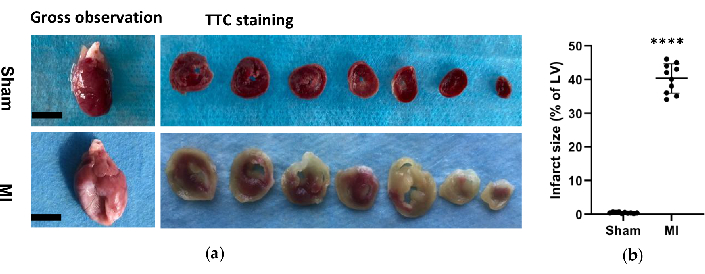
Graphique 6. Analyse morphologique des cœurs. (a) Observation et histologie grossières des cœurs de rats du groupe simulé et IM 4 semaines après l’intervention. Le cœur de l’IM présentait une paroi du ventricule gauche plus mince et plus grande par rapport au placebo ; Pour les cœurs de coloration TTC du groupe placebo et IM, les tissus viables étaient colorés en rouge et la zone de l’infarctus était pâle et non colorée. (b) La taille de l’infarctus du myocarde a été exprimée en pourcentage de la surface de l’infarctus par rapport à l’ensemble du VG. Les données sont exprimées en moyenne ± ET (n = 10 animaux dans chaque groupe).IM, infarctus du myocarde ; TTC, chlorure de triphényltétrazolium ; VG, ventricule gauche. Barre d’échelle = 5 mm. ****P < 0,0001 par rapport au groupe fictif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
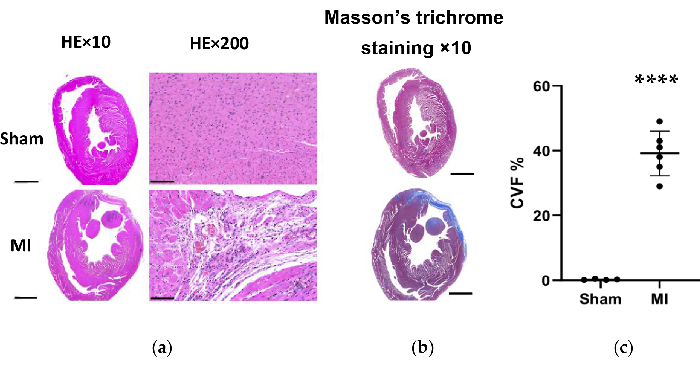
Graphique 7. Coloration trichrome du tissu cardiaque du rat par HE et Masson 4 semaines après l’intervention. (a) La paroi VG du cœur de l’IM est devenue plus mince que celle du groupe placebo (HE×10, barre d’échelle = 2 mm). L’évaluation microscopique a montré un arrangement soigné des fibres myocardiques sans changement inflammatoire dans le groupe placebo et a montré un arrangement lâche et irrégulier avec des infiltrats cellulaires inflammatoires dans le groupe MI (HE×200, barre d’échelle = 100 μm) ; (b) La coloration trichrome du tissu cardiaque par Masson montre que la fibrose myocardique est bleue dans le groupe IM (barre d’échelle = 2 mm). (c) Fraction volumique de collagène pour la coloration trichrome de Masson dans les tranches de tissu ventriculaire gauche des groupes placebo et IM. Les données sont exprimées en moyenne ± ET (n = 6 animaux dans le groupe IM). HE, hématoxyline et éosine ; IM, infarctus du myocarde ; VG, ventricule gauche. P < 0,0001 par rapport au groupe fictif. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Paramètres | Groupe fictif (n = 24) | Groupe IM (n = 33) |
| LVIDd (mm) | 8.3±1.3 | 10.1±2.9* |
| VIDV (mm) | 4.1±0.9 | 7,7±1,5*** |
| FS ( %) | 42,5±7,8 | 22,2±4,4*** |
Tableau 1 : Données échocardiographiques de rats du groupe simulé et IM 4 semaines après la ligature LAD. Les données ont été exprimées en moyennes ± écart-type, infarctus du myocarde ; LVIDd, dimensions internes ventriculaires gauches à la fin de la diastole à la fin de la diastole ; VID, dimensions internes du ventricule gauche en fin de systole ; FS %, pourcentage de raccourcissement fractionnel. *P < 0,05, par rapport au groupe fictif. P < 0,001 par rapport au groupe fictif.
Discussion
Bien qu’il existe de nombreux modèles d’IM ou d’IC chez les rongeurs 13,14,15, cette étude a mis au point une procédure de ligature LAD nouvelle et efficace pour induire l’IC post-IM chez les rats. Cependant, dans ce nouveau modèle d’HF chez le rat, les besoins d’intubation et de ventilation ou d’extériorisation du cœur ont été éliminés, ce qui a considérablement augmenté le taux de survie des rats. Pour développer ce nouveau modèle HF chez le rat, l’induction de l’IM est une étape cruciale. Par rapport aux protocoles conventionnels qui impliquaient généralement l’intubation et la ventilation ou l’extériorisation du cœur pendant la ligature 9,16,17, nous avons développé une approche améliorée sans ventilation ni extériorisation du cœur pour la première fois, permettant un taux de survie plus élevé. Il convient de noter que la procédure améliorée permet de réduire les lésions tissulaires. Par conséquent, les rats ont une récupération post-opératoire beaucoup plus rapide et un taux de survie plus élevé. Les deux points suivants nous ont permis d’obtenir ces résultats : Tout d’abord, l’inhalation continue d’oxygène pendant toute la procédure a permis une oxygénation et une ligature suffisantes sans ventilation. Deuxièmement, l’écarteur auto-rétentif Weitlaner, un instrument chirurgical clé, a été utilisé pour obtenir une exposition suffisante au cœur tout en préservant l’intégrité des côtes, ce qui a permis d’éviter l’extériorisation du cœur.
Il est bien connu que le développement réussi de l’IC post-IM chez le rat dépend en grande partie de la taille de l’infarctus, qui est liée au site de ligature de l’ACL. Dès 1979, Marc A. Pfeefer et ses collègues ont rapporté que l’occlusion de l’ACL chez le rat pouvait facilement provoquer des infarctus de la paroi libre du ventricule gauche de différentes tailles18. Afin de réduire la variation de la taille des infarctus et de développer un modèle HF plus stable après l’infarctus du myocarde, la ligature LAD a été couramment utilisée chez le rat pour induire un infarctus ventriculaire gauche à des fins de recherche19. Le principal avantage de l’occlusion LAD est de permettre une ligature précise de cette artère pour induire un IM stable qui peut provoquer une IC tout en maintenant un taux de survie beaucoup plus élevé. Dans notre procédure, nous avons choisi la position de ligature à 2,0-2,5 mm en dessous du point médian de la connexion entre le cône artériel et l’appendice auriculaire gauche, ce qui s’est avéré efficace et stable avec moins de variations de FEVG chez tous les rats du groupe IM. De plus, nous avons déterminé individuellement la taille de l’infarctus par coloration TTC et le degré de fibrose par coloration de Masson, qui ont toutes deux été largement utilisées pour évaluer ce type de modèle 20,21,22. Parallèlement, les variations moindres de ce modèle ont également été illustrées par des altérations morphologiques et des analyses histopathologiques.
Nous avons également étudié certains paramètres liés à l’IM et à l’IC après 4 semaines de ligature LAD pour aider à confirmer le développement de l’IC après l’IM. L’échocardiographie a la capacité de mesurer avec précision et de manière non invasive la fonction ventriculaire et d’évaluer les causes de la cardiopathie structurelle23. Les FEVG des souris du groupe IM étaient toutes inférieures à 50 %, ce qui pourrait être considéré comme HF12. Conformément à ces résultats, la concentration de NT-proBNP a été augmentée en conséquence, ce qui était également un indicateur important de l’altération de la fonction cardiaque. Il existe de nombreuses preuves de l’inflammation et de l’apoptose dans le cœur ischémique24, 25. L’inflammation et l’insuffisance cardiaque sont fortement interconnectées et se renforcent mutuellement26. Dans notre étude, nous avons évalué l’augmentation significative des facteurs d’inflammation, l’IL-6 et le TNF-a. Le système rénine-angiotensine-aldostérone (SRAA) activé par l’hypoperfusion rénale et l’activation sympathique est une caractéristique centrale de la physiopathologie de l’insuffisance cardiaque27. Nous avons évalué les paramètres impliqués dans le SRAA et nous avons constaté que le taux sérique de rénine était significativement plus élevé dans le groupe IM par rapport au groupe fictif, ce qui a permis de vérifier le développement de l’IC.
Il y a deux points principaux sur lesquels mettre l’accent lors de la procédure de ligature LAD. Tout d’abord, pendant toute la procédure et jusqu’à ce qu’ils se remettent de l’anesthésie, fournissez un apport continu d’oxygène aux animaux tout en les gardant au chaud. Deuxièmement, la position de la ligature sur le DAL joue un rôle clé dans la taille de l’infarctus et le degré de HF. Le site, situé à 2,0 à 2,5 mm au-dessous du point médian de la connexion entre le cône artériel et l’appendice auriculaire gauche, convient à un modèle d’IC stable et réussi avec un taux de mortalité moindre. Cependant, la limite du nouveau modèle HF chez le rat est que la procédure chirurgicale pour développer un IM sans ventilation est techniquement exigeante et difficile. L’étape clé pour réaliser ce modèle est d’obtenir une exposition suffisante du cœur pour visualiser pleinement le cœur à l’intérieur du thorax et de limiter le temps d’ouverture de la poitrine à 5 minutes, ce qui nécessite plus de pratique avant l’expérience formelle.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce modèle a été développé avec le soutien du Shandong Co-Innovation Center of Classic TCM Formula, Département de l’éducation de la province du Shandong. Nous tenons à remercier le Dr Lianfeng Wu d’avoir effectué l’échocardiographie dans cette étude.
matériels
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
Références
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon