Method Article
Um novo modelo de insuficiência cardíaca pós-infarto do miocárdio no rato
Neste Artigo
Resumo
Desenvolvemos com sucesso um modelo confiável e reprodutível de insuficiência cardíaca pós-infarto do miocárdio no rato sem ventilação ou exteriorização do coração. Isso simplifica o procedimento e beneficia os estudos adicionais sobre os possíveis mecanismos por trás da insuficiência cardíaca.
Resumo
A ligadura da artéria coronária descendente anterior (DA) tem sido amplamente utilizada para estabelecer o modelo de insuficiência cardíaca (IC) pós-infarto do miocárdio (IM) em ratos. No entanto, as desvantagens desse modelo incluem alta taxa de mortalidade após a ligadura e maiores variações tanto no tamanho do infarto quanto no grau de comprometimento da função cardíaca. Além disso, um ventilador ou exteriorização do coração é indispensável para os modelos anteriores, o que dificulta o procedimento durante a ligadura. Neste estudo, desenvolvemos um modelo confiável e reprodutível sem o ventilador ou exteriorização do coração por ligadura da artéria coronária ADA. Quatro semanas após o procedimento, observamos que as concentrações séricas de CK-MB, NT-proBNP e Renina, que foram usadas para auxiliar no diagnóstico de IM e IC, foram significativamente maiores no grupo IM em comparação com o grupo simulado. Em contraste, o valor da fração de ejeção do ventrículo esquerdo (FEVE) no grupo IM foi obviamente menor do que no grupo simulado. Além disso, o tamanho do infarto e a área de fibrose cardíaca foram confirmados individualmente e analisados quantitativamente pela coloração TTC e tricrômico de Masson. Variações menores foram encontradas no tamanho do infarto ou na área de fibrose no grupo IM, o que ajudou a desenvolver um modelo confiável e reprodutível de IC pós-IM. Este novo modelo de IC pós-IM no rato é vital para estudar os mecanismos potenciais de IM e IC. Este novo método pode ser usado para desenvolver o novo medicamento para o tratamento de IM e IC em ratos usando estratégias farmacológicas.
Introdução
A insuficiência cardíaca (IC) é considerada um problema de saúde pública mundial que afeta mais de 26 milhões de pacientes e a prevalência ainda está aumentando1. A IC é definida como quando o coração não bombeia sangue tão bem quanto deveria. Existem muitos fatores de risco para IC, incluindo doença isquêmica do coração, diabetes, hipertensão, hipertrofia do VE, obesidade, tabagismo, etc.2,3,4. O infarto do miocárdio (IM) é uma das causas mais comuns de IC5. Por quase 50 anos, a IC após o infarto do miocárdio tem sido o principal fator de morbidade, mortalidade e custo de saúde tardios6. Para uma melhor compreensão do mecanismo fisiopatológico da IC e para prevenir e tratar a IC de forma mais eficaz, um grande número de modelos animais de IC pós-IM foi desenvolvido para estudo pré-clínico. Os ratos são normalmente usados devido à fácil manutenção, custos mais baixos, capacidade de controle e alta homologia com humanos 7,8,9. A ligadura da artéria coronária esquerda (ACE), especialmente a ligadura do ramo descendente anterior (DA), é amplamente utilizada para desenvolver o modelo de IC pós-IM no rato8.
No entanto, as cirurgias que induzem IM em ratos são frequentemente tecnicamente desafiadoras de realizar devido à alta variação, operação complicada e alta mortalidade10,11. Embora alguns procedimentos tenham sido relatados, a grande maioria das cirurgias exigiu ventilação após intubação traqueal ou exteriorização do coração. Esses métodos aumentaram o custo da cirurgia, dificultaram a operação e reduziram a segurança do animal. Além disso, a extensão da IC depende do local da ligadura da ACL. A diversidade anatômica da ACL em ratos leva à inconsistência nos tamanhos dos infartos e parâmetros funcionais no modelo de rato. Diferentes locais de ligadura da ACL causam tamanho especial do infarto, que determina o grau de IC e a taxa de sobrevida.
Neste estudo, nosso objetivo foi criar um modelo de IC pós-IM confiável e reprodutível. Nossos achados permitiram cirurgias de ratos sem ventilador ou exteriorização do coração, o que resultou em uma alta taxa de sobrevida. Além disso, o local relativamente fixo da ligadura da DAE levou a menos variações de IC 4 semanas após a cirurgia. Além disso, avaliamos os efeitos do modelo de IC usando coloração histopatológica, detecção bioquímica e medição da função cardíaca, o que ajudou a estudar os mecanismos potenciais por trás da doença e desenvolver novos medicamentos para tratar a IC.
Protocolo
O protocolo foi aprovado pelo Comitê de Pesquisa de Ética Animal da Universidade de Medicina Tradicional Chinesa de Shandong.
NOTA: Ratos Sprague-Dawley machos adultos, com 10 semanas de idade, pesando 180-220 g, foram divididos aleatoriamente em 2 grupos, sham (n = 25) e MI (n = 35). Os animais foram mantidos em ciclo claro/escuro de 12/12 h e receberam água e ração ad libitum.
1. Anestesia e fornecimento contínuo de oxigênio
- Coloque os ratos em uma câmara de indução e anestesiar com isoflurano a 3%.
- Para confirmar se a anestesia estava pronta, observe o reflexo de pinça do dedo do pé. A anestesia é suficiente quando o reflexo de pinça do dedo do pé desaparece.
- Mova individualmente os ratos para uma pequena placa de cirurgia com temperatura controlada. Prenda as patas do rato no quadro.
- Coloque uma máscara no rosto do rato que forneça um suprimento constante de 3% de isoflurano e 1% de oxigênio.
2. Indução de infarto do miocárdio sem ventilação ou exteriorização do coração
- Use cremes depilatórios para remover os pelos do tórax para esterilização.
- Use um campo estéril com um orifício de 1 cm x 3 cm no campo cirúrgico do rato.
- Confirme a profundidade suficiente da anestesia com uma pitada no dedo do pé antes de operar.
- Abra o tórax com uma incisão transversal de 2,5 cm entre o terceiro e o quarto espaço intercostal na borda esquerda do esterno sem cortar as costelas.
- Separe os músculos peitoral maior e peitoral menor usando duas pinças vasculares sem cortar o tecido ou pequenos vasos sanguíneos. Posicione o afastador de retenção automática Weitlaner no tórax para separar a terceira e a quarta costelas para obter exposição suficiente do coração, mantendo a integridade da costela.
- Dissecar delicadamente o pericárdio com duas pinças.
- Use uma sutura de náilon 6/0 com uma agulha curva para ligar permanentemente a DA 2,0-2,5 mm abaixo do ponto médio da conexão do cone arterial e do apêndice atrial esquerdo. LAD pode ser facilmente reconhecido e encontrado em alguns ratos.
- Confirme a ligadura apropriada da DA após a parede anterior do ventrículo esquerdo ficar pálida.
- No grupo simulado, passe apenas a sutura sob a DA, mas não ligue.
- Remova o afastador e esprema o ar no tórax antes de suturar o músculo e a pele camada por camada.
- Após a cirurgia, coloque os ratos em uma almofada de aquecimento a 37 ° C para recuperação. Monitore todos os animais e forneça cetoprofeno (5 mg / kg SC) para analgesia a cada 24 horas até 72 horas.
NOTA: Por razões técnicas, ratos com pesos corporais menores (menos de 250 g) são preferidos para esta operação. O tempo de manter o tórax aberto, do passo 2.4-2.8, foi limitado a 5 minutos.
3. Avaliação da função cardíaca
NOTA: Para confirmar se a IC se desenvolveu com sucesso, a função cardíaca foi medida 4 semanas após o procedimento usando um sistema de ultrassom TE7 equipado com um transdutor eletrônico de 13 MHz. Durante o exame ecocardiográfico, os ratos estavam sob o mesmo protocolo anestésico utilizado para o procedimento inicial.
- Depois de raspar os pelos anteriores do peito, posicione os ratos na prancha usada para a operação anterior.
- Coloque a sonda na parede torácica anterior e obtenha imagens das incidências do eixo longo paraesternal esquerdo (PLAX) do ventrículo esquerdo (VE) (ao nível dos músculos papilares).
- Meça as dimensões internas do ventrículo esquerdo na diástole final (LVIDd) e na sístole final (LVIDs) pelo modo M a partir de três ciclos cardíacos consecutivos.
- Calcule a fração de ejeção do VE (FEVE) e o encurtamento fracionário do VE (VVE) pelo software da máquina.
4. Análise adicional do modelo de IC 4 semanas após a ligadura da LAD
- Sacrafice os ratos 4 semanas após a ligadura da LAD, administrando uma overdose de isoflurano. Meça as concentrações séricas de CK-MB, peptídeo natriurético pró-cérebro N-terminal (NT-proBNP), Renina, Angiotensina (AngII), Aldosterona (ALD), TNF-α, VEGF, IL-6 e HIF-1α usando os kits ELISA de acordo com o protocolo do fabricante.
- Para colher os corações para análise histopatológica, perfundir os corações dos ratos com solução salina fisiológica a 4 °C antes de serem removidos.
- Defina os corações em formol a 10% por 24 horas, embebido em parafina e corte em cortes de 5,0 μm de espessura transversalmente ao longo do eixo do ventrículo esquerdo.
- Monte todas as seções do coração em lâminas de vidro e pinte individualmente com Hematoxilina e Eosina (HE) e tricrômico de Masson.
- Para fins de medição do tamanho do infarto, corar os corações com cloreto de 2,3,5-trifenil tetrazólio (TTC).
- Corte os corações transversalmente a 3 mm de espessura do ápice à base em um estado semicongelado e incubado em solução TTC a 2% por 20 minutos a 37 ° C.
- Quando a cor estiver estabelecida, fixe as fatias em solução de paraformaldeído a 4% por 15 minutos e tire fotos.
- Marque o tamanho do infarto e calcule usando ImageJ. Expresse o tamanho do infarto como uma porcentagem da área do infarto versus a área total do VE.
- Para analisar quantitativamente o conteúdo de colágeno no meio da área infartada do VE, corar as seções do tecido cardíaco do rato com tricrômico de Masson.
- Após a coloração, digitalize as imagens e analise. Avaliar o grau de fibrose pela fração volumétrica de colágeno (CVF), que foi expressa em porcentagem da área fibrótica versus a área total do VE.
Resultados
O procedimento foi realizado com baixa taxa de mortalidade. Os principais instrumentos utilizados para este experimento são o afastador auto-retentor Weitlaner (13,5 cm) e o vaporizador de isoflurano mostrado na Figura 1. O modelo de IM foi desenvolvido sem ventilação ou exteriorização do coração, conforme descrito no protocolo. Durante todo o procedimento, todas as costelas foram mantidas em integridade e todo o procedimento levou cerca de 10 minutos. O diagrama esquemático do local da ligadura cirúrgica é mostrado na Figura 2. Neste estudo, 2 ratos morreram de fibrilação ventricular durante o procedimento de ligadura no grupo IM e 1 rato morreu devido a sangramento após o coração ter sido acidentalmente perfurado pela agulha curva no grupo simulado. A taxa de mortalidade foi de cerca de 5% ao longo do experimento.
A função cardíaca dos ratos foi reduzida significativamente no grupo IM, e a IC foi desenvolvida com sucesso. As medidas ecocardiográficas foram obtidas em ratos 4 semanas após o procedimento para avaliar os efeitos dos modelos de IC (Figura 3). Com base nas diretrizes da ESC de 2016 para o diagnóstico e tratamento da insuficiência cardíaca aguda e crônica12, os ratos com FEVE inferior a 50% são considerados modelos de IC bem-sucedidos. Os principais parâmetros relacionados à insuficiência cardíaca foram resumidos na Tabela 1. Ao comparar o grupo IM com o grupo sham, a FEVE no grupo IM reduziu significativamente (32,7% ± 8,0 VS 75,3% ± 4,9, P<0,001). Essas reduções significativas de SF e aumentos de LVIDd e LVIDs no grupo IM foram bons sinais de IC. Além disso, as alterações na estrutura ventricular foram observadas nas imagens de ultrassom (Figura 3). A câmara do VE ficou maior e a parede do VE ficou mais fina e rígida no grupo IM em comparação com a simulação.
Avaliação de biomarcadores de IM e IC pós-IM por ELISA
Conforme mostrado na Figura 4 e na Figura 5, as concentrações séricas do marcador cardíaco CK-MB usado para auxiliar no diagnóstico de IM aumentaram significativamente em mais de 3 vezes no grupo IM. Enquanto isso, alguns parâmetros relacionados à insuficiência cardíaca, como renina, AngII e concentrações séricas de ALD, foram maiores em comparação com o grupo simulado 4 semanas após o procedimento. As concentrações de NT-proBNP no grupo IM foram 13 vezes maiores do que no grupo simulado. Além disso, as concentrações de citocinas pró-inflamatórias no grupo IM, incluindo TNF-α e IL-6, aumentaram 400% e 300% em comparação com o grupo simulado. Enquanto isso, os fatores representativos relacionados à angiogênese, como VEGF e HIF-1α, também foram significativamente maiores em 2 e 5 vezes no grupo IM em comparação com o grupo simulado.
Alterações morfológicas e análises histopatológicas
No grupo IM, a análise morfológica dos corações revelou uma parede fina e pálida do VE, bem como formação de cicatrizes fibrosas (Figura 6). Além disso, o IM também foi verificado por meio da coloração TTC e o tamanho do infarto foi testado (Figura 6). O tamanho do infarto foi de 40,7±4,4% 4 semanas após o procedimento no grupo IM, o que mostrou a confiabilidade e estabilidade do novo método de IC pós-IM. Para a coloração HE, a avaliação microscópica mostrou um arranjo perfeito das fibras miocárdicas sem alteração inflamatória no grupo simulado. No entanto, as fibras miocárdicas tornaram-se um arranjo frouxo e irregular com infiltrados celulares inflamatórios no grupo IM (Figura 7a). Além disso, a coloração tricrômica de Masson revelou que as áreas de fibrose cardíaca estavam aumentadas no grupo IM (Figura 7a), e a fração volumétrica de colágeno (FVC) foi de 39,2±6,9% no grupo IM. Os resultados da coloração tricrômica de Masson foram consistentes com a coloração TTC, o que confirmou ainda mais o desenvolvimento bem-sucedido dos modelos MI e HF (Figura 7b, 7c).

Figura 1. Instrumentos-chave foram usados para estabelecer o modelo de IM. (a) O afastador auto-retentor Weitlaner (13,5 cm) (terceiro da esquerda); (b) O equipamento de suprimento de oxigênio; (c) O vaporizador de isoflurano. Clique aqui para ver uma versão maior desta figura.
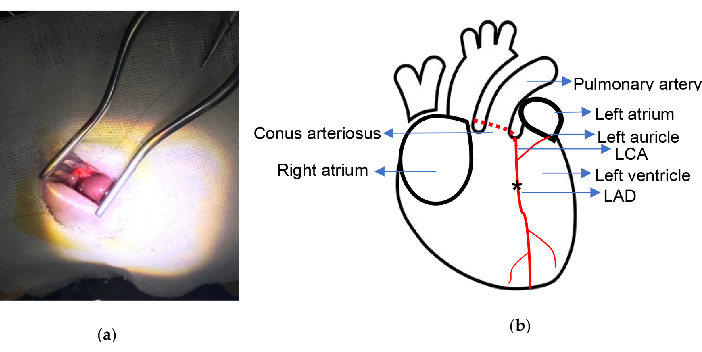
Figura 2. Esquema experimental. (a) Exposição do coração com afastador de retenção automática Weitlander; (b) O local da ligadura é indicado. O asterisco ilustra a posição da ligadura. ACE, artéria coronária esquerda; LAD, descendente anterior esquerdo. Clique aqui para ver uma versão maior desta figura.
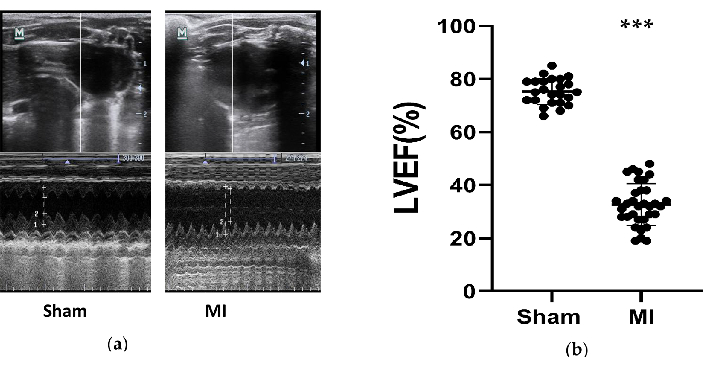
Figura 3. Medidas ecocardiográficas. (a) As imagens representativas das estruturas do ventrículo esquerdo do grupo sham e infarto do miocárdio testadas pelo modo M durante 3 ciclos cardíacos após 4 semanas do procedimento; (b) FEVE de ratos após 4 semanas do procedimento do grupo sham (n= 24) e IM (n=33). infarto do miocárdio, infarto do miocárdio. FEVE, fração de ejeção do ventrículo esquerdo. P < 0,001 em comparação com o grupo simulado. Clique aqui para ver uma versão maior desta figura.
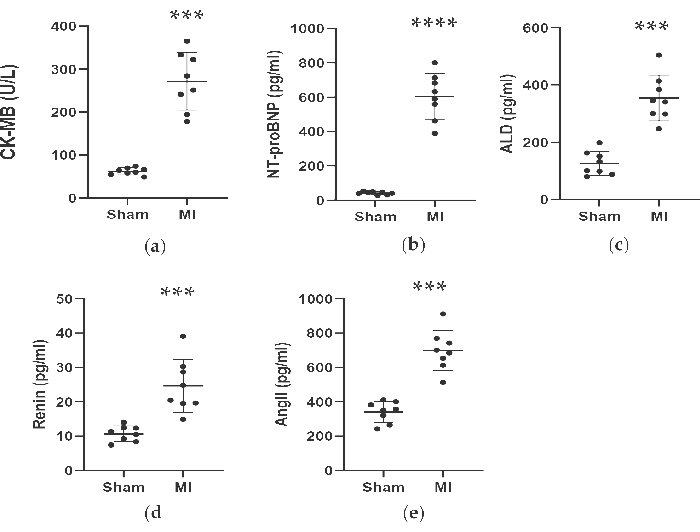
Figura 4. As concentrações de CK-MB, NT-proBNP, ALD, renina e AngII aumentaram 4 semanas após a ligadura da LAD. Os dados foram expressos como média ± DP (n = 8 animais em cada grupo). IM, infarto do miocárdio; LAD, descendente anterior esquerdo. P < 0,001 em comparação com o grupo simulado. P < 0,0001 em comparação com o grupo simulado. Clique aqui para ver uma versão maior desta figura.
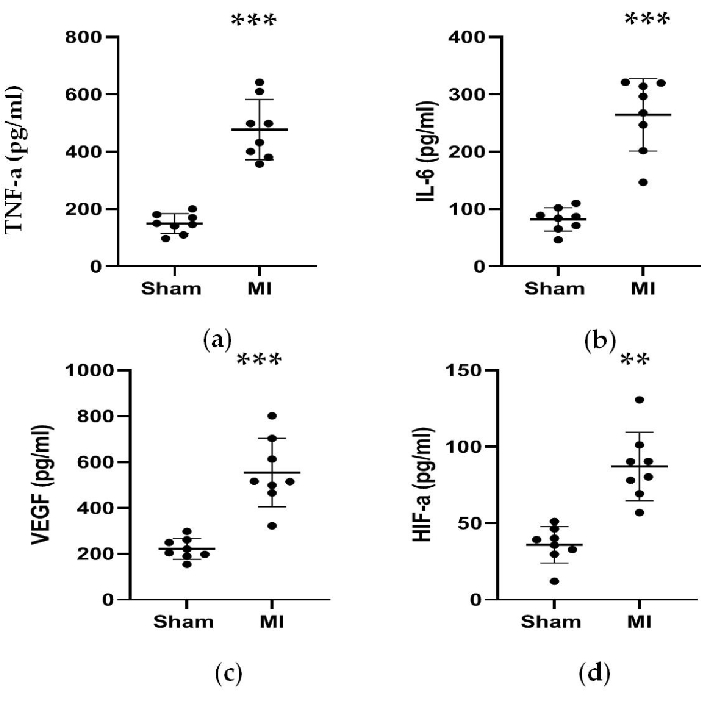
Figura 5. As concentrações de TNF-α, IL-6, VEGF e HIF-α aumentaram 4 semanas após a ligadura da LAD. (a, b) As concentrações de TNF-α e IL-6 associadas à resposta inflamatória aumentaram 4 semanas após a ligadura da LAD; (c, d) As concentrações de VEGF e HIF-α associadas à angiogênese aumentaram 4 semanas após a ligadura da LAD. Os dados são expressos em média ± DP (n = 8 animais em cada grupo). DA, descendente anterior esquerdo; infarto do miocárdio, infarto do miocárdio. **P < 0,01 em comparação com o grupo simulado. P < 0,001 em comparação com o grupo simulado. Clique aqui para ver uma versão maior desta figura.
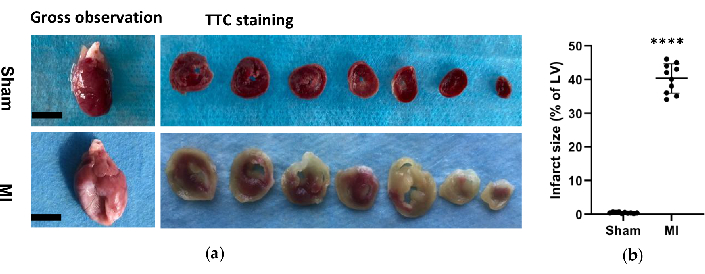
Figura 6. Análise morfológica dos corações. (a) Observação macroscópica e histologia de corações de ratos do grupo simulado e IM 4 semanas após o procedimento. O coração do IM apresentou uma parede do ventrículo esquerdo mais fina e maior em comparação com o sham; Para os corações de coloração TTC do grupo sham e MI, o tecido viável foi corado de vermelho e a área do infarto estava pálida e não corada. (b) O tamanho do infarto do miocárdio foi expresso como a porcentagem da área do infarto em relação a todo o VE. Os dados são expressos como média ± DP (n = 10 animais em cada grupo).IM, infarto do miocárdio; TTC, cloreto de trifeniltetrazólio; VE, ventrículo esquerdo. Barra de escala = 5 mm. ****P < 0,0001 em comparação com o grupo simulado. Clique aqui para ver uma versão maior desta figura.
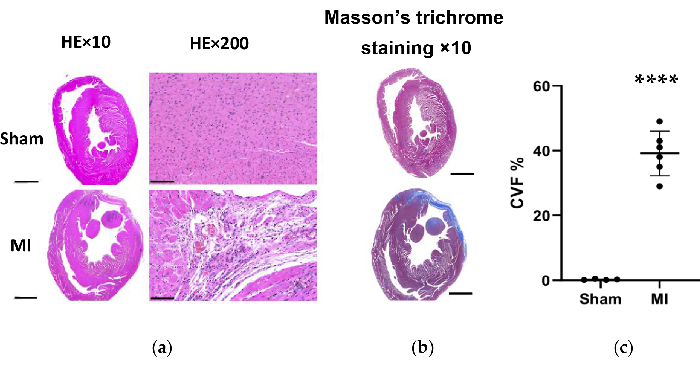
Figura 7. Coloração tricrômica de HE e Masson do tecido cardíaco de rato 4 semanas após o procedimento. (a) A parede do VE do coração IM tornou-se mais fina do que o grupo simulado (HE×10, barra de escala = 2 mm). A avaliação microscópica mostrou um arranjo puro das fibras miocárdicas sem alteração inflamatória no grupo sham e mostrou um arranjo frouxo e irregular com infiltrados celulares inflamatórios no grupo IM (HE×200, barra de escala = 100 μm); (b) A coloração tricrômica de Masson do tecido cardíaco mostra a fibrose miocárdica como azul no grupo IM (barra de escala = 2 mm). (c) Fração de volume de colágeno para coloração tricrômica de Masson em fatias de tecido ventricular esquerdo dos grupos sham e IM. Os dados são expressos em média ± DP (n = 6 animais no grupo IM). HE, hematoxilina e eosina; IM, infarto do miocárdio; VE, ventrículo esquerdo. P < 0,0001 em comparação com o grupo simulado. Clique aqui para ver uma versão maior desta figura.
| Parâmetros | Grupo simulado (n=24) | Grupo IM (n=33) |
| LVIDd (mm) | 8.3±1.3 | 10.1±2.9* |
| LVIDs (mm) | 4.1±0.9 | 7,7±1,5*** |
| FS (%) | 42,5±7,8 | 22.2±4.4*** |
Tabela 1: Dados ecocardiográficos de ratos no grupo sham e IM 4 semanas após a ligadura ADA. Os dados foram expressos como média ± DP. IM, infarto do miocárdio; LVIDd, dimensões internas do ventrículo esquerdo no final da diástole no final da diástole; IDVEs, dimensões internas do ventrículo esquerdo no final da sístole; FS%, porcentagem de encurtamento fracionário. *P < 0,05, em comparação com o grupo simulado. P < 0,001 em comparação com o grupo simulado.
Discussão
Embora existam muitos modelos existentes de IM ou IC em roedores 13,14,15, este estudo desenvolveu um novo e eficiente procedimento de ligadura LAD para induzir IC pós-IM em ratos. No entanto, neste novo modelo de IC em ratos, as necessidades de intubação e ventilação ou exteriorização do coração foram eliminadas, o que aumentou significativamente a taxa de sobrevivência dos ratos. Para desenvolver este novo modelo de IC em ratos, a indução de IM é um passo crucial. Em comparação com os protocolos convencionais que geralmente envolvem intubação e ventilação ou exteriorização do coração durante a ligadura 9,16,17, desenvolvemos uma abordagem aprimorada sem ventilação nem exteriorização do coração pela primeira vez, permitindo uma maior taxa de sobrevida. Vale a pena notar que o procedimento aprimorado leva a menos danos aos tecidos. Portanto, os ratos têm uma recuperação pós-cirúrgica muito mais rápida e maior taxa de sobrevivência. Os dois pontos a seguir nos permitiram alcançar esses resultados: Primeiro, a inalação contínua de oxigênio durante todo o procedimento permitiu oxigenação e ligadura suficientes sem ventilação. Em segundo lugar, o afastador auto-retentor Weitlaner, um instrumento cirúrgico fundamental, foi usado para obter exposição suficiente ao coração, mantendo a integridade das costelas, o que ajudou a evitar a exteriorização do coração.
É bem sabido que o desenvolvimento bem-sucedido da IC pós-IM em ratos depende em grande parte do tamanho do infarto, que está relacionado ao local de ligação da ACL. Já em 1979, Marc A. Pfeefer e seus colegas relataram que a oclusão da ACE em ratos poderia facilmente causar infartos da parede livre do ventrículo esquerdo de tamanhos variados18. Para reduzir a variação do tamanho do infarto e desenvolver um modelo de IC pós-IM mais estável, a ligadura LAD tem sido comumente usada em ratos para induzir infarto do ventrículo esquerdo para fins de pesquisa19. A principal vantagem da oclusão da DA é permitir a ligadura precisa dessa artéria para induzir um infarto do miocárdio estável que pode causar IC, mantendo uma taxa de sobrevida muito maior. Em nosso procedimento, escolhemos a posição de ligadura 2,0-2,5 mm abaixo do ponto médio da conexão entre o cone arterial e o apêndice atrial esquerdo, que se mostrou bem-sucedida e estável com menores variações na FEVE entre todos os ratos do grupo IM. Além disso, determinamos individualmente o tamanho do infarto pela coloração TTC e o grau de fibrose pela coloração de Masson, ambos amplamente utilizados para avaliar esse tipo de modelo 20,21,22. Enquanto isso, as menores variações desse modelo também foram ilustradas por meio de alterações morfológicas e análises histopatológicas.
Também estudamos alguns parâmetros relacionados ao IM e IC após 4 semanas da ligadura da DAE para ajudar a confirmar o desenvolvimento de IC após o IM. A ecocardiografia tem a capacidade de medir com precisão e não invasividade a função ventricular e avaliar as causas da doença cardíaca estrutural23. As FEVE dos camundongos do grupo IM estavam todas abaixo de 50%, o que poderia ser considerado como HF12. Em consonância com esses resultados, a concentração de NT-proBNP foi aumentada de acordo, o que também foi um importante indicador de comprometimento da função cardíaca. Existem amplas evidências de inflamação e apoptose no coração isquêmico24, 25. A inflamação e a insuficiência cardíaca estão fortemente interligadas e se reforçam mutuamente26. Em nosso estudo, avaliamos o aumento significativo dos fatores inflamatórios, IL-6 e TNF-a. O sistema renina-angiotensina-aldosterona (SRAA), ativado pela hipoperfusão renal e ativação simpática, é uma característica central na fisiopatologia da insuficiência cardíaca27. Avaliamos os parâmetros envolvidos no SRAA e verificamos que o nível sérico de renina foi significativamente maior no grupo IM em comparação com o grupo sham, o que verificou ainda mais o desenvolvimento de IC.
Existem dois pontos principais de ênfase durante o procedimento de ligadura ADA. Primeiro, durante todo o procedimento e até que eles se recuperem da anestesia, forneça um suprimento contínuo de oxigênio aos animais, mantendo-os aquecidos. Em segundo lugar, a posição de ligadura na DA tem um papel fundamental no tamanho do infarto e no grau de IC. O local 2,0-2,5 mm abaixo do ponto médio da conexão entre o cone arterial e o apêndice atrial esquerdo é apropriado para um modelo de IC estável e bem-sucedido com menor taxa de mortalidade. No entanto, a limitação do novo modelo de IC em ratos é que o procedimento cirúrgico para desenvolver IM sem ventilação é tecnicamente exigente e desafiador. O passo fundamental para alcançar esse modelo é obter exposição suficiente do coração para visualizar completamente o coração dentro do tórax e limitar o tempo que o tórax fica aberto a 5 minutos, o que requer mais prática antes do experimento formal.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este modelo foi desenvolvido com o apoio do Centro de Co-Inovação de Shandong da Fórmula Clássica da MTC, Departamento de Educação da Província de Shandong. Gostaríamos de agradecer ao Dr. Lianfeng Wu por realizar a ecocardiografia neste estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
Referências
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados