Method Article
Новая модель сердечной недостаточности после инфаркта миокарда у крыс
В этой статье
Резюме
Мы успешно разработали надежную и воспроизводимую модель сердечной недостаточности после инфаркта миокарда у крыс без вентиляции или экстериоризации сердца. Это упрощает процедуру и способствует дальнейшим исследованиям потенциальных механизмов развития сердечной недостаточности.
Аннотация
Лигирование левой передней нисходящей коронарной артерии (ПМЖ) широко использовалось для установления модели сердечной недостаточности (СН) после инфаркта миокарда (ИМ) на крысах. Однако к недостаткам этой модели можно отнести высокую смертность после лигирования и большие вариации как размера инфаркта, так и степени нарушения сердечной функции. Кроме того, для предыдущих моделей незаменим аппарат искусственной вентиляции легких или экстериоризация сердца, что усложняет процедуру при перевязке. В этом исследовании мы разработали надежную и воспроизводимую модель без аппарата искусственной вентиляции легких или экстериоризации сердца путем перевязки коронарной артерии ПМЖ. Через четыре недели после процедуры мы обнаружили, что сывороточные концентрации CK-MB, NT-proBNP и ренина, которые использовались для помощи в диагностике ИМ и СН, были значительно выше в группе ИМ по сравнению с фиктивной группой. Напротив, значение фракции выброса левого желудочка (ФВЛЖ) в группе ИМ было очевидно меньше, чем в группе симуляции. Кроме того, размер инфаркта и площадь сердечного фиброза были индивидуально подтверждены и количественно проанализированы с помощью окрашивания TTC и трихромного окрашивания по Массону. Меньшие вариации были обнаружены либо в размере инфаркта, либо в области фиброза в группе инфаркта миокарда, что помогло разработать надежную и воспроизводимую модель СН после ИМ. Эта новая модель пост-ИМ СН у крыс жизненно важна для изучения потенциальных механизмов ИМ и СН. Этот новый метод может быть использован для разработки нового препарата для лечения ИМ и СН у крыс с использованием фармакологических стратегий.
Введение
Сердечная недостаточность (СН) считается глобальной проблемой общественного здравоохранения, которая затрагивает более 26 миллионов пациентов, и распространенность продолжает расти1. СН определяется как ситуация, когда сердце не перекачивает кровь так хорошо, как должно. Существует множество факторов риска развития СН, включая ишемическую болезнь сердца, сахарный диабет, гипертензию, гипертрофию ЛЖ, ожирение, курение и т.д.2,3,4. Инфаркт миокарда (ИМ) является одной из наиболее частых причин СН5. В течение почти 50 лет СН после ИМ была основным фактором поздней заболеваемости, смертности и затрат на здравоохранение6. Для лучшего понимания патофизиологического механизма СН и более эффективной профилактики и лечения СН было разработано большое количество моделей СН на животных после ИМ. Крысы обычно используются из-за простоты обслуживания, более низкой стоимости, способности к контролю и высокой гомологии с людьми 7,8,9. Лигирование левой коронарной артерии (ЛКА), особенно лигирование левой передней нисходящей ветви (ПМЖ), широко используется для разработки модели пост-ИМ СН у крыс8.
Тем не менее, операции, которые вызывают инфаркт миокарда у крыс, часто технически сложны в выполнении из-за высокой вариативности, сложной операции и высокой смертности. Несмотря на то, что сообщалось о довольно большом количестве процедур, подавляющее большинство операций требовали либо вентиляции после интубации трахеи, либо экстериоризации сердца. Эти методы увеличивали стоимость операции, усложняли операцию и снижали безопасность животного. Кроме того, степень СН зависит от места лигирования ЛКА. Анатомическое разнообразие LCA у крыс приводит к несогласованности размеров инфаркта и функциональных параметров в модели крыс. Различные участки лигирования LCA вызывают особый размер инфаркта, который определяет степень HF и выживаемость.
В данном исследовании мы стремились создать надежную и воспроизводимую модель пост-ИМ СН. Наши результаты позволили проводить операции на крысах без аппарата искусственной вентиляции легких или экстериоризации сердца, что привело к высокой выживаемости. Кроме того, относительно фиксированное место лигирования ПМЖ привело к меньшему количеству вариаций СН через 4 недели после операции. Кроме того, мы оценили эффекты модели СН с помощью гистопатологического окрашивания, биохимического обнаружения и измерения сердечной функции, что помогло изучить потенциальные механизмы заболевания и разработать новые препараты для лечения СН.
протокол
Протокол был одобрен Исследовательским комитетом по этике животных Шаньдунского университета традиционной китайской медицины.
ПРИМЕЧАНИЕ: Взрослые самцы крыс породы Спрэг-Доули в возрасте 10 недель и массой 180-220 г были случайным образом разделены на 2 группы: фиктивные (n = 25) и MI (n = 35). Животные содержались в 12-12-часовом цикле свет/темнота и получали воду и пищу в неограниченном количестве.
1. Анестезия и непрерывная подача кислорода
- Поместите крыс в индукционную камеру и обезболите 3% изофлураном.
- Чтобы подтвердить, готова ли анестезия, понаблюдайте за рефлексом защемления пальца ноги. Обезболивание достаточно, когда рефлекс защемления пальца ноги исчезает.
- По отдельности переместите крыс в небольшую операционную доску с регулируемой температурой. Прикрепите лапы крысы к доске скотчем.
- Приложите к морде крысы маску, которая обеспечивает постоянное поступление 3% изофлурана и 1% кислорода.
2. Индукция ИМ без вентиляции или экстериоризации сердца
- Используйте кремы для депиляции для удаления волосков на грудной клетке для стерилизации.
- Используйте стерильную простыню с отверстием размером 1 см х 3 см на операционном поле крысы.
- Перед операцией подтвердите достаточную глубину анестезии щипцом ноги.
- Вскройте грудную клетку поперечным разрезом 2,5 см между третьим и четвертым межреберьем на левом краю грудины, не разрезая ребер.
- Разделите большую и малую грудные мышцы с помощью двух сосудистых щипцов, не разрезая ткани или мелкие кровеносные сосуды. Поместите самоудерживающийся ретрактор Weitlaner в грудную клетку, чтобы разделить третье и четвертое ребра, чтобы получить достаточное воздействие на сердце, сохраняя при этом целостность ребер.
- Деликатно рассеките перикард двумя щипцами.
- Используйте нейлоновый шов 6/0 с изогнутой иглой для постоянного перевязки ПМЖ на 2,0-2,5 мм ниже середины артериального конуса и соединения ушка левого предсердия. ПМЖ можно легко распознать и обнаружить у некоторых крыс.
- Подтвердите надлежащую лигирование ПМЖ после того, как передняя стенка левого желудочка побледнела.
- В бутафорской группе проходите только шов под ПМЖ, но не перевязывайте.
- Снимите ретрактор и выдавите воздух из грудной клетки, прежде чем накладывать швы на мышцы и кожу слой за слоем.
- После операции поместите крыс на грелку с температурой 37 °C для восстановления. Наблюдайте за всеми животными и вводите кетопрофен (5 мг/кг подкожно) для обезболивания каждые 24 часа до 72 часов.
ПРИМЕЧАНИЕ: По техническим причинам для этой операции предпочтительны крысы с меньшей массой тела (менее 250 г). Время удержания грудной клетки в открытом состоянии, с шага 2,4-2,8, ограничивалось 5 минутами.
3. Оценка сердечной функции
ПРИМЕЧАНИЕ: Чтобы подтвердить, успешно ли развилась СН, функция сердца была измерена через 4 недели после процедуры с помощью ультразвуковой системы TE7, оснащенной электронным датчиком с частотой 13 МГц. Во время эхокардиографии крысы находились под тем же протоколом анестезии, который использовался для первоначальной процедуры.
- После сбривания волос на передней части груди расположите крыс на доске, которая использовалась для предыдущей операции.
- Поместите зонд на переднюю грудную стенку и получите изображения с левой парастернальной проекции по длинной оси (PLAX) левого желудочка (ЛЖ) (на уровне папиллярных мышц).
- Измерьте внутренние размеры левого желудочка в конечной диастоле (LVIDd) и конечной систоле (LVIDs) с помощью M-режима из трех последовательных сердечных циклов.
- Рассчитайте фракцию выброса LV (LVEF) и фракционное укорачивание LV (LVFS) с помощью программного обеспечения машины.
4. Дальнейший анализ модели СН через 4 недели после лигирования ПМЖ
- Засахаривайте крыс через 4 недели после лигирования ПМЖ путем введения передозировки изофлурана. Измерьте сывороточные концентрации CK-MB, N-концевого промозгового натрийуретического пептида (NT-proBNP), ренина, ангиотензина (AngII), альдостерона (ALD), TNF-α, VEGF, IL-6 и HIF-1α с помощью наборов ELISA в соответствии с протоколом производителя.
- Чтобы извлечь сердца для гистопатологического анализа, перед удалением перфузируйте сердца крыс физиологическим раствором с температурой 4 °C.
- Поместите сердца в 10% формалин на 24 часа, закиньте в парафин и нарежьте срезы толщиной 5,0 мкм поперечно вдоль оси левого желудочка.
- Закрепите все участки сердца на предметных стеклах и индивидуально окрасьте гематоксилином и эозином (HE) и трихромом Массона.
- С целью измерения размеров инфаркта сердца окрашивают 2,3,5-трифенилтетразолия хлоридом (ТТС).
- Нарежьте сердцевину поперечно толщиной 3 мм от верхушки до основания в полузамороженном состоянии и инкубируйте в 2% растворе TTC в течение 20 минут при 37 °C.
- Когда цвет закрепится, зафиксируйте срезы в 4% растворе параформальдегида на 15 минут и сделайте снимки.
- Отметьте размер инфаркта и рассчитайте его с помощью ImageJ. Выразите размер инфаркта в процентах от площади инфаркта по отношению к общей площади ЛЖ.
- Для количественного анализа содержания коллагена в середине инфарктного участка ЛЖ окрашивают участки сердечной ткани крысы трихромом Массона.
- После окрашивания отсканируйте изображения и проанализируйте. Оценивайте степень фиброза по объемной фракции коллагена (CVF), которая была выражена в процентах от площади фиброза по отношению к общей площади ЛЖ.
Результаты
Процедура была выполнена с низким уровнем смертности. Основными инструментами, использованными для этого эксперимента, являются самоудерживающийся ретрактор Weitlaner (13,5 см) и изофлуран-вапорайзер, показанные на рисунке 1. Модель ИМ была разработана без вентиляции или экстериоризации сердца, как описано в протоколе. Во время всей процедуры все ребра сохранялись в целостности, и вся процедура заняла около 10 минут. Принципиальная схема места хирургического перевязки представлена на рисунке 2. В этом исследовании 2 крысы умерли от фибрилляции желудочков во время процедуры лигирования в группе ИМ, а 1 крыса умерла из-за кровотечения после случайного прокола сердца изогнутой иглой в фиктивной группе. Смертность составила около 5% на протяжении всего эксперимента.
В группе инфаркта миокарда у крыс была значительно снижена сердечная функция, и СН была успешно развита. Эхокардиографические измерения были получены у крыс через 4 недели после процедуры для оценки эффектов моделей СН (рис. 3). В соответствии с рекомендациями ESC 2016 года по диагностике и лечению острой и хронической сердечной недостаточности12, крысы с ФВЛЖ менее 50% считаются успешными моделями СН. Основные параметры, связанные с сердечной недостаточностью, были сведены в таблицу 1. При сравнении группы ИМ с фиктивной группой ФВЛЖ в группе ИМ значительно снизилась (32,7% ± 8,0 против 75,3% ± 4,9, P<0,001). Эти значительные снижения ФС и увеличения LVIDd и LVID в группе ИМ были хорошими признаками СН. Кроме того, изменения в структуре желудочков были видны по ультразвуковым изображениям (Рисунок 3). Камера ЛЖ стала больше, а стенка ЛН стала тоньше и жестче в группе ИМ по сравнению с фиктивной.
Оценка биомаркеров ИМ и пост-ИМ методом ИФА
Как показано на рисунках 4 и 5, сывороточные концентрации сердечного маркера CK-MB, используемого для помощи в диагностике ИМ, значительно выросли более чем в 3 раза в группе инфаркта миокарда. Между тем, некоторые параметры, связанные с сердечной недостаточностью, такие как концентрации ренина, AngII и ALD в сыворотке крови, были выше по сравнению с фиктивной группой через 4 недели после процедуры. Концентрации NT-proBNP в группе ИМ были в 13 раз выше, чем в фиктивной группе. Также концентрации провоспалительных цитокинов в группе ИМ, включая TNF-α и IL-6, были увеличены на 400% и 300% по сравнению с модельной группой. Между тем, в качестве репрезентативных факторов, связанных с ангиогенезом, таких как VEGF и HIF-1α, также были значительно выше в 2 и 5 раз в группе ИМ по сравнению с фиктивной группой.
Морфологические изменения и гистопатологические анализы
В группе ИМ морфологический анализ сердца выявил тонкую и бледную стенку ЛЖ, а также образование фиброзного рубца (Рисунок 6). Кроме того, ИМ также был верифицирован с помощью окрашивания TTC и был проверен размер инфаркта (Рисунок 6). Размер инфаркта составил 40,7±4,4% через 4 недели после процедуры в группе ИМ, что показало надежность и стабильность нового метода СН после ИМ. При окрашивании ПЭ микроскопическая оценка показала аккуратное расположение волокон миокарда без воспалительных изменений в фиктивной группе. Тем не менее, волокна миокарда стали рыхлыми и неравномерными с воспалительными клеточными инфильтратами в группе ИМ (рис. 7а). Кроме того, трихромное окрашивание Массона показало, что участки сердечного фиброза были увеличены в группе ИМ (рис. 7а), а объемная фракция коллагена (CVF) составила 39,2±6,9% в группе ИМ. Результаты трихромного окрашивания Массона соответствовали результатам окрашивания TTC, что еще раз подтвердило успешную разработку моделей MI и HF (рис. 7b, 7c).

Рисунок 1. Для создания модели ИМ были использованы ключевые инструменты. (a) Самоудерживающееся втягивающее устройство Weitlaner (13,5 см) (третий слева); b) оборудование для подачи кислорода; (c) Изофлуран вапорайзер. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
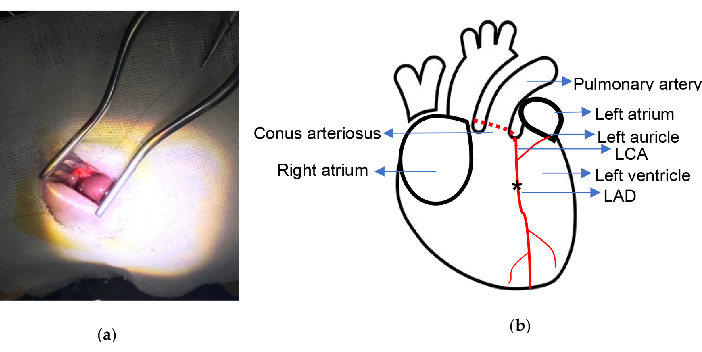
Рисунок 2. Экспериментальная схема. (a) Обнажение сердца с помощью самоудерживающегося ретрактора Weitlaner; (b) Указано место лигирования. Звездочка иллюстрирует положение лигирования. ЛКА, левая коронарная артерия; LAD, левая передняя нисходящая. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
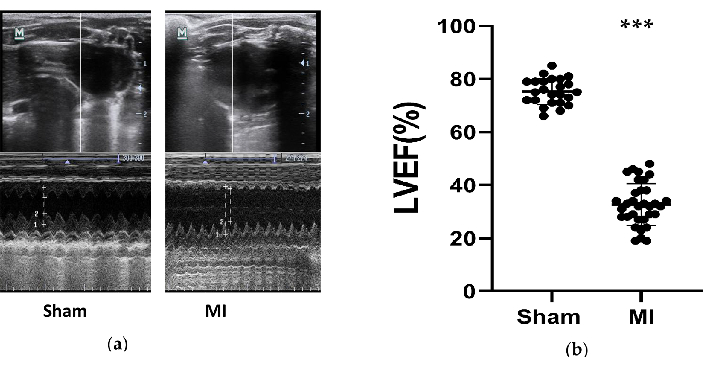
Рисунок 3. Эхокардиографические измерения. (a) Репрезентативные изображения структур левого желудочка из фиктивной группы и группы ИМ, протестированные с помощью M-Mode в течение 3 сердечных циклов после 4 недель процедуры; (b) ФВЛЖ крыс через 4 недели процедуры из группы симуляции (n=24) и ИМ (n=33). ИМ, инфаркт миокарда. ФВЛЖ, фракция выброса левого желудочка. P < 0,001 по сравнению с фиктивной группой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
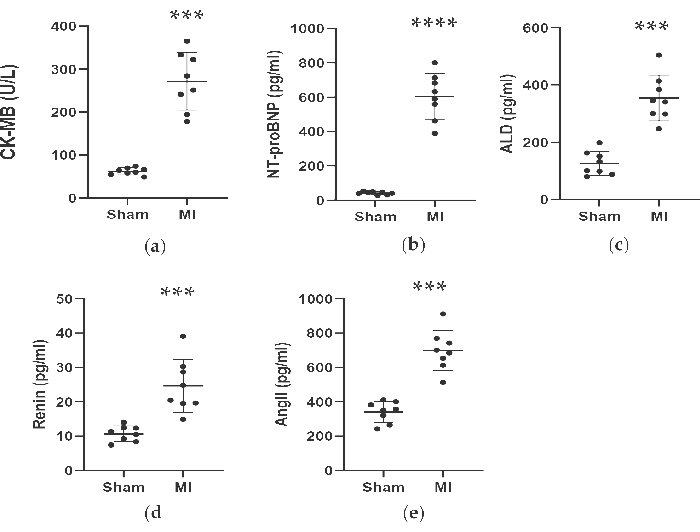
Рисунок 4. Концентрации CK-MB, NT-proBNP, ALD, Renin и AngII были повышены через 4 недели после лигирования ПМЖ. Данные выражали в виде среднего значения ± SD (n = 8 животных в каждой группе). ИМ, инфаркт миокарда; LAD, левая передняя нисходящая. P < 0,001 по сравнению с фиктивной группой. P < 0,0001 по сравнению с фиктивной группой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
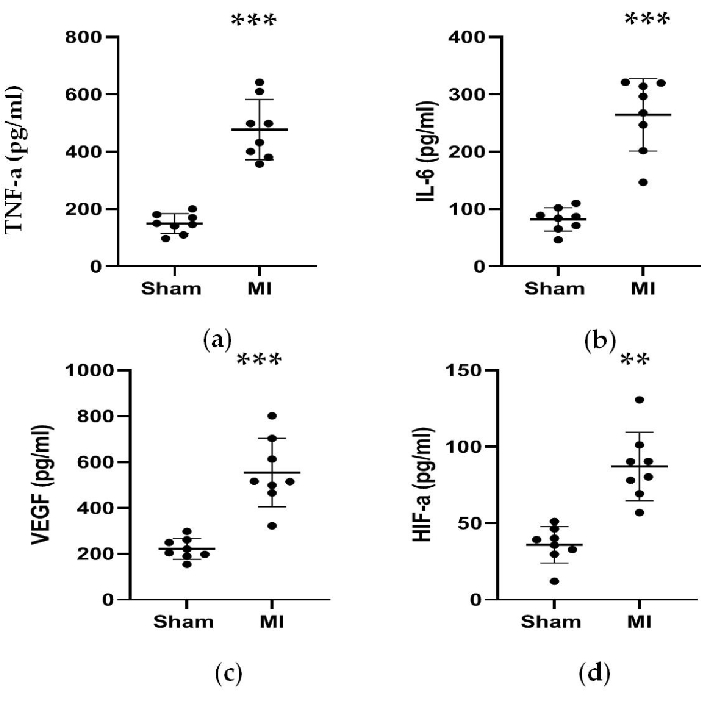
Рисунок 5. Концентрации TNF-α, IL-6, VEGF и HIF-α были повышены через 4 недели после лигирования ПМЖ. (a, b) Концентрации TNF-α и IL-6, связанные с воспалительной реакцией, были повышены через 4 недели после лигирования ПМЖ; (с, г) Концентрации VEGF и HIF-α, ассоциированных с ангиогенезом, были повышены через 4 недели после лигирования ПМЖ. Данные выражаются в виде среднего ± SD (n = 8 животных в каждой группе). ПМЖ, левый передний нисходящий; ИМ, инфаркт миокарда. **P < 0,01 по сравнению с фиктивной группой. P < 0,001 по сравнению с фиктивной группой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
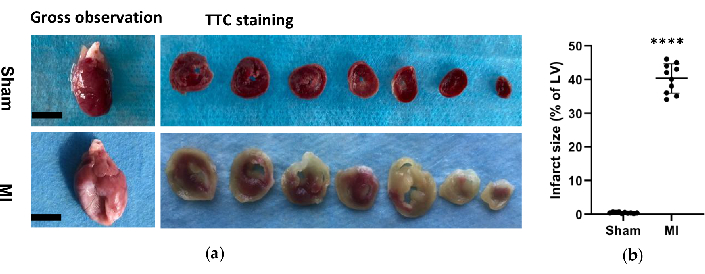
Рисунок 6. Морфологический анализ сердца. (a) Общее наблюдение и гистология сердец крыс из фиктивной группы и группы инфаркта миокарда через 4 недели после процедуры. Сердце с инфарктами миокарда показало более тонкую и большую стенку левого желудочка по сравнению с фиктивным; Для окрашивания ТТС сердца в группе симуляции и инфаркта миокарда жизнеспособная ткань окрашивалась в красный цвет, а область инфаркта была бледной и неокрашенной. (b) размер инфаркта ИМ выражался в процентах от площади инфаркта по отношению ко всей ЛЖ. Данные выражались как среднее значение ± SD (n = 10 животных в каждой группе).ИМ, инфаркт миокарда; TTC, трифенилтетразолия хлорид; ЛЖ, левый желудочек. Масштабная линейка = 5 мм. ****P < 0,0001 по сравнению с фиктивной группой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
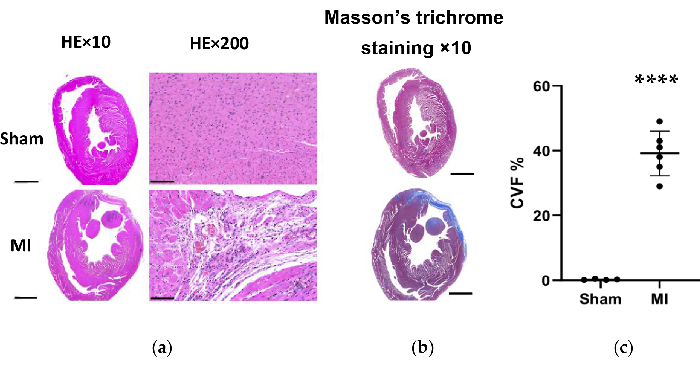
Рисунок 7. Трихромное окрашивание тканей сердца крысы по методу Хе и Массона через 4 недели после процедуры. (а) Стенка ЛЖ сердца ИМ стала тоньше, чем фиктивная группа (HE×10, масштабная линейка = 2 мм). Микроскопическая оценка показала аккуратное расположение волокон миокарда без воспалительных изменений в фиктивной группе и показало рыхлое и нерегулярное расположение с воспалительными клеточными инфильтратами в группе ИМ (HE×200, шкала = 100 мкм); (b) Трихромное окрашивание сердечной ткани по Массону показывает фиброз миокарда синим цветом в группе ИМ (масштабная линейка = 2 мм). (c) Объемная фракция коллагена для трихромного окрашивания по Массону в срезах ткани левого желудочка из фиктивной группы и группы ИМ. Данные выражаются в виде среднего значения ± SD (n = 6 животных в группе ИМ). HE, гематоксилин и эозин; ИМ, инфаркт миокарда; ЛЖ, левый желудочек. P < 0,0001 по сравнению с фиктивной группой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Параметры | Фиктивная группа (n=24) | Группа MI (n=33) |
| LVIDd (мм) | 8.3±1.3 | 10.1±2.9* |
| LVID (мм) | 4,1±0,9 | 7,7±1,5*** |
| ФС (%) | 42.5±7.8 | 22.2±4.4*** |
Таблица 1: Эхокардиографические данные крыс в группе симуляции и инфаркта миокарда через 4 недели после лигирования ПМЖ. Данные были выражены в виде среднего ± СД. ИМ, инфаркта миокарда; LVIDd, внутренние размеры левого желудочка в конце диастолы в конце диастолы; ЛВД, внутренние размеры левого желудочка в конце систолы; ФС%, процент дробного укорочения. *P < 0,05 по сравнению с фиктивной группой. P < 0,001 по сравнению с фиктивной группой.
Обсуждение
Несмотря на то, что существует множество моделей ИМ или СН у грызунов 13,14,15, в этом исследовании была разработана новая и эффективная процедура лигирования ПМЖ для индуцирования СН пост-ИМ у крыс. Тем не менее, в этой новой модели HF крыс были устранены потребности в интубации и вентиляции или экстериоризации сердца, что значительно увеличило выживаемость крыс. Для разработки этой новой модели ВЧ крысы индукция ИМ является важным шагом. По сравнению с традиционными протоколами, которые обычно включали интубацию и вентиляцию легких или экстериоризацию сердца во время лигирования 9,16,17, мы разработали улучшенный подход, при котором впервые не проводилась вентиляция и экстериоризация сердца, что позволило добиться более высокой выживаемости. Стоит отметить, что усовершенствованная процедура приводит к меньшему повреждению тканей. Таким образом, крысы имеют гораздо более быстрое послеоперационное восстановление и более высокую выживаемость. Следующие два момента позволили нам достичь этих результатов: во-первых, непрерывное вдыхание кислорода в течение всей процедуры позволило обеспечить достаточное насыщение кислородом и лигирование без вентиляции. Во-вторых, самоудерживающийся ретрактор Вейтланера, ключевой хирургический инструмент, был использован для получения достаточного воздействия на сердце, сохраняя при этом целостность ребер, что помогло избежать экстериоризации сердца.
Хорошо известно, что успешное развитие пост-ИМ СН у крыс во многом зависит от размера инфаркта, который связан с местом лигирования ЛКА. Еще в 1979 году Марк А. Пфифер и его коллеги сообщили, что окклюзия LCA у крыс может легко привести к инфарктам свободной стенки левого желудочкаразличных размеров. Для уменьшения вариабельности размеров инфаркта и разработки более стабильной модели СН после ИМ, лигирование ПМЖ обычно использовалось у крыс для индуцирования инфаркта левого желудочка в исследовательских целях19. Основным преимуществом окклюзии ПМЖ является возможность точной перевязки этой артерии для индуцирования стабильного ИМ, который может вызвать СН, сохраняя при этом гораздо более высокую выживаемость. В нашей методике мы выбрали положение лигирования на 2,0-2,5 мм ниже средней точки соединения между артериальным конусом и ушком левого предсердия, которое оказалось успешным и стабильным с меньшими вариациями ФВЛЖ среди всех крыс в группе ИМ. Кроме того, мы индивидуально определили размер инфаркта с помощью окрашивания TTC и степень фиброза по окрашиванию по Массону, оба из которых широко использовались для оценки этого вида модели 20,21,22. Между тем, меньшие вариации этой модели также были проиллюстрированы морфологическими изменениями и гистопатологическим анализом.
Мы также изучили некоторые параметры, связанные с ИМ и СН после 4 недель лигирования ПМЖ, чтобы помочь подтвердить развитие СН после ИМ. Эхокардиография обладает способностью точно и неинвазивно измерять функцию желудочков и оценивать причины структурных заболеваний сердца23. ФВЛЖ у мышей в группе ИМ были ниже 50%, что можно рассматривать как HF12. В соответствии с этими результатами, концентрация NT-proBNP была соответственно увеличена, что также является важным показателем нарушения функции сердца. Существует достаточно доказательств воспаления и апоптоза в ишемизированном сердце24, 25. Воспаление и сердечная недостаточность тесно взаимосвязаны и взаимно усиливают друг друга26. В нашем исследовании мы оценивали достоверное увеличение факторов воспаления, IL-6 и TNF-a. Ренин-ангиотензин-альдостероновая система (РААС), активируемая почечной гипоперфузией и симпатической активацией, является центральным признаком патофизиологии сердечной недостаточности. Мы оценили параметры, участвующие в РААС, и обнаружили, что уровень ренина в сыворотке крови был значительно выше в группе ИМ по сравнению с фиктивной группой, что в дальнейшем подтвердило развитие СН.
Во время процедуры лигирования ПМЖ следует выделить два основных момента. Во-первых, во время всей процедуры и до тех пор, пока они не оправятся от анестезии, обеспечьте непрерывную подачу кислорода животным, а также согрейте их. Во-вторых, положение лигирования на ПМЖ играет ключевую роль в размере инфаркта и степени СН. Участок на 2,0-2,5 мм ниже средней точки соединения между артериальным конусом и ушком левого предсердия подходит для стабильной и успешной модели СН с меньшей смертностью. Тем не менее, ограничением новой модели СН у крыс является то, что хирургическая процедура развития ИМ без вентиляции является технически сложной и сложной. Ключевым шагом для достижения этой модели является получение достаточной экспозиции сердца, чтобы полностью визуализировать сердце внутри грудной клетки, и ограничение времени открытия грудной клетки до 5 минут, что требует дополнительной практики перед формальным экспериментом.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Данная модель была разработана при поддержке Шаньдунского центра совместных инноваций классической формулы ТКМ Департамента образования провинции Шаньдун. Мы хотели бы поблагодарить доктора Ляньфэн Ву за проведение эхокардиографии в этом исследовании.
Материалы
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
Ссылки
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены