Method Article
ラットにおける心筋梗塞後の心不全の新モデル
要約
私たちは、人工呼吸器や心臓の外部化を伴わないラットの心筋梗塞後の心不全について、信頼性と再現性のあるモデルの開発に成功しました。これにより、手順が簡素化され、心不全の背後にある潜在的なメカニズムについてのさらなる研究に利益をもたらします。
要約
左前下行(LAD)冠状動脈の結紮は、心筋梗塞(MI)後の心不全(HF)のラットモデルを確立するために広く使用されています。ただし、このモデルの欠点には、結紮後の死亡率が高いこと、梗塞のサイズと心機能障害の程度の両方で大きな変動があることが含まれます。さらに、以前のモデルでは人工呼吸器または心臓の外部化が不可欠であり、結紮中の手順が複雑になります。この研究では、LAD冠状動脈を結紮することにより、人工呼吸器や心臓の外部化を使用しない、信頼性と再現性のあるモデルを開発しました。施術から4週間後、心筋梗塞および心不全の診断を支援するために使用されたCK-MB、NT-proBNP、およびレニンの血清濃度が、偽群と比較して心筋梗塞群で有意に高かったことがわかりました。対照的に、MIグループの左心室駆出率(LVEF)の値は、偽のグループよりも明らかに小さかった。さらに、梗塞の大きさと心線維症領域を個々に確認し、TTC染色とマッソントリクローム染色により定量的に解析した。MIグループの梗塞サイズまたは線維症領域のいずれかで小さな変動が見られ、MI後のHFの信頼性と再現性のあるモデルの開発に役立ちました。ラットにおける心筋梗塞後の心不全のこの新しいモデルは、心筋梗塞と心不全の潜在的なメカニズムを研究するために不可欠です。この新しい方法は、薬理学的戦略を用いてラットの心筋梗塞および心不全の治療薬を開発するために使用できます。
概要
心不全(HF)は、2,600万人以上の患者が罹患する世界的な公衆衛生問題と考えられており、その有病率は依然として増加しています1。心不全は、心臓が血液を本来あるべきほど送り出さないときと定義されます。虚血性心疾患、糖尿病、高血圧、LV肥大、肥満、喫煙など、HFには多くの危険因子があります2,3,4。心筋梗塞(MI)は、HF5の最も一般的な原因の1つです。ほぼ50年間、心筋梗塞に続く心不全は、晩期の罹患率、死亡率、および医療費の主要な要因でした6。心不全の病態生理学的メカニズムをより深く理解し、心不全をより効果的に予防および治療するために、前臨床試験のために多数の心筋憂血管後の動物心不全モデルが開発されています。ラットは通常、メンテナンスが容易で、コストが低く、制御能力があり、人間との高い相同性があるために使用されます7,8,9。左冠動脈(LCA)結紮術、特に左前下行(LAD)枝結紮術は、ラット8の心筋梗塞後のHFモデルを開発するために広く使用されています。
しかし、ラットに心筋梗塞を誘発する手術は、高いばらつき、複雑な手術、および高い死亡率のために、しばしば技術的に困難である10,11。かなりの数の手術が報告されていますが、手術の大部分は、気管挿管後の換気または心臓の外部形成のいずれかを必要としていました。これらの方法は、手術の費用を増加させ、手術をより困難にし、動物の安全性を低下させました。さらに、HFの程度はLCAのライゲーション部位に依存します。ラットのLCAの解剖学的多様性は、ラットモデルにおける梗塞のサイズと機能パラメータに一貫性のなさをもたらします。LCAの異なるライゲーション部位は、心不全の程度と生存率を決定する特別な梗塞サイズを引き起こします。
本研究では、信頼性と再現性のある心不全心筋溢血後モデルの作成を目指しました。私たちの調査結果により、人工呼吸器を使わずにラットの手術や心臓の外部化が可能になり、その結果、高い生存率が得られました。また、LAD の結紮部位が比較的固定されているため、手術後 4 週間での HF の変動が少なくなりました。さらに、病理組織学的染色、生化学的検出、心機能測定を用いてHFモデルの効果を評価し、疾患の背後にある潜在的なメカニズムの研究とHF治療のための新薬の開発に役立った。
プロトコル
このプロトコルは、山東中医薬大学の動物倫理研究委員会によって承認されました。
注:体重10週齢の成体雄Sprague-Dawleyラット(体重180〜220g)を、偽(n = 25)とMI(n = 35)の2つのグループに無作為に分けました。動物は12/12時間の明暗サイクルで飼育され、水と食物を自由に摂取されました。
1.麻酔と酸素の継続的な供給
- ラットを誘導室に入れ、3%イソフルランで麻酔します。
- 麻酔の準備ができていたかどうかを確認するために、つま先のピンチ反射を観察します。足の指のつまみ反射が消えたら麻酔で十分です。
- ラットを個別に温度制御された小さな手術ボードに移動します。ネズミの足をボードにテープで固定します。
- ラットの顔にマスクを取り付けて、3%のイソフルランと1%の酸素を一定に供給します。
2.換気または心臓の外部形成を伴わない心筋梗塞の誘導
- 脱毛クリームを使用して胸部の毛を取り除き、滅菌します。
- ラットの手術野に1 cm x 3 cmの穴が開いた滅菌ドレープを使用してください。.
- つま先をつまんで十分な麻酔の深さを確認してから手術してください。
- 肋骨を切らずに、胸骨の左端にある3番目と4番目の肋間腔の間に横方向の2.5cmの切開で胸部を開きます。
- 組織や小さな血管を切らずに、2つの血管鉗子を使用して大胸筋と小胸筋を分離します。Weitlaner自己保持リトラクターを胸部に配置して、3番目と4番目の肋骨を分離し、肋骨の完全性を維持しながら心臓を十分に露出させます。
- 2本の鉗子で心膜を繊細に解剖します。
- 湾曲した針を備えた6/0ナイロン縫合糸を使用して、円錐動脈と左心耳接続の中点から2.0〜2.5mm下のLADを永久に結紮します。LADは簡単に認識でき、一部のラットで見つけることができます。
- 左心室の前壁が青白くなった後、LADの適切な結紮を確認します。
- 偽のグループでは、LADの下に縫合糸のみを通過させますが、結紮は行わないでください。
- リトラクターを取り外し、胸部の空気を絞り出してから、筋肉と皮膚を層ごとに縫合します。
- 手術後、ラットを37°Cの加熱パッドの上に置いて回復させます。すべての動物を監視し、24時間ごとに72時間まで鎮痛用のケトプロフェン(5 mg / kg SC)を提供します。.
注:技術的な理由から、この手術には体重が小さい(250 g未満)ラットが好まれます。ステップ2.4〜2.8からチェストを開いたままにする時間は5分に制限されていました。
3. 心機能の評価
注: HF が正常に発症したかどうかを確認するために、13 MHz の電子トランスデューサーを備えた TE7 超音波システムを使用して、処置の 4 週間後に心機能を測定しました。心エコー検査中、ラットは最初の手順で使用されたのと同じ麻酔プロトコルの下にありました。
- 胸部前毛を剃った後、前の手術で使用したボードにラットを配置します。
- プローブを胸部前壁に置き、左心室(LV)の左胸骨傍長軸(PLAX)ビュー(乳頭筋のレベル)から画像を取得します。
- 拡張末期 (LVIDd) および収縮末期 (LVID) の左心室内寸を 3 つの連続した心周期から M モードで測定します。
- LV駆出率(LVEF)とLVフラクショナル短縮(LVFS)をマシンのソフトウェアで計算します。
4. LADライゲーションの4週間後のHFモデルのさらなる解析
- LAD結紮の4週間後にラットをSacraficeし、イソフルランの過剰投与を投与します。CK-MB、N末端脳性ナトリウム利尿ペプチド(NT-proBNP)、レニン、アンジオテンシン(AngII)、アルドステロン(ALD)、TNF-α、VEGF、IL-6、およびHIF-1αの血清濃度を、メーカーのプロトコルに従ってELISAキットを使用して測定します。
- 病理組織学的分析のために心臓を採取するには、ラットの心臓に4°Cの生理生理食塩水を注入してから取り出します。
- 心臓を10%ホルマリンに24時間セットし、パラフィンに埋め込み、左心室軸に沿って横方向に厚さ5.0μmでスライスします。
- 心臓のすべての部分をスライドガラスに取り付け、ヘマトキシリンとエオシン(HE)、およびマッソンのトリクロームで個別に染色します。
- 梗塞のサイズ測定のために、2,3,5-トリフェニルテトラゾリウムクロリド(TTC)で心臓を染色します。
- 心臓を頂点から基部まで厚さ3 mmで半凍結状態で横方向にスライスし、2% TTC溶液中で37°Cで20分間インキュベートします。
- 色が決まったら、スライスを4%パラホルムアルデヒド溶液に15分間固定し、写真を撮ります。
- 梗塞のサイズをマークし、ImageJを使用して計算します。梗塞のサイズは、梗塞の面積と総 LV 面積のパーセンテージで表します。
- 左室梗塞領域の中央にあるコラーゲン含有量を定量的に分析するには、ラットの心臓組織切片をマッソントリクロームで染色します。
- 染色後、画像をスキャンして解析します。線維化の程度は、総 LV 領域に対する線維化領域の割合として表されたコラーゲン体積分率 (CVF) によって評価します。
結果
この手順は低い死亡率で行われました。この実験に使用した主要な機器は、 図1に示すWeitlaner自己保持リトラクター(13.5 cm)とイソフルラン気化器です。MIモデルは、プロトコルに記載されているように、換気や心臓の外部化なしで開発されました。全処置の間、すべての肋骨は完全性に保たれ、全処置は約10分かかりました。外科的結紮部位の概略図を 図2に示します。本研究では、MI群では結紮術中に心室細動で死亡したラットは2匹、偽群では湾曲した針が誤って心臓を貫通した後の出血により1匹が死亡しました。死亡率は実験全体で約5%でした。
ラットの心機能はMI群で有意に低下し、心不全の開発に成功しました。心エコー検査の測定値は、HFモデルの影響を評価するために、手順の4週間後にラットで取得されました(図3)。急性および慢性心不全の診断と治療に関する 2016 年の ESC ガイドライン12 に基づいて、LVEF が 50% 未満のラットを成功した HF モデルと見なします。心不全に関連する主なパラメータを 表1にまとめました。MI群と偽群を比較すると、MI群のLVEFは有意に減少しました(8.0±32.7%対4.9±75.3%、P<0.001)。MI群におけるFSのこれらの有意な減少とLVIDdおよびLVIDの増加は、HFの良い兆候でした。さらに、心室構造の変化は超音波画像から見られました(図3)。LVのチャンバーは大きくなり、MIグループではシャムに比べてLVの壁が薄くて硬くなった。
ELISAによるMIおよびMI後のHFのバイオマーカーの評価
図4、図5に示すように、心筋梗塞の診断に用いた心筋マーカーCK-MBの血清濃度は、心筋梗塞群で3倍以上と有意に上昇しました。一方、レニン、AngII、ALDなどの心不全に関連する一部のパラメータは、処置後4週間で偽群と比較して高かった。MI群のNT-proBNPの濃度は、偽群の13倍でした。また、TNF-αやIL-6などのMI群の炎症誘発性サイトカインの濃度は、偽群と比較して400%および300%増加しました。一方、代表的な血管新生関連因子であるVEGFやHIF-1αも、MI群では偽群に比べて2倍から5倍と有意に高かった。
形態学的変化と病理組織学的解析
MIグループでは、心臓の形態学的解析により、薄くて淡いLV壁と線維性瘢痕の形成が明らかになりました(図6)。さらに、TTC染色による心筋梗塞の有無も確認し、梗塞の大きさを試験しました(図6)。梗塞サイズは、MIグループで施術4週間後に40.7±4.4%であり、MI後の新しいHF法の信頼性と安定性を示しました。HE染色については、顕微鏡評価により、偽群では炎症性変化のない心筋線維の整然とした配置が示されました。しかし、心筋線維は、MIグループの炎症性細胞浸潤により、緩く不規則な配置になりました(図7a)。さらに、Massonのトリクローム染色により、心筋線維症の領域がMIグループで増加し(図7a)、MIグループでコラーゲン体積分率(CVF)が39.2±6.9%であることが明らかになりました。Massonのトリクローム染色の結果はTTC染色と一致しており、MIおよびHFモデルの開発が成功したことがさらに確認されました(図7b、7c)。

図 1.MIモデルを確立するために、主要な機器が使用されました。 (a)Weitlaner自己保持リトラクター(13.5 cm)(左から3番目)。(b) 酸素供給装置。(c)イソフルラン気化器。 この図の拡大版を表示するには、ここをクリックしてください。
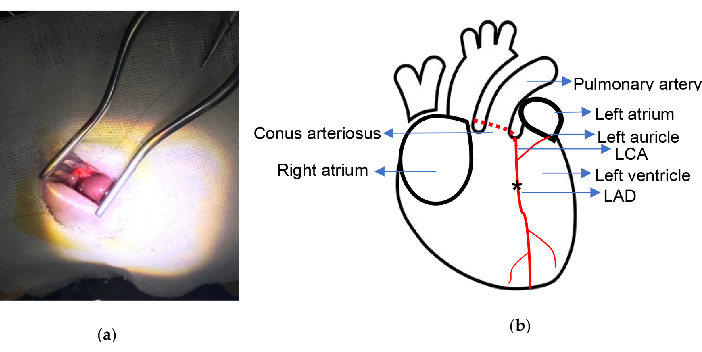
図 2.実験的な概略図。 (a)Weitlaner自己保持リトラクターによる心臓の露出。(b)結紮位置が示されている。アスタリスクはライゲーション位置を示しています。LCA、左冠状動脈;LAD、左前方下降。 この図の拡大版を表示するには、ここをクリックしてください。
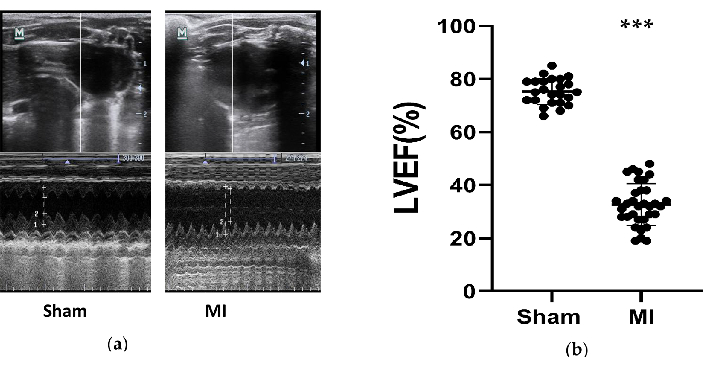
図 3.心エコー測定。 (a) 手術の 4 週間後の 3 回の心周期で M-Mode によってテストされた偽および MI グループの左心室構造の代表的な画像。(b)偽(n = 24)およびMI(n = 33)グループからの手順の4週間後のラットのLVEF。MI、心筋梗塞。LVEF、左心室駆出率。P<偽群と比較して0.001でした。 この図の拡大版を表示するには、ここをクリックしてください。
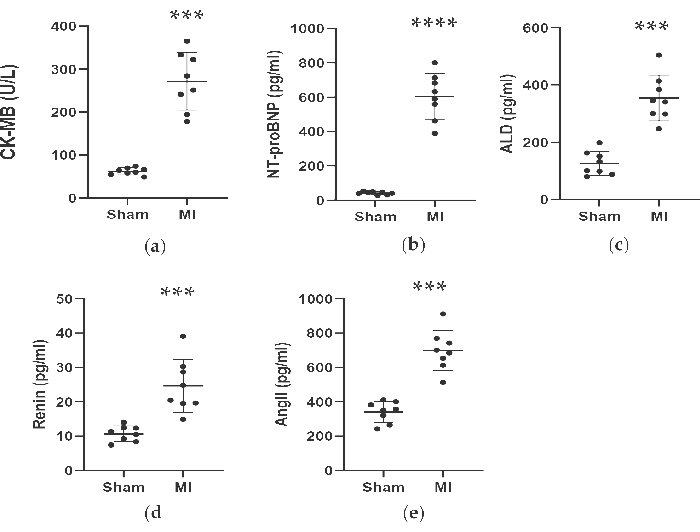
図 4.CK-MB、NT-proBNP、ALD、Renin、AngIIの濃度は、LADライゲーションの4週間後に増加しました。 データは平均 ± SDとして表されました(n = 各グループ8匹)。MI、心筋梗塞;LAD、左前方下降。P<偽群と比較して0.001でした。P<偽グループと比較して0.0001でした。 この図の拡大版を表示するには、ここをクリックしてください。
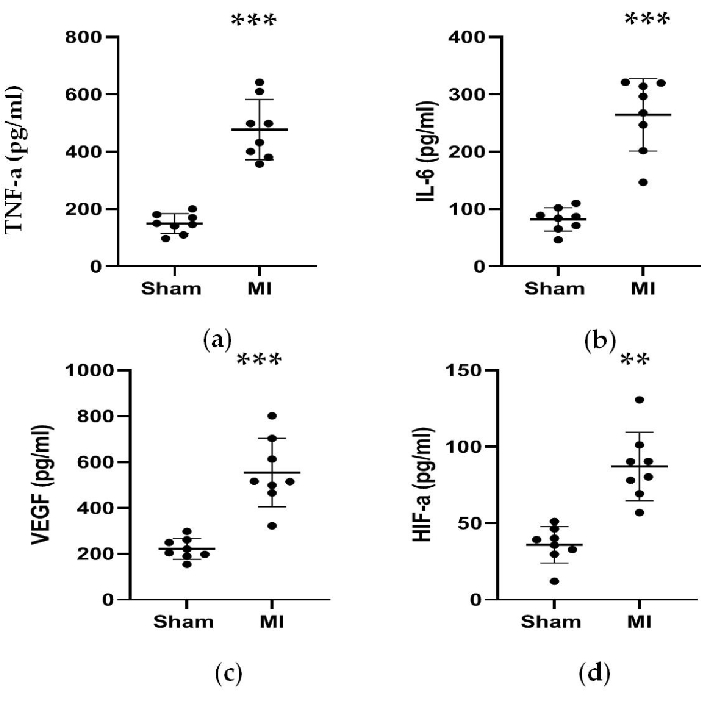
図 5.TNF-α、IL-6、VEGF、およびHIF-αの濃度は、LAD結紮の4週間後に増加しました。 (a、b)炎症反応に関連するTNF-αおよびIL-6の濃度は、LAD結紮の4週間後に増加しました。(ハ、d)血管新生に関連するVEGFおよびHIF-αの濃度は、LAD結紮の4週間後に増加しました。データは平均±SDで表されます(n = 各グループで8匹)。LAD、左前方下降;MI、心筋梗塞。**P<偽群と比較して0.01でした。P<偽群と比較して0.001でした。 この図の拡大版を表示するには、ここをクリックしてください。
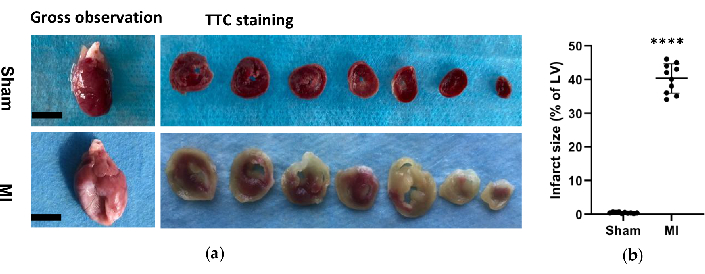
図 6.心臓の形態素解析。 (a) 処置の 4 週間後、偽および心筋梗塞群からのラット心臓の肉眼的観察と組織学。心筋梗塞の心臓は、偽の心臓と比較して、左心室壁が薄くて大きいことを示しました。偽およびMIグループのTTC染色心臓については、生存組織は赤く染色され、梗塞領域は青白く染色されていませんでした。(b)心筋梗塞のサイズは、LV全体に対する梗塞領域の割合として表され、データは平均±SD(各グループでn = 10匹)として表されました。MI、心筋梗塞;TTC、塩化トリフェニルテトラゾリウム;LV、左心室。スケールバー= 5mm. ****P < 0.0001 偽のグループと比較。 この図の拡大版を表示するには、ここをクリックしてください。
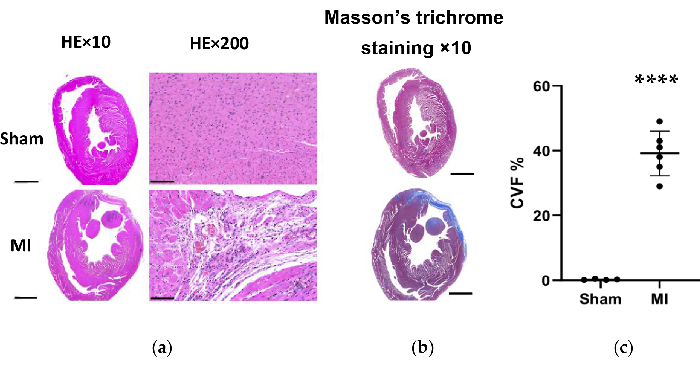
図 7.HEとMassonによるラット心臓組織のトリクローム染色 手順の4週間後。 (a)MIハートLV壁は偽基よりも薄くなりました(HE×10、スケールバー=2mm)。顕微鏡評価では、偽グループでは炎症性変化のない心筋線維の整然とした配置が示され、MIグループでは炎症性細胞浸潤を伴う緩く不規則な配置が示されました(HE×200、スケールバー= 100μm)。(b)Massonの心臓組織のトリクローム染色は、MIグループ(スケールバー= 2 mm)で心筋線維症が青色であることを示しています。(c)偽グループとMIグループの左心室組織スライスにおけるMassonのトリクローム染色のためのコラーゲン体積分率。データはSD±平均(MI群のn = 6動物)で表されます。HE、ヘマトキシリンおよびエオシン;MI、心筋梗塞;LV、左心室。P<偽グループと比較して0.0001でした。 この図の拡大版を表示するには、ここをクリックしてください。
| パラメーター | 偽グループ(n=24) | MIグループ(n=33) |
| LVIDd(ミリメートル) | 8.3±1.3 | 10.1±2.9* |
| LVIDs(ミリメートル) | 4.1±0.9 | 7.7±1.5*** |
| FS(%) | 42.5±7.8 | 22.2±4.4*** |
表1:LAD結紮の4週間後の偽およびMIグループのラットの心エコーデータ。 データは平均SD±MI、心筋梗塞として表されました。LVIDd、拡張期末期の拡張期における左心室の内寸。LVID、収縮末期の左心室内寸;FS%、パーセント分数短縮。*P<0.05で、偽群と比較して。P<偽群と比較して0.001でした。
ディスカッション
げっ歯類 13,14,15 における MI または HF の既存のモデルは多数ありますが、この研究では、ラットで MI 後の HF を誘導するための新しく効率的な LAD 結紮手順を開発しました。しかし、この新しいラットHFモデルでは、挿管や人工呼吸器、心臓の外部化の必要性が排除され、ラットの生存率が大幅に向上しました。この新しいラットHFモデルを開発するためには、心筋梗塞の誘導が重要なステップです。通常、挿管と人工呼吸器、または結紮中の心臓の外部化を伴う従来のプロトコル9,16,17と比較して、私たちは初めて心臓の換気も外部化も行わない改善されたアプローチを開発し、より高い生存率を可能にしました。改善された手順が組織の損傷を減らすことにつながることは注目に値します。したがって、ラットは手術後の回復がはるかに速く、生存率が高くなります。次の2つの点により、これらの結果を達成することができました:まず、手順全体を通して酸素を継続的に吸入することで、換気なしで十分な酸素化と結紮が可能になりました。次に、主要な手術器具であるWeitlaner自己保持リトラクターを使用して、肋骨の完全性を維持しながら心臓に十分に露出し、心臓の外部化を回避するのに役立ちました。
ラットにおける心筋梗塞後の心不全の発症が成功するかどうかは、LCAの結紮部位に関連する梗塞の大きさに大きく依存することはよく知られています。早くも1979年に、Marc A. Pfeeferと彼の同僚は、ラットのLCA閉塞がさまざまなサイズの左心室自由壁梗塞を容易に引き起こす可能性があることを報告しました18。梗塞サイズのばらつきを減らし、心筋梗塞後のより安定したHFモデルを開発するために、LAD結紮術は、研究目的で左心室梗塞を誘発するためにラットで一般的に使用されてきました19。LAD閉塞術の主な利点は、この動脈の正確な結紮を可能にして、はるかに高い生存率を維持しながらHFを引き起こす可能性のある安定した心筋梗塞を誘発できることです。私たちの手順では、円錐動脈と左心房付属器との間の接続の中間点から2.0〜2.5mm下の結紮位置を選択しました。これは、MIグループのすべてのラットでLVEFの変動が少なく、成功し安定していることが証明されました。また、TTC染色による梗塞の大きさとマッソン染色による線維化度を個別に決定し、いずれもこの種のモデル20,21,22の評価に広く用いられています。一方、このモデルのバリエーションが少ないことは、形態学的変化と組織病理学的分析を通じても示されました。
心エコー検査は、心室機能を正確かつ非侵襲的に測定し、構造的心疾患の原因を評価する能力を持っています23。MI群のマウスのLVEFは、すべて50%未満であり、これはHF12と見なすことができます。これらの結果に沿って、NT-proBNPの濃度はそれに応じて増加し、これも心機能障害の重要な指標でした。虚血性心臓の炎症とアポトーシスについては、十分な証拠が存在します24、25。炎症と心不全は強く相互に関連しており、相互に補強し合っています26。私たちの研究では、炎症因子であるIL-6とTNF-aの有意な増加を評価しました。腎の低灌流と交感神経の活性化によって活性化されるレニン-アンジオテンシン-アルドステロン系(RAAS)は、心不全の病態生理学における中心的な特徴である27。RAASに関与するパラメータを評価したところ、レニンの血清レベルはMI群の方が偽群に比べて有意に高いことがわかり、HFの発症がさらに確認されました。
LAD結紮の手順では、主に2つの点を強調します。まず、全処置中、麻酔から回復するまで、動物に酸素を継続的に供給しながら、動物を暖かく保ちます。第二に、LAD上の結紮の位置は、梗塞のサイズとHFの程度に重要な役割を果たします。円錐動脈と左心房付属器との間の接続の中間点から 2.0-2.5 mm 下の部位は、死亡率の低い安定した成功した HF モデルに適しています。ただし、ラットにおける新しい HF モデルの限界は、人工呼吸器なしで MI を発症するための外科的処置が技術的に要求が厳しく、困難であることです。このモデルを達成するための重要なステップは、胸部内の心臓を完全に視覚化し、胸部が開いている時間を5分に制限するために、心臓を十分に露出させることです。
開示事項
著者は何も開示していません。
謝辞
このモデルは、山東省教育局のクラシックTCMフォーミュラの山東共同イノベーションセンターの支援を受けて開発されました。この研究で心エコー検査を行ったLianfeng Wu博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 2% TTC solution | Solarbio | T8170-1 | |
| ELISA kits | Shanghai BlueGene Biotech CO., LTD | ||
| Forceps | shinva | ||
| H&E Staining Kit | abcam | ab245880 | |
| Isoflurane | RWD | 100 mL | |
| Kotoprofen | Zoetis | KETOFEN | |
| nylon suture 6-0 | AD surgical | #S-N618R13 | with needle |
| Scalpel blades | shinva | s2646 | |
| Scalpel Handles | shinva | ||
| Trichrome Stain (Masson) Kit | Sigma-Aldrich | HT15-1KT | |
| Ultrasound | Mindray | TE7 | |
| Veterinary Vaporizer | Matrix | vip-3000 | |
| Weitlaner Self-Retaining Retractor | shinva | ZV077RN |
参考文献
- Savarese, G., Lund, L. H. Global Public Health Burden of Heart Failure. Cardiac Failure Review. 3 (1), 7-11 (2017).
- Ziaeian, B., Fonarow, G. C. Epidemiology and aetiology of heart failure. Nature Reviews Cardiology. 13 (6), 368-378 (2016).
- Meijers, W. C., de Boer, R. A. Common risk factors for heart failure and cancer. Cardiovascular Research. 115 (5), 844-853 (2019).
- Triposkiadis, F., Xanthopoulos, A., Butler, J. Cardiovascular Aging and Heart Failure: JACC Review Topic of the Week. Journal of the American College of Cardiology. 74 (6), 804-813 (2019).
- Tanai, E., Frantz, S. Pathophysiology of Heart Failure. Comprehensive Physiology. 6 (1), 187-214 (2015).
- Cahill, T. J., Kharbanda, R. K. Heart failure after myocardial infarction in the era of primary percutaneous coronary intervention: Mechanisms, incidence and identification of patients at risk. World Journal Of Cardiology. 9 (5), 407-415 (2017).
- Houser, S. R., et al. Animal models of heart failure: a scientific statement from the American Heart Association. Circulation Research. 111 (1), 131-150 (2012).
- Patten, R. D., Hall-Porter, M. R. Small animal models of heart failure: development of novel therapies, past and present. Circulation Heart Failure. 2 (2), 138-144 (2009).
- Chen, J., et al. Ischemic Model of Heart Failure in Rats and Mice. Methods in Molecular Biology. 1816, Clifton, NJ. 175-182 (2018).
- Chen, J., Ceholski, D. K., Liang, L., Fish, K., Hajjar, R. J. Variability in coronary artery anatomy affects consistency of cardiac damage after myocardial infarction in mice. American Journal of Physiology Heart and Circulatory Physiology. 313 (2), 275-282 (2017).
- Goldman, S., Raya, T. E. Rat infarct model of myocardial infarction and heart failure. Journal of Cardiac Failure. 1 (2), 169-177 (1995).
- Ponikowski, P., et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. European Journal of Heart Failure. 18 (8), 891-975 (2016).
- Gao, E., et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse. Circulation Research. 107 (12), 1445-1453 (2010).
- vanden Bos, E. J., Mees, B. M., de Waard, M. C., de Crom, R., Duncker, D. J. A novel model of cryoinjury-induced myocardial infarction in the mouse: a comparison with coronary artery ligation. American Journal of Physiology Heart and Circulatory Physiology. 289 (3), 1291-1300 (2005).
- Lindsey, M. L., et al. Guidelines for experimental models of myocardial ischemia and infarction. American Journal of Physiology Heart and Circulatory Physiology. 314 (4), 812-838 (2018).
- Henri, O., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 133 (15), 1484-1497 (2016).
- Fu, Y. H., et al. A novel rat model of chronic heart failure following myocardial infarction. Methods and Findings in Experimental and Clinical Pharmacology. 31 (6), 367-373 (2009).
- Pfeffer, M. A., et al. Myocardial infarct size and ventricular function in rats. Circulation Research. 44 (4), 503-512 (1979).
- Samsamshariat, S. A., Samsamshariat, Z. A., Movahed, M. R. A novel method for safe and accurate left anterior descending coronary artery ligation for research in rats. Cardiovascular Revascularization Medicine: Including Molecular Interventions. 6 (3), 121-123 (2005).
- Redfors, B., Shao, Y., Omerovic, E. Myocardial infarct size and area at risk assessment in mice. Experimental and Clinical Cardiology. 17 (4), 268-272 (2012).
- Rüder, C., et al. Combinatorial G-CSF/AMD3100 treatment in cardiac repair after myocardial infarction. PloS One. 9 (8), 104644(2014).
- Valentin, J., Frobert, A., Ajalbert, G., Cook, S., Giraud, M. N. Histological Quantification of Chronic Myocardial Infarct in Rats. Journal of Visualized Experiments. (118), (2016).
- Kirkpatrick, J. N., Vannan, M. A., Narula, J., Lang, R. M. Echocardiography in heart failure: applications, utility, and new horizons. Journal of the American College of Cardiology. 50 (5), 381-396 (2007).
- Teringova, E., Tousek, P. Apoptosis in ischemic heart disease. Journal of Translational Medicine. 15 (1), 87(2017).
- Wang, X., Guo, Z., Ding, Z., Mehta, J. L. Inflammation, Autophagy, and Apoptosis After Myocardial Infarction. Journal of the American Heart Association. 7 (9), (2018).
- Van Linthout, S., Tschöpe, C. Inflammation - Cause or Consequence of Heart Failure or Both. Current Heart Failure Reports. 14 (4), 251-265 (2017).
- Orsborne, C., Chaggar, P. S., Shaw, S. M., Williams, S. G. The renin-angiotensin-aldosterone system in heart failure for the non-specialist: the past, the present and the future. Postgraduate Medical Journal. 93 (1095), 29-37 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved