A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استهداف القناة القشرية الشوكية في الفئران الوليدية باستخدام ناقل فيروسي مزدوج باستخدام جراحة الدماغ والعمود الفقري المشتركة
In This Article
Summary
يوضح هذا البروتوكول طريقة جديدة لتطبيق العلاجات الجينية على مجموعات فرعية من الخلايا في الفئران حديثي الولادة في سن ما بعد الولادة من 5 إلى 10 أيام عن طريق حقن معدل كيميائي وراثي تقدمي في القشرة الحركية الجسدية و Cre recombinase قابل للنقل إلى الوراء في الحبل الشوكي العنقي.
Abstract
تعد معالجة العقبات التي تقيد البحث على الفئران حديثي الولادة بنجاح أمرا مهما لدراسة الاختلافات في النتائج التي تظهر في إصابات الحبل الشوكي للأطفال (SCIs) مقارنة باصابات النخاع الشوكي للبالغين. بالإضافة إلى ذلك ، قد يكون إدخال العلاجات بشكل موثوق في الخلايا المستهدفة للجهاز العصبي المركزي (CNS) أمرا صعبا ، ويمكن أن تؤدي عدم الدقة إلى الإضرار بفعالية الدراسة أو العلاج. يجمع هذا البروتوكول بين تقنية النواقل الفيروسية وتقنية جراحية جديدة لإدخال العلاجات الجينية بدقة في الفئران الوليدية في يوم ما بعد الولادة 5. هنا ، يتم إدخال فيروس مصمم للنقل الرجعي (retroAAV2) من Cre في النهايات المحورية للخلايا العصبية القشرية الشوكية في الحبل الشوكي ، حيث يتم نقله لاحقا إلى أجسام الخلايا. ثم يتم حقن مستقبل مصمم ذو اتجاه مقلوب مزدوج (DIO) يتم تنشيطه حصريا بواسطة فيروس (أدوية) مصمم (DREADD) في القشرة الحركية الجسدية للدماغ. تعزز تقنية العدوى المزدوجة هذه التعبير عن DREADDs فقط في الخلايا العصبية القشرية الشوكية المصابة (CST). وبالتالي ، فإن الحقن المشترك المتزامن للقشرة الحركية الجسدية ومحطات CST العنقية هو طريقة صالحة لدراسة التعديل الكيميائي الجيني للتعافي بعد نماذج اصابات النخاع الشوكي العنقي في الفئران الوليدية.
Introduction
في حين أن اصابات النخاع الشوكي نادرة الحدوث نسبيا بين الأطفال ، إلا أنها مؤلمة بشكل خاص وتسبب إعاقة دائمة تتطلب بصيرة لوجستية هائلة. علاوة على ذلك ، يتم تصنيف نسبة أعلى من اصابات النخاع الشوكي للأطفال على أنها عنق الرحم وكاملة مقارنة بالسكان البالغين 1,2. السمة المميزة لأنواع الثدييات هي أن حديثي الولادة يتعافون بشكل ملحوظ من اصابات النخاع الشوكي بشكل أفضل من البالغين ، وهذا يوفر فرصة لتقييم آليات القيادة للتعافي في السكان الأصغر سنا3،4،5. على الرغم من ذلك ، هناك عدد أقل من الدراسات متعددة الوسائط التي تتناول أبحاث القوارض حديثي الولادة والرضع ، ويرجع ذلك جزئيا إلى الصعوبة الإضافية المتمثلة في استهداف مجموعات مختارة من الخلايا العصبية بدقة في المعالم التشريحية الأكثر إحكاما للحيوانات الأصغر سنا6. تركز هذه المقالة على الحقن المباشر للناقلات المرتبطة بالغدي التقدمي والرجعي عالي الكفاءة في الحبل الشوكي للفئران لتعديل المسارات الحركية الرئيسية مع تطبيق Cre-dependent-DREADDs ، مما يوسع نطاق دراسات التجديد متعدد الوسائط.
النواقل الفيروسية هي أدوات بيولوجية مهمة لها مجموعة واسعة من التطبيقات ، بما في ذلك إدخال المادة الوراثية لتحل محل الجينات المستهدفة ، وتنظيم بروتينات النمو ، وتتبع المشهد التشريحي للجهاز العصبي المركزي7،8،9. تمت دراسة العديد من التفاصيل التشريحية للمسارات الحركية الشوكية باستخدام المقتفيات الكلاسيكية ، أي أمين ديكستران البيوتينيل. في حين أن المتتبعات التقليدية كانت مفيدة في اكتشاف التشريح العصبي ، إلا أنها لا تخلو من عيوبها: فهي تسمي المسارات بشكل عشوائي حتى لو تم حقنها بشكل صحيح ، وقد وجدت الدراسات أنها تمتصها المحاور التالفة10،11،12. وبالتالي ، قد يؤدي ذلك إلى تفسيرات غير صحيحة في دراسات التجديد حيث يمكن الخلط بين المحاور المقطوعة وتجديد الألياف.
تستخدم الطريقة التالية نظام النواقل الفيروسية الثنائية الذي شاع مؤخرا في دراسات التشكيل ، مع ناقلين فيروسيين مختلفين في منطقتين منفصلتين من نفس الخلية العصبية13,14. الأول هو ناقل يصيب محليا أجسام الخلايا العصبية الإسقاطية. والآخر هو ناقل رجعي يتم نقله من النهايات المحورية للخلايا العصبية البارزة (الشكل 1). يحمل المتجه الرجعي Cre recombinase ، ويشتمل المتجه المحلي على تسلسل "Cre-On" مزدوج الفلوكس الذي يتم فيه تشفير بروتين الفلورسنت (mCherry). يتم عكس جين التحوير الأصلي الذي يعبر عن كل من hM3Dq و mCherry بالنسبة إلى المروج ويحيط به موقعان LoxP (الشكل 2). وبالتالي ، يتم التعبير عن mCherry فقط في الخلايا العصبية الإسقاطية المتحولة بشكل مضاعف حيث يحفز Cre recombinase حدث إعادة التركيب بين مواقع LoxP ، مما يؤدي إلى قلب اتجاه جين التحوير إلى إطار القراءة المناسب والسماح بالتعبير عن كل من DREADD والبروتين الفلوري. بمجرد أن يكون جين التحوير الفيروسي في الاتجاه الصحيح ، وعند الاقتضاء ، يمكن ل DREADDs أن تحفز بشكل عابر التعديل العصبي من خلال ليجند محقون بشكل منفصل ، أي كلوزابين-N-oxide. تم تصميم البروتوكول لمصادقة أبحاث التعديل العصبي المستحث في حديثي الولادة ، حيث يتم حقن DREADD لتعديل CSTs بشكل انتقائي. يعمل النظام ثنائي الفيروسات كبوليصة تأمين ، مما يضمن أن كل خلية إيجابية DREADD يمكن تتبعها تحت مضان بدقة عالية للتحقق من صحة الحقن.
تساعد هذه الطريقة أيضا على سد الفجوة في أبحاث حديثي الولادة. تقدم اصابات النخاع الشوكي للأطفال تحدياتها ، ويجب أن تؤكد الأبحاث التي تحلل التجديد أو الإنبات أو اللدونة على الاختلافات بين حديثي الولادة والبالغين3،15،16،17. من خلال تحسين الإجراء الجراحي وإجراء الدراسات التشريحية السابقة مع تلطيخ نيسل ، تم التحقق من صحة إحداثيات كل من حقن الجمجمة والعمود الفقري. كان الهدف هو توفير طريقة للحقن المزدوجة في الفئران حديثي الولادة مع زيادة الدقة والقدرة على البقاء.
بالنسبة للنموذج الحالي ، تم حقن الناقل المتقدم في أجسام الخلايا في القشرة الحركية الجسدية باستخدام bregma كمرجع18,19. فيما يتعلق بحقن العمود الفقري ، تم حقن الناقل الرجعي في الصفيحة V-VII ، حيث توجد نهايات محور CST20,21. هناك العديد من الأسئلة الأساسية الكامنة وراء كيفية تأثير نماذج معينة من الآفات على الحيوانات الأصغر سنا بشكل مختلف ، وكيف يختلف التعافي اللاحق عن الحيوان الأكبر سنا. توضح هذه الدراسة وسيلة قوية لدراسة إصابات عنق الرحم وإمكانية استعادة وظيفة الأطراف الأمامية في القوارض الوليدية. في المقابل ، تناولت غالبية الدراسات السابقة حركة التعافي بعد الإصابات القطنية أو الصدرية5،22،23،24. من خلال إقران الناقل الفيروسي المزدوج بتقنية الحقن الجديدة الموصوفة هنا ، يساعد هذا البروتوكول في التخفيف من بعض المشكلات (أي البقاء على قيد الحياة) التي قد تصيب تحقيقات القوارض الوليدية. هذه الطريقة قوية وعملية ومتعددة الاستخدامات: ستسمح الاختلافات الطفيفة في التقنية باستهداف مسارات مختلفة ، أي CST البطني ، CST الظهري ، والمسارات الظهرية الصاعدة.
بالنسبة لهذا النظام ، يتم حقن فيروس واحد يعمل محليا (على سبيل المثال ، AAV2) في منطقة أجسام الخلايا العصبية ذات الأهمية. يتم حقن فيروس ثان ينتقل بأثر رجعي ويتحكم في التعبير عن الفيروس المحلي في النهايات المحورية لتلك المجموعة العصبية. وبالتالي ، بحكم التعريف ، يتم تصنيف الخلايا العصبية القشرية الشوكية فقط. تم اختيار فيروس retroAAV-Cre مع محفز CMV نشط بشكل أساسي حيث يتم استخدام بلازميد المكوك لتوليد العديد من الأنماط المصلية AAV للتعبير المعتمد على Cre في عدة أنواع من الخلايا. بالنسبة للحقن القشرية ، تم اختيار AAV2 مع جين التحوير الذي يقوده المروج synapsin-1 للحد من أي تعبير عن الخلايا العصبية. نظرا لأن النظام الفيروسي 2 يعتمد بشكل أكبر على أصل وإنهاء السكان العصبيين ذوي الأهمية ، يمكن استخدام العديد من المروجين المختلفين ، إذا كان بإمكانهم دفع التعبير عن الجينات ذات الأهمية داخل السكان العصبيين محل الاهتمام. على سبيل المثال ، يمكن استبدال المروج العصبي المثير ، CamKII ، ب synapsin-1. بالإضافة إلى استخدام هذه الأنماط المصلية AAV ، يمكن أيضا تحقيق النقل الرجعي إلى غير ناضج ، وبدرجة أقل بكثير ، الخلايا العصبية الحركية القشرية الشوكية البالغة باستخدام فيروس lentivirus القابل للنقل الرجعي العالي (HiRet)25. تستخدم فيروسات HiRet lentivirus بروتين سكري خيمري لداء الكلب / VSV لاستهداف الامتصاص عند المشبك العصبي للنقل الرجعي. جنبا إلى جنب مع مروج Tet-On ، يدعم هذا النظام الفيروسي 2 التعبير المحرض بطريقة تعتمد على الرجعية26,27.
تدخل الفيروسات المرتجعة ناقلات في الفضاء المشبكي للخلية العصبية المستهدفة، مما يسمح بامتصاصها بواسطة محور الخلية ونقلها إلى جسم الخلية. في حين أن النواقل الفيروسية العدسية قد حققت نجاحا هائلا في السابق ، حيث وفرت تعبيرا طويل المدى في دراسات العلاج الجيني ، فقد تمحورت هذه الطريقة نحو النواقل الفيروسية المرتبطة بالغدي لعدة أسباب بسيطة26,28: AAV أكثر اقتصادا وفعالية بالمثل ويمثل عبئا لوجستيا أقل ، نظرا لأنه يحتوي على مستوى أمان حيوي أقل 29,30,31,32 . في حين أن AAV2 ، النمط المصلي الأكثر استخداما ، يوضح نقلا قويا لمحاور CST ، قد يلاحظ الباحثون في المستقبل أن AAV1 يوفر بعض التنوع لأنه يصنف بشكل عابر ، وبالتالي يطرح العديد من التكرارات المحتملة في الدراسات المستقبلية33. التكيف النهائي هو تشفير الفيروس الرجعي مع Cre-recombinase بحيث يمكن إدخال العديد من النواقل التقدمية في وقت واحد ، وبالتالي تقليل نفايات الفيروسات الداخلية غير الضرورية وزيادة احتمالية تعبير DREADDs في الاتجاه الصحيح.
في النهاية ، يوضح هذا البروتوكول الحقن المتزامن في القشرة والعمود الفقري العنقي ، مستهدفا على وجه التحديد أجسام الخلايا والأطراف المحورية للقناة القشرية الشوكية ، على التوالي. يظهر النقل عالي الدقة في القشرة الدماغية والحبل الشوكي. في حين أن البروتوكول الموصوف كان مثاليا لفئران Sprague Dawley التي يبلغ عمرها 5 أيام ، إلا أنه مناسب لأيام ما بعد الولادة من 4 إلى 10 مع تعديلات طفيفة على التخدير وإحداثيات التجسيم.
Protocol
تمت الموافقة على جميع الإجراءات الجراحية ورعاية الحيوانات التالية من قبل لجنة رعاية واستخدام الحيوان بجامعة تمبل. البروتوكول الموصوف هو جراحة البقاء على قيد الحياة ، وتم قتل الحيوانات في النهاية عن طريق الحقن داخل الصفاق من 100 ملغم / كغم من بنتوباربيتال الصوديوم عند الانتهاء من نقاطها الزمنية.
1. التحضير قبل الجراحة
- تحضير ما لا يقل عن إبرتين زجاجيتين مسحوبتين للحقن الفيروسي باستخدام ماصات شعرية زجاجية 3.5 nL ؛ إبرة واحدة ل DREADD وإبرة واحدة ل rCre. كإجراء احترازي ، قم بإعداد 4-5 إبر في حالة كسرها أثناء الجراحة.
- باستخدام مقص مجهري ، قطع 1-2 مم من الزجاج الزائد من الإبرة.
- لكل إبرة ، ضعها عند 30 درجة ، استخدم مائلة ماصة صغيرة لإنشاء طرف بفتحة 30-40 ميكرومتر وزاوية مشطوفة 45 درجة.
- قم بتخزين الإبر في طبق بتري مغطى ثم قم بتعقيمها عن طريق وضع طبق بتري في غطاء أمان حيوي تحت ضوء الأشعة فوق البنفسجية لمدة 15 دقيقة.
- قم بإعداد الفيروسات اللازمة عن طريق إزالة حجم مناسب من الفريزر -80 درجة مئوية قبل الإجراء ، مع الأخذ في الاعتبار أن كل سيتطلب 3 ميكرولتر من كل فيروس.
ملاحظة: نقل وتخزين الفيروس على الجليد عندما لا يكون قيد الاستخدام. تم تطوير هذا البروتوكول باستخدام AAV2-hM3Dq-mCherry و AAV2-retroCre لحقن 3 ميكرولتر من كل فيروس لكل. تم استخدام بلازميد DREADD ، pAAV-hSyn-DIO-hM3Dq-mCherry (انظر جدول المواد) ، لصنع AAV2 التقدمي بعيار فيروسي يبلغ 1.54 × 1012 نسخة جينوم (GC) / مل. تم استخدام بلازميد Cre ، pAAV-CMV-scCre ، لصنع AAV2 الرجعي بعيار فيروسي يبلغ 4.27 × 1012 GC / mL. - قم بتوصيل الحاقن بالمضخة الدقيقة وضعه في معالج دقيق بمقياس الورنية.
- للمساعدة في تأكيد وجود أو عدم وجود فيروس في الإبرة بصريا ، قم بتحميل صبغة ملونة ، أي زيت أحمر ، في الإبرة. تجنب الفقاعات في الإبرة.
- أدخل الإبرة الزجاجية في الحاقن ، وتأكد من أن الإبرة مناسبة بشكل صحيح.
- إذا كان ذلك متاحا ، كرر العملية بأكملها باستخدام مضخة حقن منفصلة لكل فيروس. إذا كان هناك مضخة حقن واحدة فقط متاحة ، فقم بإعداد إبرتين منفصلتين واستبدل الإبرة المستخدمة عندما يحين وقت تبديل الفيروسات.
2. التخدير وإعداد موقع الجراحة
- وزن الحيوان على ميزان رقمي. سجل الوزن قبل الجراحة لتحديد حجم التخدير المطلوب.
ملاحظة: وجد هذا البروتوكول أن تقنية التخدير الأكثر موثوقية لضمان مستوى مخدر مرض طوال وقت الجراحة هي مزيج من الكيتامين وانخفاض حرارة الجسم. الكيتامين غير كاف لضمان التخدير من تلقاء نفسه ، وتكميله بالزيلازين له عتبة ضيقة قبل زيادة الوفيات أثناء العملية. انخفاض حرارة الجسم من تلقاء نفسه لا يكفي للعمليات الجراحية المطولة (من المحتمل أن تتطلب جراحة العمود الفقري والدماغ المزدوجة >1 ساعة من التخدير الثابت). - تخدير الجرو عن طريق حقن الكيتامين المخفف (10 ملغ / مل) تحت الجلد بين لوحي الكتف بحيث يتلقى الحيوان جرعة 100 ملغم / كغم من الكيتامين ؛ انتظر لمدة 5 دقائق.
ملاحظة: على سبيل المثال ، في اليوم الخامس بعد الولادة ، يزن جرو الجرذ 10 جم ويتلقى 0.1 مل من محلول الكيتامين المخفف (10 مجم / مل). - ضع الجرو على الثلج المجروش لمدة 6-8 دقائق. حمايته من قضمة الصقيع عن طريق وضع الحيوان في قفاز اللاتكس أو بارافيلم لتجنب الاتصال المباشر مع الجليد.
- اضغط على القدم بقوة باستخدام ملقط لتأكيد مستوى التخدير المناسب. في حالة حدوث انسحاب انعكاسي ، اتركه لمدة 2 دقيقة إضافية على الثلج قبل المتابعة.
- تطبيق على نطاق واسع مطهر على رأس الحيوان ومنطقة الظهر باستخدام شاش معقم غارقة في محلول اليود 5 ٪. ثم ، تعقيم مع الشاش غارقة في 70 ٪ من الإيثانول. ضع المناديل المطهرة ثلاث مرات لكل منها ، بالتناوب بين اليود والإيثانول لامتصاص الشاش.
ملاحظة: ليست هناك حاجة للعناية بالعين لأن الجراء الصغار يفتحون أعينهم فقط في عمر 14 يوما. - إذا كان الحيوان سيخضع لعملية جراحية مزدوجة (الدماغ + العمود الفقري) ، فقم بتوفير بلعة ملحية طبيعية قبل الجراحة (0.02 مل / جم) تحت الجلد بين لوحي الكتف.
ملاحظة: إذا أصبح الحيوان مستجيبا أثناء الجراحة وكان هناك حاجة إلى مزيد من التخدير ، فاستبدل الحيوان على الثلج لمدة 5 دقائق.
3. المجال الجراحي وإعداد الأدوات
- الأوتوكلاف الأدوات الجراحية التي تشمل حامل مشرط ، و rongeurs ، ومرقئ ، وملقط منحني متوسط النقطة ، ومبعدات
- جهز المجهر وقم بتثبيت محول التجسيم للفئران حديثي الولادة لوضعه بإحكام داخل حامل التجسيم البالغ.
- إجراء الجراحة باستخدام قفازات معقمة. افتح عبوة من القفازات الجراحية المعقمة المعبأة مسبقا وضع غلاف القفازات المعقم على الطاولة ، باستخدام الغلاف كمنطقة إضافية لوضع الأدوات المستخدمة.
ملاحظة: من المهم اتباع الممارسة الجراحية الجيدة والحفاظ على العقم طوال العملية. - ثبت 11 شفرة في حامل المشرط. ضع محلول ملحي معقم ، وخياطة 4.0 كرومية ، وخياطة حريرية 4.0 ، ومواد للتحكم في النزيف ، على سبيل المثال ، شاش معقم ، وأدوات تطبيق معقمة ذات رؤوس قطنية ، ومثلثات.
- قم بإعداد حقلين جراحيين كما هو موضح أعلاه ، مع تخصيص موقع واحد لحج القحف والموقع الآخر مخصص لاستئصال الصفيحة الفقرية العنقية.
- استرجع الحيوان وثبته في المحول المجسم: نظرا لأن حديثي الولادة غضروفون للغاية ، قم بإصلاحهم برفق عن طريق توجيه قضبان الأذن على نطاق واسع نحو مفاصل الفك السفلي. بمجرد أن تستقر أفقيا ، أدخل لسان حال الجبهة برفق.
ملاحظة: القاعدة غير الملزمة المستخدمة لتوفير منطقة جراحية "مسطحة" هي تثبيت قضبان الأذن بنفس الارتفاع وقطعة الفم عند حوالي 2-3 مستويات أقل.
4. إجراء حج القحف وفضح القشرة الحركية الجسدية
- حدد المنطقة التي سيتم إجراء الشق فيها عن طريق الضغط على الملقط في خط الوسط أعلى فروة الرأس ، والشعور بالخيط السهمي. قم بعمل شق 1 سم على طول مستوى الخياطة السهمية ، بدءا من أعلى خط العين مباشرة. امسك الجلد مشدودا لضمان شق نظيف ومستقيم ودقيق.
- حدد bregma (تقارب الغرز الإكليلية والسهمية) عن طريق فحص الملقط بلطف على طول سطح الجمجمة وإيلاء اهتمام وثيق لخطوط الخياطة وكذلك أي مسافة بادئة ناتجة عن الملقط الذي يمتد على طول العظام الجدارية والأمامية.
- الحفاظ على الفتحة مع تطبيق السنانير المرجحة على جانب الاهتمام. لاحظ أن حقن العمود الفقري يتم على الجانب الأيمن ، وحقن الجمجمة على الجانب الأيسر.
- قم بإزالة التهاب الأعصاب باستخدام مزيج من أطراف القطن والمقص المجهري لزيادة التعرض ل bregma لزيادة الدقة. تأكد من أن الدرز الإكليلي في رؤية واضحة بما يكفي لتوفير قالب تقريبي للحقن اللاحقة.
- باستخدام المقص المجهري ، قم بقطع جزء 3 × 2 مم تقريبا من عظم الجمجمة الجبهي الأيسر المجاور مباشرة لبريغما.
ملاحظة: بمجرد إزالة سديلة العظام بعناية ، يجب أن تكون هناك نافذة شفافة بها مادة دماغية مكشوفة جاهزة للحقن. ستعمل خطوط الخياطة المتبقية على الجانب المقابل من الدماغ كدليل مرئي للحفاظ على الدقة على طول المحور الأمامي الخلفي (AP). - قم بإزالة أي حطام أو سائل دماغي نخاعي (CSF) ودم بأطراف قطنية.
ملاحظة: من الطبيعي أن يحجب الدم أو السائل الدماغي الشوكي الخط البصري قليلا ، لذلك ينصح بتنظيف المنطقة بأطراف قطنية بانتظام.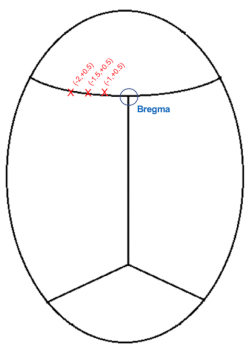
الشكل 3: رسم تخطيطي لإحداثيات حقن الجمجمة (مم) بالنسبة إلى البريغما. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
5. تحميل الفيروس ووضع حاقن
- قم بتحميل الفيروس في الحاقن عن طريق سحب ~ 5 ميكرولتر على قطعة من البارافيلم ، وضع الإبرة بحيث يستقر الطرف فوق قطرة الفيروس.
- تأكد من تحميل فيروس إضافي في الحاقن لضمان الحقن السلس. على سبيل المثال ، عند حقن ما مجموعه 3 ميكرولتر (1 ميكرولتر لكل موقع حقن) ، اسحب 4 ميكرولتر من الفيروس بمعدل 250 نانولتر / ثانية باستخدام المضخة الدقيقة.
- إزالة الفيروس الزائد مع مسح المختبر.
- ضع المعالج الدقيق بحيث يكون مقياس الورنية مرئيا ، وضع الإبرة فوق الخيط السهمي.
- اخفض الإبرة إلى أعلى المنطقة التي تمثل البريغما مباشرة (الشكل 3) ، وقم بتدوين AP والإحداثيات الإنسية الجانبية (ML).
- بالنظر إلى أن الحقن ستكون على الجانب الأيسر ، قم بإنشاء إحداثيات الهدف عن طريق طرح 1 و 1.5 و 2.0 مم (ML: -1.0 ، -1.5 ، -2.0) من إحداثيات ML ل bregma.
ملاحظة: سيكون موضع AP + 0.5 مم من bregma لجميع الحقن الثلاث. - حرك الإبرة في موضعها للحقنة الأولى. ا ف ب: +0.5 ، مل: -1.0
- اخفض الإبرة إلى الدماغ المكشوف حتى يتم وضع مسافة بادئة للقشرة الخارجية. دون ارتفاع الإبرة وانزل الإبرة إلى موضعها بطرح 0.6 مم من ارتفاع سطح الدماغ. عمق الحقن: السطح القشري -0.6 مم.
ملاحظة: من المهم ملاحظة عمق السطح لكل حقنة حيث قد تحدث اضطرابات طفيفة في وضع الفئران.
6. حقن الفيروس في القشرة الحركية الجسدية
- بمجرد وضع الإبرة في مكانها ، قم ببرمجة الحاقن لحقن 1 ميكرولتر بمعدل 250 nL / دقيقة.
- بمجرد اكتمال الحقن ، اترك الإبرة ترتاح في القشرة لمدة 3 دقائق.
- كرر الحقن للإحداثيات الأخرى: ما مجموعه 3 حقن على طول القشرة فيما يتعلق ب bregma ، وكلها على عمق -0.6 مم: 1) AP: + 0.5 مم ، ML: -1.0 مم 2) AP: + 0.5 مم ، ML: -1.5 مم 3) AP: + 0.5 مم ، ML: -2.0 مم.
- بعد الانتهاء من الحقن ، راجع القسم 9 للخياطة ، ونقل الحيوان إلى طاولة العمليات الأخرى لاستئصال الصفيحة الفقرية عنق الرحم.
7. إنشاء نافذة العمود الفقري لحقن الحبل الشوكي بدقة
- حدد موقع الشق باستخدام الأصابع لتحسس قاعدة الجمجمة. عند خط الوسط ، ابدأ الشق الخلفي 1-2 مم لقاعدة الجمجمة باستخدام شفرة #11 وقم بتمديد الشق الخلفي 1 سم لكشف العضلة السطحية. امسك الجلد مشدودا عن طريق وضع شد بالإبهام والسبابة لضمان شق نظيف.
- باستخدام النقطة الحادة للشفرة ، قم بإجراء سلسلة من الجروح برفق على طول خط الوسط للعضلة السطحية لكشف تجويف العمود الفقري وعضلات العمود الفقري العميقة. استخدم زوجا من الملقط لنشر العضلات وتصور النافذة الجراحية.
ملاحظة: ستظهر العضلات السطحية باللون الوردي الفاتح ، بينما ستظهر عضلات العمود الفقري العميقة باللون الرمادي الأبيض الفاتح. - بمجرد انكشاف عضلات العمود الفقري العميقة ، أدخل المبعدات في النافذة الجراحية. إذا لزم الأمر ، استخدم ملقط للإمساك بالجلد الجانبي والعضلات لتمديدها حول أسنان المبعدات. اسحب النافذة الجراحية إلى عرض 7-8 مم ، مما يسمح برؤية العمود الفقري دون عائق.
- حدد الفقرة العنقية الثانية (C2 أو المحور) من خلال عمليتها الشائكة البارزة التي تبرز ظهريا وتغليفا في عضلة كبيرة على شكل قبة. استخدم ملقط أو مسبار غير حاد للتعرف على هذه العملية وتحديدها ، حيث سيكون هذا هو المعلم الإرشادي.
ملاحظة: غالبا ما تكون فقرة C3 المجاورة مسدودة قليلا بواسطة عضلة C2 الكبيرة. لذلك ، يساعد التشريح اللطيف للعضلات عند C3 بالملقط أو مكشطة العظام على تحديد الفقرة والمساعدة في عد الفقرات. - باستخدام الحافة المسطحة لمكشطة العظام ، قم بكشف فقرات C3-C7 عن طريق كشط عضلة العمود الفقري العميقة برفق على الجانبين. ابدأ الإنسي وكشط جانبيا على طول الاتجاه الموازي للصفائح الفقرية لضمان التعرض المناسب ، مما سيسمح بتمييز واضح للصفائح الفقرية. السيطرة على أي نزيف مع أطراف القطن.
- باستخدام زوج من المقصات الدقيقة ، قم بقص الحواف الجانبية للصفائح الغضروفية بعناية عند C6 و C7. استخدم C2 كدليل عند حساب مستويات العمود الفقري.
- باستخدام زوج من الملقط الناعم ، قم بإزالة الجزء الذي تم تشريحه بعناية من الصفيحة لفضح الحبل الشوكي. تأكد من أن نافذة العمود الفقري كبيرة بما يكفي لاستيعاب موقع الحقن المطلوب. قم بإزالة أي أجزاء حادة أو خشنة من العظام قد تثقب الحبل الشوكي بالمقص المجهري والملقط كما هو موضح أعلاه.
- قم بإعداد الحيوان في حامل الجمجمة المجسم كما هو موضح في القسم 3.6. بالإضافة إلى ذلك ، ضع قطعة من الشاش ملفوفة تحت جذع الحيوان لرفع مؤخرته.
ملاحظة: يؤدي ارتفاع مؤخرة الحيوان إلى رفع الصدر بشكل فعال عن سطح الحامل لمنع الحركات التنفسية من التأثير على موضع الإبرة أثناء الحقن. - قبل البدء في الحقن ، قم بتنظيف نافذة العمود الفقري من أي دم أو سائل دماغي نخاعي عن طريق وضع أطراف قطنية ومثلثات سوجي برفق على المنطقة دون إهانة الحبل الشوكي. علاوة على ذلك ، قم بإنشاء حاجز حول محيط النافذة لمنع انسداد موقع الحقن عن طريق النزيف المستمر أو تسرب السائل الدماغي النخاعي. للقيام بذلك ، ضع قطعة صغيرة من القطن القابل للامتصاص في الأجزاء الجانبية من النافذة الشوكية.
8. الحقن المباشر في الحبل الشوكي الذي يستهدف النهايات المحورية
- باستخدام طرف إبرة حقن الزجاج ، قم بتقريب خط الوسط للحبل الشوكي عن طريق تحديد الشريان الشوكي. ومع ذلك ، إذا كان الشريان الشوكي بعيدا عن المركز بشكل ملحوظ أو ينحرف بأي شكل من الأشكال ، فقم بتقريب خط الوسط باستخدام موضع العملية الشائكة C2 واستقراء ذلك على طول العمود الفقري.
ملاحظة: راجع القسم 5.1 للحصول على إرشادات حول تحميل الفيروس. - بمجرد تحديدها ، ضع الإبرة خلف الصفيحة C5 مباشرة عند خط الوسط التقريبي واستخدمها كنقطة مرجعية. ثم ، باستخدام micromanipulator ، حرك الإبرة أفقيا إلى اليمين بمقدار 0.3 مم. خفض الإبرة حتى تلمس سطح الحبل الشوكي. من هذا العمق ، اغرق الإبرة 0.6 مم في الحبل الشوكي. إذا لزم الأمر ، استمر في غمر الإبرة حتى تثقب الحبل الشوكي ؛ ثم اسحب الإبرة أو خفضها إلى العمق المناسب.
- حقن 1 ميكرولتر من retroAAV2-scCre بمعدل 250 نانولتر / دقيقة. بعد اكتمال الحقن ، انتظر 2 دقيقة حتى ينتشر الفيروس في الحبل الشوكي قبل سحب الإبرة ببطء. كرر الحقن باستخدام نفس الإحداثيات الجانبية والعمق في موقعين آخرين داخل نافذة العمود الفقري ، أحدهما عند نقطة المنتصف والأخير أمام الصفيحة T1.
9. إغلاق الجرح والرعاية بعد العملية الجراحية
- أخرج الحيوان من حامل التجسيم وأخرج المبعدات أو الخطافات. قم بتنظيف منطقة الجرح ببضع قطرات من محلول ملحي طبيعي معقم.
- خياطة فروة الرأس مع 4.0 خياطة الحرير ، اثنين أو 3 خيوط في المجموع.
- عند خياطة فتحة عنق الرحم ، استخدم 4.0 أمعاء كرومية لإعادة ربط طبقات العضلات بإحكام (يجب أن تكفي 2 غرز). خياطة فتحة جلد عنق الرحم مع 4.0 الحرير (4 خيوط المتوقعة).
- بمجرد إغلاق الحيوان ، ضع ضمادة سائلة بحكمة عبر الغرز.
- ضع الحيوان تحت مصباح التدفئة وراقبه عن كثب حتى يستيقظ تماما. بمجرد أن يستيقظ الحيوان ويتحرك ويجف ، قم بتنظيف الجروح برفق بشاش معقم. لا تترك الحيوان دون مراقبة حتى يستعيد وعيه الكافي للحفاظ على راقد القص.
- إعادة الحيوان إلى القفص المنزلي مع والدته. احرص على منع الإهمال وأكل لحوم الرضع من الأم نحو الجراء:
- تعرف الباحثون على الأم تحسبا للجراحة من خلال التعامل اللطيف (5-10 دقائق) مرتين يوميا ، بدءا من أسبوع واحد قبل الجراحة.
- أعد الجراء إلى القفص المنزلي معا للحد من إزعاج الأم.
- حقن الأم مع أسيبرومازين 1.5 ملغ / كغ q12 ساعة تحت الجلد في يوم الجراحة.
ملاحظة: تخدم إدارة الألم غرضا مزدوجا يتمثل في توفير تسكين للجراء وتشجيع العودة المبكرة إلى النشاط ، وبالتالي تعزيز إعادة الاندماج مع الأم. - حقن البوبرينورفين 0.05 ملغم / كغم تحت الجلد Q8 ساعة بدءا من الجراحة لمدة 3 أيام إجمالا (أيام ما بعد الجراحة 0 ، 1 ، 2).
النتائج
يجب أن يؤدي الحقن والنقل الناجح للناقل الفيروسي إلى نقل الخلايا العصبية أحادية الجانب في الحبل الشوكي والقشرة الحركية. يوضح الشكل 4 وضع العلامات على الخلايا العصبية من الطبقة V CST في القشرة الحركية لقسم إكليلي في الدماغ يعبر عن حقن Cre-dependentent-DREADDs-mCherry بالاشتراك مع حقن العمود ...
Discussion
يعد التعديل الجيني المستحث لنشاط الدماغ باستخدام المعدلات الكيميائية الوراثية القابلة للحقن أداة قوية في دراسة الآليات المختلفة التي تكمن وراء التعافي من اصابات النخاع الشوكي. تزداد دقة استهداف المستقبلات المقترنة بالبروتين G (DREADDs) عند النظر في أن تتبع التألق يتحقق من الدقة التشريحية ف?...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذا العمل من خلال منحة زمالة من مستشفيات شرينرز للأطفال SHC-84706.
Materials
| Name | Company | Catalog Number | Comments |
| #11 scalpel blades | Roboz | RS-9801-11 | For use with the scalpel. |
| #10 Scalpel Blades | Roboz | RS-9801-10 | For use with the scalpel. |
| 1 mL Syringes | Becton, Dickinson and Company | 309659 | For anesthetic SC injection and fluid bolus |
| 4.0 silk suture | Ethicon | 771-683G | For skin closure |
| 4.0 Chromic Catgut Suture | DemeTECH | NN374-16 | To re-bind muscle during closing. |
| 48000 Micropipette Beveler | World Precision Instruments | 32416 | Used to bevel the tips of the pulled glass capillary tubes to form functional glass needles. |
| 5% Iodine Solution | Purdue Products L.P. | L01020-08 | For use in sterilzation of the surgical site. |
| 70% Ethanol | N/A | N/A | For sterilization of newly prepared glass needles, animal models during surgical preparation |
| Ketamine (Ketaset) | Zoetis | 240048 | For keeping the animal in the correct plane of consciousness during surgery. |
| Bead Sterilizer | CellPoint | 5-1450 | To heat sterilize surgical instruments. |
| Digital Scale | Okaus | REV.005 | For weighing the animal during surgical preparation. |
| Flexible Needle Attachment | World Precision Instruments | MF34G-5 | For cleaning glass needles and loading red oil into glass needles. |
| Glass Capillary Tubes | World Precision Instruments | 4878 | For pulled glass needles - should be designed for nanoliter injectors. |
| Hemostats | Roboz | RS-7231 | For general use in surgery. |
| Medium Point Curved Forceps | Roboz | RS-5136 | For general use in surgery. |
| Micromanipulator with a Vernier Scale | Kanetec | N/A | For precise targeting during surgery. |
| Microscissors | Roboz | RS-5621 | For cutting glass whisps off of freshly pulled glass capillary tubes. |
| Lab Standard Stereotaxic Instrument | Stoelting | 51600 | To hold the neonatal sterotaxic holder in place |
| Lab Standard with Mouse & Neonates Adaptor | 51615 | For neonatal skull fixation during cranial surgery and spinal injections | |
| Microscope with Light and Vernier Scale Ocular | Leitz Wetzlar | N/A | Used to visualize and measure beveling of pulled glass capillary tubes into functional glass needles. |
| MicroSyringe Pump Controller | World Precision Instruments | 62403 | To control the rate of injection. |
| Nanoliter 2000 Pump Head Injector | World Precision Instruments | 500150 | To load and inject virus in a controlled fashion. |
| Needle Puller | Narishige | PC-100 | To heat and pull apart glass capillary tubes to form glass needles. |
| pAAV-CMV-scCre | Wu lab | Cre plasmid | |
| pAAV-hSyn-DIO-hM3Dq-mCherry (plasmid #44361) | Bryan Roth’s lab through Addgene | DREADD plasmid | |
| Parafilm | Bemis | PM-996 | To assist with loading virus into the nanoinjector. |
| PrecisionGlide Needles (25G x 5/8) | Becton, Dickinson and Company | 305122 | For use with the 1mL and 10 mL syringes to allow injection of the animal model. |
| Rat Tooth Forceps | Roboz | RS-5152 | For griping spinous processes. |
| Red Oil | N/A | N/A | To provide a front for visualization of virus entering tissue during injection. |
| Retractors | Roboz | RS-6510 | To hold open the surgical wound. |
| Rongeurs | Roboz | RS-8300 | To remove muscle from the spinal column during surgery. |
| Scalpel Blade Handle | Roboz | RS-9843 | To slice open skin and fat pad of animal model during surgery. |
| Scissors | Roboz | RS-5980 | For general use in surgery. |
| Staple Removing Forceps | Kent Scientific | INS750347 | To remove the staples, should they be applied incorrectly. |
| Sterile Cloth | Phenix Research Products | BP-989 | To provide a sterile surface for the operation. |
| Sterile Cotton-Tipped Applicators | Puritan | 806-WC | To soak up blood in the surgical wound while maintaining sterility. |
| Sterile Gauze | Covidien | 2146 | To clean the surgical area and surgical tools while maintaining sterility. |
| Sterile Saline | Baxter Healthcare Corporation | 281324 | For use in blood clearing, and for replacing fluids post-surgery. |
| Surgical Gloves | N/A | N/A | For use by the surgeon to maintain sterile field during surgery. |
| Surgical Heating Pad | N/A | N/A | For maintaining the body temperature of the animal model during surgery. |
| Surgical Microscope | N/A | N/A | For enhanced visualization of the surgical wound. |
| Surgical Stapler | Kent Scientific | INS750546 | To apply the staples. |
| Water Convection Warming Pad | Baxter Healthcare Corporation | L1K018 | For use in the post-operational recovery area to maintain the body temperature of the unconscious animal. |
| Weighted Hooks | N/A | N/A | To hold open the surgical wound. |
| Liquid bandage | NewSkin | 985838 | To apply along sutures following surgery and encourage wound healing |
| Wire Cage Lamp | ZooMed | LF10EC | To help animals recover from anesthesia and retain warm body temperature naturally |
References
- Parent, S., Mac-Thiong, J., Roy-Beaudry, M., Sosa, J. F., Labelle, H. Spinal cord injury in the pediatric population: A systematic review of the literature. Journal of Neurotrauma. 28 (8), 1515-1524 (2011).
- Vitale, M. G., Goss, J. M., Matsumoto, H., Roye, D. P. Epidemiology of pediatric spinal cord injury in the united states: Years 1997 and 2000. Journal of Pediatric Orthopedics. 26 (6), 745-749 (2006).
- Bregman, B. S., Goldberger, M. E. Anatomical plasticity and sparing of function after spinal cord damage in neonatal cats. Science. 217 (4559), 553-555 (1982).
- Castro, A. J. Ipsilateral corticospinal projections after large lesions of the cerebral hemisphere in neonatal rats. Experimental Neurology. 46 (1), 1-8 (1975).
- Commissiong, J. W., Toffano, G. Complete spinal cord transection at different postnatal ages: Recovery of motor coordination correlated with spinal cord catecholamines. Experimental Brain Research. 78 (3), 597-603 (1989).
- Yuan, Q., Su, H., Chiu, K., Wu, W., Lin, Z. Contrasting neuropathology and functional recovery after spinal cord injury in developing and adult rats. Neuroscience Bulletin. 29 (4), 509-516 (2013).
- Kim, J., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualizing and manipulating neuronal circuits in vivo. The European Journal of Neuroscience. 37 (8), 1203-1220 (2013).
- Pawliuk, R., et al. Correction of sickle cell disease in transgenic mouse models by gene therapy. Science. 294 (5550), 2368-2371 (2001).
- Atasoy, D., Sternson, S. M. Chemogenetic tools for causal cellular and neuronal biology. Physiological Reviews. 98 (1), 391-418 (2018).
- Brandt, H. M., Apkarian, A. V. Biotin-dextran: A sensitive anterograde tracer for neuroanatomic studies in rat and monkey. Journal of Neuroscience Methods. 45 (1-2), 35-40 (1992).
- Veenman, C. L., Reiner, A., Honig, M. G. Biotinylated dextran amine as an anterograde tracer for single- and double-labeling studies. Journal of Neuroscience Methods. 41 (3), 239-254 (1992).
- Reiner, A., et al. Pathway tracing using biotinylated dextran amines. Journal of Neuroscience Methods. 103 (1), 23-37 (2000).
- Oguchi, M., et al. Double virus vector infection to the prefrontal network of the macaque brain. PloS One. 10 (7), 0132825 (2015).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487 (7406), 235-238 (2012).
- Bernstein, D. R., Stelzner, D. J. Plasticity of the corticospinal tract following midthoracic spinal injury in the postnatal rat. The Journal of Comparative Neurology. 221 (4), 382-400 (1983).
- Brown, K., Wolfe, B., Wrathall, J. Rapid functional recovery after spinal cord injury in young rats. Journal of Neurotrauma. 22, 559-574 (2005).
- Tillakaratne, N. J. K., et al. Functional recovery of stepping in rats after a complete neonatal spinal cord transection is not due to regrowth across the lesion site. Neuroscience. 166 (1), 23-33 (2010).
- Kartje-Tillotson, G., Neafsey, E. J., Castro, A. J. Electrophysiological analysis of motor cortical plasticity after cortical lesions in newborn rats. Brain Research. 332 (1), 103-111 (1985).
- Gennaro, M., et al. Focal stroke in the developing rat motor cortex induces age- and experience-dependent maladaptive plasticity of corticospinal system. Frontiers in Neural Circuits. 11, 47 (2017).
- Brichta, A. M., Grant, G., Paxinos, G. Cytoarchitectural organization of the spinal cord. The rat nervous system. 2, 294-309 (1985).
- Kjell, J., Olson, L. Rat models of spinal cord injury: From pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Takeoka, A., Arber, S. Functional local proprioceptive feedback circuits initiate and maintain locomotor recovery after spinal cord injury. Cell Reports. 27 (1), 71-85 (2019).
- Flynn, J. R., Graham, B. A., Galea, M. P., Callister, R. J. The role of propriospinal interneurons in recovery from spinal cord injury. Neuropharmacology. 60 (5), 809-822 (2011).
- Ohne, H., et al. Mechanism of forelimb motor function restoration in rats with cervical spinal cord hemisection-neuroanatomical validation. IBRO Reports. 7, 10-25 (2019).
- Wang, X., et al. Deconstruction of corticospinal circuits for goal-directed motor skills. Cell. 171 (2), 440-455 (2017).
- Sheikh, I. S., et al. Retrogradely transportable lentivirus tracers for mapping spinal cord locomotor circuits. Frontiers in Neural Circuits. 12, 60 (2018).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487, 235-238 (2012).
- Keefe, K. M., Junker, I. P., Sheikh, I. S., Campion, T. J., Smith, G. M. Direct injection of a lentiviral vector highlights multiple motor pathways in the rat spinal cord. Journal of Visualized Experiments: JoVE. (145), e59160 (2019).
- Hutson, T. H., Verhaagen, J., Yáñez-Muñoz, R. J., Moon, L. D. F. Corticospinal tract transduction: A comparison of seven adeno-associated viral vector serotypes and a non-integrating lentiviral vector. Gene Therapy. 19 (1), 49-60 (2012).
- Liu, Y., Keefe, K., Tang, X., Lin, S., Smith, G. M. Use of self-complementary adeno-associated virus serotype 2 as a tracer for labeling axons: Implications for axon regeneration. Plos One. 9 (2), 87447 (2014).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Abdellatif, A. A., et al. delivery to the spinal cord: Comparison between lentiviral, adenoviral, and retroviral vector delivery systems. Journal of Neuroscience Research. 84 (3), 553-567 (2006).
- Zingg, B., Peng, B., Huang, J., Tao, H. W., Zhang, L. I. Synaptic specificity and application of anterograde transsynaptic AAV for probing neural circuitry. The Journal of Neuroscience. 40 (16), 3250-3267 (2020).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences of the United States of America. 104 (12), 5163-5168 (2007).
- Roth, B. L. DREADDs for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Hasegawa, A., et al. Mechanism of forelimb motor function restoration after cervical spinal cord hemisection in rats: A comparison of juveniles and adults. Behavioural Neurology. 2016, 1035473 (2016).
- Alstermark, B., Isa, T. Circuits for skilled reaching and grasping. Annual Review of Neuroscience. 35, 559-578 (2012).
- García-Alías, G., Truong, K., Shah, P. K., Roy, R. R., Edgerton, V. R. Plasticity of subcortical pathways promote recovery of skilled hand function in rats after corticospinal and rubrospinal tract injuries. Experimental Neurology. 266, 112-119 (2015).
- Tohyama, T., et al. Contribution of propriospinal neurons to recovery of hand dexterity after corticospinal tract lesions in monkeys. Proceedings of the National Academy of Sciences of the United States of America. 114 (3), 604-609 (2017).
- Z'Graggen, W. J., et al. Compensatory sprouting and impulse rerouting after unilateral pyramidal tract lesion. Journal of Neuroscience. 20 (17), 6561-6569 (2000).
- Ueno, M., et al. Corticospinal circuits from the sensory and motor cortices differentially regulate skilled movements through distinct spinal interneurons. Cell Reports. 23 (5), 1286-1300 (2018).
- Kim, J., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. Journal of Visualized Experiments: JoVE. (91), e51863 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved