このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
脳と脊椎を組み合わせた手術を用いた二重ウイルスベクターによる新生児ラットの皮質脊髄路の標的化
要約
このプロトコルは、順行性化学遺伝修飾剤を体性運動皮質に注入し、逆行性に輸送可能なCreリコンビナーゼを頸髄に注射することにより、生後5〜10日の新生児ラットの細胞の亜集団に遺伝子治療を適用するための新しい方法を示しています。
要約
新生児ラットの研究を制約する障害にうまく取り組むことは、成人のSCIと比較した小児脊髄損傷(SCI)で見られる結果の違いを研究するために重要です。さらに、中枢神経系(CNS)の標的細胞に治療法を確実に導入することは困難な場合があり、不正確さは研究または治療の有効性を損なう可能性があります。このプロトコルは、ウイルスベクター技術と新しい外科技術を組み合わせて、出生後5日目に新生児ラットに遺伝子治療を正確に導入します。ここでは、Creの逆行性輸送(retroAAV2)のために設計されたウイルスが脊髄の皮質脊髄ニューロンの軸索終末に導入され、そこで細胞体に輸送されます。次に、デザイナードラッグ(DREADD)ウイルスによって排他的に活性化された二重フロックス逆方位(DIO)デザイナー受容体が脳の体性運動皮質に注入されます。この二重感染技術は、同時感染した皮質脊髄路(CST)ニューロンでのみDREADDの発現を促進します。したがって、体性運動皮質と頸部CST終末の同時同時注射は、新生児ラットにおける子宮頸部SCIモデル後の回復の化学遺伝学的調節を研究するための有効な方法です。
概要
SCIは小児集団では比較的まれな発生ですが、特に外傷性であり、計り知れないロジスティックの先見性を必要とする永続的な障害を引き起こします。さらに、小児SCIの割合は、成人集団と比較して子宮頸部および完全として分類されます1,2。哺乳類種の特徴は、新生児が成人よりもSCIから著しくよく回復することであり、これは若い集団の回復のための推進メカニズムを評価する機会を提供します3,4,5。それにもかかわらず、新生児および乳児のげっ歯類の研究に取り組むマルチモーダル研究は少なく、若い動物のはるかに狭い解剖学的ランドマークにあるニューロンの選択された集団を正確に標的にすることの難しさが加わったこともあり6。この記事では、高効率の順行性および逆行性アデノ関連ベクターをラット脊髄に直接注入して、Cre依存性DREADDの適用により主要な運動経路を調節し、マルチモーダル再生研究の範囲を拡大することに焦点を当てています。
ウイルスベクターは、標的遺伝子の代替、成長タンパク質のアップレギュレーション、CNS 7,8,9の解剖学的景観の追跡のための遺伝物質の導入など、幅広い用途を持つ重要な生物学的ツールです。脊髄運動経路の解剖学的詳細の多くは、古典的なトレーサー、すなわちビオチン化デキストランアミンを使用して研究されてきました。従来のトレーサーは神経解剖学の発掘に役立ってきましたが、正しく注射されても経路を無差別に標識し、損傷した軸索に取り込まれることが研究によって発見されています10,11,12。その結果、これは、切断された軸索が再生繊維と間違われる可能性のある再生研究における誤った解釈につながる可能性があります。
以下の方法は、調節研究において最近普及した2ウイルスベクターシステムを利用し、同じニューロン13、14の2つの別々の領域に2つの異なるウイルスベクターを有する。1つ目は、投射ニューロンの細胞体に局所的に感染するベクターです。もう一つは、投射ニューロンの軸索終末から輸送される逆行性ベクターです(図1)。逆行性ベクターはCreリコンビナーゼを担持し、局所ベクターは蛍光タンパク質(mCherry)がコードされる「Cre-On」ダブルフロックス配列を組み込んでいます。hM3DqとmCherryの両方を発現する天然導入遺伝子は、プロモーターに対して反転しており、2つのLoxPサイトに隣接しています(図2)。したがって、mCherryは、CreリコンビナーゼがLoxPサイト間の組換えイベントを誘発し、導入遺伝子の向きを適切な読み取りフレームに切り替え、DREADDと蛍光タンパク質の両方の発現を可能にする二重形質導入投影ニューロンでのみ発現されます。ウイルス導入遺伝子が正しい方向になると、そして該当する場合、DREADDは、別々に注入されたリガンド、すなわちクロザピン-N-オキシドを介して神経調節を一時的に誘導することができる。このプロトコルは、新生児における誘導性神経調節研究を認証するために設計されており、DREADDSが注入されてCSTを選択的に調節します。2ウイルスシステムは保険契約として機能し、すべてのDREAD陽性細胞が蛍光下で高い忠実度で追跡可能であり、注射を検証します。
この方法は、新生児研究のギャップを埋めるのにも役立ちます。小児SCIには課題があり、再生、発芽、または可塑性を分析する研究では、新生児と成人の違いを強調する必要があります3,15,16,17。外科的処置を最適化し、Nissl染色による事前の解剖学的研究を実施することにより、頭蓋注射と脊椎注射の両方の座標が検証されました。目的は、忠実度と生存率を高めた新生児ラットへの二重注射の方法を提供することでした。
現在のモデルでは、順行性ベクターを、参照18,19としてブレグマを使用して体性運動皮質の細胞体に注入しました。脊椎注射に関しては、逆行性ベクターを、CST軸索終末が存在する椎弓板V-VIIに注入した20,21。特定の病変モデルが若い動物に異なる影響を与える方法、およびその後の回復が年配の動物からどのように分岐するかの根底には多くの基本的な質問があります。この研究は、新生児げっ歯類の頸部損傷と前肢機能の回復可能性を研究するための強力な手段を示しています。対照的に、以前の研究の大部分は、腰椎または胸部の損傷後の回復運動に取り組んできました5,22,23,24。二重ウイルスベクターをここで説明する新しい注射技術と組み合わせることにより、このプロトコルは、新生児げっ歯類の調査を悩ませる可能性のある特定の問題(つまり、生存可能性)を軽減するのに役立ちます。この方法は堅牢で実用的で汎用性があり、技術のわずかなバリエーションにより、腹側CST、背側CST、および上行背側経路など、さまざまな経路を標的にすることができます。
このシステムのために、1つの局所作用型ウイルス(例えば、AAV2)が、目的のニューロン細胞体の領域に注入される。局所ウイルスの発現を制御する第2の逆行性に輸送されるウイルスは、そのニューロン集団の軸索終末に注射される。したがって、定義上、皮質脊髄ニューロンのみが標識される。シャトルプラスミドを使用して、いくつかの細胞型でCre依存性発現のためのいくつかのAAV血清型を生成するために使用されるため、retroAAV-Creウイルスは構成的に活性なCMVプロモーターで選択されました。皮質注射の場合、AAV2は、シナプシン-1プロモーターによって駆動される導入遺伝子で選択され、発現をニューロンに制限しました。2ウイルス系は、関心のあるニューロン集団の起源と終結に大きく依存しているため、関心のあるニューロン集団内で目的の遺伝子の発現を駆動できる場合は、いくつかの異なるプロモーターを使用できます。例えば、興奮性ニューロンプロモーターであるCamKIIは、シナプシン-1の代わりになり得る。これらのAAV血清型の使用に加えて、未熟への逆行性輸送、およびはるかに少ない程度で、成人の皮質脊髄運動ニューロンも、高逆行性輸送可能なレンチウイルス(HiRet)を使用して達成できます25。HiRetレンチウイルスは、キメラ狂犬病/VSV糖タンパク質を使用して、逆行性輸送のためにシナプスでの取り込みを標的にします。Tet-Onプロモーターと組み合わせると、この2ウイルス系は逆行依存的に誘導可能な発現をサポートします26,27。
逆行性ウイルスは、標的ニューロンのシナプス空間にベクターを挿入し、その細胞の軸索に取り込まれて細胞体に輸送されるようにします。レンチウイルスベクターはこれまで大きな成功を収めており、遺伝子治療研究で長期的な発現を提供していましたが、この方法はいくつかの単純な理由でアデノ随伴ウイルスベクターに軸足を移しました26,28:AAVは、バイオセーフティレベルの指定が低いことを考えると、より経済的で、同様に効果的であり、ロジスティックの負担が少ない29,30,31,32.最も使用されている血清型であるAAV2は、CST軸索の堅牢なトランスフェクションを示していますが、将来の研究者は、AAV1が経鼻発作で標識するため、ある程度の汎用性を提供することに気付く可能性があり、したがって、将来の研究でいくつかの可能な反復を提示します33。最終的な適応は、複数の順行性ベクターを同時に導入できるように、逆行性ウイルスをCre-リコンビナーゼでコードし、それによって不要な社内ウイルス廃棄物を減らし、DREADDが正しい方向に発現する可能性を最大化することです。
最終的に、このプロトコルは、皮質と頸椎への同時注射を示し、特に皮質脊髄路の細胞体と軸索終末をそれぞれ標的にします。ハイフィデリティトランスフェクションは大脳皮質と脊髄に見られます。記載されているプロトコルは、5日齢のSprague Dawleyラット用に完成されましたが、麻酔と定位座標をわずかに調整した生後4〜10日目に適しています。
プロトコル
以下の外科的および動物の世話の手順は、テンプル大学の動物の世話と使用委員会によって承認されています。記載されているプロトコルは生存手術であり、動物は最終的に、時点の完了時に100 mg / kgのペントバルビタールナトリウムの腹腔内注射によって安楽死させました。.
1.手術前の準備
- 3.5 nLガラスキャピラリーピペットを使用して、ウイルス注入用に少なくとも2本のプルドガラス針を準備します。DREADD 用の針と rCre 用の針が 1 本です。予防策として、術中に壊れた場合に備えて4〜5本の針を準備してください。
- マイクロハサミを使用して、針から1〜2 mmの余分なガラスを切り取ります。
- 各針を30°に配置し、マイクロピペットベベラーを使用して、30〜40μmの開口部と45°のベベル角度のチップを作成します。
- 針を蓋付きのペトリ皿に保管し、ペトリ皿を紫外線の下でバイオセーフティフードに15分間入れて滅菌します。
- 各動物が各ウイルスを3μL必要とすることを念頭に置いて、手順の前に-80°Cの冷凍庫から適切な容量を取り出して、必要なウイルスを準備します。
注意: 使用しないときは、ウイルスを氷上で輸送して保管してください。このプロトコルは、AAV2-hM3Dq-mCherryおよびAAV2-retroCreを使用して開発され、動物あたり3μLの各ウイルスを注入しました。DREADDプラスミドpAAV-hSyn-DIO-hM3Dq-mCherry( 材料表参照)を用いて、ウイルス力価が1.54 ×10 12 ゲノムコピー(GC)/mLの順行性AAV2を作製しました。CreプラスミドpAAV-CMV-scCreを使用して、ウイルス力価が4.27 ×10 12 GC / mLの逆行性AAV2を作製しました。 - インジェクターをマイクロポンプに接続し、バーニアスケールのマイクロマニピュレーターに入れます。
- 針にウイルスの有無を視覚的に確認するには、着色染料、つまり赤い油を針に入れます。針の泡を避けてください。
- ガラス針をインジェクターに挿入し、針が正しくフィットすることを確認します。
- 可能な場合は、ウイルスごとに個別の注入ポンプを使用してプロセス全体を繰り返します。使用可能な注入ポンプが1つしかない場合は、2つの別々の針を準備し、ウイルスを交換するときに使用済みの針を交換します。
2.麻酔と手術部位の準備
- デジタルスケールで動物の体重を量ります。術前の体重を記録して、必要な麻酔薬の量を決定します。
注:このプロトコルは、手術時間を通して満足のいく麻酔面を確保するための最も信頼できる麻酔技術は、ケタミンと低体温の組み合わせであることがわかりました。ケタミンはそれ自体で麻酔を確保するには不十分であり、キシラジンを補給することは術中死亡率を増加させる前に狭い閾値を有する。低体温だけでは、長期の手術には十分ではありません(脊椎と脳の二重手術には、>1時間の安定した麻酔が必要になる可能性があります)。 - 動物が100 mg / kgのケタミンを投与されるように、希釈したケタミン(10 mg / mL)を肩甲骨の間に皮下注射して子犬を麻酔します。5分間待ちます。
注:たとえば、生後5日目に、ラットの子犬の体重は10 gで、0.1 mLの希釈ケタミン溶液(10 mg / mL)を受け取ります。 - 子犬を砕いた氷の上に6〜8分間置きます。氷との直接接触を避けるために動物をラテックス手袋またはパラフィルムに入れることによって凍傷からそれを保護してください。
- 鉗子を使用して足をしっかりとつまんで、適切な麻酔面を確認します。反射的な離脱が発生した場合は、先に進む前に氷上でさらに2分間放置してください。
- 5%ヨウ素溶液を浸した滅菌ガーゼを使用して、動物の頭と背中の部分に消毒剤を広く塗布します。その後、70%エタノールに浸したガーゼで殺菌する。消毒用ワイプをそれぞれ3回塗り、ヨウ素とエタノールを交互に使用してガーゼを浸します。
注:若い子犬は生後14日でしか目を開けないため、アイケアは必要ありません。 - 動物が二重手術(脳+脊椎)を受ける場合は、手術前に通常の生理食塩水ボーラス(0.02 mL / g)を肩甲骨の間に皮下投与します。
注:手術中に動物が反応し、さらに麻酔が必要な場合は、動物を氷上に5分間交換します。
3.手術野と器具の準備
- メスホルダー、ロンジャー、止血剤、中点湾曲鉗子、開創器などの手術器具をオートクレーブします
- 顕微鏡を準備し、新生児ラット定位装置アダプターを取り付けて、成人の定位固定装置ホルダー内にしっかりと配置します。
- 滅菌手袋を使用して手術を行います。事前に包装された滅菌手術用手袋のパックを開き、使用済みのツールを配置するための追加の領域としてラッパーを使用して、滅菌グローブラップをテーブルに置きます。
注:適切な外科的慣行に従い、手順全体を通して無菌性を維持することが重要です。 - メスホルダーに11枚の刃を固定します。滅菌生理食塩水、4.0クロミックカットガット縫合糸、4.0シルク縫合糸、および出血を制御する材料(滅菌ガーゼ、滅菌綿先端アプリケーター、三角形など)を配置します。
- 上記のように2つの手術野を設定し、1つの部位を開頭術に割り当て、もう1つの部位を頸椎椎弓切除術に割り当てます。
- 動物を回収し、脳定位固定装置アダプターに固定します:新生児は非常に軟骨性であるため、イヤーバーを下顎関節に広く向けて穏やかに固定します。水平に安定したら、フロントマウスピースをそっと導入します。
注:「平らな」手術領域を提供するために使用される拘束力のない規則は、イヤーバーを同じ高さに固定し、マウスピースを約2〜3レベル低く固定することです。
4.開頭術を行い、体性運動皮質を露出させる
- 矢状縫合糸を感じながら、頭皮上部の正中線の鉗子を押して、切開が行われる領域を特定します。アイラインのすぐ上から始めて、矢状縫合面に沿って1 cmの切開を行います。皮膚をぴんと張って、清潔でまっすぐで正確な切開を確実にします。
- 頭蓋骨の表面に沿って鉗子を穏やかに調べ、縫合線と頭頂骨と前頭骨に沿って走る鉗子によって引き起こされるくぼみに細心の注意を払うことにより、ブレグマ(冠状縫合糸と矢状縫合糸の収束)を特定します。
- 関心のある側に加重フックを適用して開口部を維持します。脊椎注射は右側で行われ、頭蓋注射は左側で行われることに注意してください。
- 綿の先端とマイクロシザーの組み合わせで腱膜を取り除き、ブレグマの露出を最大化して精度を高めます。冠状縫合糸が、その後の注射のための大まかなテンプレートを提供するのに十分なほど横方向にはっきりと見えることを確認してください。
- マイクロハサミを使用して、ブレグマのすぐ隣にある左前頭蓋骨の約3 x 2 mmの部分を切り取ります。
注意: 骨弁を注意深く取り除いたら、脳物質が露出した透明な窓があり、注射の準備ができているはずです。脳の反対側の残りの縫合線は、前後(AP)軸に沿って精度を維持するための視覚的なガイドとして機能します。 - 綿の先端で破片、脳脊髄液(CSF)、血液を取り除きます。
注意: 血液またはCSFが視線をわずかに覆い隠すのは正常であるため、綿の先端で定期的にその領域をクリアすることをお勧めします。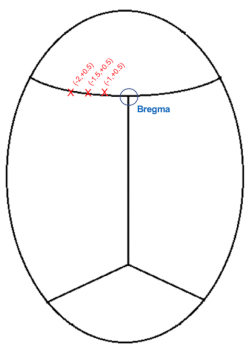
図3:ブレグマに対する頭蓋注射座標(mm)の概略図。 この図の拡大版を表示するには、ここをクリックしてください。
5.ウイルスのロードとインジェクターの配置
- パラフィルム片に~5 μLをピペッティングしてウイルスをインジェクターにロードし、先端がウイルスの液滴の上に載るように針を配置します。
- スムーズな注入を確実にするために、余分なウイルスがインジェクターにロードされていることを確認してください。例えば、合計3μL(各注射部位に1μL)を注入する場合、マイクロポンプを使用して4μLのウイルスを250nL/sの速度で回収します。
- 実験室用ワイプで余分なウイルスを取り除きます。
- バーニアスケールが見えるようにマイクロマニピュレーターを配置し、矢状縫合糸の上に針を配置します。
- 針をブレグマを表す領域のすぐ上まで下げ(図3)、APと内側外側(ML)座標を書き留めます。
- インジェクションが左側にある場合、ブレグマのML座標から1、1.5、および2.0 mm(ML:-1.0、-1.5、-2.0)を減算してターゲット座標を生成します。
注:APの位置は、3つのインジェクションすべてでブレグマから+0.5mmになります。 - 針を最初の注射の位置に動かします。AP: +0.5, ML: -1.0
- 外皮質をへこませるまで、露出した脳に針を下げます。針の高さを書き留め、脳の表面の高さから0.6 mmを引いて針を所定の位置に下げます。注入の深さ:皮質表面-0.6mm。
注:ラットの位置がわずかに乱れる可能性があるため、各注射の表面の深さに注意することが重要です。.
6.体性運動皮質にウイルスを注入する
- ニードルが所定の位置に配置されたら、250 nL/minの速度で1 μLを注入するようにインジェクターをプログラムします。
- 注射が完了したら、針を皮質に3分間置きます。
- 他の座標に対して注射を繰り返します:ブレグマに関連して皮質に沿って合計3回の注射、すべて-0.6 mmの深さで:1)AP:+ 0.5 mm、ML:-1.0 mm 2)AP:+ 0.5 mm、ML:-1.5 mm 3)AP:+ 0.5 mm、ML:-2.0 mm。
- 注射が完了したら、セクション9を参照して縫合し、子宮頸椎弓切除術のために動物を他の手術台に移します。
7.正確な脊髄注射のための脊髄窓の作成
- 指を使って頭蓋骨の基部を触診することにより、切開部位を特定します。正中線で、#11ブレードを使用して頭蓋底の1〜2 mm後方の切開を開始し、切開部を1 cm後方に伸ばして表在筋を露出させます。親指と人差し指で張力を加えて皮膚をぴんと張って保持し、きれいな切開を確実にします。
- 刃の鋭い先端を使用して、表在筋の正中線に沿って一連の切り込みを静かに行い、脊髄腔と深部脊髄筋を露出させます。一対の鉗子を使用して筋肉を広げ、手術窓を視覚化します。
注意: 表在筋は淡いピンク色に見え、深部の脊髄筋は明るい白っぽい灰色に見えます。 - 深部の脊髄筋が露出したら、開創器を手術窓に挿入します。必要に応じて、鉗子を使用して外側の皮膚と筋肉をつかみ、開創器の歯の周りに伸ばします。手術窓の幅を7〜8 mmに引っ込めて、脊椎の遮るもののない視界を可能にします。
- 2番目の頸椎(C2または軸)は、背側に突出する顕著な棘突起と大きなドーム型の筋肉にカプセル化することによって識別します。鉗子または鈍いプローブを使用して、このプロセスを感知して識別します。
注:隣接するC3椎骨は、多くの場合、大きなC2筋肉によってわずかに閉塞されています。したがって、鉗子または骨スクレーパーによるC3での筋肉の穏やかな解剖は、椎骨を定義し、椎骨のカウントに役立ちます。 - 骨スクレーパーの平らな端を使用して、深部の脊髄筋を側面にそっとこすり落とすことにより、C3-C7椎骨を露出させます。内側から始めて、椎弓板に平行な方向に沿って横方向にこすり、適切な露出を確保し、椎弓板を明確に区別できるようにします。綿の先端で出血を抑えます。
- 一対のマイクロハサミを使用して、軟骨薄板の側縁をC6およびC7で慎重に切断する。椎骨レベルを数えるときのガイドとしてC2を使用してください。
- 一対の細かい鉗子を使用して、椎弓板の解剖部分を慎重に取り除き、脊髄を露出させます。脊椎窓が目的の注射部位を収容するのに十分な大きさであることを確認してください。上記のように、脊髄に穴を開ける可能性のある骨の鋭い部分やギザギザの部分をマイクロハサミと鉗子で取り除きます。
- セクション3.6で説明されているように、動物を定位固定装置用頭蓋ホルダーにセットアップします。さらに、巻き上げたガーゼを動物の胴体の下に置き、後部を持ち上げます。
注:動物の後肢を持ち上げると、胸部がホルダーの表面から効果的に持ち上げられ、呼吸の動きが注射中の針の位置に影響を与えるのを防ぎます。 - 注射を開始する前に、脊髄を侮辱することなく、綿の先端とスギの三角形をその領域にそっと適用することにより、血液または脳脊髄液の脊髄窓を取り除きます。また、窓の周囲にバリアを設けて、連続的な出血やCSF漏出による注射部位の閉塞を防止する。これを行うには、脊椎窓の外側部分に吸収性綿の小片を置きます。
8.軸索終末を標的とした脊髄への直接注射
- ガラス注射針の先端を使用して、脊髄動脈を特定することにより、脊髄の正中線を近似します。ただし、脊髄動脈が著しく中心から外れているか、何らかの形でずれている場合は、C2棘突起の位置を使用し、これを脊椎の長さに外挿することにより、正中線を近似します。
メモ: ウイルスのロード手順については、項5.1を参照してください。 - 特定したら、針をC5椎弓板のすぐ後方のおおよその正中線に配置し、これを基準点として使用します。次に、マイクロマニピュレーターを使用して、針を横方向に右に0.3 mm動かします。脊髄の表面に触れるまで針を下げます。この深さから、針を脊髄に0.6 mm突っ込みます。必要に応じて、脊髄に穴を開けるまで針を突っ込み続けます。次に、針を適切な深さまで引っ込めるか下げます。
- 1 μL のレトロ AAV2-scCrre を 250 nL/分で注入します。注射が完了したら、ウイルスが脊髄に拡散するのを2分間待ってから、針をゆっくりと引き抜きます。脊髄窓内のさらに2つの部位(1つは中点、最後はT1椎弓板のすぐ前)で同じ側方座標と深さ座標を使用して注射を繰り返します。
9.創傷閉鎖と術後ケア
- 固定装置ホルダーから動物を取り出し、開創器またはフックを取り出します。数滴の滅菌生理食塩水で創傷領域を取り除きます。
- 4.0本のシルク縫合糸、合計2本または3本の縫合糸で頭皮を縫合します。
- 頸部の開口部を縫合するときは、4.0クロミック腸を使用して筋肉層をしっかりと再取り付けします(2本の縫合で十分です)。4.0シルクで頸部の皮膚の開口部を縫合します(4本の縫合が必要です)。
- 動物が閉じられたら、縫合糸全体に液体包帯を慎重に適用します。
- 動物を加熱ランプの下に置き、完全に目覚めるまで注意深く監視します。動物が目を覚まし、動き、乾いたら、滅菌ガーゼで傷をやさしくきれいにします。胸骨横臥を維持するのに十分な意識を取り戻すまで、動物を放置しないでください。
- 動物を母親と一緒にホームケージに戻します。母親から子犬へのネグレクトや乳児の共食いを防ぐように注意してください。
- 手術の1週間前から、1日2回(5〜10分)穏やかな取り扱いを通じて、手術を見越して母親と研究者をよく理解します。
- 子犬を一緒にホームケージに戻して、母親への混乱を制限します。
- 手術当日に母親にアセプロマジン1.5 mg / kg q12 hを皮下注射します。.
注:疼痛管理は、子犬に鎮痛を提供し、活動への早期復帰を促進し、母親との再統合を促進するという二重の目的を果たします。 - ブプレノルフィン0.05 mg / kgを皮下注射します q8 手術後から合計3日間(術後0、1、2日目)。.
結果
ウイルスベクターの注射および輸送が成功すると、脊髄および運動皮質における片側ニューロンの形質導入がもたらされるはずである。 図4 は、脳冠状切片の運動皮質における層CSTニューロンの標識を、rCreの反対側スパイン注射と同時注射したCre依存性DREADDs-mCherryを発現することを示しています。切片をdsRed抗体で染色した。
ディスカッション
注射可能な化学遺伝学的修飾因子による脳活動の誘導的遺伝的調節は、SCIからの回復の根底にあるさまざまなメカニズムを研究する上で強力なツールです。誘導性Gタンパク質共役型受容体(DREADD)のターゲティングの精度は、蛍光トレースが組織学における解剖学的精度を検証することを考慮するとさらに向上します。この論文では、選択されたニューロン経路(興奮性または抑制性のDREADDSの?...
開示事項
著者は開示するものは何もありません。
謝辞
この作業は、シュラインズ小児病院SHC-84706からのフェローシップ助成金によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| #11 scalpel blades | Roboz | RS-9801-11 | For use with the scalpel. |
| #10 Scalpel Blades | Roboz | RS-9801-10 | For use with the scalpel. |
| 1 mL Syringes | Becton, Dickinson and Company | 309659 | For anesthetic SC injection and fluid bolus |
| 4.0 silk suture | Ethicon | 771-683G | For skin closure |
| 4.0 Chromic Catgut Suture | DemeTECH | NN374-16 | To re-bind muscle during closing. |
| 48000 Micropipette Beveler | World Precision Instruments | 32416 | Used to bevel the tips of the pulled glass capillary tubes to form functional glass needles. |
| 5% Iodine Solution | Purdue Products L.P. | L01020-08 | For use in sterilzation of the surgical site. |
| 70% Ethanol | N/A | N/A | For sterilization of newly prepared glass needles, animal models during surgical preparation |
| Ketamine (Ketaset) | Zoetis | 240048 | For keeping the animal in the correct plane of consciousness during surgery. |
| Bead Sterilizer | CellPoint | 5-1450 | To heat sterilize surgical instruments. |
| Digital Scale | Okaus | REV.005 | For weighing the animal during surgical preparation. |
| Flexible Needle Attachment | World Precision Instruments | MF34G-5 | For cleaning glass needles and loading red oil into glass needles. |
| Glass Capillary Tubes | World Precision Instruments | 4878 | For pulled glass needles - should be designed for nanoliter injectors. |
| Hemostats | Roboz | RS-7231 | For general use in surgery. |
| Medium Point Curved Forceps | Roboz | RS-5136 | For general use in surgery. |
| Micromanipulator with a Vernier Scale | Kanetec | N/A | For precise targeting during surgery. |
| Microscissors | Roboz | RS-5621 | For cutting glass whisps off of freshly pulled glass capillary tubes. |
| Lab Standard Stereotaxic Instrument | Stoelting | 51600 | To hold the neonatal sterotaxic holder in place |
| Lab Standard with Mouse & Neonates Adaptor | 51615 | For neonatal skull fixation during cranial surgery and spinal injections | |
| Microscope with Light and Vernier Scale Ocular | Leitz Wetzlar | N/A | Used to visualize and measure beveling of pulled glass capillary tubes into functional glass needles. |
| MicroSyringe Pump Controller | World Precision Instruments | 62403 | To control the rate of injection. |
| Nanoliter 2000 Pump Head Injector | World Precision Instruments | 500150 | To load and inject virus in a controlled fashion. |
| Needle Puller | Narishige | PC-100 | To heat and pull apart glass capillary tubes to form glass needles. |
| pAAV-CMV-scCre | Wu lab | Cre plasmid | |
| pAAV-hSyn-DIO-hM3Dq-mCherry (plasmid #44361) | Bryan Roth’s lab through Addgene | DREADD plasmid | |
| Parafilm | Bemis | PM-996 | To assist with loading virus into the nanoinjector. |
| PrecisionGlide Needles (25G x 5/8) | Becton, Dickinson and Company | 305122 | For use with the 1mL and 10 mL syringes to allow injection of the animal model. |
| Rat Tooth Forceps | Roboz | RS-5152 | For griping spinous processes. |
| Red Oil | N/A | N/A | To provide a front for visualization of virus entering tissue during injection. |
| Retractors | Roboz | RS-6510 | To hold open the surgical wound. |
| Rongeurs | Roboz | RS-8300 | To remove muscle from the spinal column during surgery. |
| Scalpel Blade Handle | Roboz | RS-9843 | To slice open skin and fat pad of animal model during surgery. |
| Scissors | Roboz | RS-5980 | For general use in surgery. |
| Staple Removing Forceps | Kent Scientific | INS750347 | To remove the staples, should they be applied incorrectly. |
| Sterile Cloth | Phenix Research Products | BP-989 | To provide a sterile surface for the operation. |
| Sterile Cotton-Tipped Applicators | Puritan | 806-WC | To soak up blood in the surgical wound while maintaining sterility. |
| Sterile Gauze | Covidien | 2146 | To clean the surgical area and surgical tools while maintaining sterility. |
| Sterile Saline | Baxter Healthcare Corporation | 281324 | For use in blood clearing, and for replacing fluids post-surgery. |
| Surgical Gloves | N/A | N/A | For use by the surgeon to maintain sterile field during surgery. |
| Surgical Heating Pad | N/A | N/A | For maintaining the body temperature of the animal model during surgery. |
| Surgical Microscope | N/A | N/A | For enhanced visualization of the surgical wound. |
| Surgical Stapler | Kent Scientific | INS750546 | To apply the staples. |
| Water Convection Warming Pad | Baxter Healthcare Corporation | L1K018 | For use in the post-operational recovery area to maintain the body temperature of the unconscious animal. |
| Weighted Hooks | N/A | N/A | To hold open the surgical wound. |
| Liquid bandage | NewSkin | 985838 | To apply along sutures following surgery and encourage wound healing |
| Wire Cage Lamp | ZooMed | LF10EC | To help animals recover from anesthesia and retain warm body temperature naturally |
参考文献
- Parent, S., Mac-Thiong, J., Roy-Beaudry, M., Sosa, J. F., Labelle, H. Spinal cord injury in the pediatric population: A systematic review of the literature. Journal of Neurotrauma. 28 (8), 1515-1524 (2011).
- Vitale, M. G., Goss, J. M., Matsumoto, H., Roye, D. P. Epidemiology of pediatric spinal cord injury in the united states: Years 1997 and 2000. Journal of Pediatric Orthopedics. 26 (6), 745-749 (2006).
- Bregman, B. S., Goldberger, M. E. Anatomical plasticity and sparing of function after spinal cord damage in neonatal cats. Science. 217 (4559), 553-555 (1982).
- Castro, A. J. Ipsilateral corticospinal projections after large lesions of the cerebral hemisphere in neonatal rats. Experimental Neurology. 46 (1), 1-8 (1975).
- Commissiong, J. W., Toffano, G. Complete spinal cord transection at different postnatal ages: Recovery of motor coordination correlated with spinal cord catecholamines. Experimental Brain Research. 78 (3), 597-603 (1989).
- Yuan, Q., Su, H., Chiu, K., Wu, W., Lin, Z. Contrasting neuropathology and functional recovery after spinal cord injury in developing and adult rats. Neuroscience Bulletin. 29 (4), 509-516 (2013).
- Kim, J., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualizing and manipulating neuronal circuits in vivo. The European Journal of Neuroscience. 37 (8), 1203-1220 (2013).
- Pawliuk, R., et al. Correction of sickle cell disease in transgenic mouse models by gene therapy. Science. 294 (5550), 2368-2371 (2001).
- Atasoy, D., Sternson, S. M. Chemogenetic tools for causal cellular and neuronal biology. Physiological Reviews. 98 (1), 391-418 (2018).
- Brandt, H. M., Apkarian, A. V. Biotin-dextran: A sensitive anterograde tracer for neuroanatomic studies in rat and monkey. Journal of Neuroscience Methods. 45 (1-2), 35-40 (1992).
- Veenman, C. L., Reiner, A., Honig, M. G. Biotinylated dextran amine as an anterograde tracer for single- and double-labeling studies. Journal of Neuroscience Methods. 41 (3), 239-254 (1992).
- Reiner, A., et al. Pathway tracing using biotinylated dextran amines. Journal of Neuroscience Methods. 103 (1), 23-37 (2000).
- Oguchi, M., et al. Double virus vector infection to the prefrontal network of the macaque brain. PloS One. 10 (7), 0132825 (2015).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487 (7406), 235-238 (2012).
- Bernstein, D. R., Stelzner, D. J. Plasticity of the corticospinal tract following midthoracic spinal injury in the postnatal rat. The Journal of Comparative Neurology. 221 (4), 382-400 (1983).
- Brown, K., Wolfe, B., Wrathall, J. Rapid functional recovery after spinal cord injury in young rats. Journal of Neurotrauma. 22, 559-574 (2005).
- Tillakaratne, N. J. K., et al. Functional recovery of stepping in rats after a complete neonatal spinal cord transection is not due to regrowth across the lesion site. Neuroscience. 166 (1), 23-33 (2010).
- Kartje-Tillotson, G., Neafsey, E. J., Castro, A. J. Electrophysiological analysis of motor cortical plasticity after cortical lesions in newborn rats. Brain Research. 332 (1), 103-111 (1985).
- Gennaro, M., et al. Focal stroke in the developing rat motor cortex induces age- and experience-dependent maladaptive plasticity of corticospinal system. Frontiers in Neural Circuits. 11, 47 (2017).
- Brichta, A. M., Grant, G., Paxinos, G. Cytoarchitectural organization of the spinal cord. The rat nervous system. 2, 294-309 (1985).
- Kjell, J., Olson, L. Rat models of spinal cord injury: From pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Takeoka, A., Arber, S. Functional local proprioceptive feedback circuits initiate and maintain locomotor recovery after spinal cord injury. Cell Reports. 27 (1), 71-85 (2019).
- Flynn, J. R., Graham, B. A., Galea, M. P., Callister, R. J. The role of propriospinal interneurons in recovery from spinal cord injury. Neuropharmacology. 60 (5), 809-822 (2011).
- Ohne, H., et al. Mechanism of forelimb motor function restoration in rats with cervical spinal cord hemisection-neuroanatomical validation. IBRO Reports. 7, 10-25 (2019).
- Wang, X., et al. Deconstruction of corticospinal circuits for goal-directed motor skills. Cell. 171 (2), 440-455 (2017).
- Sheikh, I. S., et al. Retrogradely transportable lentivirus tracers for mapping spinal cord locomotor circuits. Frontiers in Neural Circuits. 12, 60 (2018).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487, 235-238 (2012).
- Keefe, K. M., Junker, I. P., Sheikh, I. S., Campion, T. J., Smith, G. M. Direct injection of a lentiviral vector highlights multiple motor pathways in the rat spinal cord. Journal of Visualized Experiments: JoVE. (145), e59160 (2019).
- Hutson, T. H., Verhaagen, J., Yáñez-Muñoz, R. J., Moon, L. D. F. Corticospinal tract transduction: A comparison of seven adeno-associated viral vector serotypes and a non-integrating lentiviral vector. Gene Therapy. 19 (1), 49-60 (2012).
- Liu, Y., Keefe, K., Tang, X., Lin, S., Smith, G. M. Use of self-complementary adeno-associated virus serotype 2 as a tracer for labeling axons: Implications for axon regeneration. Plos One. 9 (2), 87447 (2014).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Abdellatif, A. A., et al. delivery to the spinal cord: Comparison between lentiviral, adenoviral, and retroviral vector delivery systems. Journal of Neuroscience Research. 84 (3), 553-567 (2006).
- Zingg, B., Peng, B., Huang, J., Tao, H. W., Zhang, L. I. Synaptic specificity and application of anterograde transsynaptic AAV for probing neural circuitry. The Journal of Neuroscience. 40 (16), 3250-3267 (2020).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences of the United States of America. 104 (12), 5163-5168 (2007).
- Roth, B. L. DREADDs for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Hasegawa, A., et al. Mechanism of forelimb motor function restoration after cervical spinal cord hemisection in rats: A comparison of juveniles and adults. Behavioural Neurology. 2016, 1035473 (2016).
- Alstermark, B., Isa, T. Circuits for skilled reaching and grasping. Annual Review of Neuroscience. 35, 559-578 (2012).
- García-Alías, G., Truong, K., Shah, P. K., Roy, R. R., Edgerton, V. R. Plasticity of subcortical pathways promote recovery of skilled hand function in rats after corticospinal and rubrospinal tract injuries. Experimental Neurology. 266, 112-119 (2015).
- Tohyama, T., et al. Contribution of propriospinal neurons to recovery of hand dexterity after corticospinal tract lesions in monkeys. Proceedings of the National Academy of Sciences of the United States of America. 114 (3), 604-609 (2017).
- Z'Graggen, W. J., et al. Compensatory sprouting and impulse rerouting after unilateral pyramidal tract lesion. Journal of Neuroscience. 20 (17), 6561-6569 (2000).
- Ueno, M., et al. Corticospinal circuits from the sensory and motor cortices differentially regulate skilled movements through distinct spinal interneurons. Cell Reports. 23 (5), 1286-1300 (2018).
- Kim, J., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. Journal of Visualized Experiments: JoVE. (91), e51863 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved