需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用脑和脊柱联合手术用双病毒载体靶向新生大鼠的皮质脊髓束
摘要
该协议展示了一种通过将顺行性化学遗传修饰剂注射到体细胞运动皮层和逆行可运输的Cre重组酶到颈脊髓中,将基因疗法应用于出生后5-10天新生大鼠细胞亚群的新方法。
摘要
成功解决限制新生大鼠研究的障碍对于研究小儿脊髓损伤(SCI)与成年SCIs相比结果的差异非常重要。此外,将疗法可靠地引入中枢神经系统(CNS)的靶细胞可能具有挑战性,不准确可能会损害研究或治疗的疗效。该方案将病毒载体技术与一种新的手术技术相结合,以在出生后第5天将基因疗法准确地引入新生大鼠。在这里,一种设计用于Cre逆行运输(retroAAV2)的病毒被引入脊髓中皮质脊髓神经元的轴突末梢,随后被运送到细胞体。然后将由设计药物(DREADD)病毒专门激活的双絮体倒定向(DIO)设计受体注射到大脑的躯体运动皮层中。这种双重感染技术仅在共同感染的皮质脊髓束(CST)神经元中促进DREADD的表达。因此,同时共注射躯体运动皮层和宫颈CST末端是研究新生大鼠宫颈SCI模型后恢复的化学遗传调控的有效方法。
引言
虽然SCI在儿科人群中相对罕见,但它特别具有创伤性,并导致永久性残疾,需要巨大的后勤远见。此外,与成人人群相比,被归类为宫颈和完全性的儿童 SCI 的比例更高1,2。哺乳动物物种的一个标志是新生儿从SCI中恢复明显优于成人,这为评估年轻种群恢复的驱动机制提供了机会3,4,5。尽管如此,针对新生儿和婴儿啮齿动物研究的多模态研究较少,部分原因是在更严格的年轻动物解剖标志中准确靶向选定的神经元群体增加了难度6。本文重点研究高效顺行和逆行腺相关载体直接注射到大鼠脊髓中,以应用Cre依赖性DREADDs调节主要运动通路,扩大多模态再生研究的范围。
病毒载体是重要的生物工具,应用广泛,包括引入遗传物质以替代靶基因、上调生长蛋白以及追踪中枢神经系统7,8,9 的解剖景观。脊髓运动通路的许多解剖学细节已经使用经典示踪剂(即生物素化的葡聚糖胺)进行了研究。虽然传统的示踪剂在挖掘神经解剖学方面发挥了重要作用,但它们并非没有缺点:即使正确注射,它们也会不分青红皂白地标记通路,研究发现它们被受损的轴突吸收10,11,12。因此,这可能导致再生研究中的错误解释,其中切断的轴突可能会被误认为再生纤维。
以下方法利用最近在调制研究中推广的双病毒载体系统,在同一神经元13,14的两个独立区域中使用两种不同的病毒载体。第一种是局部感染投射神经元细胞体的载体。另一个是从投影神经元的轴突末端运输的逆行向量(图1)。逆行载体携带Cre重组酶,局部载体包含"Cre-On"双絮凝序列,其中编码荧光蛋白(mCherry)。表达hM3Dq和mCherry的天然转基因相对于启动子倒置,两侧有两个LoxP位点(图2)。因此,mCherry仅在双转导的投射神经元中表达,其中Cre重组酶诱导LoxP位点之间的重组事件,将转基因的方向翻转到适当的阅读框并允许DREADD和荧光蛋白的表达。一旦病毒转基因处于正确的方向,并且在适用的情况下,DREADDs可以通过单独注射的配体(即氯氮平-N-氧化物)瞬时诱导神经调控。该协议旨在验证新生儿的诱导神经调控研究,其中注射DREADDS以选择性地调节CST。双病毒系统充当保险单,确保每个DREADD阳性细胞在荧光下以高保真度进行追踪,以验证注射。
这种方法也有助于弥合新生儿研究的差距。儿科SCI提出了挑战,分析再生,发芽或可塑性的研究应强调新生儿和成人之间的差异3,15,16,17。通过优化手术程序并使用Nissl染色进行先前的解剖学研究,验证了颅脑和脊柱注射的坐标。目的是提供一种对新生大鼠进行双重注射的方法,以提高保真度和生存能力。
对于当前模型,使用bregma作为参考18,19将顺行载体注射到躯体运动皮层的细胞体中。在脊柱注射方面,逆行载体被注射到CST轴突末端所在的叶片V-VII中20,21。有许多基本问题隐藏在某些病变模型如何以不同的方式影响年幼的动物,以及随后的恢复如何与老年动物不同。这项研究展示了研究新生儿啮齿动物宫颈损伤和前肢功能恢复性的可靠方法。相比之下,以前的大多数研究都涉及腰椎或胸部损伤后的恢复运动5,22,23,24。通过将双病毒载体与此处描述的新型注射技术配对,该方案有助于减轻可能困扰新生儿啮齿动物研究的某些问题(即生存能力)。这种方法稳健、实用且用途广泛:技术的微小变化将允许针对不同的途径,即腹侧 CST、背侧 CST 和上升背侧通路。
对于该系统,将一种局部作用的病毒(例如AAV2)注射到感兴趣的神经元细胞体区域。控制局部病毒表达的第二种逆行运输病毒在该神经元群体的轴突末端注射。因此,根据定义,只有皮质脊髓神经元被标记。选择具有组成活性的CMV启动子的retroAAV-Cre病毒,因为穿梭质粒用于在几种细胞类型中产生几种AAV血清型,用于Cre依赖性表达。对于皮质注射,选择AAV2与由突触素-1启动子驱动的转基因一起,以限制对神经元的任何表达。由于2病毒系统更多地依赖于感兴趣的神经元群体的起源和终止,因此可以使用几种不同的启动子,如果它们可以驱动感兴趣的神经元群体中目的基因的表达。例如,兴奋性神经元启动子CamKII可以替代突触素-1。除了使用这些AAV血清型外,还可以使用高逆行可运输慢病毒(HiRet)来实现逆行转运到未成熟,并且在较小程度上,成人皮质脊髓运动神经元也可以实现。HiRet慢病毒使用嵌合狂犬病/VSV糖蛋白靶向突触摄取以进行逆行转运。结合Tet-On启动子,该2病毒系统以逆行依赖性方式支持诱导表达26,27。
逆行病毒将载体插入目标神经元的突触空间,使其被该细胞的轴突吸收并运输到细胞体。虽然慢病毒载体以前取得了巨大的成功,在基因治疗研究中提供了长期表达,但这种方法转向腺相关病毒载体有几个简单的原因26,28: AAV更经济,同样有效,并且后勤负担更少,因为它具有较低的生物安全水平名称29,30,31,32.虽然最常用的血清型AAV2显示出CST轴突的稳健转染,但未来的研究人员可能会注意到AAV1在跨标记时提供了一些多功能性,因此在未来的研究中提出了几种可能的迭代33。最后的适应是用Cre重组酶对逆行病毒进行编码,以便可以同时引入多个顺行载体,从而减少不必要的内部病毒浪费,并最大限度地提高DREADD以正确方向表达的可能性。
最终,该方案展示了同时注射到皮质和颈椎中,分别针对皮质脊髓束的细胞体和轴突末梢。高保真转染可见于大脑皮层和脊髓。虽然所描述的方案对于 Sprague Dawley 大鼠 5 天大鼠来说是完善的,但它适用于出生后 4-10 天,对麻醉和立体定向坐标进行细微调整。
研究方案
以下所有外科和动物护理程序均已获得天普大学动物护理和使用委员会的批准。所描述的方案是一种生存手术,动物最终在完成时间点时通过腹膜内注射100mg / kg戊巴比妥钠被安乐死。
1. 术前准备
- 使用3.5nL玻璃毛细管移液器准备至少两个用于病毒注射的拉动玻璃针;一根针用于DREADD,一根针用于rCre。作为预防措施,准备4-5根针,以防它们在术中断裂。
- 使用微型剪刀,从针头上切下1-2毫米多余的玻璃。
- 对于每根针,将其定位在30°,使用微量移液器倒角创建具有30-40μm孔径和45°斜角的尖端。
- 将针头储存在有盖的培养皿中,然后将培养皿置于紫外线下的生物安全罩中15分钟,对其进行消毒。
- 通过在手术前从-80°C冰箱中取出合适的体积来制备必要的病毒,请记住,每只动物将需要3μL的每种病毒。
注意:不使用时将病毒运输并储存在冰上。该协议是使用 AAV2-hM3Dq-mCherry 和 AAV2-retroCre 开发的,每只动物注射 3 μL 每种病毒。DREADD质粒pAAV-hSyn-DIO-hM3Dq-mCherry(见 材料表)用于制造顺行AAV2,病毒滴度为1.54×1012 个基因组拷贝(GC)/mL。Cre质粒pAAV-CMV-scCre用于制备逆行AAV2,病毒滴度为4.27×1012 GC/mL。 - 将注射器插入微型泵,并将其放入带有游标刻度的显微操纵器中。
- 为了帮助目视确认针头中是否存在病毒,请将彩色染料(即红色油)装入针头中。避免针头出现气泡。
- 将玻璃针插入注射器,确保针头正确贴合。
- 如果可用,请对每种病毒使用单独的注射泵重复整个过程。如果只有一个可用的注射泵,请准备两个单独的针头,并在需要更换病毒时更换用过的针头。
2.麻醉和手术部位准备
- 在数字秤上称量动物。记录术前体重以确定所需的麻醉量。
注意:该协议发现,确保在整个手术时间内令人满意的麻醉平面的最可靠的麻醉技术是氯胺酮和低温的组合。氯胺酮本身不足以保证麻醉,补充甲苯噻嗪在增加术中死亡率之前阈值较窄。低温本身不足以进行长时间的手术(双脊柱和脑部手术可能需要>1小时的稳定麻醉)。 - 通过在肩胛骨之间皮下注射稀释的氯胺酮(10mg / mL)来麻醉幼犬,以使动物接受100mg / kg剂量的氯胺酮;等待5分钟。
注意:例如,在出生后第 5 天,一只大鼠幼崽重 10 克并接受 0.1 mL 稀释的氯胺酮溶液 (10 mg/mL)。 - 将幼犬放在碎冰上 6-8 分钟。通过将动物放在乳胶手套或封口膜中来防止冻伤,以避免直接接触冰块。
- 用镊子用力捏住脚,以确认适当的麻醉平面。如果发生反射性戒断,请在冰上再停留 2 分钟,然后再继续。
- 使用浸有 5% 碘溶液的无菌纱布将防腐剂广泛涂抹在动物的头部和背部区域。然后,用浸泡在70%乙醇中的纱布消毒。每次使用消毒湿巾三次,在碘和乙醇之间交替浸泡纱布。
注意:不需要眼部护理,因为幼崽只在 14 天大时睁开眼睛。 - 如果动物要接受双重手术(脑+脊柱),术前在肩胛骨之间皮下推注生理盐水(0.02mL/g)。
注意:如果动物在手术过程中变得有反应并且需要进一步麻醉,则将动物放在冰上5分钟。
3. 手术领域和器械准备
- 高压灭菌手术工具,包括手术刀支架、圆环、止血器、中点弯曲钳和牵开器
- 准备好显微镜并安装新生大鼠立体定位适配器,将其牢固地定位在成人立体定位支架内。
- 使用消毒手套进行手术。打开一包预先包装好的无菌手术手套,将无菌手套包装放在桌子上,使用包装纸作为放置用过的工具的附加区域。
注意:遵循良好的手术实践并在整个手术过程中保持无菌非常重要。 - 将 11 刀片固定在手术刀支架中。放置无菌盐水、4.0 铬肠缝合线、4.0 丝缝线和控制出血的材料,例如无菌纱布、无菌棉尖涂抹器和三角形。
- 如上所述设置两个手术区域,一个位置分配给开颅术,另一个站点分配给宫颈板切除术。
- 取回动物并将其固定在立体定位适配器中:由于新生儿非常软骨,通过将耳杆宽阔地指向下颌关节来轻轻固定它们。水平稳定后,轻轻引入前吹嘴。
注意:用于提供"平坦"手术区域的非约束性规则是将耳杆固定在相同的高度,将吹嘴固定在大约低 2-3 层。
4.进行开颅手术并暴露躯体运动皮层
- 通过按压头皮顶部中线的镊子来确定将要切开的区域,感受矢状缝合线。沿着矢状缝合面做一个1厘米的切口,从眼线上方开始。拉紧皮肤以确保干净、笔直和精确的切口。
- 通过沿颅骨表面轻轻探查镊子并密切注意缝合线以及沿顶骨和额骨运行的镊子引起的任何凹陷来识别前膛(冠状缝合线和矢状缝线的收敛)。
- 通过在感兴趣的一侧应用加重钩子来保持开口。请注意,脊柱注射在右侧进行,颅脑注射在左侧。
- 用棉尖和微剪刀的组合清除腱膜,以最大限度地提高前膛的暴露,从而提高准确性。确保冠状缝合线在足够远的横向视野中,以便为后续注射提供粗略的模板。
- 使用显微剪刀,切出紧邻前膛骨的左额颅骨约3 x 2 mm部分。
注意:一旦骨瓣被小心地移除,应该有一个清晰的窗口,暴露的脑物质准备注射。大脑对侧的其余缝合线将作为视觉指南,以保持沿前后 (AP) 轴的准确性。 - 用棉尖清除任何碎屑、脑脊液 (CSF) 和血液。
注意:血液或脑脊液稍微模糊视线是正常的,因此建议定期用棉尖清理该区域。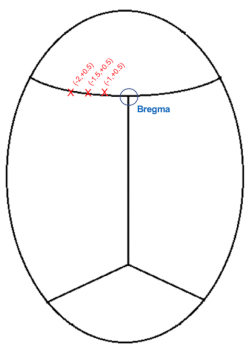
图 3:颅脑注射坐标 (mm) 相对于前膛的示意图。 请点击此处查看此图的大图。
5.加载病毒并定位注射器
- 通过将~5μL移液到一块封口膜上,将病毒装入注射器中,并定位针头,使尖端停留在病毒液滴上。
- 确保将额外的病毒装入注射器,以确保顺利注射。例如,当总共注射 3 μL(每个注射部位 1 μL)时,使用微泵以 250 nL/s 的速率提取 4 μL 病毒。
- 用实验室湿巾清除多余的病毒。
- 定位显微操纵器,使游标刻度可见,并将针定位在矢状缝合线上方。
- 将针降低到代表前膛的区域上方(图3),并记下AP和内侧(ML)坐标。
- 鉴于注射将在左侧,通过从 bregma 的 ML 坐标中减去 1、1.5 和 2.0 mm(ML: -1.0、-1.5、-2.0)来生成目标坐标。
注意:对于所有三次注射,AP位置将与bregma相距+0.5mm。 - 将针头移动到第一次注射的位置。AP: +0.5, ML: -1.0
- 将针降低到暴露的大脑,直到它缩进外皮层。记下针的高度,并通过从大脑表面的高度减去0.6毫米将针头放到位。注射深度:皮质表面-0.6毫米。
注意:重要的是要注意每次注射的表面深度,因为可能会对大鼠的定位造成轻微干扰。
6.将病毒注射到躯体运动皮层
- 针头就位后,对进样器进行编程,以 250 nL/min 的速率进样 1 μL。
- 注射完成后,让针头在皮质中休息3分钟。
- 对其他坐标重复注射:沿着皮层相对于前膛总共注射 3 次,深度均为 -0.6 毫米:1) AP: +0.5 毫米, ML: -1.0 毫米 2) AP: +0.5 毫米, ML: -1.5 毫米 3) AP: +0.5 毫米, ML: -2.0 毫米。
- 注射完成后,请参阅第9节缝合,并将动物转移到另一张手术台进行颈椎板切除术。
7. 为精确脊髓注射创建脊柱窗口
- 用手指触诊颅底识别切口部位。在中线,使用 #11 刀片开始在颅底后方 1-2 毫米处切口,并将切口向后延伸 1 厘米以露出浅表肌肉。用拇指和食指拉紧皮肤,以确保切口清洁。
- 使用刀片的尖头,沿着浅表肌的中线轻轻地进行一系列切割,以暴露脊髓腔和深部脊柱肌肉。使用一对镊子张开肌肉并观察手术窗口。
注意:浅表肌肉将显示为浅粉红色,而深部脊柱肌肉将显示为浅白灰色。 - 一旦深部脊柱肌肉暴露出来,将牵开器插入手术窗口。如有必要,使用镊子抓住侧向皮肤和肌肉,将它们拉伸到牵开器的牙齿周围。将手术窗口缩回至7-8毫米宽,以便一览无余地看到脊柱。
- 通过其突出的棘突识别第二颈椎(C2 或轴),该棘突向背侧突出并封装在大型圆顶形肌肉中。使用镊子或钝器来感受和识别这个过程,因为这将是指导标志。
注意:相邻的C3椎骨通常被大的C2肌肉轻微遮挡;因此,用镊子或刮骨器轻柔地解剖 C3 处的肌肉有助于确定椎骨并有助于椎体计数。 - 使用刮骨器的平坦边缘,通过轻轻刮掉两侧的深部脊柱肌肉来露出 C3-C7 椎骨。从内侧开始,沿平行于椎板的方向横向刮擦,以确保适当的暴露,这样可以清楚地区分椎板。用棉尖控制出血。
- 使用一把微剪刀,小心地在C6和C7处切割软骨层的侧边缘。在计算椎体水平时,请使用C2作为指导。
- 使用一对细镊子,小心地取出薄片的解剖部分以露出脊髓。确保脊柱窗口足够大以容纳所需的注射部位。如上所述,去除任何可能用显微剪刀和镊子刺穿脊髓的尖锐或锯齿状骨头部分。
- 按照第 3.6 节所述将动物放在立体定位颅骨支架中。此外,在动物的躯干下放置一块卷起的纱布,以抬高其后躯。
注意:动物后躯抬高可有效地将胸部抬离支架表面,以防止呼吸运动在注射过程中影响针头的位置。 - 在开始注射之前,通过在该区域轻轻涂抹棉尖和杉三角形来清除脊柱窗口中的任何血液或脑脊液,而不会侮辱脊髓。此外,在窗口周围形成屏障,以防止连续出血或脑脊液渗漏阻塞注射部位。为此,在脊柱窗口的侧面放置一小块可吸收的棉花。
8.直接注射到脊髓中,靶向轴突末梢
- 使用玻璃注射针的尖端,通过识别脊动脉来近似脊髓的中线。但是,如果脊髓动脉明显偏离中心或以任何方式偏离,则通过使用 C2 棘突的位置并将其外推到脊柱长度来近似中线。
注:有关加载病毒的说明,请参阅第 5.1 节。 - 一旦确定,将针头放置在C5层的后方,位于近似中线处,并将其用作参考点。然后,使用显微操纵器将针头横向向右移动0.3毫米。降低针头,直到它刚好接触脊髓表面;从这个深度,将针头插入脊髓0.6毫米。如有必要,继续插入针头,直到刺穿脊髓;然后,将针缩回或降低到适当的深度。
- 以 250 nL/min 的速度注入 1 μL 的 retroAAV2-scCre。注射完成后,等待2分钟,让病毒扩散到脊髓中,然后慢慢抽出针头。在脊柱窗口内的另外两个部位使用相同的侧向和深度坐标重复注射,一个在中点,最后一个在T1层前方。
9. 伤口闭合和术后护理
- 从立体定位支架上取出动物并取出牵开器或钩子。用几滴无菌生理盐水清除伤口区域。
- 用4.0丝缝合头皮,总共缝合两到3条。
- 缝合宫颈开口时,使用 4.0 铬肠紧紧地重新连接肌肉层(2 条缝合线就足够了)。用 4.0 丝缝合宫颈皮肤开口(预计缝合 4 条)。
- 一旦动物闭合,明智地在缝合线上使用液体绷带。
- 将动物放在加热灯下并密切监视它,直到完全重新唤醒。一旦动物清醒、移动并干燥,用无菌纱布轻轻清洁伤口。在动物恢复足够的意识以维持胸骨卧位之前,不要让动物无人看管。
- 将动物与母亲一起放回笼子里。注意防止母亲对幼崽的忽视和婴儿同类相食:
- 从手术前一周开始,每天两次,通过温和处理(5-10分钟),让研究人员熟悉预期的手术母亲。
- 将幼崽一起放回笼子里,以减少对母亲的干扰。
- 手术当天皮下注射母亲乙酰丙嗪1.5mg / kg q12小时。
注意:疼痛管理具有双重目的,即为幼崽提供镇痛并鼓励尽早恢复活动,从而促进与母亲的重新融合。 - 手术后从术后第8小时开始,皮下注射丁丙诺啡0.05mg / kg,共3天(术后第0,1,2天)。
结果
病毒载体的成功注射和运输应导致脊髓和运动皮层中单侧神经元的转导。 图 4 显示了表达 Cre-依赖性 DREADDs-mCherry 与对侧脊柱注射 rCre 共同注射的脑冠切片运动皮层中 V 层 CST 神经元的标记。切片用dsRed抗体染色。
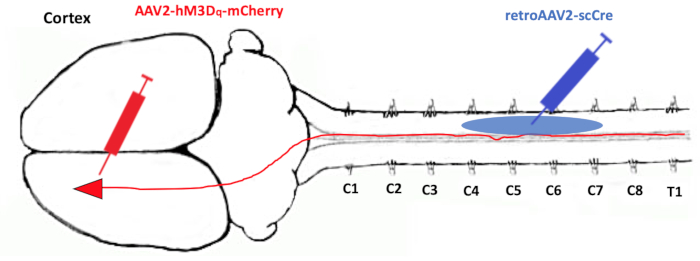
图 1:演示本协议中使用?...
讨论
使用可注射的化学遗传修饰剂对大脑活动的诱导遗传调节是研究从SCI恢复的各种机制的有力工具。当考虑到荧光示踪验证了组织学中的解剖学精度时,诱导性G蛋白偶联受体(DREADDs)的靶向准确性进一步提高。本文讨论了一种可靠的方法来探索抑制或刺激选定的神经元通路(具有兴奋性或抑制性DREADDS)是否会导致增强的轴突再生或发芽34,35。将逆行可?...
披露声明
作者没有什么可透露的。
致谢
这项工作由Shriners儿童医院SHC-84706的奖学金资助。
材料
| Name | Company | Catalog Number | Comments |
| #11 scalpel blades | Roboz | RS-9801-11 | For use with the scalpel. |
| #10 Scalpel Blades | Roboz | RS-9801-10 | For use with the scalpel. |
| 1 mL Syringes | Becton, Dickinson and Company | 309659 | For anesthetic SC injection and fluid bolus |
| 4.0 silk suture | Ethicon | 771-683G | For skin closure |
| 4.0 Chromic Catgut Suture | DemeTECH | NN374-16 | To re-bind muscle during closing. |
| 48000 Micropipette Beveler | World Precision Instruments | 32416 | Used to bevel the tips of the pulled glass capillary tubes to form functional glass needles. |
| 5% Iodine Solution | Purdue Products L.P. | L01020-08 | For use in sterilzation of the surgical site. |
| 70% Ethanol | N/A | N/A | For sterilization of newly prepared glass needles, animal models during surgical preparation |
| Ketamine (Ketaset) | Zoetis | 240048 | For keeping the animal in the correct plane of consciousness during surgery. |
| Bead Sterilizer | CellPoint | 5-1450 | To heat sterilize surgical instruments. |
| Digital Scale | Okaus | REV.005 | For weighing the animal during surgical preparation. |
| Flexible Needle Attachment | World Precision Instruments | MF34G-5 | For cleaning glass needles and loading red oil into glass needles. |
| Glass Capillary Tubes | World Precision Instruments | 4878 | For pulled glass needles - should be designed for nanoliter injectors. |
| Hemostats | Roboz | RS-7231 | For general use in surgery. |
| Medium Point Curved Forceps | Roboz | RS-5136 | For general use in surgery. |
| Micromanipulator with a Vernier Scale | Kanetec | N/A | For precise targeting during surgery. |
| Microscissors | Roboz | RS-5621 | For cutting glass whisps off of freshly pulled glass capillary tubes. |
| Lab Standard Stereotaxic Instrument | Stoelting | 51600 | To hold the neonatal sterotaxic holder in place |
| Lab Standard with Mouse & Neonates Adaptor | 51615 | For neonatal skull fixation during cranial surgery and spinal injections | |
| Microscope with Light and Vernier Scale Ocular | Leitz Wetzlar | N/A | Used to visualize and measure beveling of pulled glass capillary tubes into functional glass needles. |
| MicroSyringe Pump Controller | World Precision Instruments | 62403 | To control the rate of injection. |
| Nanoliter 2000 Pump Head Injector | World Precision Instruments | 500150 | To load and inject virus in a controlled fashion. |
| Needle Puller | Narishige | PC-100 | To heat and pull apart glass capillary tubes to form glass needles. |
| pAAV-CMV-scCre | Wu lab | Cre plasmid | |
| pAAV-hSyn-DIO-hM3Dq-mCherry (plasmid #44361) | Bryan Roth’s lab through Addgene | DREADD plasmid | |
| Parafilm | Bemis | PM-996 | To assist with loading virus into the nanoinjector. |
| PrecisionGlide Needles (25G x 5/8) | Becton, Dickinson and Company | 305122 | For use with the 1mL and 10 mL syringes to allow injection of the animal model. |
| Rat Tooth Forceps | Roboz | RS-5152 | For griping spinous processes. |
| Red Oil | N/A | N/A | To provide a front for visualization of virus entering tissue during injection. |
| Retractors | Roboz | RS-6510 | To hold open the surgical wound. |
| Rongeurs | Roboz | RS-8300 | To remove muscle from the spinal column during surgery. |
| Scalpel Blade Handle | Roboz | RS-9843 | To slice open skin and fat pad of animal model during surgery. |
| Scissors | Roboz | RS-5980 | For general use in surgery. |
| Staple Removing Forceps | Kent Scientific | INS750347 | To remove the staples, should they be applied incorrectly. |
| Sterile Cloth | Phenix Research Products | BP-989 | To provide a sterile surface for the operation. |
| Sterile Cotton-Tipped Applicators | Puritan | 806-WC | To soak up blood in the surgical wound while maintaining sterility. |
| Sterile Gauze | Covidien | 2146 | To clean the surgical area and surgical tools while maintaining sterility. |
| Sterile Saline | Baxter Healthcare Corporation | 281324 | For use in blood clearing, and for replacing fluids post-surgery. |
| Surgical Gloves | N/A | N/A | For use by the surgeon to maintain sterile field during surgery. |
| Surgical Heating Pad | N/A | N/A | For maintaining the body temperature of the animal model during surgery. |
| Surgical Microscope | N/A | N/A | For enhanced visualization of the surgical wound. |
| Surgical Stapler | Kent Scientific | INS750546 | To apply the staples. |
| Water Convection Warming Pad | Baxter Healthcare Corporation | L1K018 | For use in the post-operational recovery area to maintain the body temperature of the unconscious animal. |
| Weighted Hooks | N/A | N/A | To hold open the surgical wound. |
| Liquid bandage | NewSkin | 985838 | To apply along sutures following surgery and encourage wound healing |
| Wire Cage Lamp | ZooMed | LF10EC | To help animals recover from anesthesia and retain warm body temperature naturally |
参考文献
- Parent, S., Mac-Thiong, J., Roy-Beaudry, M., Sosa, J. F., Labelle, H. Spinal cord injury in the pediatric population: A systematic review of the literature. Journal of Neurotrauma. 28 (8), 1515-1524 (2011).
- Vitale, M. G., Goss, J. M., Matsumoto, H., Roye, D. P. Epidemiology of pediatric spinal cord injury in the united states: Years 1997 and 2000. Journal of Pediatric Orthopedics. 26 (6), 745-749 (2006).
- Bregman, B. S., Goldberger, M. E. Anatomical plasticity and sparing of function after spinal cord damage in neonatal cats. Science. 217 (4559), 553-555 (1982).
- Castro, A. J. Ipsilateral corticospinal projections after large lesions of the cerebral hemisphere in neonatal rats. Experimental Neurology. 46 (1), 1-8 (1975).
- Commissiong, J. W., Toffano, G. Complete spinal cord transection at different postnatal ages: Recovery of motor coordination correlated with spinal cord catecholamines. Experimental Brain Research. 78 (3), 597-603 (1989).
- Yuan, Q., Su, H., Chiu, K., Wu, W., Lin, Z. Contrasting neuropathology and functional recovery after spinal cord injury in developing and adult rats. Neuroscience Bulletin. 29 (4), 509-516 (2013).
- Kim, J., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualizing and manipulating neuronal circuits in vivo. The European Journal of Neuroscience. 37 (8), 1203-1220 (2013).
- Pawliuk, R., et al. Correction of sickle cell disease in transgenic mouse models by gene therapy. Science. 294 (5550), 2368-2371 (2001).
- Atasoy, D., Sternson, S. M. Chemogenetic tools for causal cellular and neuronal biology. Physiological Reviews. 98 (1), 391-418 (2018).
- Brandt, H. M., Apkarian, A. V. Biotin-dextran: A sensitive anterograde tracer for neuroanatomic studies in rat and monkey. Journal of Neuroscience Methods. 45 (1-2), 35-40 (1992).
- Veenman, C. L., Reiner, A., Honig, M. G. Biotinylated dextran amine as an anterograde tracer for single- and double-labeling studies. Journal of Neuroscience Methods. 41 (3), 239-254 (1992).
- Reiner, A., et al. Pathway tracing using biotinylated dextran amines. Journal of Neuroscience Methods. 103 (1), 23-37 (2000).
- Oguchi, M., et al. Double virus vector infection to the prefrontal network of the macaque brain. PloS One. 10 (7), 0132825 (2015).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487 (7406), 235-238 (2012).
- Bernstein, D. R., Stelzner, D. J. Plasticity of the corticospinal tract following midthoracic spinal injury in the postnatal rat. The Journal of Comparative Neurology. 221 (4), 382-400 (1983).
- Brown, K., Wolfe, B., Wrathall, J. Rapid functional recovery after spinal cord injury in young rats. Journal of Neurotrauma. 22, 559-574 (2005).
- Tillakaratne, N. J. K., et al. Functional recovery of stepping in rats after a complete neonatal spinal cord transection is not due to regrowth across the lesion site. Neuroscience. 166 (1), 23-33 (2010).
- Kartje-Tillotson, G., Neafsey, E. J., Castro, A. J. Electrophysiological analysis of motor cortical plasticity after cortical lesions in newborn rats. Brain Research. 332 (1), 103-111 (1985).
- Gennaro, M., et al. Focal stroke in the developing rat motor cortex induces age- and experience-dependent maladaptive plasticity of corticospinal system. Frontiers in Neural Circuits. 11, 47 (2017).
- Brichta, A. M., Grant, G., Paxinos, G. Cytoarchitectural organization of the spinal cord. The rat nervous system. 2, 294-309 (1985).
- Kjell, J., Olson, L. Rat models of spinal cord injury: From pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Takeoka, A., Arber, S. Functional local proprioceptive feedback circuits initiate and maintain locomotor recovery after spinal cord injury. Cell Reports. 27 (1), 71-85 (2019).
- Flynn, J. R., Graham, B. A., Galea, M. P., Callister, R. J. The role of propriospinal interneurons in recovery from spinal cord injury. Neuropharmacology. 60 (5), 809-822 (2011).
- Ohne, H., et al. Mechanism of forelimb motor function restoration in rats with cervical spinal cord hemisection-neuroanatomical validation. IBRO Reports. 7, 10-25 (2019).
- Wang, X., et al. Deconstruction of corticospinal circuits for goal-directed motor skills. Cell. 171 (2), 440-455 (2017).
- Sheikh, I. S., et al. Retrogradely transportable lentivirus tracers for mapping spinal cord locomotor circuits. Frontiers in Neural Circuits. 12, 60 (2018).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487, 235-238 (2012).
- Keefe, K. M., Junker, I. P., Sheikh, I. S., Campion, T. J., Smith, G. M. Direct injection of a lentiviral vector highlights multiple motor pathways in the rat spinal cord. Journal of Visualized Experiments: JoVE. (145), e59160 (2019).
- Hutson, T. H., Verhaagen, J., Yáñez-Muñoz, R. J., Moon, L. D. F. Corticospinal tract transduction: A comparison of seven adeno-associated viral vector serotypes and a non-integrating lentiviral vector. Gene Therapy. 19 (1), 49-60 (2012).
- Liu, Y., Keefe, K., Tang, X., Lin, S., Smith, G. M. Use of self-complementary adeno-associated virus serotype 2 as a tracer for labeling axons: Implications for axon regeneration. Plos One. 9 (2), 87447 (2014).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Abdellatif, A. A., et al. delivery to the spinal cord: Comparison between lentiviral, adenoviral, and retroviral vector delivery systems. Journal of Neuroscience Research. 84 (3), 553-567 (2006).
- Zingg, B., Peng, B., Huang, J., Tao, H. W., Zhang, L. I. Synaptic specificity and application of anterograde transsynaptic AAV for probing neural circuitry. The Journal of Neuroscience. 40 (16), 3250-3267 (2020).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences of the United States of America. 104 (12), 5163-5168 (2007).
- Roth, B. L. DREADDs for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Hasegawa, A., et al. Mechanism of forelimb motor function restoration after cervical spinal cord hemisection in rats: A comparison of juveniles and adults. Behavioural Neurology. 2016, 1035473 (2016).
- Alstermark, B., Isa, T. Circuits for skilled reaching and grasping. Annual Review of Neuroscience. 35, 559-578 (2012).
- García-Alías, G., Truong, K., Shah, P. K., Roy, R. R., Edgerton, V. R. Plasticity of subcortical pathways promote recovery of skilled hand function in rats after corticospinal and rubrospinal tract injuries. Experimental Neurology. 266, 112-119 (2015).
- Tohyama, T., et al. Contribution of propriospinal neurons to recovery of hand dexterity after corticospinal tract lesions in monkeys. Proceedings of the National Academy of Sciences of the United States of America. 114 (3), 604-609 (2017).
- Z'Graggen, W. J., et al. Compensatory sprouting and impulse rerouting after unilateral pyramidal tract lesion. Journal of Neuroscience. 20 (17), 6561-6569 (2000).
- Ueno, M., et al. Corticospinal circuits from the sensory and motor cortices differentially regulate skilled movements through distinct spinal interneurons. Cell Reports. 23 (5), 1286-1300 (2018).
- Kim, J., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. Journal of Visualized Experiments: JoVE. (91), e51863 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。