Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Targeting des kortikospinalen Trakts bei neonatalen Ratten mit einem doppelviralen Vektor mittels kombinierter Gehirn- und Wirbelsäulenchirurgie
In diesem Artikel
Zusammenfassung
Dieses Protokoll demonstriert eine neuartige Methode zur Anwendung von Gentherapien auf Subpopulationen von Zellen bei neonatalen Ratten im postnatalen Alter von 5-10 Tagen durch Injektion eines anterograden chemogenetischen Modifikators in den somatomotorischen Kortex und einer retrograden transportablen Cre-Rekombinase in das zervikale Rückenmark.
Zusammenfassung
Die erfolgreiche Überwindung der Hindernisse, die die Forschung an neonatalen Ratten behindern, ist wichtig, um die Unterschiede in den Ergebnissen bei pädiatrischen Rückenmarksverletzungen (SCIs) im Vergleich zu erwachsenen SCIs zu untersuchen. Darüber hinaus kann die zuverlässige Einführung von Therapien in die Zielzellen des zentralen Nervensystems (ZNS) eine Herausforderung darstellen, und Ungenauigkeiten können die Wirksamkeit der Studie oder Therapie beeinträchtigen. Dieses Protokoll kombiniert die virale Vektortechnologie mit einer neuartigen chirurgischen Technik, um Gentherapien bei neonatalen Ratten am postnatalen Tag 5 präzise einzuführen. Hier wird ein Virus, das für den retrograden Transport (retroAAV2) von Cre entwickelt wurde, an den Axonendigungen kortikospinaler Neuronen im Rückenmark eingeschleust, wo es anschließend zu den Zellkörpern transportiert wird. Ein doppelt gefloxter Designer-Rezeptor mit umgekehrter Orientierung (DIO), der ausschließlich durch das Designer-Drug-Virus (DREADD) aktiviert wird, wird dann in den somatomotorischen Kortex des Gehirns injiziert. Diese Doppelinfektionstechnik fördert die Expression der DREADDs nur in den koinfizierten Neuronen des kortikospinalen Trakts (CST). Daher ist die gleichzeitige Co-Injektion des somatomotorischen Kortex und der zervikalen CST-Terminals eine gültige Methode zur Untersuchung der chemogenetischen Modulation der Genesung nach zervikalen SCI-Modellen bei neonatalen Ratten.
Einleitung
Während Rückenmarksverletzung in der pädiatrischen Bevölkerung relativ selten vorkommt, ist sie besonders traumatisch und verursacht eine dauerhafte Behinderung, die eine immense logistische Voraussicht erfordert. Darüber hinaus wird ein höherer Anteil pädiatrischer Rückenmarksverletzungen als zervikal und vollständig eingestuft als in der erwachsenen Bevölkerung 1,2. Ein Kennzeichen aller Säugetierarten ist, dass sich Neugeborene deutlich besser von einer Rückenmarksverletzung erholen als erwachsene Tiere, und dies bietet die Möglichkeit, die treibenden Mechanismen für die Erholung in jüngeren Populationen zu bewerten 3,4,5. Trotzdem gibt es weniger multimodale Studien, die sich mit der Erforschung von Neugeborenen und Säuglingsnagetieren befassen, was zum Teil auf die zusätzliche Schwierigkeit zurückzuführen ist, ausgewählte Populationen von Neuronen in den viel engeren anatomischen Orientierungspunkten jüngerer Tiere genau anzuvisieren6. Dieser Artikel konzentriert sich auf die direkte Injektion von hocheffizienten anterograden und retrograden Adeno-assoziierten Vektoren in das Rückenmark der Ratte, um wichtige motorische Bahnen mit der Anwendung von Cre-abhängigen DREADDs zu modulieren, wodurch die Reichweite multimodaler Regenerationsstudien erweitert wird.
Virale Vektoren sind wichtige biologische Werkzeuge mit einer breiten Palette von Anwendungen, einschließlich der Einführung von genetischem Material, um Zielgene zu ersetzen, Wachstumsproteine hochzuregulieren und die anatomische Landschaft des ZNS 7,8,9 zu verfolgen. Viele der anatomischen Details der motorischen Bahnen der Wirbelsäule wurden mit klassischen Tracer, d.h. biotinyliertem Dextranamin, untersucht. Während traditionelle Tracer maßgeblich zur Aufdeckung der Neuroanatomie beigetragen haben, sind sie nicht ohne Nachteile: Sie markieren wahllos Signalwege, selbst wenn sie korrekt injiziert werden, und Studien haben gezeigt, dass sie von beschädigten Axonen aufgenommen werden10,11,12. Folglich könnte dies zu falschen Interpretationen in Regenerationsstudien führen, bei denen abgetrennte Axone mit regenerierenden Fasern verwechselt werden könnten.
Die folgende Methode nutzt das Zwei-Virus-Vektorsystem, das kürzlich in Modulationsstudien populär gemacht wurde, mit zwei verschiedenen viralen Vektoren in zwei getrennten Bereichen desselben Neurons13,14. Der erste ist ein Vektor, der die Zellkörper von Projektionsneuronen lokal infiziert. Der andere ist ein retrograder Vektor, der von den Axonendigungen der Projektionsneuronen transportiert wird (Abbildung 1). Der retrograde Vektor trägt Cre-Rekombinase, und der lokale Vektor enthält die "Cre-On"-Doppel-Flox-Sequenz, in der ein fluoreszierendes Protein (mCherry) kodiert ist. Das native Transgen, das sowohl hM3Dq als auch mCherry exprimiert, ist relativ zum Promotor invertiert und wird von zwei LoxP-Stellen flankiert (Abbildung 2). Daher wird mCherry nur in den doppelt transduzierten Projektionsneuronen exprimiert, bei denen die Cre-Rekombinase ein Rekombinationsereignis zwischen den LoxP-Stellen induziert, die Orientierung des Transgens in den entsprechenden Leserahmen umdreht und die Expression sowohl des DREADD als auch des fluoreszierenden Proteins ermöglicht. Sobald sich das virale Transgen in der richtigen Ausrichtung befindet, können die DREADDs vorübergehend eine Neuromodulation durch einen separat injizierten Liganden, d.h. Clozapin-N-Oxid, induzieren. Das Protokoll wurde entwickelt, um induzierbare Neuromodulationsforschung bei Neugeborenen zu authentifizieren, wobei DREADDS injiziert werden, um die CSTs selektiv zu modulieren. Das Zwei-Virus-System fungiert als Versicherungspolice und stellt sicher, dass jede DREADD-positive Zelle unter Fluoreszenz mit hoher Genauigkeit zurückverfolgt werden kann, um die Injektionen zu validieren.
Diese Methode hilft auch, die Lücke in der Neugeborenenforschung zu schließen. Pädiatrische Rückenmarksverletzung stellt ihre Herausforderungen dar, und Forschung, die Regeneration, Keimung oder Plastizität analysiert, sollte die Unterschiede zwischen Neugeborenen und Erwachsenen betonen 3,15,16,17. Durch die Optimierung des chirurgischen Eingriffs und die Durchführung früherer anatomischer Studien mit Nissl-Färbung wurden die Koordinaten sowohl für die kranialen als auch für die spinalen Injektionen validiert. Ziel war es, eine Methode zur doppelten Injektion in eine neugeborene Ratte mit erhöhter Genauigkeit und Überlebensfähigkeit bereitzustellen.
Für das aktuelle Modell wurde der anterograde Vektor in die Zellkörper des somatomotorischen Kortex injiziert, wobei Bregma als Referenz18,19 verwendet wurde. In Bezug auf die Wirbelsäuleninjektionen wurde der retrograde Vektor in Laminae V-VII injiziert, wo sich die CST-Axonendigungenbefinden 20,21. Es gibt viele grundlegende Fragen, die zugrunde liegen, wie bestimmte Läsionsmodelle jüngere Tiere unterschiedlich beeinflussen und wie die anschließende Erholung von einem älteren Tier abweicht. Diese Studie zeigt ein robustes Mittel zur Untersuchung von Gebärmutterhalsverletzungen und der Wiederherstellbarkeit der Funktion der Vordergliedmaßen bei neonatalen Nagetieren. Im Gegensatz dazu befasste sich die Mehrzahl der bisherigen Studien mit der Fortbewegung der Erholung nach Lenden- oder Thoraxverletzungen 5,22,23,24. Durch die Paarung des doppelviralen Vektors mit der hier beschriebenen neuartigen Injektionstechnik trägt dieses Protokoll dazu bei, bestimmte Probleme (z. B. die Überlebensfähigkeit) zu mildern, die die Untersuchung von Nagetieren bei Neugeborenen beeinträchtigen können. Diese Methode ist robust, praktisch und vielseitig: Leichte Variationen in der Technik ermöglichen es, verschiedene Bahnen anzuvisieren, d.h. ventrale CST, dorsale CST und die aufsteigenden dorsalen Pfade.
Für dieses System wird ein lokal wirkendes Virus (z.B. AAV2) in die Region der interessierenden neuronalen Zellkörper injiziert. Ein zweites retrograd transportiertes Virus, das die Expression des lokalen Virus steuert, wird an den Axon-Terminals für diese neuronale Population injiziert. Daher werden definitionsgemäß nur kortikospinale Neuronen markiert. Das retroAAV-Cre-Virus wurde mit einem konstitutiv aktiven CMV-Promotor ausgewählt, da das Shuttle-Plasmid verwendet wird, um mehrere AAV-Serotypen für die Cre-abhängige Expression in verschiedenen Zelltypen zu erzeugen. Für kortikale Injektionen wurde AAV2 mit dem Transgen gewählt, das vom Synapsin-1-Promotor angetrieben wird, um die Expression auf Neuronen zu beschränken. Da das 2-virale System mehr auf den Ursprung und die Beendigung der interessierenden neuronalen Population angewiesen ist, könnten mehrere verschiedene Promotoren verwendet werden, wenn sie die Expression der interessierenden Gene innerhalb der interessierenden neuronalen Population steuern können. Zum Beispiel könnte der exzitatorische neuronale Promotor CamKII das Synapsin-1 ersetzen. Neben der Verwendung dieser AAV-Serotypen kann auch ein retrograder Transport in unreife und in viel geringerem Maße adulte kortikospinale Motoneuronen mit dem hochretrograden transportablen Lentivirus (HiRet)25 erreicht werden. HiRet-Lentiviren verwenden ein chimäres Tollwut/VSV-Glykoprotein, um die Aufnahme an der Synapse für den retrograden Transport zu steuern. In Kombination mit einem Tet-On-Promotor unterstützt dieses 2-virale System die induzierbare Expression in retrograder Abhängigkeit26,27.
Retrograde Viren schleusen Vektoren in den synaptischen Raum eines Zielneurons ein, so dass es vom Axon dieser Zelle aufgenommen und in den Zellkörper transportiert werden kann. Während lentivirale Vektoren in der Vergangenheit enormen Erfolg hatten und eine langfristige Expression in Gentherapiestudien ermöglichten, konzentrierte sich diese Methode aus einigen einfachen Gründen auf Adeno-assoziierte virale Vektoren26,28: AAV ist wirtschaftlicher, ähnlich effektiv und stellt einen geringeren logistischen Aufwand dar, da es eine niedrigere Biosicherheitsstufe aufweist 29,30,31,32 . Während AAV2, der am häufigsten verwendete Serotyp, eine robuste Transfektion von CST-Axonen zeigt, könnten zukünftige Forscher feststellen, dass AAV1 eine gewisse Vielseitigkeit bietet, da es transynaptisch markiert und somit mehrere mögliche Iterationen in zukünftigen Studien hervorbringt33. Die letzte Anpassung besteht darin, das retrograde Virus mit Cre-Rekombinase zu kodieren, so dass mehrere anterograde Vektoren gleichzeitig eingeführt werden können, wodurch unnötiger interner Virusabfall reduziert und die Wahrscheinlichkeit maximiert wird, dass die DREADDs in der richtigen Ausrichtung exprimieren.
Letztendlich zeigt dieses Protokoll die gleichzeitige Injektion in den Kortex und die Halswirbelsäule, die spezifisch auf die Zellkörper bzw. die Axonendigungen des Kortikospinaltraktes abzielt. High-Fidelity-Transfektion wird in der Großhirnrinde und im Rückenmark beobachtet. Während das beschriebene Protokoll für Sprague-Dawley-Ratten im Alter von 5 Tagen perfektioniert wurde, ist es für die postnatalen Tage 4-10 mit geringfügigen Anpassungen der Anästhesie und der stereotaktischen Koordinaten geeignet.
Protokoll
Alle folgenden chirurgischen und tierpflegerischen Verfahren wurden vom Animal Care and Use Committee der Temple University genehmigt. Das beschriebene Protokoll ist eine Überlebensoperation, und die Tiere wurden schließlich durch intraperitoneale Injektion von 100 mg/kg Natriumpentobarbital nach Ablauf ihrer Zeitpunkte eingeschläfert.
1. Präoperative Vorbereitung
- Bereiten Sie mindestens zwei gezogene Glasnadeln für die Virusinjektion mit 3,5 nL Glaskapillarpipetten vor. eine Nadel für den DREADD und eine Nadel für den rCre. Bereiten Sie vorsichtshalber 4-5 Nadeln vor, falls sie intraoperativ brechen.
- Schneiden Sie mit einer Mikroschere 1-2 mm überschüssiges Glas von der Nadel ab.
- Positionieren Sie jede Nadel in einem Winkel von 30° und verwenden Sie ein Mikropipetten-Umveller, um eine Spitze mit einer Öffnung von 30-40 μm und einem abgeschrägten Winkel von 45° zu erzeugen.
- Lagern Sie die Nadeln in einer abgedeckten Petrischale und sterilisieren Sie sie dann, indem Sie die Petrischale 15 Minuten lang unter UV-Licht in eine Biosicherheitshaube legen.
- Bereiten Sie die erforderlichen Viren vor, indem Sie vor dem Eingriff ein geeignetes Volumen aus dem -80 °C-Gefrierschrank entnehmen, wobei zu berücksichtigen ist, dass jedes Tier 3 μl jedes Virus benötigt.
HINWEIS: Transportieren und lagern Sie das Virus auf Eis, wenn es nicht verwendet wird. Dieses Protokoll wurde unter Verwendung von AAV2-hM3Dq-mCherry und AAV2-retroCre entwickelt, um 3 μL jedes Virus pro Tier zu injizieren. Das DREADD-Plasmid pAAV-hSyn-DIO-hM3Dq-mCherry (siehe Materialtabelle) wurde verwendet, um das anterograde AAV2 mit einem viralen Titer von 1,54 × 1012 Genomkopien (GC)/ml herzustellen. Das Cre-Plasmid, pAAV-CMV-scCre, wurde verwendet, um das retrograde AAV2 mit einem viralen Titer von 4,27 × 1012 GC / ml herzustellen. - Stecken Sie den Injektor in die Mikropumpe und setzen Sie ihn in einen Mikromanipulator mit einer Nonius-Skala.
- Um das Vorhandensein oder Fehlen von Viren in der Nadel visuell zu bestätigen, laden Sie farbigen Farbstoff, d.h. rotes Öl, in die Nadel. Vermeiden Sie Blasen in der Nadel.
- Führen Sie die Glasnadel in den Injektor ein und stellen Sie sicher, dass die Nadel richtig sitzt.
- Falls verfügbar, wiederholen Sie den gesamten Vorgang mit einer separaten Injektionspumpe für jedes Virus. Wenn nur eine Injektionspumpe verfügbar ist, bereiten Sie zwei separate Nadeln vor und ersetzen Sie die gebrauchte Nadel, wenn es Zeit ist, die Viren auszutauschen.
2. Anästhesie und Vorbereitung der Operationsstelle
- Wiegen Sie das Tier auf einer digitalen Waage. Notieren Sie das präoperative Gewicht, um das erforderliche Anästhesievolumen zu bestimmen.
HINWEIS: Dieses Protokoll ergab, dass die zuverlässigste Anästhesietechnik, um eine zufriedenstellende Anästhesieebene während der gesamten Operationszeit zu gewährleisten, eine Kombination aus Ketamin und Hypothermie ist. Ketamin reicht nicht aus, um eine Anästhesie allein zu gewährleisten, und die Ergänzung mit Xylazin hat eine enge Schwelle, bevor die intraoperative Mortalität erhöht wird. Hypothermie allein reicht für längere Operationen nicht aus (Doppelwirbelsäulen- und Gehirnoperationen erfordern wahrscheinlich >1 Stunde Daueranästhesie). - Betäubung des Welpen durch subkutane Injektion von verdünntem Ketamin (10 mg/ml) zwischen die Schulterblätter, so dass das Tier eine Dosis von 100 mg/kg Ketamin erhält; Warten Sie 5 Minuten.
HINWEIS: Zum Beispiel wiegt ein Rattenwelpe am postnatalen Tag 5 10 g und erhält 0,1 ml der verdünnten Ketaminlösung (10 mg / ml). - Legen Sie den Welpen für 6-8 Minuten auf zerstoßenes Eis. Schützen Sie es vor Erfrierungen, indem Sie das Tier in einen Latexhandschuh oder Parafilm legen, um direkten Kontakt mit Eis zu vermeiden.
- Drücken Sie den Fuß mit einer Pinzette fest zusammen, um eine geeignete Anästhesieebene zu bestätigen. Bei reflexartigem Entzug weitere 2 Minuten auf Eis legen, bevor Sie fortfahren.
- Tragen Sie ein Antiseptikum auf den Kopf- und Rückenbereich des Tieres auf, indem Sie sterile Gaze verwenden, die mit einer 5% igen Jodlösung getränkt ist. Dann sterilisieren Sie mit Gaze, die in 70% Ethanol getränkt ist. Tragen Sie die antiseptischen Tücher jeweils dreimal auf, abwechselnd zwischen Jod und Ethanol, um die Gaze einzuweichen.
HINWEIS: Es besteht keine Notwendigkeit für Augenpflege, da junge Welpen ihre Augen erst im Alter von 14 Tagen öffnen. - Wenn ein Tier doppelt operiert werden soll (Gehirn + Wirbelsäule), stellen Sie vor der Operation einen normalen Kochsalzlösung (0,02 ml/g) subkutan zwischen den Schulterblättern vor.
HINWEIS: Wenn das Tier während der Operation ansprechbar ist und eine weitere Anästhesie erforderlich ist, legen Sie das Tier für 5 Minuten auf Eis.
3. Chirurgische Feld- und Instrumentenvorbereitung
- Autoklavieren Sie die chirurgischen Instrumente, zu denen ein Skalpellhalter, Rongeurs, Hämostaten, eine gekrümmte Zange mit mittlerem Punkt und Retraktoren gehören
- Bereiten Sie das Mikroskop vor und installieren Sie den stereotaktischen Adapter für Neugeborene an der Ratte, um ihn fest im stereotaktischen Halter für Erwachsene zu positionieren.
- Führen Sie die Operation mit sterilisierten Handschuhen durch. Öffnen Sie eine Packung vorverpackter steriler OP-Handschuhe und legen Sie die sterile Handschuhfolie auf den Tisch, wobei Sie die Verpackung als zusätzlichen Bereich verwenden, um gebrauchte Werkzeuge abzulegen.
HINWEIS: Es ist wichtig, eine gute chirurgische Praxis zu befolgen und die Sterilität während des gesamten Eingriffs aufrechtzuerhalten. - Befestigen Sie eine 11-Klinge in der Skalpellhalterung. Positionieren Sie sterile Kochsalzlösung, 4.0 chromierte Katgutnaht, 4.0 Seidennaht und Materialien zur Blutungskontrolle, z. B. sterile Gaze, sterile Applikatoren mit Baumwollspitzen und Dreiecke.
- Richten Sie wie oben beschrieben zwei chirurgische Felder ein, wobei eine Stelle für die Kraniotomie und die andere für die zervikale Laminektomie reserviert ist.
- Entnahmen Sie das Tier und sichern Sie es im stereotaktischen Adapter: Da die Neugeborenen sehr knorpelig sind, fixieren Sie sie vorsichtig, indem Sie die Ohrstangen breit in Richtung der Unterkiefergelenke richten. Nach der horizontalen Stabilisierung das vordere Mundstück vorsichtig einführen.
HINWEIS: Eine unverbindliche Regel, die verwendet wird, um einen "flachen" Operationsbereich bereitzustellen, besteht darin, die Ohrstangen auf der gleichen Höhe und das Mundstück auf ca. 2-3 Ebenen niedriger zu befestigen.
4. Durchführung der Kraniotomie und Freilegung des somatomotorischen Kortex
- Identifizieren Sie den Bereich, in dem der Schnitt gemacht wird, indem Sie die Pinzette in der Mittellinie auf der Oberseite der Kopfhaut drücken und nach der sagittalen Naht tasten. Machen Sie einen 1 cm langen Schnitt entlang der sagittalen Nahtebene, beginnend unmittelbar über der Augenlinie. Halten Sie die Haut straff, um einen sauberen, geraden und präzisen Schnitt zu gewährleisten.
- Identifizieren Sie Bregma (die Konvergenz der koronalen und sagittalen Nähte), indem Sie die Pinzette vorsichtig entlang der Schädeloberfläche abtasten und genau auf die Nahtlinien sowie auf jede Vertiefung achten, die durch die Zange verursacht wird, die entlang der parietalen und frontalen Knochen verläuft.
- Halten Sie die Öffnung mit der Anwendung von gewichteten Haken auf der Seite von Interesse. Beachten Sie, dass die Wirbelsäuleninjektion auf der rechten Seite erfolgt, die Schädelinjektion auf der linken Seite.
- Beseitigen Sie die Aponeurose mit einer Kombination aus Baumwollspitzen und Mikroschere, um die Exposition von Bregma für eine erhöhte Genauigkeit zu maximieren. Stellen Sie sicher, dass die koronale Naht seitlich weit genug sichtbar ist, um eine grobe Schablone für nachfolgende Injektionen zu bieten.
- Schneiden Sie mit der Mikroschere etwa einen 3 x 2 mm großen Abschnitt des linken Stirnkopfknochens aus, der unmittelbar an Bregma angrenzt.
HINWEIS: Sobald der Knochenlappen vorsichtig entfernt wurde, sollte ein freies Fenster mit freiliegender Hirnsubstanz für die Injektion bereit sein. Die verbleibenden Nahtlinien auf der kontralateralen Seite des Gehirns dienen als visueller Leitfaden für die Aufrechterhaltung der Genauigkeit entlang der anterior-posterioren (AP) Achse. - Beseitigen Sie alle Ablagerungen, Liquor cerebrospinalis (CSF) und Blut mit Baumwollspitzen.
HINWEIS: Es ist normal, dass Blut oder Liquor die Sichtlinie leicht verdecken, daher ist es ratsam, den Bereich regelmäßig mit Baumwollspitzen zu reinigen.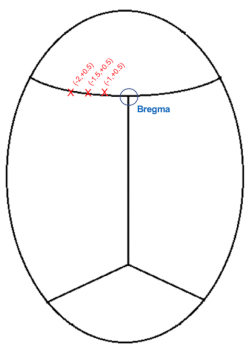
Abbildung 3: Schematische Darstellung der kranialen Injektionskoordinaten (mm) relativ zu bregma. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
5. Laden des Virus und Positionieren des Injektors
- Laden Sie das Virus in den Injektor, indem Sie ~ 5 μL auf ein Stück Parafilm pipettieren, und positionieren Sie die Nadel so, dass die Spitze auf dem Tropfen des Virus aufliegt.
- Stellen Sie sicher, dass zusätzliche Viren in den Injektor geladen werden, um eine reibungslose Injektion zu gewährleisten. Wenn Sie beispielsweise insgesamt 3 μl (1 μl für jede Injektionsstelle) injizieren, ziehen Sie mit der Mikropumpe 4 μl des Virus mit einer Geschwindigkeit von 250 nL/s ab.
- Entfernen Sie das überschüssige Virus mit einem Labortuch.
- Positionieren Sie den Mikromanipulator so, dass die Nonius-Skala sichtbar ist, und positionieren Sie die Nadel über der sagittalen Naht.
- Senken Sie die Nadel bis knapp über den Bereich, der Bregma darstellt (Abbildung 3), und notieren Sie sich die AP- und medial-lateralen (ML) Koordinaten.
- Unter der Annahme, dass sich die Injektionen auf der linken Seite befinden, generieren Sie Zielkoordinaten, indem Sie 1, 1,5 und 2,0 mm (ML: -1,0, -1,5, -2,0) von den ML-Koordinaten für Bregma subtrahieren.
HINWEIS: Die AP-Position beträgt +0,5 mm von Bregma für alle drei Injektionen. - Bringen Sie die Nadel für die erste Injektion in Position. AP: +0,5, ML: -1,0
- Senken Sie die Nadel auf das exponierte Gehirn, bis sie in den äußeren Kortex eindringt. Notieren Sie sich die Höhe der Nadel und bringen Sie die Nadel in Position, indem Sie 0,6 mm von der Höhe der Gehirnoberfläche abziehen. Injektionstiefe: kortikale Oberfläche -0,6 mm.
HINWEIS: Es ist wichtig, die Tiefe der Oberfläche für jede Injektion zu beachten, da leichte Störungen in der Positionierung der Ratte auftreten können.
6. Injektion von Viren in den somatomotorischen Kortex
- Sobald die Nadel eingesetzt ist, programmieren Sie den Injektor so, dass er 1 μL mit einer Geschwindigkeit von 250 nL/min injiziert.
- Sobald die Injektion abgeschlossen ist, lassen Sie die Nadel 3 Minuten lang im Kortex ruhen.
- Wiederholen Sie die Injektionen für die anderen Koordinaten: insgesamt 3 Injektionen entlang des Kortex in Bezug auf Bregma, alle in einer Tiefe von -0,6 mm: 1) AP: +0,5 mm, ML: -1,0 mm 2) AP: +0,5 mm, ML: -1,5 mm 3) AP: +0,5 mm, ML: -2,0 mm.
- Nach Abschluss der Injektionen wird in Abschnitt 9 zur Naht das Tier auf den anderen Operationstisch für die zervikale Laminektomie gebracht.
7. Schaffung eines Wirbelsäulenfensters für präzise Rückenmarksinjektionen
- Identifizieren Sie die Inzisionsstelle, indem Sie mit den Fingern die Schädelbasis abtasten. Beginnen Sie in der Mittellinie den Schnitt 1-2 mm hinter der Schädelbasis mit einer Klinge # 11 und verlängern Sie den Schnitt 1 cm nach hinten, um den oberflächlichen Muskel freizulegen. Halten Sie die Haut straff, indem Sie mit Daumen und Zeigefinger Spannung ausüben, um einen sauberen Schnitt zu gewährleisten.
- Machen Sie mit der scharfen Spitze der Klinge vorsichtig eine Reihe von Schnitten entlang der Mittellinie des oberflächlichen Muskels, um die Wirbelsäulenhöhle und die tiefe Wirbelsäulenmuskulatur freizulegen. Verwenden Sie eine Pinzette, um den Muskel zu spreizen und das Operationsfenster zu visualisieren.
HINWEIS: Der oberflächliche Muskel erscheint hellrosa, während die tiefe Wirbelsäulenmuskulatur hell weißlich-grau erscheint. - Sobald die tiefe Wirbelsäulenmuskulatur freigelegt wurde, führen Sie Retraktoren in das Operationsfenster ein. Wenn nötig, greifen Sie mit einer Pinzette nach der seitlichen Haut und den Muskeln, um sie um die Zähne der Retraktoren zu dehnen. Ziehen Sie das OP-Fenster auf eine Breite von 7-8 mm zurück, um eine ungehinderte Sicht auf die Wirbelsäule zu ermöglichen.
- Identifizieren Sie den zweiten Halswirbel (C2 oder Achse) anhand seines prominenten Dornfortsatzes, der dorsal hervorragt und in einen großen kuppelförmigen Muskel einkapselt. Verwenden Sie eine Pinzette oder eine stumpfe Sonde, um diesen Prozess zu ertasten und zu identifizieren, da dies der bestimmende Meilenstein sein wird.
HINWEIS: Der benachbarte C3-Wirbel wird oft leicht durch den großen C2-Muskel verdeckt; Daher hilft eine sanfte Präparation des Muskels an C3 mit einer Pinzette oder einem Knochenschaber, den Wirbel zu definieren und die Wirbelzählung zu unterstützen. - Legen Sie mit der flachen Kante eines Knochenschabers die C3-C7-Wirbel frei, indem Sie den tiefen Wirbelsäulenmuskel vorsichtig zu den Seiten abkratzen. Beginnen Sie medial und kratzen Sie seitlich entlang der Richtung parallel zu den Wirbellaminae, um eine ordnungsgemäße Exposition zu gewährleisten, die eine klare Unterscheidung der Wirbellaminae ermöglicht. Kontrollieren Sie Blutungen mit Baumwollspitzen.
- Schneiden Sie mit einer Mikroschere vorsichtig die seitlichen Ränder der knorpeligen Laminae bei C6 und C7 ab. Verwenden Sie C2 als Richtschnur bei der Zählung der Wirbelstufen.
- Entfernen Sie mit einer feinen Pinzette vorsichtig den präparierten Teil der Lamina, um das Rückenmark freizulegen. Stellen Sie sicher, dass das Wirbelsäulenfenster groß genug ist, um die gewünschte Injektionsstelle aufzunehmen. Entfernen Sie alle scharfen oder gezackten Teile des Knochens, die das Rückenmark mit Mikroschere und Pinzette wie oben beschrieben durchstechen können.
- Setzen Sie das Tier wie in Abschnitt 3.6 beschrieben in den stereotaktischen Schädelhalter ein. Legen Sie außerdem ein zusammengerolltes Stück Gaze unter den Rüssel des Tieres, um die Hinterhand anzuheben.
HINWEIS: Durch die Anhebung der Hinterhand des Tieres wird der Thorax effektiv von der Oberfläche des Halters abgehoben, um zu verhindern, dass Atembewegungen die Position der Nadel während der Injektion beeinflussen. - Bevor Sie mit der Injektion beginnen, reinigen Sie das Wirbelsäulenfenster von Blut oder Liquor cerebrospinalis, indem Sie vorsichtig Baumwollspitzen und Sugi-Dreiecke auf den Bereich auftragen, ohne das Rückenmark zu beleidigen. Schaffen Sie außerdem eine Barriere um den Umfang des Fensters, um einen Verschluss der Injektionsstelle durch kontinuierliche Blutungen oder Liquorleckagen zu verhindern. Legen Sie dazu ein kleines Stück resorbierbare Baumwolle in die seitlichen Teile des Wirbelsäulenfensters.
8. Direkte Injektionen in das Rückenmark mit Blick auf Axonendigungen
- Nähern Sie sich mit der Spitze der Glasinjektionsnadel der Mittellinie des Rückenmarks, indem Sie die Spinalarterie identifizieren. Wenn die Arteria spinalis jedoch merklich außermittig ist oder in irgendeiner Weise abweicht, nähern Sie sich der Mittellinie an, indem Sie die Position des C2-Dornfortsatzes verwenden und diese über die Länge der Wirbelsäule extrapolieren.
HINWEIS: Anweisungen zum Laden des Virus finden Sie in Abschnitt 5.1. - Nach der Identifizierung platzieren Sie die Nadel direkt hinter der C5-Lamina an der ungefähren Mittellinie und verwenden Sie diese als Referenzpunkt. Bewegen Sie dann die Nadel mit dem Mikromanipulator seitlich um 0,3 mm nach rechts. Senken Sie die Nadel, bis sie nur noch die Oberfläche des Rückenmarks berührt. Aus dieser Tiefe tauchen Sie die Nadel 0,6 mm in das Rückenmark. Falls erforderlich, tauchen Sie die Nadel weiter ein, bis sie das Rückenmark durchsticht. Ziehen Sie dann die Nadel auf die entsprechende Tiefe zurück oder senken Sie sie.
- Injizieren Sie 1 μL retroAAV2-scCre bei 250 nL/min. Nachdem die Injektion abgeschlossen ist, warten Sie 2 Minuten, bis das Virus in das Rückenmark diffundiert ist, bevor Sie die Nadel langsam zurückziehen. Wiederholen Sie die Injektionen mit den gleichen lateralen und Tiefenkoordinaten an zwei weiteren Stellen innerhalb des Wirbelsäulenfensters, eine am Mittelpunkt und die letzte direkt vor der T1-Lamina.
9. Wundverschluss und Nachsorge
- Nehmen Sie das Tier aus dem stereotaktischen Halter und nehmen Sie die Retraktoren oder Haken heraus. Reinigen Sie den Wundbereich mit ein paar Tropfen steriler normaler Kochsalzlösung.
- Vernähen Sie die Kopfhaut mit 4.0 Seidennaht, insgesamt zwei oder 3 Nähte.
- Wenn Sie die zervikale Öffnung vernähen, verwenden Sie 4.0 chromic gut, um die Muskelschichten wieder fest zu befestigen (2 Nähte sollten ausreichen). Vernähen Sie die zervikale Hautöffnung mit 4,0 Seide (4 Nähte erwartet).
- Sobald das Tier verschlossen ist, legen Sie vorsichtig einen flüssigen Verband über die Nähte.
- Legen Sie das Tier unter eine Heizlampe und beobachten Sie es genau, bis es vollständig wieder erwacht ist. Sobald das Tier wach, bewegt und trocken ist, reinigen Sie die Wunden vorsichtig mit steriler Gaze. Lassen Sie das Tier nicht unbeaufsichtigt, bis es wieder ausreichend Bewusstsein erlangt hat, um die Liegeposition des Brustbeins aufrechtzuerhalten.
- Bringen Sie das Tier mit seiner Mutter in den Hauskäfig zurück. Achten Sie darauf, Vernachlässigung und Kannibalisierung des Säuglings von der Mutter gegenüber den Welpen zu vermeiden:
- Machen Sie die Untersucher mit der Mutter in Erwartung der Operation durch sanfte Handhabung (5-10 min) zweimal täglich, beginnend eine Woche vor der Operation, vertraut.
- Bringen Sie die Welpen zusammen in den Hauskäfig zurück, um Störungen für die Mutter zu begrenzen.
- Injizieren Sie der Mutter am Tag der Operation Acepromazin 1,5 mg/kg alle 12 h subkutan.
HINWEIS: Die Schmerztherapie dient dem doppelten Zweck, den Welpen Analgesie zu bieten und eine frühere Rückkehr zur Aktivität zu fördern, wodurch die Wiedereingliederung in die Mutter gefördert wird. - Injizieren Sie Buprenorphin 0,05 mg/kg subkutan alle 8 h beginnend nach der Operation für insgesamt 3 Tage (postoperative Tage 0, 1, 2).
Ergebnisse
Eine erfolgreiche Injektion und ein erfolgreicher Transport des viralen Vektors sollten zur Transduktion von einseitigen Neuronen im Rückenmark und im motorischen Kortex führen. Abbildung 4 zeigt die Markierung von CST-Neuronen der Schicht V im motorischen Kortex eines koronalen Hirnschnitts, der Cre-abhängige-DREADDs-mCherry exprimiert, die zusammen mit einer kontralateralen Wirbelsäuleninjektion von rCre injiziert wurden. Die Schnitte wurden mit dsRed-Antikörpern gefärbt.
Diskussion
Die induzierbare genetische Modulation der Gehirnaktivität mit injizierbaren chemogenetischen Modifikatoren ist ein leistungsfähiges Werkzeug bei der Untersuchung der verschiedenen Mechanismen, die der Genesung von Rückenmarksverletzungen zugrunde liegen. Die Genauigkeit des Targetings für die induzierbaren G-Protein-gekoppelten Rezeptoren (DREADDs) wird weiter erhöht, wenn man bedenkt, dass die Fluoreszenzverfolgung die anatomische Präzision in der Histologie validiert. Dieser Artikel diskutiert eine zuverlässige...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch ein Stipendium der Shriners Hospitals for Children SHC-84706 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| #11 scalpel blades | Roboz | RS-9801-11 | For use with the scalpel. |
| #10 Scalpel Blades | Roboz | RS-9801-10 | For use with the scalpel. |
| 1 mL Syringes | Becton, Dickinson and Company | 309659 | For anesthetic SC injection and fluid bolus |
| 4.0 silk suture | Ethicon | 771-683G | For skin closure |
| 4.0 Chromic Catgut Suture | DemeTECH | NN374-16 | To re-bind muscle during closing. |
| 48000 Micropipette Beveler | World Precision Instruments | 32416 | Used to bevel the tips of the pulled glass capillary tubes to form functional glass needles. |
| 5% Iodine Solution | Purdue Products L.P. | L01020-08 | For use in sterilzation of the surgical site. |
| 70% Ethanol | N/A | N/A | For sterilization of newly prepared glass needles, animal models during surgical preparation |
| Ketamine (Ketaset) | Zoetis | 240048 | For keeping the animal in the correct plane of consciousness during surgery. |
| Bead Sterilizer | CellPoint | 5-1450 | To heat sterilize surgical instruments. |
| Digital Scale | Okaus | REV.005 | For weighing the animal during surgical preparation. |
| Flexible Needle Attachment | World Precision Instruments | MF34G-5 | For cleaning glass needles and loading red oil into glass needles. |
| Glass Capillary Tubes | World Precision Instruments | 4878 | For pulled glass needles - should be designed for nanoliter injectors. |
| Hemostats | Roboz | RS-7231 | For general use in surgery. |
| Medium Point Curved Forceps | Roboz | RS-5136 | For general use in surgery. |
| Micromanipulator with a Vernier Scale | Kanetec | N/A | For precise targeting during surgery. |
| Microscissors | Roboz | RS-5621 | For cutting glass whisps off of freshly pulled glass capillary tubes. |
| Lab Standard Stereotaxic Instrument | Stoelting | 51600 | To hold the neonatal sterotaxic holder in place |
| Lab Standard with Mouse & Neonates Adaptor | 51615 | For neonatal skull fixation during cranial surgery and spinal injections | |
| Microscope with Light and Vernier Scale Ocular | Leitz Wetzlar | N/A | Used to visualize and measure beveling of pulled glass capillary tubes into functional glass needles. |
| MicroSyringe Pump Controller | World Precision Instruments | 62403 | To control the rate of injection. |
| Nanoliter 2000 Pump Head Injector | World Precision Instruments | 500150 | To load and inject virus in a controlled fashion. |
| Needle Puller | Narishige | PC-100 | To heat and pull apart glass capillary tubes to form glass needles. |
| pAAV-CMV-scCre | Wu lab | Cre plasmid | |
| pAAV-hSyn-DIO-hM3Dq-mCherry (plasmid #44361) | Bryan Roth’s lab through Addgene | DREADD plasmid | |
| Parafilm | Bemis | PM-996 | To assist with loading virus into the nanoinjector. |
| PrecisionGlide Needles (25G x 5/8) | Becton, Dickinson and Company | 305122 | For use with the 1mL and 10 mL syringes to allow injection of the animal model. |
| Rat Tooth Forceps | Roboz | RS-5152 | For griping spinous processes. |
| Red Oil | N/A | N/A | To provide a front for visualization of virus entering tissue during injection. |
| Retractors | Roboz | RS-6510 | To hold open the surgical wound. |
| Rongeurs | Roboz | RS-8300 | To remove muscle from the spinal column during surgery. |
| Scalpel Blade Handle | Roboz | RS-9843 | To slice open skin and fat pad of animal model during surgery. |
| Scissors | Roboz | RS-5980 | For general use in surgery. |
| Staple Removing Forceps | Kent Scientific | INS750347 | To remove the staples, should they be applied incorrectly. |
| Sterile Cloth | Phenix Research Products | BP-989 | To provide a sterile surface for the operation. |
| Sterile Cotton-Tipped Applicators | Puritan | 806-WC | To soak up blood in the surgical wound while maintaining sterility. |
| Sterile Gauze | Covidien | 2146 | To clean the surgical area and surgical tools while maintaining sterility. |
| Sterile Saline | Baxter Healthcare Corporation | 281324 | For use in blood clearing, and for replacing fluids post-surgery. |
| Surgical Gloves | N/A | N/A | For use by the surgeon to maintain sterile field during surgery. |
| Surgical Heating Pad | N/A | N/A | For maintaining the body temperature of the animal model during surgery. |
| Surgical Microscope | N/A | N/A | For enhanced visualization of the surgical wound. |
| Surgical Stapler | Kent Scientific | INS750546 | To apply the staples. |
| Water Convection Warming Pad | Baxter Healthcare Corporation | L1K018 | For use in the post-operational recovery area to maintain the body temperature of the unconscious animal. |
| Weighted Hooks | N/A | N/A | To hold open the surgical wound. |
| Liquid bandage | NewSkin | 985838 | To apply along sutures following surgery and encourage wound healing |
| Wire Cage Lamp | ZooMed | LF10EC | To help animals recover from anesthesia and retain warm body temperature naturally |
Referenzen
- Parent, S., Mac-Thiong, J., Roy-Beaudry, M., Sosa, J. F., Labelle, H. Spinal cord injury in the pediatric population: A systematic review of the literature. Journal of Neurotrauma. 28 (8), 1515-1524 (2011).
- Vitale, M. G., Goss, J. M., Matsumoto, H., Roye, D. P. Epidemiology of pediatric spinal cord injury in the united states: Years 1997 and 2000. Journal of Pediatric Orthopedics. 26 (6), 745-749 (2006).
- Bregman, B. S., Goldberger, M. E. Anatomical plasticity and sparing of function after spinal cord damage in neonatal cats. Science. 217 (4559), 553-555 (1982).
- Castro, A. J. Ipsilateral corticospinal projections after large lesions of the cerebral hemisphere in neonatal rats. Experimental Neurology. 46 (1), 1-8 (1975).
- Commissiong, J. W., Toffano, G. Complete spinal cord transection at different postnatal ages: Recovery of motor coordination correlated with spinal cord catecholamines. Experimental Brain Research. 78 (3), 597-603 (1989).
- Yuan, Q., Su, H., Chiu, K., Wu, W., Lin, Z. Contrasting neuropathology and functional recovery after spinal cord injury in developing and adult rats. Neuroscience Bulletin. 29 (4), 509-516 (2013).
- Kim, J., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualizing and manipulating neuronal circuits in vivo. The European Journal of Neuroscience. 37 (8), 1203-1220 (2013).
- Pawliuk, R., et al. Correction of sickle cell disease in transgenic mouse models by gene therapy. Science. 294 (5550), 2368-2371 (2001).
- Atasoy, D., Sternson, S. M. Chemogenetic tools for causal cellular and neuronal biology. Physiological Reviews. 98 (1), 391-418 (2018).
- Brandt, H. M., Apkarian, A. V. Biotin-dextran: A sensitive anterograde tracer for neuroanatomic studies in rat and monkey. Journal of Neuroscience Methods. 45 (1-2), 35-40 (1992).
- Veenman, C. L., Reiner, A., Honig, M. G. Biotinylated dextran amine as an anterograde tracer for single- and double-labeling studies. Journal of Neuroscience Methods. 41 (3), 239-254 (1992).
- Reiner, A., et al. Pathway tracing using biotinylated dextran amines. Journal of Neuroscience Methods. 103 (1), 23-37 (2000).
- Oguchi, M., et al. Double virus vector infection to the prefrontal network of the macaque brain. PloS One. 10 (7), 0132825 (2015).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487 (7406), 235-238 (2012).
- Bernstein, D. R., Stelzner, D. J. Plasticity of the corticospinal tract following midthoracic spinal injury in the postnatal rat. The Journal of Comparative Neurology. 221 (4), 382-400 (1983).
- Brown, K., Wolfe, B., Wrathall, J. Rapid functional recovery after spinal cord injury in young rats. Journal of Neurotrauma. 22, 559-574 (2005).
- Tillakaratne, N. J. K., et al. Functional recovery of stepping in rats after a complete neonatal spinal cord transection is not due to regrowth across the lesion site. Neuroscience. 166 (1), 23-33 (2010).
- Kartje-Tillotson, G., Neafsey, E. J., Castro, A. J. Electrophysiological analysis of motor cortical plasticity after cortical lesions in newborn rats. Brain Research. 332 (1), 103-111 (1985).
- Gennaro, M., et al. Focal stroke in the developing rat motor cortex induces age- and experience-dependent maladaptive plasticity of corticospinal system. Frontiers in Neural Circuits. 11, 47 (2017).
- Brichta, A. M., Grant, G., Paxinos, G. Cytoarchitectural organization of the spinal cord. The rat nervous system. 2, 294-309 (1985).
- Kjell, J., Olson, L. Rat models of spinal cord injury: From pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Takeoka, A., Arber, S. Functional local proprioceptive feedback circuits initiate and maintain locomotor recovery after spinal cord injury. Cell Reports. 27 (1), 71-85 (2019).
- Flynn, J. R., Graham, B. A., Galea, M. P., Callister, R. J. The role of propriospinal interneurons in recovery from spinal cord injury. Neuropharmacology. 60 (5), 809-822 (2011).
- Ohne, H., et al. Mechanism of forelimb motor function restoration in rats with cervical spinal cord hemisection-neuroanatomical validation. IBRO Reports. 7, 10-25 (2019).
- Wang, X., et al. Deconstruction of corticospinal circuits for goal-directed motor skills. Cell. 171 (2), 440-455 (2017).
- Sheikh, I. S., et al. Retrogradely transportable lentivirus tracers for mapping spinal cord locomotor circuits. Frontiers in Neural Circuits. 12, 60 (2018).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487, 235-238 (2012).
- Keefe, K. M., Junker, I. P., Sheikh, I. S., Campion, T. J., Smith, G. M. Direct injection of a lentiviral vector highlights multiple motor pathways in the rat spinal cord. Journal of Visualized Experiments: JoVE. (145), e59160 (2019).
- Hutson, T. H., Verhaagen, J., Yáñez-Muñoz, R. J., Moon, L. D. F. Corticospinal tract transduction: A comparison of seven adeno-associated viral vector serotypes and a non-integrating lentiviral vector. Gene Therapy. 19 (1), 49-60 (2012).
- Liu, Y., Keefe, K., Tang, X., Lin, S., Smith, G. M. Use of self-complementary adeno-associated virus serotype 2 as a tracer for labeling axons: Implications for axon regeneration. Plos One. 9 (2), 87447 (2014).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Abdellatif, A. A., et al. delivery to the spinal cord: Comparison between lentiviral, adenoviral, and retroviral vector delivery systems. Journal of Neuroscience Research. 84 (3), 553-567 (2006).
- Zingg, B., Peng, B., Huang, J., Tao, H. W., Zhang, L. I. Synaptic specificity and application of anterograde transsynaptic AAV for probing neural circuitry. The Journal of Neuroscience. 40 (16), 3250-3267 (2020).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences of the United States of America. 104 (12), 5163-5168 (2007).
- Roth, B. L. DREADDs for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Hasegawa, A., et al. Mechanism of forelimb motor function restoration after cervical spinal cord hemisection in rats: A comparison of juveniles and adults. Behavioural Neurology. 2016, 1035473 (2016).
- Alstermark, B., Isa, T. Circuits for skilled reaching and grasping. Annual Review of Neuroscience. 35, 559-578 (2012).
- García-Alías, G., Truong, K., Shah, P. K., Roy, R. R., Edgerton, V. R. Plasticity of subcortical pathways promote recovery of skilled hand function in rats after corticospinal and rubrospinal tract injuries. Experimental Neurology. 266, 112-119 (2015).
- Tohyama, T., et al. Contribution of propriospinal neurons to recovery of hand dexterity after corticospinal tract lesions in monkeys. Proceedings of the National Academy of Sciences of the United States of America. 114 (3), 604-609 (2017).
- Z'Graggen, W. J., et al. Compensatory sprouting and impulse rerouting after unilateral pyramidal tract lesion. Journal of Neuroscience. 20 (17), 6561-6569 (2000).
- Ueno, M., et al. Corticospinal circuits from the sensory and motor cortices differentially regulate skilled movements through distinct spinal interneurons. Cell Reports. 23 (5), 1286-1300 (2018).
- Kim, J., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. Journal of Visualized Experiments: JoVE. (91), e51863 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten