A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
התמקדות במערכת הקורטיקוספינלית בחולדות ילודים עם וקטור דו-ויראלי באמצעות ניתוח משולב של המוח ועמוד השדרה
In This Article
Summary
פרוטוקול זה מדגים שיטה חדשנית ליישום טיפולים גנטיים על תת-אוכלוסיות של תאים בחולדות ילודים בגילאים שלאחר הלידה 5-10 ימים על ידי הזרקת משנה כימוגנטית אנטרוגרדית לקליפת המוח הסומטומוטורית ורקומבינאז Cre הניתן להובלה רטרוגרדית לחוט השדרה הצווארי.
Abstract
התמודדות מוצלחת עם המכשולים המגבילים את המחקר על חולדות יילודים חשובה לחקר ההבדלים בתוצאות שנראו בפגיעות בחוט השדרה בילדים (SCIs) בהשוואה ל-SCIs של מבוגרים. בנוסף, החדרה אמינה של טיפולים לתאי המטרה של מערכת העצבים המרכזית (CNS) יכולה להיות מאתגרת, ואי דיוקים יכולים לפגוע ביעילות המחקר או הטיפול. פרוטוקול זה משלב טכנולוגיה וקטורית ויראלית עם טכניקה כירורגית חדשנית כדי להחדיר במדויק טיפולים גנטיים לחולדות ילודים ביום 5 שלאחר הלידה. כאן, וירוס שהונדס להובלה רטרוגרדית (retroAAV2) של Cre מוצג במסופי האקסון של נוירונים קורטיקוספינליים בחוט השדרה, שם הוא מועבר לאחר מכן לגופי התא. קולטן מעצבים בעל אוריינטציה הפוכה כפולה (DIO) המופעל באופן בלעדי על ידי נגיף תרופת המעצבים (DREADD) מוזרק לאחר מכן לקליפת המוח הסומטומוטורית של המוח. טכניקת זיהום כפול זו מקדמת את הביטוי של ה- DREADDs רק בתאי העצב של מערכת הקורטיקוספינל (CST) הנגועים במשותף. לפיכך, הזרקה משותפת סימולטנית של קליפת המוח הסומטומוטורית ומסופי CST צוואריים היא שיטה תקפה לחקר המודולציה הכימוגנית של ההחלמה בעקבות מודלים של SCI צווארי בחולדות ילודים.
Introduction
אמנם מד"ב הוא תופעה נדירה יחסית באוכלוסיית הילדים, אך הוא טראומטי במיוחד וגורם לנכות קבועה הדורשת ראיית הנולד לוגיסטית עצומה. יתר על כן, שיעור גבוה יותר של SCIs ילדים מסווג צוואר הרחם ושלם בהשוואה לאוכלוסייה הבוגרת 1,2. סימן היכר של מיני יונקים הוא שיילודים מחלימים טוב יותר ממד"ב מאשר מבוגרים, וזה מציע הזדמנות להעריך את מנגנוני ההתאוששות באוכלוסיות צעירותיותר 3,4,5. למרות זאת, ישנם פחות מחקרים רב-מודאליים המתמודדים עם מחקר מכרסמים של ילודים ותינוקות, בין היתר בשל הקושי הנוסף למקד במדויק אוכלוסיות נבחרות של נוירונים בציוני הדרך האנטומיים ההדוקים בהרבה של בעלי חיים צעירים6. מאמר זה מתמקד בהזרקה ישירה של וקטורים אנטרוגרדיים ומדרדרים הקשורים לאדנו יעילים ביותר לתוך חוט השדרה של החולדות כדי לווסת מסלולים מוטוריים עיקריים עם יישום של Cre-dependent-DREADDs, ומרחיב את טווח ההגעה של מחקרי התחדשות רב-מודאליים.
וקטורים נגיפיים הם כלים ביולוגיים חשובים עם מגוון רחב של יישומים, כולל הכנסת חומר גנטי כתחליף לגני מטרה, לווסת חלבוני גדילה ולהתחקות אחר הנוף האנטומי של מערכת העצבים המרכזית 7,8,9. רבים מהפרטים האנטומיים של מסלולים מוטוריים בעמוד השדרה נחקרו באמצעות עוקבים קלאסיים, כלומר, דקסטרן אמין ביוטינילציה. בעוד שעוקבים מסורתיים סייעו בחשיפת נוירואנטומיה, הם אינם נטולי חסרונות: הם מתייגים מסלולים ללא הבחנה גם אם הם מוזרקים כהלכה, ומחקרים מצאו כי הם נלקחים על ידי אקסונים פגומים10,11,12. כתוצאה מכך, הדבר עלול להוביל לפרשנויות שגויות במחקרי התחדשות שבהם אקסונים מנותקים עלולים לטעות בחידוש סיבים.
השיטה הבאה משתמשת במערכת הווקטורים הדו-ויראליים שזכתה לפופולריות לאחרונה במחקרי אפנון, עם שני וקטורים נגיפיים שונים בשני אזורים נפרדים של אותו נוירון13,14. הראשון הוא וקטור שמדביק באופן מקומי את גופי התאים של נוירוני ההקרנה. השני הוא וקטור מדרדר שמועבר מקצות האקסון של נוירוני ההקרנה (איור 1). הווקטור המדרדר נושא את Cre recombinase, והווקטור המקומי משלב את הרצף הכפול "Cre-On" שבו מקודד חלבון פלואורסצנטי (mCherry). הטרנסג'ן המקומי שמבטא גם את ה-hM3Dq וגם את ה-mCherry הוא הפוך יחסית למקדם ומוקף בשני אתרי LoxP (איור 2). לפיכך, mCherry מתבטא רק בנוירוני ההקרנה המותמרים כפליים שבהם Cre recombinase משרה אירוע רקומבינציה בין אתרי LoxP, הופך את האוריינטציה של הטרנסגן למסגרת הקריאה המתאימה ומאפשר ביטוי הן של ה-DREADD והן של החלבון הפלואורסצנטי. ברגע שהטרנסגן הנגיפי נמצא בכיוון הנכון, וכאשר הדבר ישים, ה-DREADDs יכולים לגרום באופן ארעי לנוירומודולציה באמצעות ליגנד מוזרק בנפרד, כלומר קלוזאפין-N-אוקסיד. הפרוטוקול נועד לאמת מחקר נוירומודולציה אינדוקטיבי בילודים, שבו DREADDS מוזרקים כדי לווסת את ה- CSTs באופן סלקטיבי. המערכת הדו-ויראלית פועלת כפוליסת ביטוח, ומבטיחה שכל תא חיובי ל-DREADD ניתן למעקב תחת פלואורסצנטיות בנאמנות גבוהה כדי לאמת את הזריקות.
שיטה זו מסייעת גם לגשר על הפער בחקר היילודים. מד"ב ילדים מציב את האתגרים שלו, ומחקרים המנתחים התחדשות, הנבטה או פלסטיות צריכים להדגיש את ההבדלים בין ילודים למבוגרים 3,15,16,17. על ידי אופטימיזציה של ההליך הכירורגי וביצוע מחקרים אנטומיים קודמים עם צביעת ניסל, אומתו הקואורדינטות הן של זריקות הגולגולת והן של עמוד השדרה. המטרה הייתה לספק שיטה להזרקות כפולות לתוך חולדה ילודים עם נאמנות ושרידות מוגברות.
עבור המודל הנוכחי, וקטור האנטרוגרד הוזרק לתוך גופי התאים של קליפת המוח הסומטומוטורית באמצעות ברגמה כהפניה18,19. מבחינת זריקות עמוד השדרה, הווקטור המדרדר הוזרק ל-laminae V-VII, שם שוכנים20,21 מסופי האקסון CST. ישנן שאלות בסיסיות רבות העומדות בבסיס האופן שבו מודלים מסוימים של נגעים משפיעים על בעלי חיים צעירים באופן שונה, וכיצד ההחלמה שלאחר מכן מתפצלת מבעל חיים מבוגר יותר. מחקר זה מדגים אמצעי איתן לחקר פגיעות צוואר הרחם ויכולת ההשבה של תפקוד הרחם במכרסמים ילודים. לעומת זאת, רוב המחקרים הקודמים התייחסו לתנועת ההחלמה בעקבות פגיעות במותניים או בבית החזה 5,22,23,24. על ידי התאמת הווקטור הנגיפי הכפול עם טכניקת ההזרקה החדשנית המתוארת כאן, פרוטוקול זה מסייע למתן בעיות מסוימות (כלומר, שרידות) שעלולות לפגוע בחקירות מכרסמים ילודים. שיטה זו היא חזקה, מעשית ורב-תכליתית: שינויים קלים בטכניקה יאפשרו מיקוד במסלולים שונים, כלומר CST גחוני, CST גב והמסלולים הגביים העולים.
עבור מערכת זו, וירוס אחד הפועל באופן מקומי (למשל, AAV2) מוזרק באזור של גופי התאים העצביים המעניינים. נגיף שני המועבר בנסיגה ושולט בביטוי הנגיף המקומי מוזרק במסופי האקסון עבור אותה אוכלוסייה עצבית. לכן, מעצם הגדרתם, רק נוירונים קורטיקוספינליים מסומנים. נגיף ה-retroAAV-Cre נבחר עם מקדם CMV פעיל באופן מכונן, שכן פלסמיד המעבורת משמש ליצירת מספר סרוטיפים של AAV לביטוי תלוי Cre במספר סוגי תאים. עבור זריקות קליפת המוח, AAV2 נבחר עם הטרנסגן המונע על ידי מקדם סינפסין-1 כדי להגביל כל ביטוי לנוירונים. מכיוון שהמערכת הדו-ויראלית מסתמכת יותר על המקור והסיום של האוכלוסייה העצבית המעניינת, ניתן להשתמש במספר מקדמים שונים, אם הם יכולים להניע את הביטוי של הגנים המעניינים בתוך האוכלוסייה העצבית המעניינת. לדוגמה, מקדם העצבים המעורר, CamKII, יכול להיות מוחלף בסינפסין-1. בנוסף לשימוש בסרוטיפים אלה של AAV, הובלה מדרדרת לתוך לא בשלה, ובמידה פחותה בהרבה, נוירונים מוטוריים קורטיקוספינליים בוגרים יכולים להיות מושגים גם באמצעות lentivirus גבוה retrograde הובלה (HiRet)25. HiRet lentiviruses משתמשים בגליקופרוטאין כימרי של כלבת/VSV כדי למקד את הקליטה בסינפסה להובלה מדרדרת. בשילוב עם מקדם Tet-On, מערכת 2-ויראלית זו תומכת בביטוי אינדוקטיבי באופן תלוי רטרוגרד26,27.
וירוסים מדרדרים מכניסים וקטורים לחלל הסינפטי של נוירון מטרה, ומאפשרים לו להיקלט על ידי האקסון של התא ולהעביר אותו לגוף התא. בעוד שווקטורים לנטי-ויראליים זכו בעבר להצלחה אדירה, וסיפקו ביטוי ארוך טווח במחקרי ריפוי גנטי, שיטה זו פנתה לכיוון וקטורים נגיפיים הקשורים לאדנו מכמה סיבות פשוטות26,28: AAV חסכוני יותר, יעיל באופן דומה, ומהווה פחות נטל לוגיסטי, בהתחשב בכך שיש לו רמת בטיחות ביולוגית נמוכה יותר29,30,31,32 . בעוד ש-AAV2, הסרוטיפ הנפוץ ביותר, מדגים טרנספקציה חזקה של אקסונים של CST, חוקרים עתידיים עשויים לציין כי AAV1 מציע רב-תכליתיות מסוימת מכיוון שהוא מתייג באופן טרנסינטי, ובכך מציג מספר איטרציות אפשריות במחקרים עתידיים33. ההסתגלות הסופית היא לקודד את הנגיף המדרדר עם Cre-recombinase כך שניתן יהיה להכניס מספר וקטורים אנטרוגרדיים בו זמנית, ובכך להפחית פסולת וירוסים פנימית מיותרת ולמקסם את הסבירות שה- DREADDs יתבטאו בכיוון הנכון.
בסופו של דבר, פרוטוקול זה מדגים הזרקה סימולטנית לתוך קליפת המוח ועמוד השדרה הצווארי, המכוונת במיוחד לגופי התאים ולקצות האקסון של מערכת הקורטיקוצפינל, בהתאמה. העברה בנאמנות גבוהה נראית בקליפת המוח ובחוט השדרה. בעוד שהפרוטוקול המתואר שוכלל עבור חולדות ספראג דאולי בנות 5 ימים, הוא מתאים לימים שלאחר הלידה 4-10 עם התאמות קלות להרדמה וקואורדינטות סטריאוטקטיות.
Protocol
כל ההליכים הכירורגיים והטיפול בבעלי חיים הבאים אושרו על ידי ועדת הטיפול והשימוש בבעלי חיים של אוניברסיטת טמפל. הפרוטוקול המתואר הוא ניתוח הישרדותי, ובעלי החיים הומתו בסופו של דבר על ידי הזרקה תוך-צפקית של 100 מ"ג/ק"ג נתרן פנטוברביטל בסיום נקודות הזמן שלהם.
1. הכנה טרום ניתוחית
- הכן לפחות שתי מחטי זכוכית משוכות להזרקה ויראלית באמצעות פיפטות נימי זכוכית 3.5 nL; מחט אחת עבור DREADD ומחט אחת עבור rCre. כאמצעי זהירות, הכינו 4-5 מחטים למקרה שהן נשברות תוך ניתוחיות.
- באמצעות microscissors, לחתוך 1-2 מ"מ של זכוכית עודפת מן המחט.
- עבור כל מחט, מקם אותה ב-30°, השתמש במשופע מיקרופיפטה כדי ליצור קצה עם מפתח צמצם של 30-40 מיקרומטר וזווית משופעת של 45°.
- אחסנו את המחטים בצלחת פטרי מכוסה ולאחר מכן עקרו אותן על ידי הנחת צלחת הפטרי במכסה בטיחות ביולוגית תחת אור UV למשך 15 דקות.
- הכן את הווירוסים הדרושים על ידי הסרת נפח מתאים מהמקפיא -80 מעלות צלזיוס לפני ההליך, תוך התחשבות בכך שכל בעל חיים ידרוש 3 μL של כל וירוס.
הערה: יש להעביר ולאחסן את הנגיף על קרח כאשר אינו בשימוש. פרוטוקול זה פותח באמצעות AAV2-hM3Dq-mCherry ו-AAV2-retroCre כדי להזריק 3 μL מכל נגיף לכל חיה. פלסמיד DREADD, pAAV-hSyn-DIO-hM3Dq-mCherry (ראו טבלת חומרים), שימש לייצור AAV2 אנטרוגרד עם טיטר נגיפי של 1.54 × 1012 עותקי גנום (GC)/mL. פלסמיד Cre, pAAV-CMV-scCre, שימש לייצור AAV2 בנסיגה עם טיטר ויראלי של 4.27 × 1012 GC/mL. - חבר את המזרק לתוך micropump ומניחים אותו micromanipulator עם סולם Vernier.
- כדי לעזור לאשר באופן חזותי את נוכחותו או היעדרו של וירוס במחט, טען צבע צבעוני, כלומר שמן אדום, לתוך המחט. הימנע בועות במחט.
- הכנס את מחט הזכוכית לתוך המזרק, להבטיח כי המחט מתאימה כראוי.
- אם זמין, חזור על כל התהליך עם משאבת הזרקה נפרדת עבור כל וירוס. אם יש רק משאבת הזרקה אחת זמינה, הכינו שתי מחטים נפרדות והחליפו את המחט המשומשת כאשר הגיע הזמן להחליף את הווירוסים.
2. הרדמה והכנת אתר כירורגי
- שקלו את החיה בקנה מידה דיגיטלי. רשום את המשקל לפני הניתוח כדי לקבוע את נפח חומר ההרדמה הנדרש.
הערה: פרוטוקול זה מצא כי טכניקת ההרדמה האמינה ביותר כדי להבטיח מישור הרדמה משביע רצון לאורך כל זמן הניתוח היא שילוב של קטמין והיפותרמיה. קטמין אינו מספיק כדי להבטיח הרדמה בפני עצמה, ולתוספת שלו עם קסילזין יש סף צר לפני הגדלת התמותה התוך-ניתוחית. היפותרמיה כשלעצמה אינה מספיקה לניתוחים ממושכים (ניתוחי עמוד שדרה כפול ומוח דורשים ככל הנראה >שעה של הרדמה יציבה). - הרדמת הגור על ידי הזרקת קטמין מדולל (10 מ"ג/מ"ל) תת עורית בין השכמות, כך שהחיה מקבלת מנה של 100 מ"ג/ק"ג קטמין; המתן 5 דקות.
הערה: לדוגמה, ביום 5 שלאחר הלידה, גור חולדות שוקל 10 גרם ומקבל 0.1 מ"ל מתמיסת הקטמין המדוללת (10 מ"ג/מ"ל). - מניחים את הגור על קרח כתוש למשך 6-8 דקות. הגן עליו מפני כוויות קור על ידי הצבת החיה בכפפת לטקס או פרפילם כדי למנוע מגע ישיר עם קרח.
- צבוט את כף הרגל בחוזקה באמצעות מלקחיים כדי לאשר מישור הרדמה מתאים. אם מתרחשת נסיגה רפלקסיבית, השאירו למשך 2 דקות נוספות על הקרח לפני שתמשיכו.
- יש למרוח חומר חיטוי נרחב על אזור הראש והגב של בעל החיים באמצעות גזה סטרילית ספוגה בתמיסת 5% יוד. לאחר מכן, לעקר עם גזה ספוג 70% אתנול. החל את מגבונים חיטוי שלוש פעמים כל אחד, לסירוגין בין יוד אתנול כדי לספוג את גזה.
הערה: אין צורך בטיפול עיניים מכיוון שגורים צעירים פוקחים את עיניהם רק בגיל 14 יום. - אם בעל חיים עומד לעבור ניתוח כפול (מוח + עמוד שדרה), יש לספק בולוס מלח רגיל לפני הניתוח (0.02 מ"ל/גרם) תת עורית בין השכמות.
הערה: אם בעל החיים מגיב במהלך הניתוח ונדרשת הרדמה נוספת, החלף את החיה על קרח למשך 5 דקות.
3. שדה כירורגי והכנת מכשירים
- אוטוקלאב את כלי הניתוח הכוללים מחזיק אזמל, רונגרים, המוסטאטים, מלקחיים מעוקלים בנקודה בינונית ומחזירים
- הכינו את המיקרוסקופ והתקינו את המתאם הסטריאוטקסי של החולדה הפגושה כדי למקם אותו היטב בתוך המחזיק הסטריאוטקסי הבוגר.
- בצע את הניתוח באמצעות כפפות מעוקרות. פתחו חבילה של כפפות כירורגיות סטריליות ארוזות מראש והניחו את עטיפת הכפפות הסטריליות על השולחן, תוך שימוש בעטיפה כאזור נוסף להנחת כלים משומשים.
הערה: חשוב לעקוב אחר פרקטיקה כירורגית טובה ולשמור על סטריליות לאורך כל ההליך. - אבטחו להב 11 במחזיק האזמל. מקם תפר מלח סטרילי, תפר קטגוט כרומי 4.0, תפר משי 4.0 וחומרים לשליטה בדימום, למשל, גזה סטרילית, אפליקטורים סטריליים עם קצוות כותנה ומשולשים.
- הגדר שני שדות כירורגיים כמתואר לעיל, כאשר אתר אחד מוקצה לכריתת גולגולת והאתר השני מוקצה לכריתת רחם צווארית.
- שלוף את החיה ואבטח אותה במתאם הסטריאוטקסי: מכיוון שהיילודים הם מאוד סחוסיים, תקן אותם בעדינות על ידי הפניית מוטות האוזניים באופן רחב לכיוון המפרקים המנדיבולריים. לאחר התייצבות אופקית, הציגו בעדינות את הפייה הקדמית.
הערה: כלל לא מחייב המשמש למתן אזור כירורגי "שטוח" הוא לקבע את מוטות האוזניים באותו גובה ואת השופר בערך 2-3 רמות נמוך יותר.
4. ביצוע craniotomy וחשיפת קליפת המוח הסומטומוטורית
- זהה את האזור בו יבוצע החתך על ידי לחיצה על המלקחיים בקו האמצע בחלק העליון של הקרקפת, תחושה לתפר הסגיטלי. בצע חתך של 1 ס"מ לאורך מישור התפר הסגיטלי, החל מיד מעל קו העין. החזיקו את העור מתוח כדי להבטיח חתך נקי, ישר ומדויק.
- זהה ברגמה (ההתכנסות של התפרים הכתריים והסגיטליים) על ידי בדיקה עדינה של המלקחיים לאורך פני הגולגולת ותשומת לב רבה לקווי התפר, כמו גם לכל כניסה הנגרמת על ידי המלקחיים העוברים לאורך העצמות הקודקודיות והמצחיות.
- שמור על הפתח עם יישום של ווים משוקללים בצד העניין. שים לב כי הזרקת עמוד השדרה נעשית בצד ימין, הזרקת הגולגולת היא בצד שמאל.
- נקה את האפונורוזיס עם שילוב של קצות הכותנה והמיקרו-סקיסורים כדי למקסם את החשיפה של ברגמה לדיוק מוגבר. ודא שהתפר הכתר נמצא בראייה ברורה מספיק לרוחב כדי לספק תבנית גסה להזרקות הבאות.
- באמצעות המיקרו-מספריים, חותכים כ-3X2 מ"מ מקטע של עצם הגולגולת הקדמית השמאלית הסמוכה לברגמה.
הערה: לאחר הסרת דש העצם בזהירות, צריך להיות חלון שקוף עם חומר מוחי חשוף מוכן להזרקה. קווי התפר הנותרים בצד הנגדי של המוח ישמשו כמדריך חזותי לשמירה על דיוק לאורך הציר הקדמי-אחורי (AP). - נקה כל פסולת, נוזל מוחי (CSF) ודם עם קצוות כותנה.
הערה: זה נורמלי עבור דם או CSF כדי לטשטש מעט את קו הראייה, ולכן מומלץ לנקות את האזור עם טיפים כותנה באופן קבוע.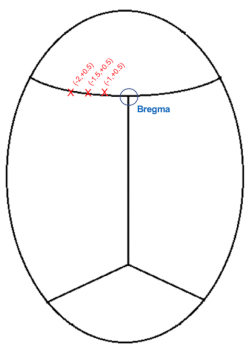
איור 3: המחשה סכמטית של קואורדינטות הזרקת הגולגולת (מ"מ) ביחס לברגמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
5. טעינת הנגיף ומיקום המזרק
- טען את הנגיף לתוך המזרק על ידי pipetting ~ 5 μL על חתיכת parafilm, ולמקם את המחט כך קצה נח על גבי טיפה של הנגיף.
- ודא כי וירוס נוסף נטען לתוך המזרק כדי להבטיח הזרקה חלקה. לדוגמה, כאשר מזריקים סך של 3 μL (1 μL עבור כל אתר הזרקה), למשוך 4 μL של הנגיף בקצב של 250 nL/s באמצעות micropump.
- הסר את הנגיף העודף עם מגבון מעבדה.
- מקם את המיקרומניפולטור כך שסולם ורנייה יהיה גלוי, ומקם את המחט מעל התפר הסגיטלי.
- הנמיכו את המחט בדיוק מעל האזור המייצג ברגמה (איור 3), ורשמו למטה את קואורדינטות AP וקואורדינטות מדיאלי-לרוחב (ML).
- בהתחשב בכך שהזריקות יהיו בצד שמאל, צור קואורדינטות מטרה על ידי חיסור 1, 1.5 ו- 2.0 מ"מ (ML: -1.0, -1.5, -2.0) מקואורדינטות ML עבור ברגמה.
הערה: מיקום AP יהיה +0.5 מ"מ מברגמה עבור כל שלוש הזריקות. - הזיזו את המחט למקומה לקראת ההזרקה הראשונה. נקודת גישה: +0.5, ML: -1.0
- הורידו את המחט למוח החשוף עד שהיא מכניסה את קליפת המוח החיצונית. שימו לב לגובה המחט והורידו את המחט למקומה על ידי חיסור של 0.6 מ"מ מגובה פני השטח של המוח. עומק ההזרקה: משטח קליפת המוח -0.6 מ"מ.
הערה: חשוב לציין את עומק המשטח עבור כל הזרקה, שכן ייתכנו שיבושים קלים במיקום החולדה.
6. הזרקת וירוס לקליפת המוח הסומטומוטורית
- לאחר שהמחט נמצאת במקומה, יש לתכנת את המזרק להזריק 1 μL בקצב של 250 nL/min.
- לאחר השלמת ההזרקה, אפשרו למחט לנוח בקליפת המוח למשך 3 דקות.
- חזור על הזריקות עבור הקואורדינטות האחרות: סך של 3 זריקות לאורך קליפת המוח ביחס לברגמה, כולן בעומק של -0.6 מ"מ: 1) AP: +0.5 מ"מ, ML: -1.0 מ"מ 2) AP: +0.5 מ"מ, ML: -1.5 מ"מ 3) AP: +0.5 מ"מ, ML: -2.0 מ"מ.
- לאחר השלמת הזריקות, יש לעיין בסעיף 9 לתפר, ולהעביר את החיה לשולחן הניתוחים השני לצורך כריתת רחם צווארית.
7. יצירת חלון עמוד שדרה להזרקות מדויקות של חוט השדרה
- זהה את אתר החתך באמצעות האצבעות כדי למשש את בסיס הגולגולת. בקו האמצע, להתחיל את החתך 1-2 מ"מ אחורי לבסיס הגולגולת באמצעות להב #11 ולהרחיב את החתך 1 ס"מ אחורי כדי לחשוף את השריר השטחי. החזיקו את העור מתוח על ידי מריחת מתח עם האגודל והאצבע המורה כדי להבטיח חתך נקי.
- באמצעות הנקודה החדה של הלהב, בעדינות לבצע סדרה של חתכים לאורך קו האמצע של השריר השטחי כדי לחשוף את חלל עמוד השדרה ואת שרירי עמוד השדרה העמוקים. השתמש בזוג מלקחיים כדי לפתוח את השריר ולדמיין את חלון הניתוח.
הערה: השריר השטחי ייראה ורוד בהיר, בעוד שרירי עמוד השדרה העמוקים יופיעו בצבע אפור-לבנבן בהיר. - לאחר חשיפת שרירי עמוד השדרה העמוקים, יש להכניס את המשיבים לחלון הניתוח. במידת הצורך, השתמש מלקחיים כדי לתפוס את העור לרוחב ואת השרירים כדי למתוח אותם סביב השיניים של retractors. החזירו את חלון הניתוח לרוחב של 7-8 מ"מ, מה שמאפשר מבט ללא הפרעה על עמוד השדרה.
- זהה את החוליה הצווארית השנייה (C2 או ציר) על ידי התהליך הסיבובי הבולט שלה המקרין באופן דורסלי ועטיפה בשריר גדול בצורת כיפה. השתמש במלקחיים או בגשושית קהה כדי להרגיש ולזהות את התהליך הזה, שכן זה יהיה ציון הדרך המנחה.
הערה: החוליה C3 הסמוכה מוסתרת לעתים קרובות מעט על ידי שריר C2 הגדול; לכן, דיסקציה עדינה של שריר ב- C3 עם מלקחיים או מגרד עצם מסייעת להגדיר את החוליה ולסייע בספירת החוליות. - באמצעות הקצה השטוח של מגרד עצם, חשוף את חוליות C3-C7 על ידי גירוד עדין של שריר עמוד השדרה העמוק לצדדים. התחילו מדיאלית וגרדו לרוחב לאורך הכיוון המקביל ללמינה החולית כדי להבטיח חשיפה נכונה, שתאפשר הבחנה ברורה של למינה חולייתית. לשלוט על כל דימום עם קצוות כותנה.
- בעזרת זוג מיקרו-מספריים, חותכים בזהירות את הקצוות הצדדיים של הלמינה הסחוסית ב-C6 וב-C7. השתמש ב- C2 כמדריך בעת ספירת רמות חוליות.
- באמצעות זוג מלקחיים עדינים, להסיר בזהירות את החלק המנותק של lamina כדי לחשוף את חוט השדרה. ודא שחלון עמוד השדרה גדול מספיק כדי להתאים לאתר ההזרקה הרצוי. הסר חלקים חדים או משוננים של עצם שעלולים לנקב את חוט השדרה עם מיקרו-מספריים ומלקחיים כמתואר לעיל.
- הגדר את החיה במחזיק הגולגולת הסטריאוטקסית כמתואר בסעיף 3.6. בנוסף, הניחו חתיכת גזה מגולגלת מתחת לגזע החיה כדי להגביה את אחוריה.
הערה: הגבהה של אחורי החיה מרימה ביעילות את בית החזה מפני השטח של המחזיק כדי למנוע מתנועות נשימה להשפיע על מיקום המחט במהלך ההזרקה. - לפני תחילת ההזרקות, נקה את חלון עמוד השדרה מכל דם או נוזל מוחי על ידי מריחה עדינה של קצוות כותנה ומשולשי סוגי על האזור מבלי להעליב את חוט השדרה. יתר על כן, ליצור מחסום סביב היקף החלון כדי למנוע חסימה של אתר ההזרקה על ידי דימום מתמשך או דליפת CSF. כדי לעשות זאת, מניחים חתיכה קטנה של כותנה נספגת בחלקים לרוחב של חלון עמוד השדרה.
8. הזרקות ישירות לתוך חוט השדרה המכוונות אל הדקים של האקסון
- באמצעות קצה מחט הזרקת הזכוכית, יש להעריך את קו האמצע של חוט השדרה על ידי זיהוי עורק עמוד השדרה. עם זאת, אם עורק עמוד השדרה נמצא באופן ניכר מחוץ למרכז או סוטה בכל דרך שהיא, העריכו את קו האמצע על ידי שימוש במיקום של התהליך הספיני C2 ואקסטרפולציה זו לאורך עמוד השדרה.
הערה: עיין בסעיף 5.1 לקבלת הוראות לטעינת הנגיף. - לאחר הזיהוי, מקם את המחט רק אחורית ללמינה C5 בקו האמצע המשוער והשתמש בה כנקודת הייחוס. לאחר מכן, באמצעות micromanipulator, להזיז את המחט לרוחב ימינה על ידי 0.3 מ"מ. הורד את המחט עד שהוא פשוט נוגע בפני השטח של חוט השדרה; מעומק זה, לצלול את המחט 0.6 מ"מ לתוך חוט השדרה. במידת הצורך, להמשיך לצלול את המחט עד שהוא מנקב את חוט השדרה; לאחר מכן, נסוג או הורד את המחט לעומק המתאים.
- הזרקת 1 μL של retroAAV2-scCre ב-250 nL/min. לאחר השלמת ההזרקה, המתן 2 דקות עד שהנגיף יתפזר לתוך חוט השדרה לפני נסיגה איטית של המחט. חזור על הזריקות באמצעות אותן קואורדינטות רוחביות ועומק בשני אתרים נוספים בתוך חלון עמוד השדרה, אחד בנקודת האמצע והאחרון רק קדמי ללמינה T1.
9. סגירת פצעים וטיפול לאחר הניתוח
- הסר את החיה מהמחזיק הסטריאוטקסי והוצא את המשיבים או הווים. נקה את אזור הפצע עם כמה טיפות של מלח רגיל סטרילי.
- לתפור את הקרקפת עם 4.0 תפר משי, שניים או 3 תפרים בסך הכל.
- בעת תפירת פתח צוואר הרחם, יש להשתמש במעי כרומי 4.0 כדי לחבר מחדש בחוזקה את שכבות השריר (2 תפרים אמורים להספיק). תפר את עור צוואר הרחם נפתח עם 4.0 משי (4 תפרים צפויים).
- לאחר סגירת החיה, יש למרוח תחבושת נוזלית על פני התפרים.
- הניחו את החיה מתחת למנורת חימום ועקבו אחריה מקרוב עד שתתעורר מחדש לחלוטין. ברגע שהחיה ערה, זזה ויבשה, נקו בעדינות את הפצעים עם גזה סטרילית. אין להשאיר את בעל החיים ללא השגחה עד שהוא חזר להכרה מספקת כדי לשמור על שכיבה סטרנלית.
- החזירו את החיה לכלוב הבית עם אמה. דאגו למנוע הזנחה וקניבליזציה של התינוק מהאם כלפי הגורים:
- היכרות עם החוקרים לקראת ניתוח באמצעות טיפול עדין (5-10 דקות) פעמיים ביום, החל משבוע לפני הניתוח.
- החזירו את הגורים לכלוב הבית יחד כדי להגביל את ההפרעה לאם.
- להזריק לאם אצפרומזין 1.5 מ"ג/ק"ג q12 שעות תת עורית ביום הניתוח.
הערה: טיפול בכאב משרת את המטרה הכפולה של מתן משככי כאבים לגורים ועידוד חזרה מוקדמת יותר לפעילות, ובכך מקדם השתלבות מחדש עם האם. - להזריק buprenorphine 0.05 מ"ג/ק"ג תת עורית q8 h החל לאחר הניתוח במשך 3 ימים בסך הכל (ימים לאחר הניתוח 0, 1, 2).
תוצאות
הזרקה מוצלחת והובלה של הווקטור הנגיפי אמורה לגרום להתמרה של נוירונים חד צדדיים בחוט השדרה ובקליפת המוח המוטורית. איור 4 מדגים את התיוג של נוירוני CST בשכבה V בקליפת המוח המוטורית של מקטע קורונל מוחי המבטא Cre-dependent-DREADDs-mCherry שהוזרק יחד עם הזרקת עמוד שדרה קונטרלטרלית של rCre. החלקי...
Discussion
מודולציה גנטית בלתי ניתנת להשראה של פעילות המוח באמצעות משנים כימוגנטיים הניתנים להזרקה היא כלי רב עוצמה בחקר המנגנונים השונים העומדים בבסיס ההתאוששות מ- SCI. הדיוק של המיקוד עבור קולטנים מצומדים לחלבון G (DREADDs) מוגבר עוד יותר כאשר לוקחים בחשבון שמעקב פלואורסצנטי מאמת את הדיוק האנטומי בהיס?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו מומנה על ידי מענק מלגה מבתי החולים לילדים של Shriners SHC-84706.
Materials
| Name | Company | Catalog Number | Comments |
| #11 scalpel blades | Roboz | RS-9801-11 | For use with the scalpel. |
| #10 Scalpel Blades | Roboz | RS-9801-10 | For use with the scalpel. |
| 1 mL Syringes | Becton, Dickinson and Company | 309659 | For anesthetic SC injection and fluid bolus |
| 4.0 silk suture | Ethicon | 771-683G | For skin closure |
| 4.0 Chromic Catgut Suture | DemeTECH | NN374-16 | To re-bind muscle during closing. |
| 48000 Micropipette Beveler | World Precision Instruments | 32416 | Used to bevel the tips of the pulled glass capillary tubes to form functional glass needles. |
| 5% Iodine Solution | Purdue Products L.P. | L01020-08 | For use in sterilzation of the surgical site. |
| 70% Ethanol | N/A | N/A | For sterilization of newly prepared glass needles, animal models during surgical preparation |
| Ketamine (Ketaset) | Zoetis | 240048 | For keeping the animal in the correct plane of consciousness during surgery. |
| Bead Sterilizer | CellPoint | 5-1450 | To heat sterilize surgical instruments. |
| Digital Scale | Okaus | REV.005 | For weighing the animal during surgical preparation. |
| Flexible Needle Attachment | World Precision Instruments | MF34G-5 | For cleaning glass needles and loading red oil into glass needles. |
| Glass Capillary Tubes | World Precision Instruments | 4878 | For pulled glass needles - should be designed for nanoliter injectors. |
| Hemostats | Roboz | RS-7231 | For general use in surgery. |
| Medium Point Curved Forceps | Roboz | RS-5136 | For general use in surgery. |
| Micromanipulator with a Vernier Scale | Kanetec | N/A | For precise targeting during surgery. |
| Microscissors | Roboz | RS-5621 | For cutting glass whisps off of freshly pulled glass capillary tubes. |
| Lab Standard Stereotaxic Instrument | Stoelting | 51600 | To hold the neonatal sterotaxic holder in place |
| Lab Standard with Mouse & Neonates Adaptor | 51615 | For neonatal skull fixation during cranial surgery and spinal injections | |
| Microscope with Light and Vernier Scale Ocular | Leitz Wetzlar | N/A | Used to visualize and measure beveling of pulled glass capillary tubes into functional glass needles. |
| MicroSyringe Pump Controller | World Precision Instruments | 62403 | To control the rate of injection. |
| Nanoliter 2000 Pump Head Injector | World Precision Instruments | 500150 | To load and inject virus in a controlled fashion. |
| Needle Puller | Narishige | PC-100 | To heat and pull apart glass capillary tubes to form glass needles. |
| pAAV-CMV-scCre | Wu lab | Cre plasmid | |
| pAAV-hSyn-DIO-hM3Dq-mCherry (plasmid #44361) | Bryan Roth’s lab through Addgene | DREADD plasmid | |
| Parafilm | Bemis | PM-996 | To assist with loading virus into the nanoinjector. |
| PrecisionGlide Needles (25G x 5/8) | Becton, Dickinson and Company | 305122 | For use with the 1mL and 10 mL syringes to allow injection of the animal model. |
| Rat Tooth Forceps | Roboz | RS-5152 | For griping spinous processes. |
| Red Oil | N/A | N/A | To provide a front for visualization of virus entering tissue during injection. |
| Retractors | Roboz | RS-6510 | To hold open the surgical wound. |
| Rongeurs | Roboz | RS-8300 | To remove muscle from the spinal column during surgery. |
| Scalpel Blade Handle | Roboz | RS-9843 | To slice open skin and fat pad of animal model during surgery. |
| Scissors | Roboz | RS-5980 | For general use in surgery. |
| Staple Removing Forceps | Kent Scientific | INS750347 | To remove the staples, should they be applied incorrectly. |
| Sterile Cloth | Phenix Research Products | BP-989 | To provide a sterile surface for the operation. |
| Sterile Cotton-Tipped Applicators | Puritan | 806-WC | To soak up blood in the surgical wound while maintaining sterility. |
| Sterile Gauze | Covidien | 2146 | To clean the surgical area and surgical tools while maintaining sterility. |
| Sterile Saline | Baxter Healthcare Corporation | 281324 | For use in blood clearing, and for replacing fluids post-surgery. |
| Surgical Gloves | N/A | N/A | For use by the surgeon to maintain sterile field during surgery. |
| Surgical Heating Pad | N/A | N/A | For maintaining the body temperature of the animal model during surgery. |
| Surgical Microscope | N/A | N/A | For enhanced visualization of the surgical wound. |
| Surgical Stapler | Kent Scientific | INS750546 | To apply the staples. |
| Water Convection Warming Pad | Baxter Healthcare Corporation | L1K018 | For use in the post-operational recovery area to maintain the body temperature of the unconscious animal. |
| Weighted Hooks | N/A | N/A | To hold open the surgical wound. |
| Liquid bandage | NewSkin | 985838 | To apply along sutures following surgery and encourage wound healing |
| Wire Cage Lamp | ZooMed | LF10EC | To help animals recover from anesthesia and retain warm body temperature naturally |
References
- Parent, S., Mac-Thiong, J., Roy-Beaudry, M., Sosa, J. F., Labelle, H. Spinal cord injury in the pediatric population: A systematic review of the literature. Journal of Neurotrauma. 28 (8), 1515-1524 (2011).
- Vitale, M. G., Goss, J. M., Matsumoto, H., Roye, D. P. Epidemiology of pediatric spinal cord injury in the united states: Years 1997 and 2000. Journal of Pediatric Orthopedics. 26 (6), 745-749 (2006).
- Bregman, B. S., Goldberger, M. E. Anatomical plasticity and sparing of function after spinal cord damage in neonatal cats. Science. 217 (4559), 553-555 (1982).
- Castro, A. J. Ipsilateral corticospinal projections after large lesions of the cerebral hemisphere in neonatal rats. Experimental Neurology. 46 (1), 1-8 (1975).
- Commissiong, J. W., Toffano, G. Complete spinal cord transection at different postnatal ages: Recovery of motor coordination correlated with spinal cord catecholamines. Experimental Brain Research. 78 (3), 597-603 (1989).
- Yuan, Q., Su, H., Chiu, K., Wu, W., Lin, Z. Contrasting neuropathology and functional recovery after spinal cord injury in developing and adult rats. Neuroscience Bulletin. 29 (4), 509-516 (2013).
- Kim, J., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualizing and manipulating neuronal circuits in vivo. The European Journal of Neuroscience. 37 (8), 1203-1220 (2013).
- Pawliuk, R., et al. Correction of sickle cell disease in transgenic mouse models by gene therapy. Science. 294 (5550), 2368-2371 (2001).
- Atasoy, D., Sternson, S. M. Chemogenetic tools for causal cellular and neuronal biology. Physiological Reviews. 98 (1), 391-418 (2018).
- Brandt, H. M., Apkarian, A. V. Biotin-dextran: A sensitive anterograde tracer for neuroanatomic studies in rat and monkey. Journal of Neuroscience Methods. 45 (1-2), 35-40 (1992).
- Veenman, C. L., Reiner, A., Honig, M. G. Biotinylated dextran amine as an anterograde tracer for single- and double-labeling studies. Journal of Neuroscience Methods. 41 (3), 239-254 (1992).
- Reiner, A., et al. Pathway tracing using biotinylated dextran amines. Journal of Neuroscience Methods. 103 (1), 23-37 (2000).
- Oguchi, M., et al. Double virus vector infection to the prefrontal network of the macaque brain. PloS One. 10 (7), 0132825 (2015).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487 (7406), 235-238 (2012).
- Bernstein, D. R., Stelzner, D. J. Plasticity of the corticospinal tract following midthoracic spinal injury in the postnatal rat. The Journal of Comparative Neurology. 221 (4), 382-400 (1983).
- Brown, K., Wolfe, B., Wrathall, J. Rapid functional recovery after spinal cord injury in young rats. Journal of Neurotrauma. 22, 559-574 (2005).
- Tillakaratne, N. J. K., et al. Functional recovery of stepping in rats after a complete neonatal spinal cord transection is not due to regrowth across the lesion site. Neuroscience. 166 (1), 23-33 (2010).
- Kartje-Tillotson, G., Neafsey, E. J., Castro, A. J. Electrophysiological analysis of motor cortical plasticity after cortical lesions in newborn rats. Brain Research. 332 (1), 103-111 (1985).
- Gennaro, M., et al. Focal stroke in the developing rat motor cortex induces age- and experience-dependent maladaptive plasticity of corticospinal system. Frontiers in Neural Circuits. 11, 47 (2017).
- Brichta, A. M., Grant, G., Paxinos, G. Cytoarchitectural organization of the spinal cord. The rat nervous system. 2, 294-309 (1985).
- Kjell, J., Olson, L. Rat models of spinal cord injury: From pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Takeoka, A., Arber, S. Functional local proprioceptive feedback circuits initiate and maintain locomotor recovery after spinal cord injury. Cell Reports. 27 (1), 71-85 (2019).
- Flynn, J. R., Graham, B. A., Galea, M. P., Callister, R. J. The role of propriospinal interneurons in recovery from spinal cord injury. Neuropharmacology. 60 (5), 809-822 (2011).
- Ohne, H., et al. Mechanism of forelimb motor function restoration in rats with cervical spinal cord hemisection-neuroanatomical validation. IBRO Reports. 7, 10-25 (2019).
- Wang, X., et al. Deconstruction of corticospinal circuits for goal-directed motor skills. Cell. 171 (2), 440-455 (2017).
- Sheikh, I. S., et al. Retrogradely transportable lentivirus tracers for mapping spinal cord locomotor circuits. Frontiers in Neural Circuits. 12, 60 (2018).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487, 235-238 (2012).
- Keefe, K. M., Junker, I. P., Sheikh, I. S., Campion, T. J., Smith, G. M. Direct injection of a lentiviral vector highlights multiple motor pathways in the rat spinal cord. Journal of Visualized Experiments: JoVE. (145), e59160 (2019).
- Hutson, T. H., Verhaagen, J., Yáñez-Muñoz, R. J., Moon, L. D. F. Corticospinal tract transduction: A comparison of seven adeno-associated viral vector serotypes and a non-integrating lentiviral vector. Gene Therapy. 19 (1), 49-60 (2012).
- Liu, Y., Keefe, K., Tang, X., Lin, S., Smith, G. M. Use of self-complementary adeno-associated virus serotype 2 as a tracer for labeling axons: Implications for axon regeneration. Plos One. 9 (2), 87447 (2014).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Abdellatif, A. A., et al. delivery to the spinal cord: Comparison between lentiviral, adenoviral, and retroviral vector delivery systems. Journal of Neuroscience Research. 84 (3), 553-567 (2006).
- Zingg, B., Peng, B., Huang, J., Tao, H. W., Zhang, L. I. Synaptic specificity and application of anterograde transsynaptic AAV for probing neural circuitry. The Journal of Neuroscience. 40 (16), 3250-3267 (2020).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences of the United States of America. 104 (12), 5163-5168 (2007).
- Roth, B. L. DREADDs for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Hasegawa, A., et al. Mechanism of forelimb motor function restoration after cervical spinal cord hemisection in rats: A comparison of juveniles and adults. Behavioural Neurology. 2016, 1035473 (2016).
- Alstermark, B., Isa, T. Circuits for skilled reaching and grasping. Annual Review of Neuroscience. 35, 559-578 (2012).
- García-Alías, G., Truong, K., Shah, P. K., Roy, R. R., Edgerton, V. R. Plasticity of subcortical pathways promote recovery of skilled hand function in rats after corticospinal and rubrospinal tract injuries. Experimental Neurology. 266, 112-119 (2015).
- Tohyama, T., et al. Contribution of propriospinal neurons to recovery of hand dexterity after corticospinal tract lesions in monkeys. Proceedings of the National Academy of Sciences of the United States of America. 114 (3), 604-609 (2017).
- Z'Graggen, W. J., et al. Compensatory sprouting and impulse rerouting after unilateral pyramidal tract lesion. Journal of Neuroscience. 20 (17), 6561-6569 (2000).
- Ueno, M., et al. Corticospinal circuits from the sensory and motor cortices differentially regulate skilled movements through distinct spinal interneurons. Cell Reports. 23 (5), 1286-1300 (2018).
- Kim, J., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. Journal of Visualized Experiments: JoVE. (91), e51863 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved