Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Нацеливание на кортикоспинальный тракт у неонатальных крыс с двойным вирусным вектором с использованием комбинированной хирургии головного мозга и позвоночника
В этой статье
Резюме
Этот протокол демонстрирует новый метод применения генной терапии к субпопуляциям клеток у неонатальных крыс в постнатальном возрасте 5-10 дней путем введения антероградного хемогенетического модификатора в соматодвигательную кору и ретроградно транспортируемой рекомбиназы Cre в шейный спинной мозг.
Аннотация
Успешное устранение препятствий, которые сдерживают исследования на неонатальных крысах, важно для изучения различий в результатах, наблюдаемых при детских травмах спинного мозга (SCIs) по сравнению со взрослыми SCIs. Кроме того, надежное введение терапии в клетки-мишени центральной нервной системы (ЦНС) может быть сложной задачей, а неточности могут поставить под угрозу эффективность исследования или терапии. Этот протокол сочетает в себе вирусную векторную технологию с новым хирургическим методом для точного введения генной терапии у неонатальных крыс на послеродовом дне 5. Здесь вирус, спроектированный для ретроградного транспорта (retroAAV2) Cre, вводится в аксонные терминали кортикоспинальных нейронов в спинном мозге, где он впоследствии транспортируется в клеточные тела. Затем в соматодвигательную кору головного мозга вводится дизайнерский рецептор с двойной инвертированной ориентацией (DIO), активируемый исключительно вирусом дизайнерских лекарств (ов) (DREADD). Этот метод двойной инфекции способствует экспрессии DREADD только в коинфицированных нейронах кортикоспинального тракта (CST). Таким образом, одновременная совместная инъекция соматомоторной коры и шейных терминалей CST является допустимым методом изучения хемогенетической модуляции восстановления по моделям цервикальной ТСМ у новорожденных крыс.
Введение
Хотя ТСМ является относительно редким явлением в педиатрической популяции, она особенно травматична и вызывает постоянную инвалидность, требующую огромного логистического предвидения. Кроме того, более высокая доля детских ВЦИ классифицируется как цервикальная и полная по сравнению со взрослым населением 1,2. Отличительной чертой всех видов млекопитающих является то, что новорожденные значительно лучше восстанавливаются после ТСМ, чем взрослые, и это дает возможность оценить движущие механизмы восстановления в более молодых популяциях 3,4,5. Несмотря на это, существует меньше мультимодальных исследований, посвященных исследованиям новорожденных и детенышей грызунов, отчасти из-за дополнительной сложности точного нацеливания на отдельные популяции нейронов в гораздо более жестких анатомических ориентирах молодых животных6. Эта статья посвящена прямому введению высокоэффективных антероградных и ретроградных аденоассоциированных векторов в спинной мозг крыс для модуляции основных двигательных путей с применением Cre-dependent-DREADD, расширяя охват исследований мультимодальной регенерации.
Вирусные векторы являются важными биологическими инструментами с широким спектром применений, включая введение генетического материала для замены генов-мишеней, повышения регуляции белков роста и отслеживания анатомического ландшафта ЦНС 7,8,9. Многие анатомические детали спинномозговых путей были изучены с использованием классических индикаторов, то есть биотинилированного декстранамина. В то время как традиционные индикаторы сыграли важную роль в раскрытии нейроанатомии, они не лишены своих недостатков: они без разбора маркируют пути, даже если они правильно введены, и исследования показали, что они поглощаются поврежденными аксонами 10,11,12. Следовательно, это может привести к неправильным интерпретациям в исследованиях регенерации, где отрезанные аксоны могут быть ошибочно приняты за регенерирующие волокна.
Следующий метод использует двухвирусную векторную систему, недавно популяризированную в исследованиях модуляции, с двумя различными вирусными векторами в двух отдельных областях одного и того же нейрона13,14. Первый представляет собой вектор, который локально заражает клеточные тела проекционных нейронов. Другой представляет собой ретроградный вектор, переносимый из аксонных терминалей проекционных нейронов (рисунок 1). Ретроградный вектор несет рекомбиназу Cre, а локальный вектор включает в себя двойную флоксированную последовательность «Cre-On», в которой кодируется флуоресцентный белок (mCherry). Нативный трансген, экспрессирующий как hM3Dq, так и mCherry, инвертирован относительно промотора и окружен двумя loxP-сайтами (рисунок 2). Таким образом, mCherry выражается только в дважды трансдуцированных проекционных нейронах, где cre-рекомбиназа индуцирует событие рекомбинации между сайтами LoxP, переворачивая ориентацию трансгена в соответствующую рамку считывания и позволяя экспрессировать как DREADD, так и флуоресцентный белок. Как только вирусный трансген находится в правильной ориентации, и когда это применимо, DREADD могут временно индуцировать нейромодуляцию через отдельно введенный лиганд, то есть клозапин-N-оксид. Протокол был разработан для аутентификации индуцируемых исследований нейромодуляции у новорожденных, в которых DREADDS вводятся для селективной модуляции ГПСП. Двухвирусная система действует как страховой полис, гарантируя, что каждая DREADD-положительная клетка отслеживается под флуоресценцией с высокой точностью для проверки инъекций.
Этот метод также помогает преодолеть разрыв в неонатальных исследованиях. Педиатрическая ТСМ представляет свои проблемы, и исследования, анализирующие регенерацию, прорастание или пластичность, должны подчеркнуть различия между новорожденными и взрослыми 3,15,16,17. Оптимизируя хирургическую процедуру и выполняя предыдущие анатомические исследования с окрашиванием Nissl, координаты как для черепных, так и для спинальных инъекций были проверены. Цель состояла в том, чтобы обеспечить метод двойных инъекций неонатальной крысе с повышенной точностью и живучестью.
Для текущей модели антероградный вектор вводили в клеточные тела соматодвигательной коры, используя брегму в качестве эталона18,19. С точки зрения спинальных инъекций, ретроградный вектор вводили в пластинки V-VII, где терминали аксона CST находятся20,21. Существует много фундаментальных вопросов, лежащих в основе того, как определенные модели поражения по-разному влияют на молодых животных и как последующее восстановление отличается от более старого животного. Это исследование демонстрирует надежные средства изучения травм шейки матки и восстанавливаемости функции передней конечности у новорожденных грызунов. Напротив, большинство предыдущих исследований касались восстановления локомоции после травм поясницы или грудной клетки 5,22,23,24. Сочетая двойной вирусный вектор с новой техникой инъекций, описанной здесь, этот протокол помогает смягчить определенные проблемы (например, живучесть), которые могут препятствовать исследованиям новорожденных грызунов. Этот метод является надежным, практичным и универсальным: небольшие вариации в технике позволят нацеливаться на различные пути, то есть вентральный CST, дорсальный CST и восходящие дорсальные пути.
Для этой системы один локально действующий вирус (например, AAV2) вводится в область интересующих тел нейрональных клеток. Второй ретроградно транспортируемый вирус, который контролирует экспрессию местного вируса, вводится в терминалы аксона для этой нейронной популяции. Таким образом, по определению, маркируются только кортикоспинальные нейроны. РетроAAV-Cre вирус был выбран с конститутивно активным промотором ЦМВ, поскольку челночная плазмида используется для генерации нескольких серотипов AAV для Cre-зависимой экспрессии в нескольких типах клеток. Для корковых инъекций AAV2 был выбран с трансгеном, приводимым в действие промотором синапсина-1, чтобы ограничить любую экспрессию нейронами. Поскольку 2-вирусная система больше зависит от происхождения и прекращения интересующей нейронной популяции, можно использовать несколько различных промоторов, если они могут управлять экспрессией генов, представляющих интерес в интересующей нейронной популяции. Например, возбуждающий нейрональный промотор, CamKII, может быть заменен синапсином-1. В дополнение к использованию этих серотипов AAV, ретроградный транспорт в незрелый и в гораздо меньшей степени, взрослые кортикоспинальные двигательные нейроны также могут быть достигнуты с использованием высоко ретроградного транспортабельного лентивируса (HiRet)25. Лентивирусы HiRet используют химерный гликопротеин Rabies / VSV для нацеливания поглощения синапсом для ретроградного транспорта. В сочетании с промотором Tet-On эта 2-вирусная система поддерживает индуцируемую экспрессию ретроградно-зависимым образом26,27.
Ретроградные вирусы вставляют векторы в синаптическое пространство нейрона-мишени, позволяя ему поглощаться аксоном этой клетки и транспортироваться в тело клетки. В то время как лентивирусные векторы ранее имели огромный успех, обеспечивая долгосрочную экспрессию в исследованиях генной терапии, этот метод развернулся в сторону аденоассоциированных вирусных векторов по нескольким простым причинам26,28: AAV более экономичен, так же эффективен и представляет меньшую логистическую нагрузку, учитывая, что он имеет более низкий уровень биобезопасности 29,30,31,32 . В то время как AAV2, наиболее часто используемый серотип, демонстрирует надежную трансфекцию аксонов CST, будущие исследователи могут отметить, что AAV1 предлагает некоторую универсальность, поскольку он маркирует трансинаптически, тем самым выдвигая несколько возможных итераций в будущих исследованиях33. Окончательная адаптация заключается в кодировании ретроградного вируса кре-рекомбиназой таким образом, чтобы несколько антероградных векторов могли быть введены одновременно, тем самым уменьшая ненужные внутренние вирусные отходы и максимизируя вероятность того, что DREADD экспрессируются в правильной ориентации.
В конечном счете, этот протокол демонстрирует одновременную инъекцию в кору и шейный отдел позвоночника, особенно нацеленную на клеточные тела и аксонные терминали кортикоспинального тракта соответственно. Высокоточная трансфекция наблюдается в коре головного мозга и спинном мозге. В то время как описанный протокол был усовершенствован для крыс Sprague Dawley 5-дневного возраста, он подходит для послеродовых дней 4-10 с незначительными корректировками анестезии и стереотаксических координат.
протокол
Все следующие хирургические процедуры и процедуры по уходу за животными были одобрены Комитетом по уходу и использованию животных Университета Темпл. Описанный протокол представляет собой операцию по выживанию, и животные были в конечном итоге усыплены путем внутрибрюшинной инъекции 100 мг / кг пентобарбитала натрия по завершении их временных точек.
1. Предоперационная подготовка
- Подготовьте по крайней мере две вытянутые стеклянные иглы для вирусной инъекции с использованием стеклянных капиллярных пипеток 3,5 нЛ; одна игла для DREADD и одна игла для rCre. В качестве меры предосторожности приготовьте 4-5 игл на случай, если они сломаются интраоперационно.
- С помощью микросублиц срежьте с иглы 1-2 мм лишнего стекла.
- Для каждой иглы расположите ее под углом 30°, используйте микропипетку для создания наконечника с диафрагмой 30-40 мкм и скошенным углом 45°.
- Храните иглы в покрытой чашке Петри, а затем стерилизуйте их, помещая чашку Петри в вытяжку биобезопасности под ультрафиолетовым светом в течение 15 минут.
- Подготовьте необходимые вирусы, удалив подходящий объем из морозильной камеры -80 °C перед процедурой, имея в виду, что каждому животному потребуется 3 мкл каждого вируса.
ПРИМЕЧАНИЕ: Транспортируйте и храните вирус на льду, когда он не используется. Этот протокол был разработан с использованием AAV2-hM3Dq-mCherry и AAV2-retroCre для инъекции 3 мкл каждого вируса на животное. Плазмида DREADD, pAAV-hSyn-DIO-hM3Dq-mCherry (см. Таблицу материалов), использовалась для создания антероградного AAV2 с вирусным титром 1,54 × 1012 копий генома (GC)/мл. Плазмида Cre, pAAV-CMV-scCre, использовалась для получения ретроградного AAV2 с вирусным титром 4,27 × 1012 ГК/мл. - Подключите инжектор к микронасосу и поместите его в микроманипулятор со шкалой Вернье.
- Чтобы помочь визуально подтвердить наличие или отсутствие вируса в игле, загрузите в иглу цветной краситель, т.е. красное масло. Избегайте пузырьков в игле.
- Вставьте стеклянную иглу в инжектор, убедившись, что игла подходит правильно.
- Если доступно, повторите весь процесс с помощью отдельного инъекционного насоса для каждого вируса. Если есть только один доступный инъекционный насос, подготовьте две отдельные иглы и замените использованную иглу, когда придет время менять вирусы.
2. Анестезия и подготовка хирургического участка
- Взвешивайте животное на цифровых весах. Запишите предоперационный вес, чтобы определить объем необходимого анестетика.
ПРИМЕЧАНИЕ: Этот протокол показал, что наиболее надежным методом анестезии для обеспечения удовлетворительной плоскости анестезии на протяжении всего операционного времени является комбинация кетамина и гипотермии. Кетамина недостаточно для обеспечения анестезии самостоятельно, и добавление его ксилазином имеет узкий порог перед увеличением интраоперационной смертности. Гипотермия сама по себе недостаточна для длительных операций (двойные операции на позвоночнике и головном мозге, вероятно, требуют >1 ч устойчивой анестезии). - Обезболить щенка путем введения разбавленного кетамина (10 мг/мл) подкожно между лопатками, чтобы животное получало дозу кетамина 100 мг/кг; подождите 5 мин.
ПРИМЕЧАНИЕ: Например, на 5-й послеродовой день щенок крысы весит 10 г и получает 0,1 мл разбавленного раствора кетамина (10 мг/мл). - Поместите щенка на измельченный лед на 6-8 мин. Защитите его от обморожения, поместив животное в латексную перчатку или парапленку, чтобы избежать прямого контакта со льдом.
- Крепко зажмите стопу с помощью щипцов, чтобы подтвердить соответствующую анестетикальную плоскость. Если происходит рефлекторный уход, оставьте еще на 2 минуты на льду, прежде чем продолжить.
- Широко наносить антисептик на голову и спину животного с помощью стерильной марли, смоченной 5% раствором йода. Затем стерилизовать марлей, смоченной в 70% этаноле. Нанесите антисептические салфетки три раза каждая, чередуя йод и этанол, чтобы замочить марлю.
ПРИМЕЧАНИЕ: Нет необходимости в уходе за глазами, так как молодые щенки открывают глаза только в возрасте 14 дней. - Если животное должно получить двойную операцию (мозг + позвоночник), обеспечьте нормальный физиологический раствор перед операцией (0,02 мл / г) подкожно между лопатками.
ПРИМЕЧАНИЕ: если животное становится отзывчивым во время операции и требуется дальнейшая анестезия, то замените животное на лед в течение 5 минут.
3. Подготовка хирургических полей и инструментов
- Автоклав хирургических инструментов, которые включают держатель скальпеля, ронгеры, гемостаты, щипцы со средней точкой и втягивающие устройства
- Подготовьте микроскоп и установите стереотаксический адаптер для неонатальных крыс, чтобы надежно расположить его в стереотаксическом держателе для взрослых.
- Проводите операцию в стерилизованных перчатках. Откройте пачку расфасованных стерильных хирургических перчаток и поместите стерильную перчаточную пленку на стол, используя обертку в качестве дополнительной области для размещения использованных инструментов.
ПРИМЕЧАНИЕ: Важно следовать надлежащей хирургической практике и поддерживать стерильность на протяжении всей процедуры. - Закрепите 11-лезвие в держателе скальпеля. Позиционируйте стерильный физиологический раствор, 4,0-хромный кетгутовый шов, шелковый шов 4,0 и материалы для контроля кровотечения, например, стерильная марля, стерильные аппликаторы с хлопковыми наконечниками и треугольники.
- Создайте два хирургических поля, как описано выше, причем один участок назначен для трепанации черепа, а другой - для цервикальной ламинэктомии.
- Извлеките животное и закрепите его в стереотаксическом адаптере: поскольку новорожденные очень хрящевые, осторожно зафиксируйте их, широко направив ушные вкладыши к нижнечелюстным суставам. После горизонтальной стабилизации аккуратно введите передний мундштук.
ПРИМЕЧАНИЕ: Необязательное правило, используемое для обеспечения «плоской» хирургической области, заключается в том, чтобы зафиксировать наушники на той же высоте, а мундштук примерно на 2-3 уровня ниже.
4. Выполнение трепанации черепа и обнажение соматодвигательной коры
- Определите область, где будет сделан разрез, надавливая на щипцы в средней линии на верхней части кожи головы, чувствуя сагиттальный шов. Сделайте разрез 1 см вдоль плоскости сагиттального шва, начиная непосредственно над линией глаз. Держите кожу подтянутой, чтобы обеспечить чистый, прямой и точный разрез.
- Определите брегму (конвергенцию коронального и сагиттального швов), осторожно прощупав щипцы вдоль поверхности черепа и уделяя пристальное внимание линиям шва, а также любым углублениям, вызванным щипцами, идущими вдоль теменной и лобной костей.
- Поддерживайте отверстие с применением утяжеленных крючков на интересующей стороне. Отметим, что спинальная инъекция производится с правой стороны, черепная инъекция – с левой.
- Очистите апоневроз с помощью комбинации хлопковых наконечников и микросублиц, чтобы максимизировать экспозицию брегмы для повышения точности. Убедитесь, что корональный шов находится на видном месте достаточно далеко сбоку, чтобы обеспечить грубый шаблон для последующих инъекций.
- Используя микросубчики, вырежьте примерно 3 х 2 мм участок левой лобной кости черепа, непосредственно прилегающий к брегме.
ПРИМЕЧАНИЕ: После того, как костный лоскут был тщательно удален, должно быть четкое окно с открытым мозговым веществом, готовым к инъекции. Остальные линии шва на контралатеральной стороне мозга будут выступать в качестве визуального руководства для поддержания точности вдоль передне-задней оси (AP). - Очистите любой мусор, спинномозговую жидкость (CSF) и кровь с помощью хлопковых кончиков.
ПРИМЕЧАНИЕ: Для крови или ликвора нормально слегка затемнять зрительную линию, поэтому желательно регулярно очищать область хлопковыми кончиками.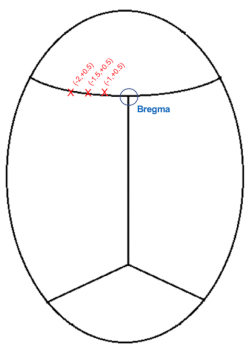
Рисунок 3: Схематическая иллюстрация координат черепной инъекции (мм) относительно брегмы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Загрузка вируса и позиционирование инжектора
- Загрузите вирус в инжектор, пипетируя ~ 5 мкл на кусок парапленки, и расположите иглу так, чтобы наконечник покоился поверх капли вируса.
- Убедитесь, что дополнительный вирус загружен в инжектор для обеспечения плавного впрыска. Например, при введении в общей сложности 3 мкл (1 мкл на каждое место инъекции) выводят 4 мкл вируса со скоростью 250 нл/с с помощью микронасоса.
- Удалите лишний вирус лабораторной салфеткой.
- Расположите микроманипулятор так, чтобы была видна шкала Вернье, и расположите иглу над сагиттальным швом.
- Опустите иглу чуть выше области, представляющей брегму (рисунок 3), и запишите координаты AP и medial-lateral (ML).
- Учитывая, что инъекции будут находиться с левой стороны, генерируйте координаты цели, вычитая координаты 1, 1,5 и 2,0 мм (ML: -1,0, -1,5, -2,0) из координат ML для брегмы.
ПРИМЕЧАНИЕ: Позиция AP будет +0,5 мм от брегмы для всех трех инъекций. - Переместите иглу в положение для первой инъекции. AP: +0.5, ML: -1.0
- Опустите иглу к обнаженному мозгу до тех пор, пока она не вдавится во внешнюю кору. Запишите вниз высоту иглы и опустите иглу в нужное положение, вычитая 0,6 мм из высоты поверхности мозга. Глубина инъекции: кортикальная поверхность -0,6 мм.
ПРИМЕЧАНИЕ: Важно отметить глубину поверхности для каждой инъекции, так как могут возникнуть небольшие нарушения в позиционировании крысы.
6. Введение вируса в соматодвигательную кору
- Как только игла будет на месте, запрограммируйте инжектор на инъекцию 1 мкл со скоростью 250 нл/мин.
- Как только инъекция будет завершена, дайте игле отдохнуть в коре в течение 3 минут.
- Повторите инъекции для других координат: всего 3 инъекции вдоль коры по отношению к брегме, все на глубине -0,6 мм: 1) AP: +0,5 мм, ML: -1,0 мм 2) AP: +0,5 мм, ML: -1,5 мм 3) AP: +0,5 мм, ML: -2,0 мм.
- После завершения инъекций обратитесь к разделу 9 для наложения шва и перенесите животное на другой операционный стол для цервикальной ламинэктомии.
7. Создание спинного окна для точных инъекций спинного мозга
- Определите место разреза, используя пальцы для пальпации основания черепа. На средней линии начните разрез на 1-2 мм сзади к основанию черепа с помощью лезвия No 11 и вытяните разрез на 1 см сзади, чтобы обнажить поверхностную мышцу. Держите кожу подтянутой, накладывая натяжение большим и указательным пальцами, чтобы обеспечить чистый разрез.
- Используя острое острие лезвия, аккуратно сделайте серию разрезов вдоль средней линии поверхностной мышцы, чтобы обнажить спинномозговую полость и глубокие спинные мышцы. Используйте пару щипцов, чтобы раздвинуть мышцу и визуализировать хирургическое окно.
ПРИМЕЧАНИЕ: Поверхностная мышца будет казаться светло-розовой, в то время как глубокие спинные мышцы будут казаться светлыми беловато-серыми. - После того, как глубокие спинные мышцы были обнажены, вставьте втягивающие устройства в хирургическое окно. При необходимости используйте щипцы, чтобы захватить боковую кожу и мышцы, чтобы растянуть их вокруг зубов втягивающих устройств. Втягивайте хирургическое окно до 7-8 мм в ширину, обеспечивая беспрепятственный обзор позвоночника.
- Определите второй шейный (С2 или ось) подобрал по его выдающемуся остистому отростку, который проецируется дорсально и инкапсуляция в большую куполообразную мышцу. Используйте щипцы или тупой зонд, чтобы почувствовать и идентифицировать этот процесс, так как это будет ориентиром.
ПРИМЕЧАНИЕ: Соседний позвонок C3 часто слегка закупоривается большой мышцей C2; поэтому мягкое рассечение мышцы при С3 с помощью щипцов или костного скребка помогает определить позвонок и помогает в подсчете позвонков. - Используя плоский край костного скребка, обнажите позвонки C3-C7, осторожно соскоблив глубокую спинномозговую мышцу в стороны. Начинают медиально и соскребают латерально по направлению, параллельному позвоночным пластинкам, чтобы обеспечить правильное воздействие, что позволит четко различать позвоночные пластинки. Контролируйте любое кровотечение с помощью хлопковых наконечников.
- Используя пару микросублиц, аккуратно срежьте боковые края хрящевых пластинок при С6 и С7. Используйте C2 в качестве ориентира при подсчете уровней позвонков.
- Используя пару тонких щипцов, осторожно удалите рассеченную часть пластинки, чтобы обнажить спинной мозг. Убедитесь, что спинномозговое окно достаточно велико, чтобы вместить желаемое место инъекции. Удалите любые острые или зубчатые участки кости, которые могут проколоть спинной мозг с помощью микросублиц и щипцов, как описано выше.
- Поместите животное в стереотаксический краниальный держатель, как описано в разделе 3.6. Кроме того, поместите свернутый кусок марли под хобот животного, чтобы поднять его задние четвертины.
ПРИМЕЧАНИЕ: Поднятие задних конечностей животного эффективно поднимает грудную клетку с поверхности держателя, чтобы предотвратить влияние дыхательных движений на положение иглы во время инъекции. - Перед началом инъекций очистите спинномозговое окно от любой крови или спинномозговой жидкости, осторожно приложив хлопковые кончики и треугольники Суги к области, не оскорбляя спинной мозг. Далее создают барьер по периметру окна, чтобы предотвратить окклюзию места инъекции непрерывным кровотечением или утечкой ликвора. Для этого поместите небольшой кусочек рассасывающегося хлопка в боковые части спинномозгового окна.
8. Прямые инъекции в спинной мозг, нацеленные на аксонные терминалы
- Используя кончик стеклянной инъекционной иглы, приближайте среднюю линию спинного мозга, идентифицируя спинномозговую артерию. Однако, если спинномозговая артерия заметно смещена от центра или каким-либо образом отклоняется, аппроксимируйте среднюю линию, используя положение остистого отростка С2 и экстраполируя его вниз по длине позвоночника.
ПРИМЕЧАНИЕ: Обратитесь к разделу 5.1 для получения инструкций по загрузке вируса. - После идентификации расположите иглу чуть позади ламины С5 на приблизительной средней линии и используйте ее в качестве контрольной точки. Затем, используя микроманипулятор, переместите иглу латерально вправо на 0,3 мм. Опустите иглу до тех пор, пока она не коснется поверхности спинного мозга; с этой глубины вонзить иглу на 0,6 мм в спинной мозг. При необходимости продолжайте погружать иглу до тех пор, пока она не проколет спинной мозг; затем втяните или опустите иглу на соответствующую глубину.
- Вводят 1 мкл ретроAAV2-scCre при 250 нл/мин. После того, как инъекция будет завершена, подождите 2 минуты, пока вирус диффундирует в спинной мозг, прежде чем медленно снимать иглу. Повторите инъекции, используя те же боковые и глубинные координаты еще в двух местах в спинномозговом окне, один в средней точке и последний прямо перед пластинкой Т1.
9. Закрытие ран и послеоперационный уход
- Извлеките животное из стереотаксического держателя и выньте втягивающие устройства или крючки. Очистите раневую область несколькими каплями стерильного нормального физиологического раствора.
- Зашить кожу головы 4,0 шелковым швом, всего два или 3 шва.
- При наложении швов на цервикальное отверстие используйте 4,0 хромированную кишку для плотного прикрепления мышечных слоев (достаточно 2 швов). Зашить отверстие кожи шейки матки 4,0 шелком (ожидается 4 шва).
- Как только животное будет закрыто, разумно наложите жидкую повязку на швы.
- Поместите животное под нагревательную лампу и внимательно следите за ним до полного пробуждения. Как только животное проснется, пошевелится и высохнет, аккуратно очистите раны стерильной марлей. Не оставляйте животное без присмотра до тех пор, пока оно не придет в достаточное сознание для поддержания грудинного покоя.
- Верните животное в домашнюю клетку вместе с матерью. Позаботьтесь о том, чтобы предотвратить пренебрежение и каннибализацию младенцев от матери по отношению к щенкам:
- Знакомьте исследователей с матерью в ожидании операции путем бережного обращения (5-10 минут) два раза в день, начиная за неделю до операции.
- Верните детенышей в домашнюю клетку вместе, чтобы ограничить разрушение матери.
- Вводят матери ацепромазин 1,5 мг/кг q12 ч подкожно в день операции.
ПРИМЕЧАНИЕ: Лечение боли служит двойной цели обеспечения анальгезии для щенков и поощрения более раннего возвращения к активности, тем самым способствуя реинтеграции с матерью. - Вводят бупренорфин 0,05 мг/кг подкожно q8 ч, начиная после операции в течение 3 дней в общей сложности (послеоперационные дни 0, 1, 2).
Результаты
Успешная инъекция и транспортировка вирусного вектора должны привести к трансдукции односторонних нейронов в спинном мозге и моторной коре. Рисунок 4 демонстрирует маркировку нейронов слоя V CST в моторной коре коронального отдела мозга, экспрессирующих Cre-dependent-DREADDs-mCherr...
Обсуждение
Индуцируемая генетическая модуляция мозговой активности инъекционными хемогенетическими модификаторами является мощным инструментом в изучении различных механизмов, лежащих в основе восстановления после ТСМ. Точность нацеливания на индуцируемые рецепторы, связанные с G-белком (DREAD...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа финансировалась за счет стипендиального гранта от Shriners Hospitals for Children SHC-84706.
Материалы
| Name | Company | Catalog Number | Comments |
| #11 scalpel blades | Roboz | RS-9801-11 | For use with the scalpel. |
| #10 Scalpel Blades | Roboz | RS-9801-10 | For use with the scalpel. |
| 1 mL Syringes | Becton, Dickinson and Company | 309659 | For anesthetic SC injection and fluid bolus |
| 4.0 silk suture | Ethicon | 771-683G | For skin closure |
| 4.0 Chromic Catgut Suture | DemeTECH | NN374-16 | To re-bind muscle during closing. |
| 48000 Micropipette Beveler | World Precision Instruments | 32416 | Used to bevel the tips of the pulled glass capillary tubes to form functional glass needles. |
| 5% Iodine Solution | Purdue Products L.P. | L01020-08 | For use in sterilzation of the surgical site. |
| 70% Ethanol | N/A | N/A | For sterilization of newly prepared glass needles, animal models during surgical preparation |
| Ketamine (Ketaset) | Zoetis | 240048 | For keeping the animal in the correct plane of consciousness during surgery. |
| Bead Sterilizer | CellPoint | 5-1450 | To heat sterilize surgical instruments. |
| Digital Scale | Okaus | REV.005 | For weighing the animal during surgical preparation. |
| Flexible Needle Attachment | World Precision Instruments | MF34G-5 | For cleaning glass needles and loading red oil into glass needles. |
| Glass Capillary Tubes | World Precision Instruments | 4878 | For pulled glass needles - should be designed for nanoliter injectors. |
| Hemostats | Roboz | RS-7231 | For general use in surgery. |
| Medium Point Curved Forceps | Roboz | RS-5136 | For general use in surgery. |
| Micromanipulator with a Vernier Scale | Kanetec | N/A | For precise targeting during surgery. |
| Microscissors | Roboz | RS-5621 | For cutting glass whisps off of freshly pulled glass capillary tubes. |
| Lab Standard Stereotaxic Instrument | Stoelting | 51600 | To hold the neonatal sterotaxic holder in place |
| Lab Standard with Mouse & Neonates Adaptor | 51615 | For neonatal skull fixation during cranial surgery and spinal injections | |
| Microscope with Light and Vernier Scale Ocular | Leitz Wetzlar | N/A | Used to visualize and measure beveling of pulled glass capillary tubes into functional glass needles. |
| MicroSyringe Pump Controller | World Precision Instruments | 62403 | To control the rate of injection. |
| Nanoliter 2000 Pump Head Injector | World Precision Instruments | 500150 | To load and inject virus in a controlled fashion. |
| Needle Puller | Narishige | PC-100 | To heat and pull apart glass capillary tubes to form glass needles. |
| pAAV-CMV-scCre | Wu lab | Cre plasmid | |
| pAAV-hSyn-DIO-hM3Dq-mCherry (plasmid #44361) | Bryan Roth’s lab through Addgene | DREADD plasmid | |
| Parafilm | Bemis | PM-996 | To assist with loading virus into the nanoinjector. |
| PrecisionGlide Needles (25G x 5/8) | Becton, Dickinson and Company | 305122 | For use with the 1mL and 10 mL syringes to allow injection of the animal model. |
| Rat Tooth Forceps | Roboz | RS-5152 | For griping spinous processes. |
| Red Oil | N/A | N/A | To provide a front for visualization of virus entering tissue during injection. |
| Retractors | Roboz | RS-6510 | To hold open the surgical wound. |
| Rongeurs | Roboz | RS-8300 | To remove muscle from the spinal column during surgery. |
| Scalpel Blade Handle | Roboz | RS-9843 | To slice open skin and fat pad of animal model during surgery. |
| Scissors | Roboz | RS-5980 | For general use in surgery. |
| Staple Removing Forceps | Kent Scientific | INS750347 | To remove the staples, should they be applied incorrectly. |
| Sterile Cloth | Phenix Research Products | BP-989 | To provide a sterile surface for the operation. |
| Sterile Cotton-Tipped Applicators | Puritan | 806-WC | To soak up blood in the surgical wound while maintaining sterility. |
| Sterile Gauze | Covidien | 2146 | To clean the surgical area and surgical tools while maintaining sterility. |
| Sterile Saline | Baxter Healthcare Corporation | 281324 | For use in blood clearing, and for replacing fluids post-surgery. |
| Surgical Gloves | N/A | N/A | For use by the surgeon to maintain sterile field during surgery. |
| Surgical Heating Pad | N/A | N/A | For maintaining the body temperature of the animal model during surgery. |
| Surgical Microscope | N/A | N/A | For enhanced visualization of the surgical wound. |
| Surgical Stapler | Kent Scientific | INS750546 | To apply the staples. |
| Water Convection Warming Pad | Baxter Healthcare Corporation | L1K018 | For use in the post-operational recovery area to maintain the body temperature of the unconscious animal. |
| Weighted Hooks | N/A | N/A | To hold open the surgical wound. |
| Liquid bandage | NewSkin | 985838 | To apply along sutures following surgery and encourage wound healing |
| Wire Cage Lamp | ZooMed | LF10EC | To help animals recover from anesthesia and retain warm body temperature naturally |
Ссылки
- Parent, S., Mac-Thiong, J., Roy-Beaudry, M., Sosa, J. F., Labelle, H. Spinal cord injury in the pediatric population: A systematic review of the literature. Journal of Neurotrauma. 28 (8), 1515-1524 (2011).
- Vitale, M. G., Goss, J. M., Matsumoto, H., Roye, D. P. Epidemiology of pediatric spinal cord injury in the united states: Years 1997 and 2000. Journal of Pediatric Orthopedics. 26 (6), 745-749 (2006).
- Bregman, B. S., Goldberger, M. E. Anatomical plasticity and sparing of function after spinal cord damage in neonatal cats. Science. 217 (4559), 553-555 (1982).
- Castro, A. J. Ipsilateral corticospinal projections after large lesions of the cerebral hemisphere in neonatal rats. Experimental Neurology. 46 (1), 1-8 (1975).
- Commissiong, J. W., Toffano, G. Complete spinal cord transection at different postnatal ages: Recovery of motor coordination correlated with spinal cord catecholamines. Experimental Brain Research. 78 (3), 597-603 (1989).
- Yuan, Q., Su, H., Chiu, K., Wu, W., Lin, Z. Contrasting neuropathology and functional recovery after spinal cord injury in developing and adult rats. Neuroscience Bulletin. 29 (4), 509-516 (2013).
- Kim, J., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualizing and manipulating neuronal circuits in vivo. The European Journal of Neuroscience. 37 (8), 1203-1220 (2013).
- Pawliuk, R., et al. Correction of sickle cell disease in transgenic mouse models by gene therapy. Science. 294 (5550), 2368-2371 (2001).
- Atasoy, D., Sternson, S. M. Chemogenetic tools for causal cellular and neuronal biology. Physiological Reviews. 98 (1), 391-418 (2018).
- Brandt, H. M., Apkarian, A. V. Biotin-dextran: A sensitive anterograde tracer for neuroanatomic studies in rat and monkey. Journal of Neuroscience Methods. 45 (1-2), 35-40 (1992).
- Veenman, C. L., Reiner, A., Honig, M. G. Biotinylated dextran amine as an anterograde tracer for single- and double-labeling studies. Journal of Neuroscience Methods. 41 (3), 239-254 (1992).
- Reiner, A., et al. Pathway tracing using biotinylated dextran amines. Journal of Neuroscience Methods. 103 (1), 23-37 (2000).
- Oguchi, M., et al. Double virus vector infection to the prefrontal network of the macaque brain. PloS One. 10 (7), 0132825 (2015).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487 (7406), 235-238 (2012).
- Bernstein, D. R., Stelzner, D. J. Plasticity of the corticospinal tract following midthoracic spinal injury in the postnatal rat. The Journal of Comparative Neurology. 221 (4), 382-400 (1983).
- Brown, K., Wolfe, B., Wrathall, J. Rapid functional recovery after spinal cord injury in young rats. Journal of Neurotrauma. 22, 559-574 (2005).
- Tillakaratne, N. J. K., et al. Functional recovery of stepping in rats after a complete neonatal spinal cord transection is not due to regrowth across the lesion site. Neuroscience. 166 (1), 23-33 (2010).
- Kartje-Tillotson, G., Neafsey, E. J., Castro, A. J. Electrophysiological analysis of motor cortical plasticity after cortical lesions in newborn rats. Brain Research. 332 (1), 103-111 (1985).
- Gennaro, M., et al. Focal stroke in the developing rat motor cortex induces age- and experience-dependent maladaptive plasticity of corticospinal system. Frontiers in Neural Circuits. 11, 47 (2017).
- Brichta, A. M., Grant, G., Paxinos, G. Cytoarchitectural organization of the spinal cord. The rat nervous system. 2, 294-309 (1985).
- Kjell, J., Olson, L. Rat models of spinal cord injury: From pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Takeoka, A., Arber, S. Functional local proprioceptive feedback circuits initiate and maintain locomotor recovery after spinal cord injury. Cell Reports. 27 (1), 71-85 (2019).
- Flynn, J. R., Graham, B. A., Galea, M. P., Callister, R. J. The role of propriospinal interneurons in recovery from spinal cord injury. Neuropharmacology. 60 (5), 809-822 (2011).
- Ohne, H., et al. Mechanism of forelimb motor function restoration in rats with cervical spinal cord hemisection-neuroanatomical validation. IBRO Reports. 7, 10-25 (2019).
- Wang, X., et al. Deconstruction of corticospinal circuits for goal-directed motor skills. Cell. 171 (2), 440-455 (2017).
- Sheikh, I. S., et al. Retrogradely transportable lentivirus tracers for mapping spinal cord locomotor circuits. Frontiers in Neural Circuits. 12, 60 (2018).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487, 235-238 (2012).
- Keefe, K. M., Junker, I. P., Sheikh, I. S., Campion, T. J., Smith, G. M. Direct injection of a lentiviral vector highlights multiple motor pathways in the rat spinal cord. Journal of Visualized Experiments: JoVE. (145), e59160 (2019).
- Hutson, T. H., Verhaagen, J., Yáñez-Muñoz, R. J., Moon, L. D. F. Corticospinal tract transduction: A comparison of seven adeno-associated viral vector serotypes and a non-integrating lentiviral vector. Gene Therapy. 19 (1), 49-60 (2012).
- Liu, Y., Keefe, K., Tang, X., Lin, S., Smith, G. M. Use of self-complementary adeno-associated virus serotype 2 as a tracer for labeling axons: Implications for axon regeneration. Plos One. 9 (2), 87447 (2014).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Abdellatif, A. A., et al. delivery to the spinal cord: Comparison between lentiviral, adenoviral, and retroviral vector delivery systems. Journal of Neuroscience Research. 84 (3), 553-567 (2006).
- Zingg, B., Peng, B., Huang, J., Tao, H. W., Zhang, L. I. Synaptic specificity and application of anterograde transsynaptic AAV for probing neural circuitry. The Journal of Neuroscience. 40 (16), 3250-3267 (2020).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences of the United States of America. 104 (12), 5163-5168 (2007).
- Roth, B. L. DREADDs for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Hasegawa, A., et al. Mechanism of forelimb motor function restoration after cervical spinal cord hemisection in rats: A comparison of juveniles and adults. Behavioural Neurology. 2016, 1035473 (2016).
- Alstermark, B., Isa, T. Circuits for skilled reaching and grasping. Annual Review of Neuroscience. 35, 559-578 (2012).
- García-Alías, G., Truong, K., Shah, P. K., Roy, R. R., Edgerton, V. R. Plasticity of subcortical pathways promote recovery of skilled hand function in rats after corticospinal and rubrospinal tract injuries. Experimental Neurology. 266, 112-119 (2015).
- Tohyama, T., et al. Contribution of propriospinal neurons to recovery of hand dexterity after corticospinal tract lesions in monkeys. Proceedings of the National Academy of Sciences of the United States of America. 114 (3), 604-609 (2017).
- Z'Graggen, W. J., et al. Compensatory sprouting and impulse rerouting after unilateral pyramidal tract lesion. Journal of Neuroscience. 20 (17), 6561-6569 (2000).
- Ueno, M., et al. Corticospinal circuits from the sensory and motor cortices differentially regulate skilled movements through distinct spinal interneurons. Cell Reports. 23 (5), 1286-1300 (2018).
- Kim, J., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. Journal of Visualized Experiments: JoVE. (91), e51863 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены