Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cibler le tractus corticospinal chez les rats néonatals avec un vecteur double viral à l’aide d’une chirurgie combinée du cerveau et de la colonne vertébrale
Dans cet article
Résumé
Ce protocole démontre une nouvelle méthode d’application de thérapies géniques à des sous-populations de cellules chez des rats néonatals âgés de 5 à 10 jours après la naissance en injectant un modificateur chimiogénétique antérograde dans le cortex somatomoteur et une Cre recombinase rétrogradablement transportable dans la moelle épinière cervicale.
Résumé
Il est important de s’attaquer avec succès aux obstacles qui entravent la recherche sur les rats nouveau-nés pour étudier les différences dans les résultats observés dans les lésions de la moelle épinière (LME) pédiatriques par rapport aux lésions médullaires adultes. En outre, l’introduction fiable de thérapies dans les cellules cibles du système nerveux central (SNC) peut être difficile, et les inexactitudes peuvent compromettre l’efficacité de l’étude ou de la thérapie. Ce protocole combine la technologie des vecteurs viraux avec une nouvelle technique chirurgicale pour introduire avec précision des thérapies géniques chez les rats nouveau-nés au 5e jour postnatal. Ici, un virus conçu pour le transport rétrograde (rétroAAV2) de Cre est introduit aux terminaisons axonales des neurones corticospinaux de la moelle épinière, où il est ensuite transporté vers les corps cellulaires. Un récepteur concepteur à double flox à orientation inversée (DIO) exclusivement activé par le virus DREADD (drogue(s) de synthèse (DREADD) est ensuite injecté dans le cortex somatomoteur du cerveau. Cette technique de double infection favorise l’expression des DREADDs uniquement dans les neurones cortico-infectés (CST). Ainsi, la co-injection simultanée du cortex somatomoteur et des terminaux CST cervicaux est une méthode valide pour étudier la modulation chimiogénétique de la récupération à la suite de modèles de lésions médullaires cervicales chez le rat nouveau-né.
Introduction
Bien que l’ICS soit relativement rare dans la population pédiatrique, elle est particulièrement traumatisante et entraîne une invalidité permanente nécessitant une immense prévoyance logistique. De plus, une proportion plus élevée de lésions médullaires pédiatriques est classée comme cervicale et complète par rapport à la population adulte 1,2. Une caractéristique des espèces de mammifères est que les nouveau-nés se rétablissent nettement mieux de la lésion médullaire que les adultes, ce qui offre l’occasion d’évaluer les mécanismes moteurs du rétablissement dans les populations plus jeunes 3,4,5. Malgré cela, il y a moins d’études multimodales abordant la recherche sur les rongeurs nouveau-nés et infantiles, en partie en raison de la difficulté supplémentaire de cibler avec précision certaines populations de neurones dans les repères anatomiques beaucoup plus serrés des jeunes animaux6. Cet article se concentre sur l’injection directe de vecteurs adéno-associés antérogrades et rétrogrades hautement efficaces dans la moelle épinière du rat pour moduler les principales voies motrices avec l’application de Cre-dépendant-DREADDs, élargissant ainsi la portée des études de régénération multimodale.
Les vecteurs viraux sont des outils biologiques importants avec un large éventail d’applications, y compris l’introduction de matériel génétique pour remplacer les gènes cibles, réguler à la hausse les protéines de croissance et tracer le paysage anatomique du SNC 7,8,9. De nombreux détails anatomiques des voies motrices de la colonne vertébrale ont été étudiés à l’aide de traceurs classiques, c’est-à-dire l’amine de dextrane biotinylée. Bien que les traceurs traditionnels aient joué un rôle déterminant dans la découverte de la neuroanatomie, ils ne sont pas sans inconvénients: ils marquent indistinctement les voies même s’ils sont correctement injectés, et des études ont montré qu’ils sont absorbés par des axones endommagés10,11,12. Par conséquent, cela pourrait conduire à des interprétations incorrectes dans les études de régénération où les axones sectionnés pourraient être confondus avec des fibres régénérantes.
La méthode suivante utilise le système de vecteurs biviraux récemment popularisé dans les études de modulation, avec deux vecteurs viraux différents dans deux zones distinctes du même neurone13,14. Le premier est un vecteur qui infecte localement les corps cellulaires des neurones de projection. L’autre est un vecteur rétrograde transporté depuis les terminaisons axonales des neurones de projection (Figure 1). Le vecteur rétrograde porte la Cre recombinase, et le vecteur local incorpore la séquence à double flox « Cre-On » dans laquelle une protéine fluorescente (mCherry) est codée. Le transgène natif exprimant à la fois hM3Dq et mCherry est inversé par rapport au promoteur et est flanqué de deux sites LoxP (Figure 2). Ainsi, mCherry n’est exprimé que dans les neurones de projection doublement transduits où la Cre recombinase induit un événement de recombinaison entre les sites LoxP, inversant l’orientation du transgène dans le cadre de lecture approprié et permettant l’expression à la fois du DREADD et de la protéine fluorescente. Une fois que le transgène viral est dans la bonne orientation, et le cas échéant, les DREADDs peuvent induire transitoirement une neuromodulation par le biais d’un ligand injecté séparément, c’est-à-dire la clozapine-N-oxyde. Le protocole a été conçu pour authentifier la recherche sur la neuromodulation inductible chez les nouveau-nés, dans laquelle des DREADDS sont injectés pour moduler les CST de manière sélective. Le système biviral agit comme une police d’assurance, garantissant que chaque cellule DREADD-positive est traçable sous fluorescence avec une haute fidélité pour valider les injections.
Cette méthode aide également à combler les lacunes dans la recherche néonatale. La lésion médullaire pédiatrique présente ses défis, et la recherche analysant la régénération, la germination ou la plasticité devrait mettre l’accent sur les différences entre les nouveau-nés et les adultes 3,15,16,17. En optimisant l’intervention chirurgicale et en réalisant des études anatomiques préalables avec coloration Nissl, les coordonnées des injections crâniennes et vertébrales ont été validées. L’objectif était de fournir une méthode d’injections doubles chez un rat nouveau-né avec une fidélité et une capacité de survie accrues.
Pour le modèle actuel, le vecteur antérograde a été injecté dans les corps cellulaires du cortex somatomoteur en utilisant le bregma comme référence18,19. En ce qui concerne les injections vertébrales, le vecteur rétrograde a été injecté dans les lames V-VII, où résident les terminaux axonaux CST20,21. De nombreuses questions fondamentales sous-tendent la façon dont certains modèles de lésions affectent différemment les jeunes animaux et comment le rétablissement ultérieur diverge d’un animal plus âgé. Cette étude démontre un moyen robuste d’étudier les lésions cervicales et la récupérabilité de la fonction des membres antérieurs chez les rongeurs néonatals. En revanche, la majorité des études antérieures ont porté sur la locomotion de récupération à la suite de blessures lombaires ou thoraciques 5,22,23,24. En associant le vecteur double viral à la nouvelle technique d’injection décrite ici, ce protocole aide à atténuer certains problèmes (c.-à-d. la capacité de survie) qui peuvent nuire aux enquêtes néonatales sur les rongeurs. Cette méthode est robuste, pratique et polyvalente : de légères variations dans la technique permettront de cibler différentes voies, c’est-à-dire la CST ventrale, la CST dorsale et les voies dorsales ascendantes.
Pour ce système, un virus à action locale (par exemple, AAV2) est injecté dans la région des corps cellulaires neuronaux d’intérêt. Un deuxième virus transporté rétrograde qui contrôle l’expression du virus local est injecté aux terminaisons axonales pour cette population neuronale. Ainsi, par définition, seuls les neurones corticospinaux sont étiquetés. Le virus rétroAAV-Cre a été choisi avec un promoteur de CMV constituant actif, car le plasmide navette est utilisé pour générer plusieurs sérotypes AAV pour l’expression Cre-dépendante dans plusieurs types cellulaires. Pour les injections corticales, AAV2 a été choisi avec le transgène entraîné par le promoteur de la synapsine-1 pour limiter toute expression aux neurones. Parce que le système 2-viral repose davantage sur l’origine et la terminaison de la population neuronale d’intérêt, plusieurs promoteurs différents pourraient être utilisés, s’ils peuvent conduire l’expression des gènes d’intérêt au sein de la population neuronale d’intérêt. Par exemple, le promoteur neuronal excitateur, CamKII, pourrait être substitué à la synapsine-1. En plus de l’utilisation de ces sérotypes AAV, le transport rétrograde dans les motoneurones corticospinaux immatures et, dans une bien moindre mesure, adultes peut également être réalisé à l’aide du lentivirus transportable hautement rétrograde (HiRet)25. Les lentivirus HiRet utilisent une glycoprotéine chimérique rage/VSV pour cibler l’absorption au niveau de la synapse pour le transport rétrograde. Combiné à un promoteur Tet-On, ce système 2-viral supporte l’expression inductible de manière rétrogradedépendante 26,27.
Les virus rétrogrades insèrent des vecteurs dans l’espace synaptique d’un neurone cible, ce qui lui permet d’être absorbé par l’axone de cette cellule et transporté vers le corps cellulaire. Alors que les vecteurs lentiviraux ont déjà connu un énorme succès, fournissant une expression à long terme dans les études de thérapie génique, cette méthode s’est tournée vers les vecteurs viraux adéno-associés pour quelques raisons simples26,28: AAV est plus économique, tout aussi efficace et présente moins de fardeau logistique, étant donné qu’il a une désignation de niveau de biosécurité inférieure 29,30,31,32 . Alors que AAV2, le sérotype le plus utilisé, démontre une transfection robuste des axones CST, les futurs chercheurs pourraient noter que AAV1 offre une certaine polyvalence car il marque de manière transynaptique, mettant ainsi en avant plusieurs itérations possibles dans de futures études33. L’adaptation finale consiste à coder le virus rétrograde avec la Cre-recombinase afin que plusieurs vecteurs antérogrades puissent être introduits simultanément, réduisant ainsi les déchets viraux internes inutiles et maximisant la probabilité que les DREADDs s’expriment dans la bonne orientation.
En fin de compte, ce protocole démontre l’injection simultanée dans le cortex et la colonne cervicale, ciblant spécifiquement les corps cellulaires et les terminaisons axonales du tractus corticospinal, respectivement. La transfection haute fidélité est observée dans le cortex cérébral et la moelle épinière. Bien que le protocole décrit ait été perfectionné pour les rats Sprague Dawley âgés de 5 jours, il convient aux jours postnataux 4 à 10 avec des ajustements mineurs à l’anesthésie et aux coordonnées stéréotaxiques.
Protocole
Toutes les procédures chirurgicales et de soins aux animaux suivantes ont été approuvées par le Comité de soin et d’utilisation des animaux de l’Université Temple. Le protocole décrit est une chirurgie de survie, et les animaux ont finalement été euthanasiés par injection intrapéritonéale de 100 mg/kg de pentobarbital sodique à la fin de leurs points temporels.
1. Préparation préopératoire
- Préparer au moins deux aiguilles en verre tiré pour l’injection virale à l’aide de pipettes capillaires en verre de 3,5 nL; une aiguille pour le DREADD et une aiguille pour le rCre. Par mesure de précaution, préparez 4-5 aiguilles au cas où elles se casseraient en peropératoire.
- À l’aide de microciseaux, coupez 1 à 2 mm d’excès de verre de l’aiguille.
- Pour chaque aiguille, positionnez-la à 30°, utilisez un biseauteur à micropipette pour créer une pointe avec une ouverture de 30-40 μm et un angle biseauté de 45°.
- Conservez les aiguilles dans une boîte de Petri couverte, puis stérilisez-les en plaçant la boîte de Petri dans une cagoule de biosécurité sous lumière UV pendant 15 min.
- Préparez les virus nécessaires en retirant un volume approprié du congélateur à -80 °C avant l’intervention, en gardant à l’esprit que chaque animal aura besoin de 3 μL de chaque virus.
REMARQUE : Transportez et conservez le virus sur de la glace lorsqu’il n’est pas utilisé. Ce protocole a été développé en utilisant AAV2-hM3Dq-mCherry et AAV2-retroCre pour injecter 3 μL de chaque virus par animal. Le plasmide DREADD, pAAV-hSyn-DIO-hM3Dq-mCherry (voir le tableau des matériaux), a été utilisé pour fabriquer l’AAV2 antérograde avec un titre viral de 1,54 × 1012 copies du génome (GC)/mL. Le plasmide Cre, pAAV-CMV-scCre, a été utilisé pour fabriquer l’AAV2 rétrograde avec un titre viral de 4,27 × 1012 GC / mL. - Branchez l’injecteur dans la micropompe et placez-le dans un micromanipulateur avec une balance de Vernier.
- Pour aider à confirmer visuellement la présence ou l’absence de virus dans l’aiguille, chargez un colorant coloré, c’est-à-dire de l’huile rouge, dans l’aiguille. Évitez les bulles dans l’aiguille.
- Insérez l’aiguille en verre dans l’injecteur, en vous assurant que l’aiguille s’ajuste correctement.
- Si disponible, répétez l’ensemble du processus avec une pompe d’injection distincte pour chaque virus. S’il n’y a qu’une seule pompe d’injection disponible, préparez deux aiguilles distinctes et remplacez l’aiguille usagée lorsqu’il est temps d’échanger les virus.
2. Anesthésie et préparation du site chirurgical
- Pesez l’animal sur une balance numérique. Notez le poids préopératoire pour déterminer le volume d’anesthésique requis.
REMARQUE: Ce protocole a révélé que la technique anesthésique la plus fiable pour assurer un plan anesthésique satisfaisant tout au long de la période opératoire est une combinaison de kétamine et d’hypothermie. La kétamine est insuffisante pour assurer l’anesthésie seule, et la compléter avec de la xylazine a un seuil étroit avant d’augmenter la mortalité peropératoire. L’hypothermie seule n’est pas suffisante pour les chirurgies prolongées (la double chirurgie de la colonne vertébrale et du cerveau nécessite probablement >1 h d’anesthésie constante). - Anesthésier le chiot en injectant de la kétamine diluée (10 mg/mL) par voie sous-cutanée entre les omoplates afin que l’animal reçoive une dose de 100 mg/kg de kétamine; Attendez 5 min.
REMARQUE : Par exemple, au 5e jour postnatal, un raton pèse 10 g et reçoit 0,1 mL de la solution de kétamine diluée (10 mg/mL). - Placez le chiot sur de la glace pilée pendant 6-8 min. Protégez-le contre les engelures en plaçant l’animal dans un gant ou un parafilm en latex pour éviter tout contact direct avec la glace.
- Pincez fermement le pied à l’aide d’une pince pour confirmer un plan anesthésique approprié. Si un retrait réflexif se produit, laisser reposer 2 minutes supplémentaires sur la glace avant de continuer.
- Appliquer largement l’antiseptique sur la tête et le dos de l’animal à l’aide d’une gaze stérile imbibée d’une solution d’iode à 5%. Ensuite, stérilisez avec de la gaze imbibée d’éthanol à 70%. Appliquez les lingettes antiseptiques trois fois chacune, en alternant entre l’iode et l’éthanol pour faire tremper la gaze.
REMARQUE: Il n’y a pas besoin de soins oculaires car les jeunes chiots n’ouvrent les yeux qu’à l’âge de 14 jours. - Si un animal doit subir une double chirurgie (cerveau + colonne vertébrale), fournir un bolus salin normal avant la chirurgie (0,02 mL/g) par voie sous-cutanée entre les omoplates.
REMARQUE : si l’animal réagit pendant la chirurgie et qu’une anesthésie supplémentaire est nécessaire, replacez l’animal sur la glace pendant 5 minutes.
3. Domaine chirurgical et préparation des instruments
- Autoclave les outils chirurgicaux qui comprennent un porte-scalpel, des rongeurs, des hémostatiques, des pinces courbes à point moyen et des rétracteurs
- Préparez le microscope et installez l’adaptateur stéréotaxique pour le rat nouveau-né afin de le positionner fermement dans le support stéréotaxique adulte.
- Effectuez la chirurgie à l’aide de gants stérilisés. Ouvrez un paquet de gants chirurgicaux stériles préemballés et placez l’enveloppe de gants stériles sur la table, en utilisant l’emballage comme zone supplémentaire pour placer les outils usagés.
REMARQUE: Il est important de suivre une bonne pratique chirurgicale et de maintenir la stérilité tout au long de la procédure. - Fixez une lame 11 dans le porte-scalpel. Placez une solution saline stérile, une suture chromique 4.0 catgut, une suture de soie 4.0 et des matériaux pour contrôler les saignements, par exemple de la gaze stérile, des applicateurs stériles à pointe de coton et des triangles.
- Mettre en place deux champs chirurgicaux comme décrit ci-dessus, avec un site assigné pour la craniotomie et l’autre site assigné pour la laminectomie cervicale.
- Récupérez l’animal et fixez-le dans l’adaptateur stéréotaxique : comme les nouveau-nés sont très cartilagineux, fixez-les doucement en dirigeant largement les barres d’oreille vers les articulations mandibulaires. Une fois stabilisé horizontalement, introduisez doucement l’embout buccal avant.
REMARQUE: Une règle non contraignante utilisée pour fournir une zone chirurgicale « plate » consiste à fixer les barres auriculaires à la même hauteur et l’embout buccal à environ 2-3 niveaux plus bas.
4. Effectuer la craniotomie et exposer le cortex somatomoteur
- Identifiez la zone où l’incision sera faite en appuyant sur la pince dans la ligne médiane sur le dessus du cuir chevelu, en sentant la suture sagittale. Faites une incision de 1 cm le long du plan de suture sagittale, en commençant immédiatement au-dessus de la ligne des yeux. Tenez la peau tendue pour assurer une incision propre, droite et précise.
- Identifier le bregma (la convergence des sutures coronales et sagittales) en sondant doucement les forceps le long de la surface du crâne et en portant une attention particulière aux lignes de suture ainsi qu’à toute indentation causée par les pinces longeant les os pariétaux et frontaux.
- Maintenir l’ouverture avec l’application de crochets lestés du côté de l’intérêt. Notez que l’injection vertébrale se fait du côté droit, l’injection crânienne est du côté gauche.
- Effacer l’aponévrose avec une combinaison des pointes de coton et des microciseaux pour maximiser l’exposition au bregma pour une précision accrue. Assurez-vous que la suture coronale est bien visible suffisamment latéralement pour fournir un gabarit approximatif pour les injections ultérieures.
- À l’aide des microciseaux, découpez environ une section de 3 x 2 mm de l’os frontal gauche du crâne immédiatement adjacent au bregma.
REMARQUE: Une fois que le lambeau osseux a été soigneusement retiré, il devrait y avoir une fenêtre claire avec la matière cérébrale exposée prête à être injectée. Les lignes de suture restantes du côté controlatéral du cerveau agiront comme un guide visuel pour maintenir la précision le long de l’axe antéro-postérieur (AP). - Enlevez tous les débris, le liquide céphalorachidien (LCR) et le sang avec des pointes de coton.
REMARQUE: Il est normal que le sang ou le LCR obscurcisse légèrement la ligne visuelle, il est donc conseillé de nettoyer régulièrement la zone avec des pointes de coton.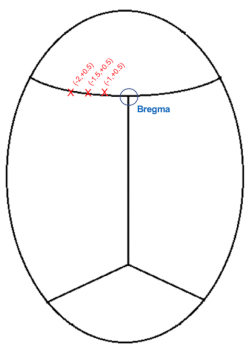
Figure 3 : Illustration schématique des coordonnées crâniennes d’injection (mm) par rapport au bregma. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Chargement du virus et positionnement de l’injecteur
- Chargez le virus dans l’injecteur en pipetant ~5 μL sur un morceau de parafilm et positionnez l’aiguille de manière à ce que l’embout repose sur la gouttelette du virus.
- Assurez-vous que le virus supplémentaire est chargé dans l’injecteur pour assurer une injection en douceur. Par exemple, lors de l’injection d’un total de 3 μL (1 μL pour chaque site d’injection), prélever 4 μL du virus à un débit de 250 nL/s à l’aide de la micropompe.
- Retirez l’excès de virus avec une lingette de laboratoire.
- Positionnez le micromanipulateur de manière à ce que l’échelle de Vernier soit visible et placez l’aiguille au-dessus de la suture sagittale.
- Abaissez l’aiguille juste au-dessus de la zone représentant le bregma (Figure 3) et notez les coordonnées AP et médiale-latérale (ML).
- Étant donné que les injections seront sur le côté gauche, générez les coordonnées de la cible en soustrayant 1, 1,5 et 2,0 mm (ML: -1,0, -1,5, -2,0) des coordonnées ML pour le bregma.
REMARQUE: La position AP sera de +0,5 mm de bregma pour les trois injections. - Déplacez l’aiguille en position pour la première injection. AP: +0.5, ML: -1.0
- Abaissez l’aiguille jusqu’au cerveau exposé jusqu’à ce qu’elle indente le cortex externe. Notez la hauteur de l’aiguille et abaissez l’aiguille en soustrayant 0,6 mm de la hauteur de la surface du cerveau. Profondeur d’injection: surface corticale -0,6 mm.
REMARQUE : Il est important de noter la profondeur de la surface pour chaque injection, car de légères perturbations du positionnement du rat peuvent survenir.
6. Injection du virus dans le cortex somatomoteur
- Une fois l’aiguille en place, programmez l’injecteur pour injecter 1 μL à un débit de 250 nL/min.
- Une fois l’injection terminée, laissez l’aiguille reposer dans le cortex pendant 3 minutes.
- Répéter les injections pour les autres coordonnées: un total de 3 injections le long du cortex par rapport au bregma, le tout à une profondeur de -0,6 mm: 1) AP: +0,5 mm, ML: -1,0 mm 2) AP: +0,5 mm, ML: -1,5 mm 3) AP: +0,5 mm, ML: -2,0 mm.
- Une fois les injections terminées, reportez-vous à la section 9 pour la suture et transférez l’animal à l’autre table d’opération pour une laminectomie cervicale.
7. Création d’une fenêtre vertébrale pour des injections précises de la moelle épinière
- Identifiez le site d’incision en utilisant les doigts pour palper la base du crâne. À mi-parcours, commencez l’incision de 1 à 2 mm en arrière de la base du crâne à l’aide d’une lame #11 et étendez l’incision de 1 cm vers l’arrière pour exposer le muscle superficiel. Maintenez la peau tendue en appliquant une tension avec le pouce et l’index pour assurer une incision propre.
- En utilisant la pointe tranchante de la lame, faites doucement une série de coupures le long de la ligne médiane du muscle superficiel pour exposer la cavité vertébrale et les muscles profonds de la colonne vertébrale. Utilisez une paire de forceps pour ouvrir le muscle et visualiser la fenêtre chirurgicale.
REMARQUE: Le muscle superficiel apparaîtra rose clair, tandis que les muscles rachidiens profonds apparaîtront d’un gris blanchâtre clair. - Une fois que les muscles profonds de la colonne vertébrale ont été exposés, insérez des rétracteurs dans la fenêtre chirurgicale. Si nécessaire, utilisez des pinces pour saisir la peau latérale et les muscles afin de les étirer autour des dents des rétracteurs. Rétractez la fenêtre chirurgicale à 7-8 mm de largeur, permettant une vue dégagée de la colonne vertébrale.
- Identifier la deuxième vertèbre cervicale (C2 ou axe) par son apophyse épineuse proéminente qui se projette dorsalement et encapsule dans un grand muscle en forme de dôme. Utilisez une pince ou une sonde émoussée pour sentir et identifier ce processus, car ce sera le point de repère directeur.
REMARQUE: La vertèbre C3 adjacente est souvent légèrement obstruée par le gros muscle C2; par conséquent, une dissection douce du muscle en C3 avec une pince ou un grattoir osseux aide à définir la vertèbre et aide au comptage vertébral. - À l’aide du bord plat d’un grattoir osseux, exposer les vertèbres C3-C7 en grattant doucement le muscle rachidien profond sur les côtés. Commencez médialement et raclez latéralement le long de la direction parallèle aux lames vertébrales pour assurer une exposition appropriée, ce qui permettra une distinction claire des lames vertébrales. Contrôlez tout saignement avec des pointes de coton.
- À l’aide d’une paire de microciseaux, couper soigneusement les bords latéraux des lames cartilagineuses à C6 et C7. Utilisez C2 comme guide lors du comptage des niveaux vertébraux.
- À l’aide d’une paire de pinces fines, retirez soigneusement la partie disséquée de la lame pour exposer la moelle épinière. Assurez-vous que la fenêtre vertébrale est suffisamment grande pour accueillir le site d’injection souhaité. Enlevez toutes les parties tranchantes ou dentelées de l’os qui peuvent percer la moelle épinière avec des microciseaux et des forceps comme décrit ci-dessus.
- Installez l’animal dans le support crânien stéréotaxique comme décrit à la section 3.6. De plus, placez un morceau de gaze enroulé sous le tronc de l’animal pour élever son arrière-train.
REMARQUE : L’élévation de l’arrière-train de l’animal soulève efficacement le thorax de la surface du support pour empêcher les mouvements respiratoires d’affecter la position de l’aiguille pendant l’injection. - Avant de commencer les injections, nettoyez la fenêtre vertébrale de tout sang ou liquide céphalorachidien en appliquant doucement des pointes de coton et des triangles Sugi sur la zone sans insulter la moelle épinière. De plus, créez une barrière autour du périmètre de la fenêtre pour empêcher l’occlusion du site d’injection par un saignement continu ou une fuite de LCR. Pour ce faire, placez un petit morceau de coton résorbable dans les parties latérales de la fenêtre vertébrale.
8. Injections directes dans la moelle épinière ciblant les terminaisons axonales
- À l’aide de la pointe de l’aiguille d’injection en verre, approximez la ligne médiane de la moelle épinière en identifiant l’artère rachidienne. Cependant, si l’artère rachidienne est visiblement décentrée ou dévie de quelque manière que ce soit, approximez la ligne médiane en utilisant la position du processus épineux C2 et en l’extrapolant le long de la colonne vertébrale.
REMARQUE : reportez-vous à la section 5.1 pour obtenir des instructions sur le chargement du virus. - Une fois identifiée, placez l’aiguille juste en arrière de la lame C5 à la ligne médiane approximative et utilisez-la comme point de référence. Ensuite, à l’aide du micromanipulateur, déplacez l’aiguille latéralement vers la droite de 0,3 mm. Abaissez l’aiguille jusqu’à ce qu’elle touche simplement la surface de la moelle épinière; À partir de cette profondeur, plongez l’aiguille de 0,6 mm dans la moelle épinière. Si nécessaire, continuez à plonger l’aiguille jusqu’à ce qu’elle perfore la moelle épinière; Ensuite, rétractez ou abaissez l’aiguille à la profondeur appropriée.
- Injecter 1 μL de rétroAAV2-scCre à 250 nL/min. Une fois l’injection terminée, attendez 2 minutes que le virus se diffuse dans la moelle épinière avant de retirer lentement l’aiguille. Répétez les injections en utilisant les mêmes coordonnées latérales et de profondeur à deux autres sites dans la fenêtre vertébrale, l’un au milieu et le dernier juste avant la lame T1.
9. Fermeture de la plaie et soins postopératoires
- Retirez l’animal du support stéréotaxique et retirez les rétracteurs ou les crochets. Nettoyez la zone de la plaie avec quelques gouttes de solution saline normale stérile.
- Suturez le cuir chevelu avec 4.0 suture de soie, deux ou 3 sutures au total.
- Lorsque vous suturez l’ouverture cervicale, utilisez l’intestin chromique 4.0 pour rattacher étroitement les couches musculaires (2 sutures devraient suffire). Suturer l’ouverture de la peau cervicale avec de la soie 4.0 (4 sutures attendues).
- Une fois l’animal fermé, appliquez judicieusement un bandage liquide sur les sutures.
- Placez l’animal sous une lampe chauffante et surveillez-le de près jusqu’à ce qu’il soit entièrement réveillé. Une fois que l’animal est éveillé, en mouvement et sec, nettoyez doucement les plaies avec de la gaze stérile. Ne laissez pas l’animal sans surveillance jusqu’à ce qu’il ait repris suffisamment conscience pour maintenir une position couchée sternale.
- Remettez l’animal dans la cage familiale avec sa mère. Prenez soin de prévenir la négligence et la cannibalisation du nourrisson de la mère envers les chiots:
- Familiariser les investigateurs avec la mère en prévision de la chirurgie grâce à une manipulation douce (5-10 min) deux fois par jour, en commençant une semaine avant la chirurgie.
- Remettez les chiots ensemble dans la cage familiale pour limiter les perturbations pour la mère.
- Injecter à la mère 1,5 mg/kg d’acépromazine toutes les 12 h par voie sous-cutanée le jour de la chirurgie.
NOTE: La gestion de la douleur sert le double objectif de fournir une analgésie pour les chiots et d’encourager un retour plus rapide à l’activité, favorisant ainsi la réintégration avec la mère. - Injecter 0,05 mg/kg de buprénorphine par voie sous-cutanée toutes les 8 heures en commençant après la chirurgie pendant 3 jours au total (jours postopératoires 0, 1, 2).
Résultats
L’injection et le transport réussis du vecteur viral devraient entraîner la transduction des neurones unilatéraux dans la moelle épinière et le cortex moteur. La figure 4 montre le marquage des neurones CST de couche V dans le cortex moteur d’une section coronale cérébrale exprimant Cre-dépendant-DREADDs-mCherry co-injecté avec une injection controlatérale de rCre dans la colonne vertébrale. Les sections ont été colorées avec l’anticorps dsRed.
Discussion
La modulation génétique inductible de l’activité cérébrale avec des modificateurs chimiogénétiques injectables est un outil puissant pour étudier les divers mécanismes qui sous-tendent la récupération des lésions médullaires. La précision du ciblage des récepteurs couplés aux protéines G inductibles (DREADD) est encore accrue si l’on considère que le tracé de fluorescence valide la précision anatomique en histologie. Cet article traite d’une méthode fiable pour explorer si l’inhibition ou la ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par une bourse de recherche des Hôpitaux Shriners pour enfants SHC-84706.
matériels
| Name | Company | Catalog Number | Comments |
| #11 scalpel blades | Roboz | RS-9801-11 | For use with the scalpel. |
| #10 Scalpel Blades | Roboz | RS-9801-10 | For use with the scalpel. |
| 1 mL Syringes | Becton, Dickinson and Company | 309659 | For anesthetic SC injection and fluid bolus |
| 4.0 silk suture | Ethicon | 771-683G | For skin closure |
| 4.0 Chromic Catgut Suture | DemeTECH | NN374-16 | To re-bind muscle during closing. |
| 48000 Micropipette Beveler | World Precision Instruments | 32416 | Used to bevel the tips of the pulled glass capillary tubes to form functional glass needles. |
| 5% Iodine Solution | Purdue Products L.P. | L01020-08 | For use in sterilzation of the surgical site. |
| 70% Ethanol | N/A | N/A | For sterilization of newly prepared glass needles, animal models during surgical preparation |
| Ketamine (Ketaset) | Zoetis | 240048 | For keeping the animal in the correct plane of consciousness during surgery. |
| Bead Sterilizer | CellPoint | 5-1450 | To heat sterilize surgical instruments. |
| Digital Scale | Okaus | REV.005 | For weighing the animal during surgical preparation. |
| Flexible Needle Attachment | World Precision Instruments | MF34G-5 | For cleaning glass needles and loading red oil into glass needles. |
| Glass Capillary Tubes | World Precision Instruments | 4878 | For pulled glass needles - should be designed for nanoliter injectors. |
| Hemostats | Roboz | RS-7231 | For general use in surgery. |
| Medium Point Curved Forceps | Roboz | RS-5136 | For general use in surgery. |
| Micromanipulator with a Vernier Scale | Kanetec | N/A | For precise targeting during surgery. |
| Microscissors | Roboz | RS-5621 | For cutting glass whisps off of freshly pulled glass capillary tubes. |
| Lab Standard Stereotaxic Instrument | Stoelting | 51600 | To hold the neonatal sterotaxic holder in place |
| Lab Standard with Mouse & Neonates Adaptor | 51615 | For neonatal skull fixation during cranial surgery and spinal injections | |
| Microscope with Light and Vernier Scale Ocular | Leitz Wetzlar | N/A | Used to visualize and measure beveling of pulled glass capillary tubes into functional glass needles. |
| MicroSyringe Pump Controller | World Precision Instruments | 62403 | To control the rate of injection. |
| Nanoliter 2000 Pump Head Injector | World Precision Instruments | 500150 | To load and inject virus in a controlled fashion. |
| Needle Puller | Narishige | PC-100 | To heat and pull apart glass capillary tubes to form glass needles. |
| pAAV-CMV-scCre | Wu lab | Cre plasmid | |
| pAAV-hSyn-DIO-hM3Dq-mCherry (plasmid #44361) | Bryan Roth’s lab through Addgene | DREADD plasmid | |
| Parafilm | Bemis | PM-996 | To assist with loading virus into the nanoinjector. |
| PrecisionGlide Needles (25G x 5/8) | Becton, Dickinson and Company | 305122 | For use with the 1mL and 10 mL syringes to allow injection of the animal model. |
| Rat Tooth Forceps | Roboz | RS-5152 | For griping spinous processes. |
| Red Oil | N/A | N/A | To provide a front for visualization of virus entering tissue during injection. |
| Retractors | Roboz | RS-6510 | To hold open the surgical wound. |
| Rongeurs | Roboz | RS-8300 | To remove muscle from the spinal column during surgery. |
| Scalpel Blade Handle | Roboz | RS-9843 | To slice open skin and fat pad of animal model during surgery. |
| Scissors | Roboz | RS-5980 | For general use in surgery. |
| Staple Removing Forceps | Kent Scientific | INS750347 | To remove the staples, should they be applied incorrectly. |
| Sterile Cloth | Phenix Research Products | BP-989 | To provide a sterile surface for the operation. |
| Sterile Cotton-Tipped Applicators | Puritan | 806-WC | To soak up blood in the surgical wound while maintaining sterility. |
| Sterile Gauze | Covidien | 2146 | To clean the surgical area and surgical tools while maintaining sterility. |
| Sterile Saline | Baxter Healthcare Corporation | 281324 | For use in blood clearing, and for replacing fluids post-surgery. |
| Surgical Gloves | N/A | N/A | For use by the surgeon to maintain sterile field during surgery. |
| Surgical Heating Pad | N/A | N/A | For maintaining the body temperature of the animal model during surgery. |
| Surgical Microscope | N/A | N/A | For enhanced visualization of the surgical wound. |
| Surgical Stapler | Kent Scientific | INS750546 | To apply the staples. |
| Water Convection Warming Pad | Baxter Healthcare Corporation | L1K018 | For use in the post-operational recovery area to maintain the body temperature of the unconscious animal. |
| Weighted Hooks | N/A | N/A | To hold open the surgical wound. |
| Liquid bandage | NewSkin | 985838 | To apply along sutures following surgery and encourage wound healing |
| Wire Cage Lamp | ZooMed | LF10EC | To help animals recover from anesthesia and retain warm body temperature naturally |
Références
- Parent, S., Mac-Thiong, J., Roy-Beaudry, M., Sosa, J. F., Labelle, H. Spinal cord injury in the pediatric population: A systematic review of the literature. Journal of Neurotrauma. 28 (8), 1515-1524 (2011).
- Vitale, M. G., Goss, J. M., Matsumoto, H., Roye, D. P. Epidemiology of pediatric spinal cord injury in the united states: Years 1997 and 2000. Journal of Pediatric Orthopedics. 26 (6), 745-749 (2006).
- Bregman, B. S., Goldberger, M. E. Anatomical plasticity and sparing of function after spinal cord damage in neonatal cats. Science. 217 (4559), 553-555 (1982).
- Castro, A. J. Ipsilateral corticospinal projections after large lesions of the cerebral hemisphere in neonatal rats. Experimental Neurology. 46 (1), 1-8 (1975).
- Commissiong, J. W., Toffano, G. Complete spinal cord transection at different postnatal ages: Recovery of motor coordination correlated with spinal cord catecholamines. Experimental Brain Research. 78 (3), 597-603 (1989).
- Yuan, Q., Su, H., Chiu, K., Wu, W., Lin, Z. Contrasting neuropathology and functional recovery after spinal cord injury in developing and adult rats. Neuroscience Bulletin. 29 (4), 509-516 (2013).
- Kim, J., et al. Viral transduction of the neonatal brain delivers controllable genetic mosaicism for visualizing and manipulating neuronal circuits in vivo. The European Journal of Neuroscience. 37 (8), 1203-1220 (2013).
- Pawliuk, R., et al. Correction of sickle cell disease in transgenic mouse models by gene therapy. Science. 294 (5550), 2368-2371 (2001).
- Atasoy, D., Sternson, S. M. Chemogenetic tools for causal cellular and neuronal biology. Physiological Reviews. 98 (1), 391-418 (2018).
- Brandt, H. M., Apkarian, A. V. Biotin-dextran: A sensitive anterograde tracer for neuroanatomic studies in rat and monkey. Journal of Neuroscience Methods. 45 (1-2), 35-40 (1992).
- Veenman, C. L., Reiner, A., Honig, M. G. Biotinylated dextran amine as an anterograde tracer for single- and double-labeling studies. Journal of Neuroscience Methods. 41 (3), 239-254 (1992).
- Reiner, A., et al. Pathway tracing using biotinylated dextran amines. Journal of Neuroscience Methods. 103 (1), 23-37 (2000).
- Oguchi, M., et al. Double virus vector infection to the prefrontal network of the macaque brain. PloS One. 10 (7), 0132825 (2015).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487 (7406), 235-238 (2012).
- Bernstein, D. R., Stelzner, D. J. Plasticity of the corticospinal tract following midthoracic spinal injury in the postnatal rat. The Journal of Comparative Neurology. 221 (4), 382-400 (1983).
- Brown, K., Wolfe, B., Wrathall, J. Rapid functional recovery after spinal cord injury in young rats. Journal of Neurotrauma. 22, 559-574 (2005).
- Tillakaratne, N. J. K., et al. Functional recovery of stepping in rats after a complete neonatal spinal cord transection is not due to regrowth across the lesion site. Neuroscience. 166 (1), 23-33 (2010).
- Kartje-Tillotson, G., Neafsey, E. J., Castro, A. J. Electrophysiological analysis of motor cortical plasticity after cortical lesions in newborn rats. Brain Research. 332 (1), 103-111 (1985).
- Gennaro, M., et al. Focal stroke in the developing rat motor cortex induces age- and experience-dependent maladaptive plasticity of corticospinal system. Frontiers in Neural Circuits. 11, 47 (2017).
- Brichta, A. M., Grant, G., Paxinos, G. Cytoarchitectural organization of the spinal cord. The rat nervous system. 2, 294-309 (1985).
- Kjell, J., Olson, L. Rat models of spinal cord injury: From pathology to potential therapies. Disease Models & Mechanisms. 9 (10), 1125-1137 (2016).
- Takeoka, A., Arber, S. Functional local proprioceptive feedback circuits initiate and maintain locomotor recovery after spinal cord injury. Cell Reports. 27 (1), 71-85 (2019).
- Flynn, J. R., Graham, B. A., Galea, M. P., Callister, R. J. The role of propriospinal interneurons in recovery from spinal cord injury. Neuropharmacology. 60 (5), 809-822 (2011).
- Ohne, H., et al. Mechanism of forelimb motor function restoration in rats with cervical spinal cord hemisection-neuroanatomical validation. IBRO Reports. 7, 10-25 (2019).
- Wang, X., et al. Deconstruction of corticospinal circuits for goal-directed motor skills. Cell. 171 (2), 440-455 (2017).
- Sheikh, I. S., et al. Retrogradely transportable lentivirus tracers for mapping spinal cord locomotor circuits. Frontiers in Neural Circuits. 12, 60 (2018).
- Kinoshita, M., et al. Genetic dissection of the circuit for hand dexterity in primates. Nature. 487, 235-238 (2012).
- Keefe, K. M., Junker, I. P., Sheikh, I. S., Campion, T. J., Smith, G. M. Direct injection of a lentiviral vector highlights multiple motor pathways in the rat spinal cord. Journal of Visualized Experiments: JoVE. (145), e59160 (2019).
- Hutson, T. H., Verhaagen, J., Yáñez-Muñoz, R. J., Moon, L. D. F. Corticospinal tract transduction: A comparison of seven adeno-associated viral vector serotypes and a non-integrating lentiviral vector. Gene Therapy. 19 (1), 49-60 (2012).
- Liu, Y., Keefe, K., Tang, X., Lin, S., Smith, G. M. Use of self-complementary adeno-associated virus serotype 2 as a tracer for labeling axons: Implications for axon regeneration. Plos One. 9 (2), 87447 (2014).
- Tervo, D. G. R., et al. A designer AAV variant permits efficient retrograde access to projection neurons. Neuron. 92 (2), 372-382 (2016).
- Abdellatif, A. A., et al. delivery to the spinal cord: Comparison between lentiviral, adenoviral, and retroviral vector delivery systems. Journal of Neuroscience Research. 84 (3), 553-567 (2006).
- Zingg, B., Peng, B., Huang, J., Tao, H. W., Zhang, L. I. Synaptic specificity and application of anterograde transsynaptic AAV for probing neural circuitry. The Journal of Neuroscience. 40 (16), 3250-3267 (2020).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences of the United States of America. 104 (12), 5163-5168 (2007).
- Roth, B. L. DREADDs for neuroscientists. Neuron. 89 (4), 683-694 (2016).
- Hasegawa, A., et al. Mechanism of forelimb motor function restoration after cervical spinal cord hemisection in rats: A comparison of juveniles and adults. Behavioural Neurology. 2016, 1035473 (2016).
- Alstermark, B., Isa, T. Circuits for skilled reaching and grasping. Annual Review of Neuroscience. 35, 559-578 (2012).
- García-Alías, G., Truong, K., Shah, P. K., Roy, R. R., Edgerton, V. R. Plasticity of subcortical pathways promote recovery of skilled hand function in rats after corticospinal and rubrospinal tract injuries. Experimental Neurology. 266, 112-119 (2015).
- Tohyama, T., et al. Contribution of propriospinal neurons to recovery of hand dexterity after corticospinal tract lesions in monkeys. Proceedings of the National Academy of Sciences of the United States of America. 114 (3), 604-609 (2017).
- Z'Graggen, W. J., et al. Compensatory sprouting and impulse rerouting after unilateral pyramidal tract lesion. Journal of Neuroscience. 20 (17), 6561-6569 (2000).
- Ueno, M., et al. Corticospinal circuits from the sensory and motor cortices differentially regulate skilled movements through distinct spinal interneurons. Cell Reports. 23 (5), 1286-1300 (2018).
- Kim, J., Grunke, S. D., Levites, Y., Golde, T. E., Jankowsky, J. L. Intracerebroventricular viral injection of the neonatal mouse brain for persistent and widespread neuronal transduction. Journal of Visualized Experiments: JoVE. (91), e51863 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon