A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
في الجسم الحي وظيفة المجموعات الفرعية التفاضلية للخلايا المتغصنة الجلدية للحث على مناعة Th17 في عدوى المبيضات البيضاء داخل الأدمة
In This Article
Summary
هنا ، نوضح الوظيفة في الجسم الحي للمجموعات الفرعية للخلايا المتغصنة الجلدية في مناعة Th17 لعدوى المبيضات البيضاء الجلدية العميقة.
Abstract
الجلد هو العضو الحاجز الخارجي في الجسم ، والذي يحتوي على عدة أنواع من الخلايا المتغصنة (DCs) ، وهي مجموعة من الخلايا المهنية العارضة للمستضد. عندما يواجه الجلد مسببات الأمراض الغازية ، تبدأ DCs الجلدية المختلفة استجابة مناعية مميزة للخلايا التائية لحماية الجسم. من بين مسببات الأمراض الغازية ، تؤدي العدوى الفطرية على وجه التحديد إلى استجابة مناعية واقية من الإنترلوكين -17 التي تنتج Th17. تم تطوير بروتوكول للتمييز بكفاءة بين خلايا Th17 عن طريق عدوى المبيضات البيضاء داخل الأدمة للتحقيق في مجموعة فرعية من الخلايا النامية الجلدية المسؤولة عن إحداث مناعة Th17. كشف قياس التدفق الخلوي وتحليلات التعبير الجيني عن تحريض بارز للاستجابة المناعية Th17 في الغدد الليمفاوية التي تستنزف الجلد والجلد المصاب. باستخدام سلالات الفأر المستنفدة للمجموعة الفرعية من DC الناجمة عن سموم الخناق ، تم العثور على CD301b + DCs الجلدية مسؤولة عن تركيب التمايز الأمثل Th17 في هذا النموذج. وبالتالي ، يوفر هذا البروتوكول طريقة قيمة لدراسة وظيفة في الجسم الحي للمجموعات الفرعية التفاضلية من DCs الجلدية لتحديد مناعة Th17 ضد العدوى الفطرية الجلدية العميقة.
Introduction
الجلد هو العضو الحاجز الخارجي ، والذي يحمي الجسم من غزو مسببات الأمراض الخارجية والمحفزات1. يتكون الجلد من طبقتين متميزتين ، بما في ذلك البشرة - ظهارة طبقية من الخلايا الكيراتينية - والأدمة الأساسية - وهي شبكة كثيفة من الكولاجين والمكونات الهيكلية الأخرى. كنسيج حاجز ظهاري أساسي ، يوفر الجلد بشكل أساسي حواجز مادية ويساهم في حواجز مناعية إضافية لأنه يحتوي على العديد من الخلايا المناعية المقيمة2،3. من بين الخلايا المناعية الجلدية ، تعد الخلايا المتغصنة (DCs) نوعا من الخلايا المهنية العارضة للمستضد ، والتي تمتص بنشاط المستضدات الذاتية وغير الذاتية وتهاجر إلى الغدد الليمفاوية الإقليمية (LNs) لبدء استجابات الخلايا التائية الخاصة بالمستضد والتسامح وفقا لطبيعة المستضدات4.
يؤوي الجلد خلايا مقدمة لمستضد البشرة ، وهي خلايا لانجرهانز (LCs) ونوعين على الأقل من DCs ، بما في ذلك DCs التقليدية من النوع الجلدي 1 (cDC1) والنوع الجلدي من النوع 2 التقليدية DCs (cDC2) 5. LCs البشرانية من أصل أحادي الخلية الجنيني وتحافظ على عدد خلاياها عن طريق الإدامة الذاتية في ظل ظروف التماثل6. في المقابل ، فإن cDC1 و cDC2 الجلدية من أصل الخلايا الجذعية المكونة للدم ويتم تجديدها باستمرار بواسطة أسلاف ملتزمة بالتيار المستمر5. تتميز DCs الجلدية بعلامات سطحها ، مقسمة تقريبا إلى Langerin + (بما في ذلك LCs و cDC1) و CD11b + Langerin- مجموعات (بشكل أساسي cDC2). بالإضافة إلى ذلك ، كشفت هذه المجموعة أن مجموعة CD11b + Langerin- DC مصنفة أيضا إلى مجموعتين فرعيتين وفقا لتعبير CD301b7.
تتمحور السمات الوظيفية المهمة للتيار المستمر الجلدي على تقسيم العمل ، والذي يتم تحديده بشكل أساسي من خلال الطبيعة الجوهرية لكل مجموعة فرعية من DCs ، والمواقع في الموقع من DCs ، والبيئة المكروية للأنسجة ، والإشارات الالتهابية المحلية8. تتطلب هذه الخصائص الوظيفية للخلايا المزمنة الجلدية التحقيق في دور مجموعات فرعية محددة من التيار المستمر خلال أنواع معينة من الاستجابة المناعية للجلد. عند التحفيز المستضد بواسطة DCs الجلدية في LNs المستنزفة ، تتمايز خلايا CD4 + T الساذجة إلى مجموعات فرعية محددة من الخلايا التائية المساعدة ، والتي تنتج مجموعة من السيتوكينات المحددة لممارسة وظيفتها المستجيب9. من بين المجموعات الفرعية للخلايا التائية المساعدة CD4 + ، تلعب خلايا Th17 المنتجة للإنترلوكين -17 (IL-17) دورا مهما في أمراض المناعة الذاتية والمناعة المضادة للفطريات10. في هذا الصدد ، كانت العدوى الفطرية الجلدية نموذجا قويا لدراسة مناعة Th17 في الجسم الحي11،12،13. عندما تتعرض الجلود المجردة من الشريط اللاصق لخميرة المبيضات البيضاء (C. albicans) ، تلعب LCs للبشرة دورا محوريا في دفع تمايز Th17 الخاص بالمستضد14.
تتطلب المناعة الوقائية ضد عدوى المطثية البيضاء داخل الأدمة مناعة فطرية مثل النشاط الانحلال للفيبرين للأرومات الليفية والخلايا البلعمية15. ومع ذلك ، لا يعرف سوى القليل عن دور مجموعات فرعية من DC الجلدية في إنشاء مناعة Th17 في عدوى C. albicans الجلدية العميقة. تصف هذه الورقة طريقة عدوى الجلد داخل الأدمة من المطثية البيضاء ، والتي تنتج استجابات مناعية محلية وإقليمية ل Th17. كشف تطبيق سلالات فأر استنفاد مجموعة فرعية من DC الناجمة عن سموم الخناق (DT) أن CD301b + DCs الجلدية ضرورية لمناعة Th17 في هذا النموذج. يسمح النهج الموصوف هنا بدراسة استجابة Th17 للعدوى الفطرية الجلدية الغازية العميقة.
Protocol
ملاحظة: تمت الموافقة على جميع التجارب على من قبل لجنة رعاية واستخدامه في المؤسسة (IACUC ، معرف الموافقة: 2019-0056 ، 2019-0055). تم استخدام إناث الفئران من النوع البري (WT) C57BL / 6 التي تتراوح أعمارها بين سبعة إلى 9 أسابيع وزنها 18-24 جم في هذه الدراسة. أجريت بعض الدراسات باستخدام إناث مستقبلات السموم لانجرين والخناق (DTR) والفئران CD301b-DTR من نفس العمر والوزن. تم استخدام أربعة إلى ستة فئران في كل مجموعة لإجراء تجربة ، وتمثل البيانات ثلاث تجارب مستقلة. تم إجراء هذا العمل في ظل ظروف السلامة البيولوجية من المستوى 3 ، والتي يمكن تنفيذها أيضا في ظل ظروف السلامة البيولوجية من المستوى 2 وفقا للمبادئ التوجيهية المؤسسية (درجة حرارة الغرفة 23 درجة مئوية ± 3 درجات مئوية ، الرطوبة 50٪ ± 10٪).
1. تحضير المبيضات البيضاء
ملاحظة: تم إجراء التجارب في هذا القسم في خزانة السلامة البيولوجية.
- Streak C. albicans سلالة SC5314 على صفيحة أجار خميرة - ببتون - سكر العنب - الأدينين (YPDA) باستخدام حلقة تلقيح وإبرة.
- احتضان اللوحة رأسا على عقب لمدة يومين عند 30 درجة مئوية.
ملاحظة: يمكن تخزين لوحة أجار YPDA مع C. albicans عند 4 درجات مئوية لمدة تصل إلى شهر واحد. - اعزل مستعمرة واحدة من اللوحة للتلقيح في 10 مل من وسط YPDA في أنبوب سعة 50 مل باستخدام طرف ماصة معقمة.
- احتضان عند 30 درجة مئوية مع الاهتزاز عند 230-250 دورة في الدقيقة لمدة ~ 17 ساعة.
- ضع تعليق الخميرة في كوفيت ، وقم بقياس الكثافة الضوئية (OD) عند 600 نانومتر كل 30 دقيقة باستخدام مقياس الطيف الضوئي UV-VIS حتى يصل OD600 إلى 1.5-2.0.
ملاحظة: قد تستغرق هذه الخطوة 16-18 ساعة. - قم بتدوير معلق الخميرة على حرارة 1000 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية وأعد تعليق خلايا الخميرة بكمية مناسبة من محلول ملحي معقم مخزن بالفوسفات (PBS).
- عد خلايا المطثية البيضاء باستخدام مقياس كثافة الدم وقم بتدوير المعلق عند 1000 × جم لمدة 5 دقائق.
- تخلص من المادة الطافية ، وأعد تعليق C. البيضاء الخلايا في PBS إلى تركيز 1 × 107 خلايا في 40 ميكرولتر من PBS لكل وسادة قدم.
- لتحضير المقتول بالحرارة (HK ) C. albicans ، اقتل خلايا الخميرة عن طريق التسخين عند 65 درجة مئوية لمدة 60 دقيقة باستخدام خلاط التسخين بعد تحديد رقم الخلية.
2. عدوى وسادة قدم الفأر بالمطثية البيضاء
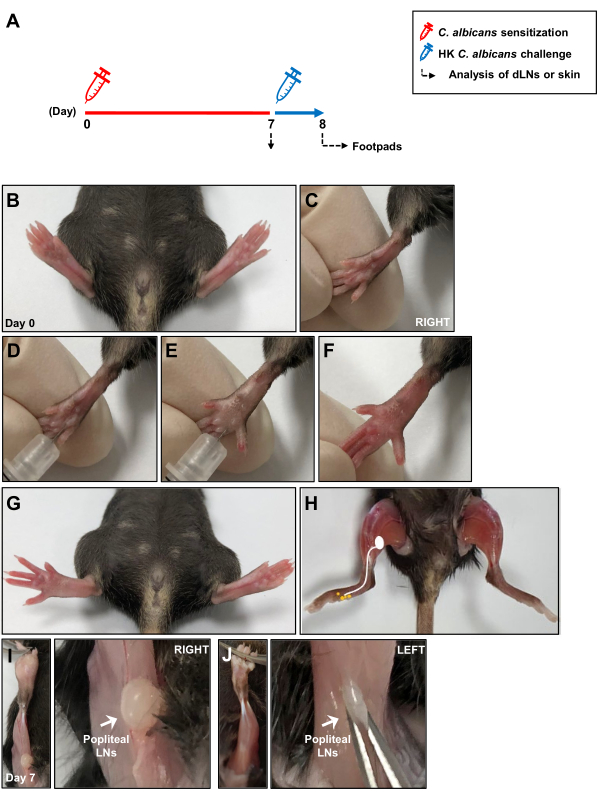
الشكل 1: رسم تخطيطي لنموذج عدوى المبيضات البيضاء داخل الأدمة. (أ) تم حقن وسادات القدم الخلفية للفئران داخل الجلد ب 1 × 107 C. albicans. بعد 7 أيام ، أعيد تعريض وسادات أقدام الفئران إلى 1 × 107 HK C. albicans عن طريق الحقن داخل الأدمة ، وتم قياس استجابة فرط الحساسية من النوع المتأخر بعد 24 ساعة من تحدي المستضد. تم تحليل الاستجابة المناعية المحلية أثناء التحسس بالمطثية البيضاء بعد 7 أيام في LNs التي تستنزف الجلد. (ب ، ج) صور وسادات القدم قبل حقن وسادة القدم داخل الأدمة مع المطثية البيضاء البيضاء. (د، ه) حقن المطثية البيضاء في الأدمة العميقة لوسادة القدم اليمنى. (F ، G) العلامات السريرية للاحمرار والتورم بعد حقن وسادة القدم اليمنى. (ح) رسم تخطيطي يوضح المسارات اللمفاوية من وسادة القدم إلى LNs المأبضية بعد حقن المطثية البيضاء البيضاء . (I) LNs المأبضية المكشوفة الموجودة خلف الركبة بعد 7 أيام من حقن المطثية البيضاء و (J) بدون حقن. الاختصارات: هونج كونج = مقتول حراريا. LNs = الغدد الليمفاوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بتخدير الفئران باستخدام الأيزوفلوران في غرفة الحث حتى يكون معدل التنفس البطيء للفئران ولا تظهر أي استجابات انسحابية لقرصات إصبع القدم أو الذيل.
ملاحظة: أثناء التخدير ، يوصى باستخدام مرهم العين لمنع جفاف العين ، خاصة للتخدير الذي يستمر لأكثر من 5 دقائق. - قم بإزالة الغطاء من إبرة 31 جم ، وقم بتحميل حقنة الأنسولين سعة 0.3 مل بالمطثية البيضاء المحضرة من الخطوة 1.9 بعد خلط الخلايا.
- قم بإزالة الفأر المخدر من غرفة الحث ، وحقن 40 ميكرولتر من خلايا الخميرة برفق (1 × 107 خلايا) في الأدمة العميقة لوسادة القدم اليمنى لحساسية المطثية البيضاء البيضاء.
ملاحظة: الحد الأقصى للحجم الذي يمكن حقنه في وسادة القدم هو 50 ميكرولتر. - اسحب إبرة المحقنة ببطء من موقع الحقن.
- ضع كل فأر بمفرده في قفص حتى يتعافى تماما من التخدير ثم أعده بأمان إلى قفص المنزل.
- لتطوير استجابة خاصة بالمستضد ل C. albicans ، تحدي وسادة القدم اليمنى للفئران باستخدام HK C. albicans عن طريق الحقن داخل الأدمة بعد 7 أيام من التحسس ، كما هو موضح سابقا (1 × 107 خلايا ؛ 40 ميكرولتر لكل وسادة قدم ؛ كرر الخطوات 2.1-2.5).
- حصاد LNs التي تستنزف الجلد بعد 7 أيام من التحسس C. albicans أو أنسجة وسادة القدم الآفة بعد 24 ساعة من تحدي المستضد بعد القتل الرحيم في غرفة CO2 .
3. استنفاد الخلايا التغصنية الناجم عن السموم الدفتيريا في الجسم الحي
ملاحظة: في هذه الدراسة ، تم علاج كل من الفئران Langerin-DTR و CD301b-DTR ب DT قبل يوم واحد من التحسس داخل الأدمة ل C. albicans.
- قم بإعداد محلول 10 ميكروغرام / مل من DT في PBS.
- قم بإزالة الغطاء من إبرة حقنة الأنسولين سعة 1 مل ، واخلط DT ، واملأ المحقنة ب DT.
- كبح جماح الفئران بشكل صحيح في وضع الرأس لأسفل.
- تطهير الجانب البطني للفئران بنسبة 70٪ من الإيثانول.
- حقن كل فأر ببطء ب 100 ميكرولتر من 1 ميكروغرام DT داخل الصفاق في الربع الأيسر السفلي من البطن لاستنفاد مجموعات فرعية محددة من الخلايا المتغصنة.
ملاحظة: احرص على عدم إتلاف الأعضاء أثناء الحقن. - انتظر لمدة 5 ثوان ؛ ثم قم بإزالة الإبرة ببطء.
4. تفاعل البوليميراز المتسلسل الكمي في الوقت الحقيقي
- ضع الماوس في غرفة ثاني أكسيد الكربون2 حتى لا تلاحظ أي حركة تنفس.
- قم بتطهير الفأر بنسبة 70٪ من الإيثانول ، وقطع الآفة من جلد وسادة القدم الخلفية إلى قطع صغيرة باستخدام الملقط والمقص.
- اغمر الأنسجة المقطعة تماما في كاشف عزل الحمض النووي الريبي.
- قم بتجانس العينات باستخدام مجانس الأنسجة وفقا لتعليمات الشركة المصنعة (دورتان مدة كل منهما 3 دقائق عند 30 هرتز).
ملاحظة: تم استخدام حبات الفولاذ المقاوم للصدأ لتحلل الأنسجة في هذه الدراسة. - تدور عند 10,000 × جم لمدة 5 دقائق ، 4 درجات مئوية.
- انقل المادة الطافية بعناية إلى أنبوب جديد.
- عزل الحمض النووي الريبي الكلي من الجلد الآفة باستخدام مجموعة عزل الحمض النووي الريبي الكاملة.
- حدد تركيز الحمض النووي الريبي باستخدام مقياس الطيف الضوئي للأشعة فوق البنفسجية.
- قم بتصنيع (كدنا) باستخدام مجموعة نسخ عكسية لتفاعل البوليميراز المتسلسل الكمي في الوقت الفعلي (qPCR).
- قم بإجراء qPCR في الوقت الفعلي باستخدام نظام PCR في الوقت الفعلي من خلال مراقبة تخليق الحمض النووي مزدوج الشريطة أثناء دورات تفاعل البوليميراز المتسلسل باستخدام صبغة الفلورسنت الخضراء.
ملاحظة: في هذه الدراسة ، تم تطبيع النتائج إلى مستوى هيبوكسانثين جوانين فوسفوريبوسيلترانسفيراز (Hprt). يتم سرد التسلسلات التمهيدية في الجدول 1 ، وبروتوكول PCR على النحو التالي: التمسخ الأولي عند 95 درجة مئوية لمدة 30 ثانية ، والتضخيم لمدة 42 دورة (95 درجة مئوية لمدة 5 ثوان ، 60 درجة مئوية لمدة 30 ثانية).
5. عزل الخلايا وتحليل قياس التدفق الخلوي
- بعد القتل الرحيم لثاني أكسيد الكربون2 ، قم بتشريح الفئران باستخدام الملقط والمقص ، وكشف وحصاد LNs التي تستنزف وسادة القدم بعناية والتي تسمى LNs المأبضية ، والموجودة خلف الركبة.
- قم بإعداد معلقات أحادية الخلية من LNs التي تستنزف وسادة القدم لكل فأر عن طريق تصفية الأنسجة من خلال مصفاة 70 ميكرومتر بعد التجانس باستخدام مكبس حقنة سعة 3 مل.
- اغسل الخلايا باستخدام PBS وقم بالدوران عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية واغسل الخلايا باستخدام PBS مرة أخرى.
- تدور عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية وأعد تعليق الخلايا في وسط RPMI-10 كامل يحتوي على 55 ميكرومتر β-ميركابتو إيثانول ، و 50 نانوغرام / مل فوربول 12-ميريستات 13-أسيتات (PMA) ، و 500 نانوغرام / مل من الأيونومايسين في صفيحة بئر 24 لتحفيز الخلايا التائية.
- بعد ساعة واحدة ، أضف 10 ميكروغرام / مل من بريفيلدين أ و 1000 × مونينسين إلى تعليق الخلية وثقافتها لمدة 5 ساعات إضافية.
- احصد الخلايا واغسلها بمخزن مؤقت لفرز الخلايا المنشط بالفلورة (FACS).
- قم بالدوران عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية وتخلص من المادة الطافية.
- قم بتلطيخ الخلايا الميتة بصبغة تلطيخ الخلايا الميتة القابلة للإصلاح واحتضانها لمدة 30 دقيقة عند 4 درجات مئوية.
- اغسل العينات باستخدام المخزن المؤقت FACS وقم بتدويرها عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية ، وصمة عار الخلايا بالأجسام المضادة لعلامات السطح المترافقة بالفلوروكروم وحاصرات مستقبلات Fc لمدة 30 دقيقة عند 4 درجات مئوية.
- اغسل العينات باستخدام المخزن المؤقت FACS وقم بتدويرها عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية وأعد تعليق الخلايا المحببة في محلول التثبيت والنفاذية لمدة 15-20 دقيقة عند 4 درجات مئوية للتلوين داخل الخلايا.
- اغسل العينات بمحلول غسيل 1x وقم بتدويرها عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية ، وقم بتلطيخ السيتوكين داخل الخلايا لمدة 30 دقيقة عند 4 درجات مئوية.
- اغسل العينات باستخدام 1x المخزن المؤقت للغسيل وقم بتدويرها عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أعد تعليق الخلايا في الحجم المناسب (200-300 ميكرولتر) من المخزن المؤقت FACS.
- تحليل تعبير البروتين باستخدام قياس التدفق الخلوي.
النتائج
هنا ، أظهرنا نموذج عدوى داخل الأدمة من C. albicans لدراسة دور الاستجابة المناعية الجلدية Th17 بوساطة DC في الجسم الحي. بعد الحقن الأولي داخل الأدمة مع C. albicans في وسادة القدم ، تم تكبير LNs التي تستنزف الجلد (الشكل 2 أ). خلال فترة التحسس ، زادت نسبة الخلا?...
Discussion
تصف هذه الورقة طريقة عدوى المطثية البيضاء داخل الأدمة التي تسمح بدراسة دور DCs الجلدية في الاستجابة المناعية Th17 في الجسم الحي. من خلال تطبيق تحليل قياس التدفق الخلوي متعدد العوامل مع سلالات الفئران التي يسببها DT ، وجدنا أن CD301b + DCs الجلدية هي مجموعة فرعية جل...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم دعم هذا البحث من قبل منحة بحثية لكلية Samjung-Dalim من كلية الطب بجامعة يونسي (6-2019-0125) ، من خلال برنامج أبحاث العلوم الأساسية من خلال المؤسسة الوطنية للبحوث في جمهورية كوريا بتمويل من وزارة التعليم (2019R1A6A1A03032869) ووزارة العلوم وتكنولوجيا المعلومات والاتصالات (2018R1A5A2025079 ، 2019M3A9E8022135 ، و 2020R1C1C1014513) ، والمراكز الكورية لمكافحة الأمراض والوقاية منها (KCDC ، 2020-ER6714-00).
Materials
| Name | Company | Catalog Number | Comments |
| 0.3 mL (31 G) insulin syringe | BD | 328822 | |
| 1x Perm/Wash buffer | BD | 554723 | |
| 1 mL (30 G) syringe insulin syringe | BD | 328818 | |
| 24 well-plate | Falcon | 353047 | |
| 50 mL conical tube | Falcon | 50050 | |
| 70 μm strainer | Falcon | 352350 | |
| 70% ethanol | |||
| ABI StepOnePlus real-time PCR system | Applied Biosystems | ||
| Anesthesia chamber | Harvard Apparatus | ||
| Brefeldin A | BD | BD 555029 | |
| β-Mercaptoethanol | Gibco | 21985023 | |
| Candida albicans strain SC5314 | provided by Daniel Kaplan at Pittsburgh University | ||
| CD3 | BioLegend | 100216 | Clone 17A2 |
| CD301b-DTR mice | provided by Akiko Iwasaki at Yale University | ||
| CD4 | BioLegend | 100408 | Clone GK1.5 |
| CD44 | eBioscience | 47-0441-80 | Clone IM7 |
| CD8a | BD Biosciences | 553031 | Clone 53.6.7 |
| Centrifuge | |||
| Clicker counter | |||
| Cuvette | Kartell | KA.1938 | |
| Cytofix/Cytoperm solution | BD | 554722 | |
| Diphtheria toxin (DT) | Sigma | ||
| Dulbecco's phosphate-buffered saline (DPBS) | Welgene | LB001-02 | |
| FACS (Fluorescence-activated cell sorting) buffer | In-house | ||
| Fc receptor blocker | BD | 553142 | |
| Fetal bovine serum (FBS) | Welgene | S101-07 | |
| Forceps | Roboz | for harvesting sample | |
| Hemocytometer | Fisher Scientific | 267110 | |
| Hybrid-R total RNA kit | GeneAll Biotechnology | 305-101 | |
| hydroxyethyl piperazine ethane sulfonic acid (HEPES) | Gibco | 15630-080 | |
| IL-17A (intracellular cytokine) | BioLegend | 506912 | Clone TC11-18H10.1 |
| Ionomycin | Sigma | I0634 | |
| Isoflurane | |||
| Langerin-DTR | provided by Heung Kyu Lee at Korea Advanced Institute of Science and Technology | ||
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit | Invitrogen | L34957 | |
| Loop and Needle | SPL | 90010 | |
| Monensin | BD | BD554724 | |
| NanoDrop 2000 | Thermo Scientific | ||
| Penicillin | Gibco | 15140-122 | |
| Petri dish | SPL | 10090 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| PrimeScript RT Master Mix | Takara Bio | RR360A | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scissors | Roboz | for harvesting sample | |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | |
| Sterile pipette tip | |||
| SYBR Green Premix Ex Taq II | Takara Bio | RR820A | |
| TCRβ | BioLegend | 109228 | Clone H57-597 |
| ThermoMixer C | Eppendorf | ||
| TissueLyser | QIAGEN | ||
| UV-VIS spectrophotometer | PerkinElmer | ||
| Wild-type C57BL/6 mice | Orient Bio | 7- to 9-week-old mice were used | |
| Yeast-peptone-dextrose-adenine (YPDA) medium, liquid, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose) | |||
| YPDA agar plate, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose, 2% Bacto agar) |
References
- Nestle, F. O., Di Meglio, P., Qin, J. Z., Nickoloff, B. J. Skin immune sentinels in health and disease. Nature Reviews Immunology. 9 (10), 679-691 (2009).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta. 1758 (12), 2080-2095 (2006).
- Kabashima, K., Honda, T., Ginhoux, F., Egawa, G. The immunological anatomy of the skin. Nature Reviews Immunology. 19 (1), 19-30 (2019).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Kashem, S. W., Haniffa, M., Kaplan, D. H. Antigen-presenting cells in the skin. Annual Review of Immunology. 35, 469-499 (2017).
- Kaplan, D. H. Ontogeny and function of murine epidermal Langerhans cells. Nature Immunology. 18 (10), 1068-1075 (2017).
- Kim, T. G., et al. Skin-specific CD301b(+) dermal dendritic cells drive IL-17-mediated psoriasis-like immune response in mice. Journal of Investigative Dermatology. 138 (4), 844-853 (2018).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- O'Shea, J. J., Paul, W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 327 (5969), 1098-1102 (2010).
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annual Review of Immunology. 27, 485-517 (2009).
- Hernandez-Santos, N., Gaffen, S. L. Th17 cells in immunity to Candida albicans. Cell Host & Microbe. 11 (5), 425-435 (2012).
- Burstein, V. L., et al. IL-17-mediated immunity controls skin infection and T helper 1 response during experimental Microsporum canis dermatophytosis. Journal of Investivative Dermatology. 138 (8), 1744-1753 (2018).
- Sparber, F., et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host & Microbe. 25 (3), 389-403 (2019).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Santus, W., et al. Skin infections are eliminated by cooperation of the fibrinolytic and innate immune systems. Science Immunology. 2 (15), (2017).
- Kashem, S. W., et al. Candida albicans morphology and dendritic cell subsets determine T helper cell differentiation. Immunity. 42 (2), 356-366 (2015).
- Chen, H., Zhou, X., Ren, B., Cheng, L. The regulation of hyphae growth in Candida albicans. Virulence. 11 (1), 337-348 (2020).
- Santus, W., Mingozzi, F., Vai, M., Granucci, F., Zanoni, I. Deep dermal injection as a model of Candida albicans skin infection for histological analyses. Journal of Visualized Experiments: JoVE. (136), e57574 (2018).
- Villablanca, E. J., Mora, J. R. A two-step model for Langerhans cell migration to skin-draining LN. European Journal of Immunology. 38 (11), 2975-2980 (2008).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Marcoux, D., et al. Deep cutaneous fungal infections in immunocompromised children. Journal of the American Academy of Dermatology. 61 (5), 857-864 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved