Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Im lebenden Organismus Funktion differentieller Untergruppen kutaner dendritischer Zellen zur Induktion der Th17-Immunität bei intradermalen Candida albicans-Infektionen
In diesem Artikel
Zusammenfassung
In dieser Arbeit zeigen wir die in vivo Funktion von kutanen dendritischen Zelluntergruppen in der Th17-Immunität einer tiefen dermalen Candida albicans-Infektion .
Zusammenfassung
Die Haut ist das äußerste Barriereorgan des Körpers, das mehrere Arten von dendritischen Zellen (DCs) enthält, eine Gruppe von professionellen Antigen-präsentierenden Zellen. Wenn die Haut auf eindringende Krankheitserreger trifft, initiieren verschiedene kutane DCs eine ausgeprägte T-Zell-Immunantwort, um den Körper zu schützen. Unter den eindringenden Krankheitserregern führt eine Pilzinfektion spezifisch zu einer schützenden Interleukin-17-produzierenden Th17-Immunantwort. Es wurde ein Protokoll zur effizienten Differenzierung von Th17-Zellen durch intradermale Candida albicans-Infektion entwickelt, um eine Untergruppe von kutanen DCs zu untersuchen, die für die Induktion der Th17-Immunität verantwortlich sind. Durchflusszytometrie und Genexpressionsanalysen zeigten eine ausgeprägte Induktion der Th17-Immunantwort in hautdrainierenden Lymphknoten und infizierter Haut. Unter Verwendung von Diphtherietoxin-induzierten DC-Subset-depletierenden Mausstämmen wurde festgestellt, dass CD301b+ dermale DCs für die optimale Th17-Differenzierung in diesem Modell verantwortlich sind. Somit bietet dieses Protokoll eine wertvolle Methode, um in vivo die Funktion differentieller Untergruppen von kutanen DCs zu untersuchen, um die Th17-Immunität gegen Pilzinfektionen in der tiefen Haut zu bestimmen.
Einleitung
Die Haut ist das äußerste Barriereorgan, das den Körper vor eindringenden Krankheitserregern und Reizen von außen schützt1. Die Haut besteht aus zwei unterschiedlichen Schichten, darunter die Epidermis - ein geschichtetes Epithel aus Keratinozyten - und die darunter liegende Dermis - ein dichtes Netzwerk aus Kollagen und anderen strukturellen Komponenten. Als primäres epitheliales Barrieregewebe stellt die Haut hauptsächlich physikalische Barrieren dar und trägt zu zusätzlichen immunologischen Barrieren bei, da sie zahlreiche ansässige Immunzellen enthält 2,3. Unter den kutanen Immunzellen sind dendritische Zellen (DCs) eine Art professioneller Antigen-präsentierender Zellen, die aktiv Selbst- und Nicht-Selbstantigene aufnehmen und zu den regionalen Lymphknoten (LNs) wandern, um antigenspezifische T-Zell-Antworten und Toleranz entsprechend der Art der Antigene zu initiieren4.
Die Haut beherbergt epidermale Antigen-präsentierende Zellen, nämlich die Langerhans-Zellen (LCs) und mindestens zwei Arten von DCs, einschließlich dermaler konventioneller Typ-1-DCs (cDC1) und dermaler konventioneller Typ-2-DCs (cDC2)5. Epidermale LCs sind embryonalen monozytären Ursprungs und behalten ihre Zellzahl durch Selbsterhaltung unter homöostatischen Bedingungenbei 6. Im Gegensatz dazu stammen die dermalen cDC1 und cDC2 aus hämatopoetischen Stammzellen und werden kontinuierlich durch DC-gebundene Vorläuferzellen aufgefüllt5. Kutane DCs zeichnen sich durch ihre Oberflächenmarker aus, die grob in Langerin+ (einschließlich LCs und cDC1) und CD11b+Langerin-Populationen (hauptsächlich cDC2) unterteilt sind. Darüber hinaus hat diese Gruppe gezeigt, dass die CD11b+Langerin-DC-Population gemäß der CD301b-Expression in zwei Untergruppen eingeteilt wird7.
Die wichtigen funktionellen Merkmale kutaner DCs konzentrieren sich auf eine Arbeitsteilung, die hauptsächlich durch die intrinsische Natur jeder Untergruppe von DCs, die In-situ-Lokalisation der DCs, die Mikroumgebung des Gewebes und lokale Entzündungsreize bestimmtwird 8. Diese funktionellen Eigenschaften der kutanen DCs machen es notwendig, die Rolle bestimmter Untergruppen von DCs bei bestimmten Arten der Immunantwort der Haut zu untersuchen. Nach antigener Stimulation durch kutane DCs in den drainierenden LNs differenzieren sich naive CD4+ T-Zellen in spezifische Untergruppen von Helfer-T-Zellen, die eine Reihe definierter Zytokine produzieren, um ihre Effektorfunktion auszuüben9. Unter den CD4+-Helfer-T-Zellen spielen Interleukin-17 (IL-17)-produzierende Th17-Zellen eine entscheidende Rolle bei Autoimmunerkrankungen und der antimykotischen Immunität10. In dieser Hinsicht war die kutane Pilzinfektion ein robustes Modell zur Untersuchung der Th17-Immunität in vivo 11,12,13. Wenn die Haut mit Klebeband epikutan der Hefe Candida albicans (C. albicans) ausgesetzt wird, spielen epidermale LCs eine entscheidende Rolle bei der Steuerung der antigenspezifischen Th17-Differenzierung14.
Eine schützende Immunität gegen eine intradermale C . albicans-Infektion erfordert eine angeborene Immunität, wie z. B. die fibrinolytische Aktivität von Fibroblasten und Phagozyten15. Es ist jedoch wenig über die Rolle kutaner DC-Untergruppen bei der Etablierung der Th17-Immunität bei einer tiefen dermalen C. albicans-Infektion bekannt. In dieser Arbeit wird eine Methode der intradermalen Hautinfektion von C. albicans beschrieben, die lokale und regionale Th17-Immunantworten hervorruft. Die Anwendung von Diphtherietoxin (DT)-induzierten DC-Subset-Depletions-Mausstämmen zeigte, dass CD301b+ dermale DCs für die Th17-Immunität in diesem Modell entscheidend sind. Der hier beschriebene Ansatz ermöglicht die Untersuchung der Th17-Antwort auf eine tiefe dermale invasive Pilzinfektion.
Protokoll
HINWEIS: Alle Tierversuche wurden vom Institution Animal Care and Use Committee (IACUC, Zulassungs-ID: 2019-0056, 2019-0055) genehmigt. Für diese Studie wurden sieben bis 9 Wochen alte weibliche Wildtyp-Mäuse (WT) C57BL/6 mit einem Gewicht von 18-24 g verwendet. Einige Studien wurden mit weiblichen Langerin-Diphtherie-Toxin-Rezeptoren (DTR) und CD301b-DTR-Mäusen gleichen Alters und Gewichts durchgeführt. In jeder Gruppe wurden vier bis sechs Mäuse für ein Experiment verwendet, und die Daten sind repräsentativ für drei unabhängige Experimente. Diese Arbeiten wurden unter Bedingungen der Biosicherheitsstufe 3 durchgeführt, die auch unter den Bedingungen der Biosicherheitsstufe 2 gemäß den institutionellen Richtlinien (Raumtemperatur 23 °C ± 3 °C, Luftfeuchtigkeit 50 % ± 10 %) durchgeführt werden konnten.
1. Zubereitung von Candida albicans
HINWEIS: Die Versuche in diesem Abschnitt wurden in einer biologischen Sicherheitswerkbank durchgeführt.
- Streifen Sie C. albicans mit einer Impfschlaufe und einer Nadel auf eine Hefe-Pepton-Dextrose-Adenin (YPDA)-Agarplatte.
- Inkubieren Sie die Platte 2 Tage lang kopfüber bei 30 °C.
HINWEIS: Die YPDA Agarplatte mit C. albicans kann bis zu 1 Monat bei 4 °C gelagert werden. - Isolieren Sie eine einzelne Kolonie von der Platte für die Inokulation in 10 ml YPDA-Medium in einem 50-ml-Röhrchen mit einer sterilen Pipettenspitze.
- Inkubieren bei 30 °C mit Schütteln bei 230-250 U/min für ~17 h.
- Geben Sie die Hefesuspension in eine Küvette und messen Sie die optische Dichte (OD) bei 600 nm alle 30 min mit einem UV-VIS-Spektralphotometer, bis der OD600 1,5-2,0 erreicht.
HINWEIS: Dieser Schritt kann 16-18 Stunden dauern. - Die Hefesuspension bei 1000 × g 5 min schleudern.
- Den Überstand verwerfen und die Hefezellen in einer geeigneten Menge steriler phosphatgepufferter Kochsalzlösung (PBS) resuspendieren.
- Zählen Sie die C . albicans-Zellen mit einem Hämozytometer und schleudern Sie die Suspension 5 Minuten lang bei 1000 × g .
- Den Überstand verwerfen und die C. albicans-Zellen in PBS auf eine Konzentration von 1 × 107 Zellen in 40 μl PBS pro Fußballen resuspendieren.
- Für die Herstellung von hitzeabgetöteten (HK) C. albicans die Hefezellen durch Erhitzen bei 65 °C für 60 min mit einem Heizmischer abtöten, nachdem die Zellzahl bestimmt wurde.
2. Infektion mit Mausfußballen mit C. albicans
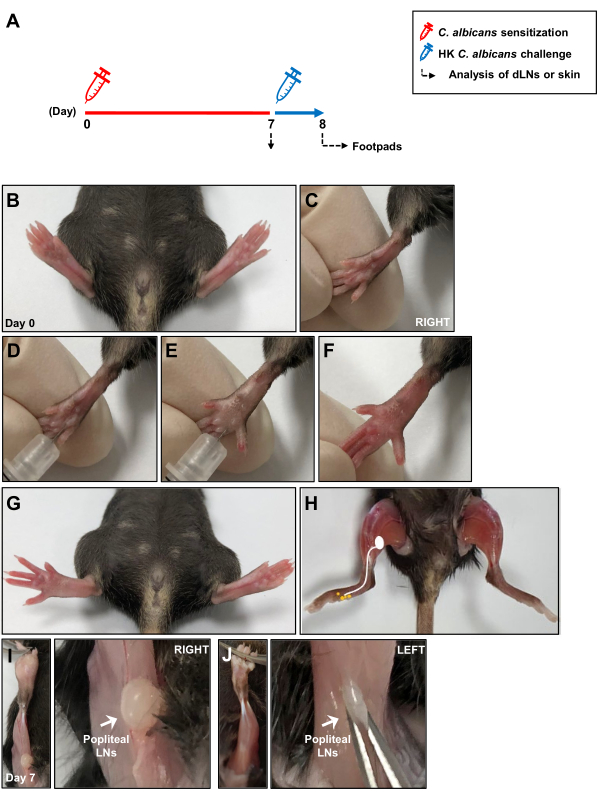
Abbildung 1: Schematische Darstellung des intradermalen Candida albicans-Infektionsmodells . (A) Die Hinterfußballen von Mäusen wurden intradermal mit 1 ×10 7 C. albicans injiziert. Nach 7 Tagen wurden die Fußballen der Mäuse durch intradermale Injektion erneut 1 × 107 HK C. albicans ausgesetzt, und die Überempfindlichkeitsreaktion des Spättyps wurde 24 Stunden nach der Antigenprovokation gemessen. Die lokale Immunantwort während der Sensibilisierung von C. albicans wurde nach 7 Tagen bei hautdrainierenden LNs analysiert. (B, C) Bilder von Fußballen vor der intradermalen Fußballeninjektion mit C. albicans. (D, E) Injektion von C. albicans in die tiefe Dermis des rechten Fußballens. (F, G) Klinische Anzeichen von Rötungen und Schwellungen nach der Injektion des rechten Fußballens. (H) Eine Skizze, die die Lymphwege vom Fußballen zu den kehlkehligen LNs nach der Injektion von C. albicans zeigt. (I) Freiliegende popliteale LNs hinter dem Knie 7 Tage nach der Injektion von C. albicans und (J) ohne Injektion. Abkürzungen: HK = hitzegetötet; LNs = Lymphknoten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Betäuben Sie die Mäuse mit Isofluran in einer Induktionskammer, bis die Mäuse eine langsame Atemfrequenz haben und keine Entzugsreaktionen auf Zehen- oder Schwanzklemmungen zeigen.
HINWEIS: Während der Narkose wird eine Augensalbe empfohlen, um trockene Augen zu vermeiden, insbesondere bei einer Narkose, die länger als 5 Minuten dauert. - Entfernen Sie die Kappe von einer 31-g-Nadel und befüllen Sie die 0,3-ml-Insulinspritze mit dem vorbereiteten C. albicans aus Schritt 1.9, nachdem Sie die Zellen gemischt haben.
- Nehmen Sie die anästhesierte Maus aus der Induktionskammer und injizieren Sie vorsichtig 40 μl der Hefezellen (1 × 107 Zellen) in die tiefe Dermis des rechten Fußballens zur Sensibilisierung von C. albicans .
HINWEIS: Das maximale Volumen, das in ein Fußpolster injiziert werden kann, beträgt 50 μl. - Ziehen Sie die Spritzennadel langsam von der Injektionsstelle zurück.
- Setzen Sie jede Maus allein in einen Käfig, bis sie sich vollständig von der Narkose erholt hat, und bringen Sie sie dann sicher in den Heimkäfig zurück.
- Um eine antigenspezifische Antwort auf C. albicans zu entwickeln, fordern Sie den rechten Fußballen der Mäuse mit dem vorbereiteten HK C. albicans durch intradermale Injektion 7 Tage nach der Sensibilisierung heraus, wie zuvor beschrieben (1 × 107 Zellen; 40 μL pro Fußballen; wiederholen Sie die Schritte 2.1-2.5).
- Entnahme von hautdrainierenden LNs 7 Tage nach der Sensibilisierung von C. albicans oder von läsionalem Fußballengewebe 24 h nach Antigenprovokation nach Euthanasie in einer CO2 -Kammer.
3. Diphtherietoxin-induzierte Depletion dendritischer Zellen in vivo
HINWEIS: In dieser Studie wurden sowohl Langerin-DTR- als auch CD301b-DTR-Mäuse 1 Tag vor und nach einer intradermalen Sensibilisierung gegen C. albicans mit DT behandelt.
- Bereiten Sie eine 10 μg/ml-DT-Lösung in PBS vor.
- Entfernen Sie die Kappe von der Nadel einer 1-ml-Insulinspritze, mischen Sie das DT und füllen Sie die Spritze mit dem DT.
- Halten Sie die Mäuse richtig mit dem Kopf nach unten fest.
- Desinfizieren Sie die Bauchseite der Mäuse mit 70% Ethanol.
- Injizieren Sie jeder Maus langsam 100 μl 1 μg DT intraperitoneal in den unteren linken Quadranten des Abdomens, um spezifische dendritische Zelluntergruppen zu depletieren.
HINWEIS: Achten Sie darauf, die Organe während der Injektion nicht zu beschädigen. - Warten Sie 5 s; Entfernen Sie dann langsam die Nadel.
4. Quantitative Echtzeit-Polymerase-Kettenreaktion
- Platzieren Sie die Maus in einer CO2 - Kammer, bis keine Atembewegung mehr zu beobachten ist.
- Desinfizieren Sie die Maus mit 70%igem Ethanol und schneiden Sie die Läsion von der Haut des hinteren Fußballens mit einer Pinzette und einer Schere in kleine Stücke.
- Tauchen Sie das geschnittene Gewebe vollständig in das RNA-Isolationsreagenz.
- Homogenisieren Sie die Proben mit einem Gewebehomogenisator gemäß den Anweisungen des Herstellers (2 Zyklen à 3 min bei 30 Hz).
HINWEIS: In dieser Studie wurden Edelstahlkügelchen für die Gewebelyse verwendet. - Bei 10.000 × g 5 min, 4 °C schleudern.
- Den Überstand vorsichtig in ein frisches Röhrchen umfüllen.
- Isolieren Sie die Gesamt-RNA aus der läsionalen Haut mit einem Gesamt-RNA-Isolationskit.
- Bestimmen Sie die RNA-Konzentration mit einem UV-Vis-Spektralphotometer.
- Synthetisieren Sie cDNA mit einem reversen Transkriptionskit für die quantitative Echtzeit-Polymerase-Kettenreaktion (qPCR).
- Führen Sie eine Echtzeit-qPCR mit dem Echtzeit-PCR-System durch, indem Sie die Synthese doppelsträngiger DNA während der PCR-Zyklen mit grünem Fluoreszenzfarbstoff überwachen.
HINWEIS: In dieser Studie wurden die Ergebnisse auf das Niveau der Hypoxanthin-Guanin-Phosphoribosyltransferase (Hprt) normalisiert. Die Primersequenzen sind in Tabelle 1 aufgeführt, und das PCR-Protokoll sieht wie folgt aus: anfängliche Denaturierung bei 95 °C für 30 s, Amplifikation für 42 Zyklen (95 °C für 5 s, 60 °C für 30 s).
5. Zellisolierung und durchflusszytometrische Analyse
- Nach der CO2 -Euthanasie sezieren Sie die Mäuse mit einer Zange und einer Schere, wobei Sie die fußballenentwässernden LNs, die als Kniekehlen bezeichnet werden und sich hinter dem Knie befinden, vorsichtig freilegen und ernten.
- Bereiten Sie einzellige Suspensionen aus den fußballendrainierenden LNs jeder Maus her, indem Sie das Gewebe nach der Homogenisierung mit dem Kolben einer 3-ml-Spritze durch ein 70-μm-Sieb filtrieren.
- Die Zellen mit PBS waschen und bei 500 × g 5 min bei 4 °C schleudern.
- Entsorgen Sie den Überstand und waschen Sie die Zellen erneut mit PBS.
- Bei 500 × g 5 min bei 4 °C schleudern.
- Verwerfen Sie den Überstand und resuspendieren Sie die Zellen in vollständigem RPMI-10-Medium, das 55 μM β-Mercaptoethanol, 50 ng/ml Phorbol-12-Myristat-13-acetat (PMA) und 500 ng/ml Ionomycin in einer 24-Well-Platte für die T-Zell-Stimulation enthält.
- Nach 1 h geben Sie 10 μg/ml Brefeldin A und 1000x Monensin für weitere 5 h in die Zellsuspension und Kultur.
- Ernten Sie die Zellen und waschen Sie sie mit Puffer der fluoreszenzaktivierten Zellsortierung (FACS).
- Bei 500 × g 5 min bei 4 °C schleudern und den Überstand wegwerfen.
- Die abgestorbenen Zellen mit einem fixierbaren Farbstoff zur Färbung abgestorbener Zellen färben und 30 min bei 4 °C inkubieren.
- Waschen Sie die Proben mit FACS-Puffer und schleudern Sie sie bei 500 × g für 5 min bei 4 °C.
- Entsorgen Sie den Überstand und färben Sie die Zellen 30 Minuten lang bei 4 °C mit Fluorochrom-konjugierten Oberflächenmarker-Antikörpern und Fc-Rezeptorblockern.
- Waschen Sie die Proben mit FACS-Puffer und schleudern Sie sie bei 500 × g für 5 min bei 4 °C.
- Entsorgen Sie den Überstand und resuspendieren Sie die pelletierten Zellen in Fixierungs- und Permeabilisierungslösung für 15-20 min bei 4 °C für die intrazelluläre Färbung.
- Waschen Sie die Proben mit 1x Waschpuffer und schleudern Sie sie bei 500 × g für 5 min bei 4 °C.
- Entsorgen Sie den Überstand und führen Sie eine intrazelluläre Zytokinfärbung für 30 Minuten bei 4 °C durch.
- Waschen Sie die Proben mit 1x Waschpuffer und schleudern Sie bei 500 x g für 5 min bei 4 °C.
- Resuspendieren Sie die Zellen im entsprechenden Volumen (200-300 μl) FACS-Puffer.
- Analysieren Sie die Proteinexpression mit Hilfe der Durchflusszytometrie.
Ergebnisse
In dieser Arbeit haben wir ein intradermales Infektionsmodell von C. albicans demonstriert, um die Rolle der kutanen DC-vermittelten Th17-Immunantwort in vivo zu untersuchen. Nach einer initialen intradermalen Injektion mit C. albicans in den Fußballen wurden die hautdrainierenden LNs vergrößert (Abbildung 2A). Während der Sensibilisierungsphase war das Verhältnis von CD4+- zu CD8+-Effektor-T-Zellen deutl...
Diskussion
In dieser Arbeit wird eine Methode der intradermalen C. albicans-Infektion beschrieben, die es ermöglicht, die Rolle kutaner DCs bei der Th17-Immunantwort in vivo zu untersuchen. Durch die Anwendung multiparametrischer durchflusszytometrischer Analysen mit DT-induzierten Mausstämmen fanden wir heraus, dass CD301b+ dermale DCs eine entscheidende kutane DC-Untergruppe für die Initiierung der Th17-Immunität gegen eine tiefe dermale C . albicans-Infektion...
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Diese Forschung wurde unterstützt durch das Forschungsstipendium der Samjung-Dalim-Fakultät des Yonsei University College of Medicine (6-2019-0125), durch ein Grundlagenforschungsprogramm der National Research Foundation der Republik Korea, das vom Bildungsministerium (2019R1A6A1A03032869) und dem Ministerium für Wissenschaft und Informations- und Kommunikationstechnologie (2018R1A5A2025079, 2019M3A9E8022135 und 2020R1C1C14513) finanziert wurde, und von den Korea Centers for Disease Control and Prevention (KCDC, 2020-ER6714-00).
Materialien
| Name | Company | Catalog Number | Comments |
| 0.3 mL (31 G) insulin syringe | BD | 328822 | |
| 1x Perm/Wash buffer | BD | 554723 | |
| 1 mL (30 G) syringe insulin syringe | BD | 328818 | |
| 24 well-plate | Falcon | 353047 | |
| 50 mL conical tube | Falcon | 50050 | |
| 70 μm strainer | Falcon | 352350 | |
| 70% ethanol | |||
| ABI StepOnePlus real-time PCR system | Applied Biosystems | ||
| Anesthesia chamber | Harvard Apparatus | ||
| Brefeldin A | BD | BD 555029 | |
| β-Mercaptoethanol | Gibco | 21985023 | |
| Candida albicans strain SC5314 | provided by Daniel Kaplan at Pittsburgh University | ||
| CD3 | BioLegend | 100216 | Clone 17A2 |
| CD301b-DTR mice | provided by Akiko Iwasaki at Yale University | ||
| CD4 | BioLegend | 100408 | Clone GK1.5 |
| CD44 | eBioscience | 47-0441-80 | Clone IM7 |
| CD8a | BD Biosciences | 553031 | Clone 53.6.7 |
| Centrifuge | |||
| Clicker counter | |||
| Cuvette | Kartell | KA.1938 | |
| Cytofix/Cytoperm solution | BD | 554722 | |
| Diphtheria toxin (DT) | Sigma | ||
| Dulbecco's phosphate-buffered saline (DPBS) | Welgene | LB001-02 | |
| FACS (Fluorescence-activated cell sorting) buffer | In-house | ||
| Fc receptor blocker | BD | 553142 | |
| Fetal bovine serum (FBS) | Welgene | S101-07 | |
| Forceps | Roboz | for harvesting sample | |
| Hemocytometer | Fisher Scientific | 267110 | |
| Hybrid-R total RNA kit | GeneAll Biotechnology | 305-101 | |
| hydroxyethyl piperazine ethane sulfonic acid (HEPES) | Gibco | 15630-080 | |
| IL-17A (intracellular cytokine) | BioLegend | 506912 | Clone TC11-18H10.1 |
| Ionomycin | Sigma | I0634 | |
| Isoflurane | |||
| Langerin-DTR | provided by Heung Kyu Lee at Korea Advanced Institute of Science and Technology | ||
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit | Invitrogen | L34957 | |
| Loop and Needle | SPL | 90010 | |
| Monensin | BD | BD554724 | |
| NanoDrop 2000 | Thermo Scientific | ||
| Penicillin | Gibco | 15140-122 | |
| Petri dish | SPL | 10090 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| PrimeScript RT Master Mix | Takara Bio | RR360A | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scissors | Roboz | for harvesting sample | |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | |
| Sterile pipette tip | |||
| SYBR Green Premix Ex Taq II | Takara Bio | RR820A | |
| TCRβ | BioLegend | 109228 | Clone H57-597 |
| ThermoMixer C | Eppendorf | ||
| TissueLyser | QIAGEN | ||
| UV-VIS spectrophotometer | PerkinElmer | ||
| Wild-type C57BL/6 mice | Orient Bio | 7- to 9-week-old mice were used | |
| Yeast-peptone-dextrose-adenine (YPDA) medium, liquid, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose) | |||
| YPDA agar plate, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose, 2% Bacto agar) |
Referenzen
- Nestle, F. O., Di Meglio, P., Qin, J. Z., Nickoloff, B. J. Skin immune sentinels in health and disease. Nature Reviews Immunology. 9 (10), 679-691 (2009).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta. 1758 (12), 2080-2095 (2006).
- Kabashima, K., Honda, T., Ginhoux, F., Egawa, G. The immunological anatomy of the skin. Nature Reviews Immunology. 19 (1), 19-30 (2019).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Kashem, S. W., Haniffa, M., Kaplan, D. H. Antigen-presenting cells in the skin. Annual Review of Immunology. 35, 469-499 (2017).
- Kaplan, D. H. Ontogeny and function of murine epidermal Langerhans cells. Nature Immunology. 18 (10), 1068-1075 (2017).
- Kim, T. G., et al. Skin-specific CD301b(+) dermal dendritic cells drive IL-17-mediated psoriasis-like immune response in mice. Journal of Investigative Dermatology. 138 (4), 844-853 (2018).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- O'Shea, J. J., Paul, W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 327 (5969), 1098-1102 (2010).
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annual Review of Immunology. 27, 485-517 (2009).
- Hernandez-Santos, N., Gaffen, S. L. Th17 cells in immunity to Candida albicans. Cell Host & Microbe. 11 (5), 425-435 (2012).
- Burstein, V. L., et al. IL-17-mediated immunity controls skin infection and T helper 1 response during experimental Microsporum canis dermatophytosis. Journal of Investivative Dermatology. 138 (8), 1744-1753 (2018).
- Sparber, F., et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host & Microbe. 25 (3), 389-403 (2019).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Santus, W., et al. Skin infections are eliminated by cooperation of the fibrinolytic and innate immune systems. Science Immunology. 2 (15), (2017).
- Kashem, S. W., et al. Candida albicans morphology and dendritic cell subsets determine T helper cell differentiation. Immunity. 42 (2), 356-366 (2015).
- Chen, H., Zhou, X., Ren, B., Cheng, L. The regulation of hyphae growth in Candida albicans. Virulence. 11 (1), 337-348 (2020).
- Santus, W., Mingozzi, F., Vai, M., Granucci, F., Zanoni, I. Deep dermal injection as a model of Candida albicans skin infection for histological analyses. Journal of Visualized Experiments: JoVE. (136), e57574 (2018).
- Villablanca, E. J., Mora, J. R. A two-step model for Langerhans cell migration to skin-draining LN. European Journal of Immunology. 38 (11), 2975-2980 (2008).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Marcoux, D., et al. Deep cutaneous fungal infections in immunocompromised children. Journal of the American Academy of Dermatology. 61 (5), 857-864 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten