Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В естественных условиях Функция дифференциальных субпопуляций кожных дендритных клеток индуцировать иммунитет к Th17 при внутрикожной инфекции Candida albicans
В этой статье
Резюме
Здесь мы демонстрируем функцию in vivo кожных субпопуляций дендритных клеток в иммунитете Th17 к глубокой дермальной инфекции Candida albicans .
Аннотация
Кожа является самым внешним барьерным органом в организме, который содержит несколько типов дендритных клеток (ДК), группу профессиональных антигенпрезентирующих клеток. Когда кожа сталкивается с вторгшимися патогенами, различные кожные ДК инициируют отчетливый иммунный ответ Т-клеток для защиты организма. Среди вторгшихся патогенов грибковая инфекция вызывает защитный иммунный ответ Th17, продуцирующий интерлейкин-17. Был разработан протокол эффективной дифференцировки клеток Th17 при внутрикожной инфекции Candida albicans для исследования подмножества кожных ДК, ответственных за индуцирование иммунитета к Th17. Проточная цитометрия и анализ экспрессии генов выявили заметную индукцию иммунного ответа Th17 в дренирующих кожу лимфатических узлах и инфицированной коже. С использованием индуцированных дифтерийным токсином штаммов мышей, истощающих субпопуляцию DC, было обнаружено, что CD301b+ дермальные DC отвечают за оптимальную дифференцировку Th17 в этой модели. Таким образом, этот протокол представляет собой ценный метод изучения in vivo функции дифференциальных подмножеств кожных ДК для определения иммунитета Th17 против глубоких грибковых инфекций кожи.
Введение
Кожа является самым внешним барьерным органом, который защищает организм от вторжения внешних патогенов и раздражителей1. Кожа состоит из двух отдельных слоев, в том числе эпидермиса – многослойного эпителия кератиноцитов – и нижележащей дермы – плотной сети коллагена и других структурных компонентов. Являясь первичной эпителиальной барьерной тканью, кожа в основном обеспечивает физические барьеры и способствует созданию дополнительных иммунологических барьеров, поскольку она содержит многочисленные резидентные иммунные клетки 2,3. Среди кожных иммунных клеток дендритные клетки (ДК) представляют собой тип профессиональных антигенпрезентирующих клеток, которые активно поглощают собственные и несобственные антигены и мигрируют в регионарные лимфатические узлы (ЛУ) для инициирования антиген-специфических Т-клеточных ответов и толерантности в соответствии с природой антигенов4.
Кожа содержит эпидермальные антигенпрезентирующие клетки, а именно клетки Лангерганса (LC) и, по крайней мере, два типа DC, включая обычные DC 1-го типа (cDC1) и обычные DC 2-го типа (cDC2)5. Эпидермальные ЛК имеют эмбриональное моноцитарное происхождение и сохраняют свое количество клеток путем самовоспроизводства в гомеостатических условиях6. Напротив, дермальные cDC1 и cDC2 имеют гемопоэтическое происхождение стволовых клеток и постоянно пополняются предшественниками, коммитированными DC5. ДК кожи характеризуются их поверхностными маркерами, грубо разделенными на популяции Langerin+ (включая LCs и cDC1) и CD11b+Langerin- (в основном cDC2). Кроме того, эта группа показала, что популяция CD11b+Langerin-DC далее классифицируется на две подгруппы в соответствии с экспрессией CD301b7.
Важные функциональные особенности кожных ДК сосредоточены на разделении труда, определяемом в основном внутренней природой каждого подмножества ДК, местами расположения ДК in situ, микроокружением тканей и местнымивоспалительными сигналами. Эти функциональные характеристики кожных ДК обуславливают необходимость изучения роли конкретных подмножеств ДК во время определенных типов иммунного ответа кожи. При антигенной стимуляции кожными ДК в дренирующих ЛН наивные CD4+ Т-клетки дифференцируются в специфические подмножества хелперных Т-клеток, которые продуцируют набор определенных цитокинов для осуществления своей эффекторной функции9. Среди субпопуляций CD4+ хелперных Т-клеток интерлейкин-17 (IL-17)-продуцирующие клетки Th17 играют решающую роль в развитии аутоиммунных заболеваний и противогрибкового иммунитета. В связи с этим кожная грибковая инфекция является надежной моделью для изучения иммунитета к Th17 in vivo 11,12,13. Когда обнаженная лентой кожа подвергается эпикутанному воздействию дрожжей Candida albicans (C. albicans), эпидермальные ЖК играют ключевую роль в стимулировании антиген-специфической дифференцировки Th1714.
Защитный иммунитет против внутрикожной инфекции C. albicans требует врожденного иммунитета, такого как фибринолитическая активность фибробластов и фагоцитов15. Тем не менее, мало что известно о роли кожных субпопуляций ДК в формировании иммунитета к Th17 при глубокой дермальной инфекции C. albicans . В данной работе описан метод внутрикожной инфекции кожи C. albicans, который вызывает локальные и регионарные иммунные реакции Th17. Применение индуцированных дифтерийным токсином (DT) штаммов мышей с истощением субпопуляции DC показало, что кожные DC CD301b+ имеют решающее значение для иммунитета к Th17 в этой модели. Описанный здесь подход позволяет изучить ответ Th17 на глубокую дермальную инвазивную грибковую инфекцию.
Access restricted. Please log in or start a trial to view this content.
протокол
ПРИМЕЧАНИЕ: Все эксперименты на животных были одобрены Комитетом по уходу за животными и их использованию (IACUC, идентификатор одобрения: 2019-0056, 2019-0055). Для исследования были использованы самки мышей дикого типа (WT) C57BL/6 в возрасте от 7 до 9 недель с массой 18-24 г. Некоторые исследования были проведены с участием самок мышей с рецептором лангерин-дифтерийного токсина (DTR) и CD301b-DTR одного возраста и веса. От четырех до шести мышей в каждой группе использовались для эксперимента, и данные репрезентативны для трех независимых экспериментов. Эта работа проводилась в условиях уровня биобезопасности 3, который также может быть выполнен в условиях уровня биобезопасности 2 в соответствии с организационными рекомендациями (температура в помещении 23 °C ± 3 °C, влажность 50% ± 10%).
1. Приготовление Candida albicans
ПРИМЕЧАНИЕ: Эксперименты в этом разделе проводились в шкафу биологической безопасности.
- Процедите штамм C. albicans SC5314 на агаровую пластину дрожжевого пептон-декстроза-аденина (YPDA) с помощью инокуляционной петли и иглы.
- Выдержать тарелку вверх дном в течение 2 суток при температуре 30 °C.
ПРИМЕЧАНИЕ: Агаровую пластину YPDA с C. albicans можно хранить при температуре 4 °C до 1 месяца. - Выделите одну колонию из планшета для инокуляции в 10 мл среды YPDA в пробирке объемом 50 мл с помощью стерильного наконечника для дозатора.
- Инкубировать при 30 °C с встряхиванием при 230-250 об/мин в течение ~17 часов.
- Поместите дрожжевую суспензию в кювету и измеряйте оптическую плотность (OD) на длине волны 600 нм каждые 30 минут с помощью спектрофотометра UV-VIS до тех пор, пока OD600 не достигнет 1,5-2,0.
ПРИМЕЧАНИЕ: Этот шаг может занять 16-18 часов. - Дрожжевую суспензию закрутить при 1000 × г в течение 5 минут.
- Выбросьте надосадочную жидкость и ресуспендируйте дрожжевые клетки в соответствующем количестве стерильного фосфатно-солевого буфера (PBS).
- Подсчитайте клетки C. albicans с помощью гемоцитометра и вращайте суспензию при 1000 × г в течение 5 минут.
- Отбросьте надосадочную жидкость и ресуспендируйте клетки C. albicans в PBS до концентрации 1 × 107 клеток в 40 мкл PBS на подушечку ноги.
- Для приготовления C. albicans, убитых при нагревании (HK) C. albicans, дрожжевые клетки должны быть уничтожены путем нагрева при температуре 65 °C в течение 60 мин с помощью нагревательного миксера после определения количества клеток.
2. Заражение подушечки лапы мыши C. albicans
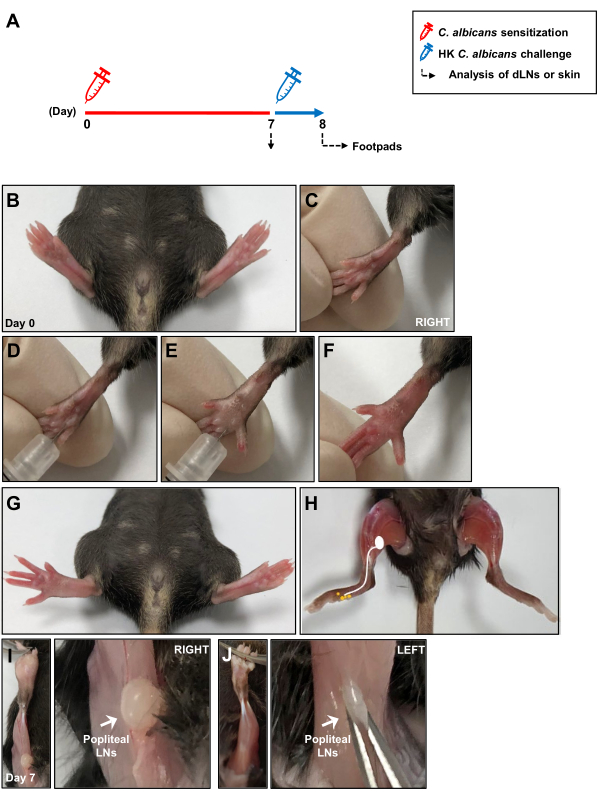
Рисунок 1: Принципиальная схема модели внутрикожной инфекции Candida albicans . (A) Задние подушечки лап мышей вводили внутрикожно 1 × 107 C. albicans. Через 7 дней подушечки лап мышей повторно подвергались воздействию 1 × 107 HK C. albicans путем внутрикожной инъекции, а реакция гиперчувствительности замедленного типа измерялась через 24 ч после провокации антигеном. Местный иммунный ответ во время сенсибилизации C. albicans был проанализирован через 7 дней в дренирующих кожу LNs. (B, C) Изображения подушечек лап перед внутрикожной инъекцией C. albicans. (Д, Д) Инъекция C. albicans в глубокую дерму правой подушечки стопы. (Ф, Г) Клинические признаки покраснения и отека после введения правой подушечки стопы. (H) Эскиз, показывающий лимфатические пути от подушечки стопы до подколенных LN после инъекции C. albicans . (I) Обнаженные подколенные LN, расположенные за коленом, через 7 дней после инъекции C. albicans и (J) без инъекции. Сокращения: HK = термически убитый; LNs = лимфатические узлы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Обезболивайте мышей изофлураном в индукционной камере до тех пор, пока у мышей не будет медленного дыхания и они не проявят реакции отмены на щипки пальцев ног или хвоста.
ПРИМЕЧАНИЕ: Во время анестезии рекомендуется использовать глазную мазь для предотвращения сухости глаз, особенно при длительности анестезии более 5 минут. - Снимите колпачок с иглы 31 G и загрузите в инсулиновый шприц объемом 0,3 мл подготовленный C. albicans из шага 1.9 после смешивания клеток.
- Извлеките мышь, находящуюся под наркозом, из индукционной камеры и осторожно введите 40 мкл дрожжевых клеток (1 ×10 7 клеток) в глубокую дерму правой подушечки лапы для сенсибилизации C. albicans .
ПРИМЕЧАНИЕ: Максимальный объем, который может быть введен в подушечку для ног, составляет 50 μл. - Медленно извлеките иглу шприца из места инъекции.
- Поместите каждую мышь в клетку по отдельности до тех пор, пока она полностью не оправится от анестезии, а затем безопасно верните ее в домашнюю клетку.
- Для выработки антиген-специфического ответа на C. albicans необходимо ввести приготовленный препарат HK C. albicans на правую подушечку лапы мышей через 7 дней после сенсибилизации, как описано ранее (1 × 107 клеток; 40 мкл на подушечку ноги; повторить шаги 2.1-2.5).
- Забор дренирующих кожу LN через 7 дней после сенсибилизации C. albicans или поражения тканей подушечки стопы через 24 ч после провокации антигеном после эвтаназии в камере CO2 .
3. Истощение дендритных клеток, вызванное дифтерийным токсином, in vivo
Примечание: В этом исследовании мышам Langerin-DTR и CD301b-DTR вводили DT за 1 день до и после внутрикожной сенсибилизации к C. albicans.
- Приготовьте раствор DT в концентрации 10 мкг/мл в PBS.
- Снимите колпачок с иглы инсулинового шприца объемом 1 мл, перемешайте DT и наполните шприц DT.
- Правильно удерживайте мышей в положении головой вниз.
- Продезинфицируйте брюшную сторону мышей 70% этанолом.
- Медленно вводите каждой мыши 100 мкл 1 г DT внутрибрюшинно в нижний левый квадрант брюшной полости, чтобы истощить определенные субпопуляции дендритных клеток.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не повредить органы во время инъекции. - Подождите 5 секунд; Затем медленно извлеките иглу.
4. Количественная полимеразная цепная реакция в реальном времени
- Поместите мышь в камеру сCO2 до тех пор, пока не исчезнет дыхание.
- Продезинфицируйте мышь 70% этанолом, а очаг поражения с кожи задней подушечки лапы разрежьте на мелкие кусочки с помощью щипцов и ножниц.
- Полностью погрузите срезанные ткани в реагент для выделения РНК.
- Гомогенизируйте образцы с помощью тканевого гомогенизатора в соответствии с инструкциями производителя (2 цикла по 3 мин при частоте 30 Гц).
ПРИМЕЧАНИЕ: В этом исследовании для лизиса тканей использовались бусины из нержавеющей стали. - Отжим при 10 000 × г в течение 5 минут, 4 °C.
- Осторожно переложите надосадочную жидкость в свежую трубку.
- Изолируйте общую РНК из пораженной кожи с помощью набора для выделения общей РНК.
- Определение концентрации РНК с помощью УФ-ВИД спектрофотометра.
- Синтезируйте кДНК с помощью набора для обратной транскрипции для количественной полимеразной цепной реакции (кПЦР) в реальном времени.
- Выполняйте кПЦР в реальном времени с помощью системы ПЦР в реальном времени, контролируя синтез двухцепочечной ДНК во время циклов ПЦР с использованием зеленого флуоресцентного красителя.
ПРИМЕЧАНИЕ: В данном исследовании результаты были нормализованы до уровня гипоксантин-гуанинфосфорибозилтрансферазы (Hprt). Последовательности праймеров перечислены в таблице 1, а протокол ПЦР выглядит следующим образом: начальная денатурация при 95 °C в течение 30 с, амплификация в течение 42 циклов (95 °C в течение 5 с, 60 °C в течение 30 с).
5. Выделение клеток и проточный цитометрический анализ
- После эвтаназии CO2 препарируйте мышей с помощью щипцов и ножниц, осторожно обнажая и собирая ЛН, дренирующие подушечки стопы, называемые подколенными ЛН, расположенные за коленом.
- Приготовьте суспензию одиночных клеток из ЛН, дренирующих подушечки стопы каждой мыши, фильтруя ткани через ситечко 70 мкм после гомогенизации с помощью поршня шприца объемом 3 мл.
- Промойте клетки PBS и отверните при 500 × г в течение 5 минут при 4 °C.
- Выбросьте надосадочную жидкость, и снова промойте клетки PBS.
- Отжим при 500 × г в течение 5 минут при 4 °C.
- Удалите надосадочную жидкость и ресуспендируйте клетки в полной среде RPMI-10, содержащей 55 мкМ β-меркаптоэтанола, 50 нг/мл форбола 12-миристат 13-ацетата (PMA) и 500 нг/мл иономицина в 24-луночной пластине для стимуляции Т-клеток.
- Через 1 ч добавьте 10 мкг/мл брефелдина А и 1000x монензина в клеточную суспензию и культивируйте еще 5 ч.
- Соберите клетки и промойте их с помощью буфера для сортировки клеток, активируемого флуоресценцией (FACS).
- Отжимайте при 500 × г в течение 5 минут при 4 °C и выбросьте надосадочную жидкость.
- Окрашивайте мертвые клетки фиксируемым красителем для окрашивания мертвых клеток и инкубируйте в течение 30 минут при температуре 4 °C.
- Промойте образцы с помощью буфера FACS и открутите их при температуре 500 × г в течение 5 минут при 4 °C.
- Выбросьте надосадочную жидкость и окрашивайте клетки антителами, конъюгированными с флуорохромом, и блокатором Fc-рецепторов в течение 30 минут при 4 °C.
- Промойте образцы с помощью буфера FACS и открутите их при температуре 500 × г в течение 5 минут при 4 °C.
- Отбросить надосадочную жидкость и ресуспендировать гранулированные клетки в раствор фиксации и пермеабилизации на 15-20 мин при 4 °C для внутриклеточного окрашивания.
- Промойте образцы с помощью 1x промывочного буфера и вращайте их при 500 × г в течение 5 минут при 4 °C.
- Выбросьте надосадочную жидкость и проведите внутриклеточное окрашивание цитокином в течение 30 мин при 4 °C.
- Промойте образцы с помощью 1x промывочного буфера и отжимайте при 500 x g в течение 5 минут при 4 °C.
- Ресуспендируйте элементы в соответствующем объеме (200-300 мкл) буфера FACS.
- Анализируйте экспрессию белка с помощью проточной цитометрии.
Access restricted. Please log in or start a trial to view this content.
Результаты
Здесь мы продемонстрировали модель внутрикожной инфекции C. albicans для изучения роли кожного DC-опосредованного иммунного ответа Th17 in vivo. После первоначальной внутрикожной инъекции C. albicans в подушечку стопы дренирующие кожу ЛН были увеличены (р?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В данной работе описан метод внутрикожной инфекции C. albicans , позволяющий изучить роль кожных ДК в иммунном ответе Th17 in vivo. Применяя многопараметрический проточный цитометрический анализ с DT-индуцированными линиями мышей, мы обнаружили, что CD301b+ дермаль?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Это исследование было поддержано исследовательским грантом факультета Самджунг-Далим Медицинского колледжа Университета Ёнсе (6-2019-0125), Программой фундаментальных научных исследований через Национальный исследовательский фонд Республики Корея, финансируемой Министерством образования (2019R1A6A1A03032869) и Министерством науки и информационных и коммуникационных технологий (2018R1A5A2025079, 2019M3A9E8022135 и 2020R1C1C1014513), а также Корейскими центрами по контролю и профилактике заболеваний (KCDC, 2020-ER6714-00).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.3 mL (31 G) insulin syringe | BD | 328822 | |
| 1x Perm/Wash buffer | BD | 554723 | |
| 1 mL (30 G) syringe insulin syringe | BD | 328818 | |
| 24 well-plate | Falcon | 353047 | |
| 50 mL conical tube | Falcon | 50050 | |
| 70 μm strainer | Falcon | 352350 | |
| 70% ethanol | |||
| ABI StepOnePlus real-time PCR system | Applied Biosystems | ||
| Anesthesia chamber | Harvard Apparatus | ||
| Brefeldin A | BD | BD 555029 | |
| β-Mercaptoethanol | Gibco | 21985023 | |
| Candida albicans strain SC5314 | provided by Daniel Kaplan at Pittsburgh University | ||
| CD3 | BioLegend | 100216 | Clone 17A2 |
| CD301b-DTR mice | provided by Akiko Iwasaki at Yale University | ||
| CD4 | BioLegend | 100408 | Clone GK1.5 |
| CD44 | eBioscience | 47-0441-80 | Clone IM7 |
| CD8a | BD Biosciences | 553031 | Clone 53.6.7 |
| Centrifuge | |||
| Clicker counter | |||
| Cuvette | Kartell | KA.1938 | |
| Cytofix/Cytoperm solution | BD | 554722 | |
| Diphtheria toxin (DT) | Sigma | ||
| Dulbecco's phosphate-buffered saline (DPBS) | Welgene | LB001-02 | |
| FACS (Fluorescence-activated cell sorting) buffer | In-house | ||
| Fc receptor blocker | BD | 553142 | |
| Fetal bovine serum (FBS) | Welgene | S101-07 | |
| Forceps | Roboz | for harvesting sample | |
| Hemocytometer | Fisher Scientific | 267110 | |
| Hybrid-R total RNA kit | GeneAll Biotechnology | 305-101 | |
| hydroxyethyl piperazine ethane sulfonic acid (HEPES) | Gibco | 15630-080 | |
| IL-17A (intracellular cytokine) | BioLegend | 506912 | Clone TC11-18H10.1 |
| Ionomycin | Sigma | I0634 | |
| Isoflurane | |||
| Langerin-DTR | provided by Heung Kyu Lee at Korea Advanced Institute of Science and Technology | ||
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit | Invitrogen | L34957 | |
| Loop and Needle | SPL | 90010 | |
| Monensin | BD | BD554724 | |
| NanoDrop 2000 | Thermo Scientific | ||
| Penicillin | Gibco | 15140-122 | |
| Petri dish | SPL | 10090 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| PrimeScript RT Master Mix | Takara Bio | RR360A | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scissors | Roboz | for harvesting sample | |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | |
| Sterile pipette tip | |||
| SYBR Green Premix Ex Taq II | Takara Bio | RR820A | |
| TCRβ | BioLegend | 109228 | Clone H57-597 |
| ThermoMixer C | Eppendorf | ||
| TissueLyser | QIAGEN | ||
| UV-VIS spectrophotometer | PerkinElmer | ||
| Wild-type C57BL/6 mice | Orient Bio | 7- to 9-week-old mice were used | |
| Yeast-peptone-dextrose-adenine (YPDA) medium, liquid, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose) | |||
| YPDA agar plate, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose, 2% Bacto agar) |
Ссылки
- Nestle, F. O., Di Meglio, P., Qin, J. Z., Nickoloff, B. J. Skin immune sentinels in health and disease. Nature Reviews Immunology. 9 (10), 679-691 (2009).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta. 1758 (12), 2080-2095 (2006).
- Kabashima, K., Honda, T., Ginhoux, F., Egawa, G. The immunological anatomy of the skin. Nature Reviews Immunology. 19 (1), 19-30 (2019).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Kashem, S. W., Haniffa, M., Kaplan, D. H. Antigen-presenting cells in the skin. Annual Review of Immunology. 35, 469-499 (2017).
- Kaplan, D. H. Ontogeny and function of murine epidermal Langerhans cells. Nature Immunology. 18 (10), 1068-1075 (2017).
- Kim, T. G., et al. Skin-specific CD301b(+) dermal dendritic cells drive IL-17-mediated psoriasis-like immune response in mice. Journal of Investigative Dermatology. 138 (4), 844-853 (2018).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- O'Shea, J. J., Paul, W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 327 (5969), 1098-1102 (2010).
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annual Review of Immunology. 27, 485-517 (2009).
- Hernandez-Santos, N., Gaffen, S. L. Th17 cells in immunity to Candida albicans. Cell Host & Microbe. 11 (5), 425-435 (2012).
- Burstein, V. L., et al. IL-17-mediated immunity controls skin infection and T helper 1 response during experimental Microsporum canis dermatophytosis. Journal of Investivative Dermatology. 138 (8), 1744-1753 (2018).
- Sparber, F., et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host & Microbe. 25 (3), 389-403 (2019).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Santus, W., et al. Skin infections are eliminated by cooperation of the fibrinolytic and innate immune systems. Science Immunology. 2 (15), (2017).
- Kashem, S. W., et al. Candida albicans morphology and dendritic cell subsets determine T helper cell differentiation. Immunity. 42 (2), 356-366 (2015).
- Chen, H., Zhou, X., Ren, B., Cheng, L. The regulation of hyphae growth in Candida albicans. Virulence. 11 (1), 337-348 (2020).
- Santus, W., Mingozzi, F., Vai, M., Granucci, F., Zanoni, I. Deep dermal injection as a model of Candida albicans skin infection for histological analyses. Journal of Visualized Experiments: JoVE. (136), e57574(2018).
- Villablanca, E. J., Mora, J. R. A two-step model for Langerhans cell migration to skin-draining LN. European Journal of Immunology. 38 (11), 2975-2980 (2008).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Marcoux, D., et al. Deep cutaneous fungal infections in immunocompromised children. Journal of the American Academy of Dermatology. 61 (5), 857-864 (2009).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены