È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In vivo Funzione di sottogruppi differenziali di cellule dendritiche cutanee nell'induzione dell'immunità Th17 nell'infezione intradermica da Candida albicans
In questo articolo
Riepilogo
Qui, dimostriamo la funzione in vivo di sottogruppi di cellule dendritiche cutanee nell'immunità Th17 dell'infezione dermica profonda da Candida albicans .
Abstract
La pelle è l'organo barriera più esterno del corpo, che contiene diversi tipi di cellule dendritiche (DC), un gruppo di cellule professionali che presentano l'antigene. Quando la pelle incontra agenti patogeni invasori, diverse DC cutanee avviano una risposta immunitaria distinta delle cellule T per proteggere il corpo. Tra i patogeni invasori, l'infezione fungina guida specificamente una risposta immunitaria protettiva Th17 che produce interleuchina-17. È stato sviluppato un protocollo per differenziare in modo efficiente le cellule Th17 mediante infezione intradermica da Candida albicans per studiare un sottogruppo di DC cutanee responsabili dell'induzione dell'immunità Th17. La citometria a flusso e le analisi di espressione genica hanno rivelato un'importante induzione della risposta immunitaria Th17 nei linfonodi drenanti e nella pelle infetta. Utilizzando ceppi murini depletivi del sottoinsieme DC indotti dalla tossina difterica, le DC dermiche CD301b+ sono risultate responsabili del montaggio della differenziazione ottimale di Th17 in questo modello. Pertanto, questo protocollo fornisce un metodo prezioso per studiare la funzione in vivo di sottogruppi differenziali di DC cutanee per determinare l'immunità Th17 contro l'infezione fungina cutanea profonda.
Introduzione
La pelle è l'organo barriera più esterno, che protegge il corpo dall'invasione di agenti patogeni e stimoli esterni1. La pelle è composta da due strati distinti, tra cui l'epidermide, un epitelio stratificato di cheratinociti, e il derma sottostante, una fitta rete di collagene e altri componenti strutturali. Come tessuto di barriera epiteliale primario, la pelle fornisce principalmente barriere fisiche e contribuisce a ulteriori barriere immunologiche in quanto contiene numerose cellule immunitarie residenti 2,3. Tra le cellule immunitarie cutanee, le cellule dendritiche (DC) sono un tipo di cellule professionali presentanti l'antigene, che assorbono attivamente antigeni self e non-self e migrano verso i linfonodi regionali (LN) per avviare le risposte e la tolleranza delle cellule T antigene-specifiche in base alla natura degli antigeni4.
La pelle ospita cellule presentanti l'antigene epidermico, vale a dire le cellule di Langerhans (LC) e almeno due tipi di DC, tra cui le DC convenzionali dermiche di tipo 1 (cDC1) e le DC convenzionali dermiche di tipo 2 (cDC2)5. Le LC epidermiche sono di origine monocitica embrionale e mantengono il loro numero di cellule autoperpetuandosi in condizioni omeostatiche6. Al contrario, le cellule staminali dermiche cDC1 e cDC2 sono di origine ematopoietica e vengono continuamente rifornite dai progenitori DC5. Le DC cutanee sono caratterizzate dai loro marcatori di superficie, approssimativamente divisi in popolazioni di Langerin+ (inclusi LC e cDC1) e CD11b+Langerin- (principalmente cDC2). Inoltre, questo gruppo ha rivelato che la popolazione CD11b+Langerin-DC è ulteriormente classificata in due sottogruppi in base all'espressione7 di CD301b.
Le importanti caratteristiche funzionali delle DC cutanee sono incentrate su una divisione del lavoro, determinata principalmente dalla natura intrinseca di ciascun sottogruppo di DC, dalle posizioni in situ delle DC, dal microambiente tissutale e dai segnali infiammatori locali8. Queste caratteristiche funzionali delle DC cutanee richiedono lo studio del ruolo di specifici sottogruppi di DC durante alcuni tipi di risposta immunitaria della pelle. Dopo stimolazione antigenica da parte di DC cutanee nei LN drenanti, le cellule T CD4+ naive si differenziano in sottogruppi specifici di cellule T helper, che producono un insieme di citochine definite per esercitare la loro funzione effettrice9. Tra i sottogruppi di cellule T helper CD4+, le cellule Th17 produttrici di interleuchina-17 (IL-17) svolgono un ruolo cruciale nelle malattie autoimmuni e nell'immunità antifungina10. A questo proposito, l'infezione fungina cutanea è stata un modello robusto per studiare l'immunità Th17 in vivo 11,12,13. Quando le pelli strippate con nastro adesivo sono esposte per via epicutanea al lievito Candida albicans (C. albicans), le LC epidermiche svolgono un ruolo fondamentale nel guidare la differenziazione Th17 antigene-specifica14.
L'immunità protettiva contro l'infezione intradermica da C. albicans richiede un'immunità innata come l'attività fibrinolitica dei fibroblasti e dei fagociti15. Tuttavia, poco si sa sul ruolo dei sottogruppi cutanei di DC nello stabilire l'immunità Th17 nell'infezione cutanea profonda da C. albicans. Questo articolo descrive un metodo di infezione cutanea intradermica di C. albicans, che produce risposte immunitarie Th17 locali e regionali. L'applicazione di ceppi murini di deplezione del sottogruppo di DC indotta dalla tossina difterica (DT) ha rivelato che le DC dermiche CD301b+ sono cruciali per l'immunità Th17 in questo modello. L'approccio qui descritto consente lo studio della risposta Th17 all'infezione fungina invasiva profonda del derma.
Access restricted. Please log in or start a trial to view this content.
Protocollo
NOTA: Tutti gli esperimenti sugli animali sono stati approvati dall'Institution Animal Care and Use Committee (IACUC, Approval ID: 2019-0056, 2019-0055). Per questo studio sono stati utilizzati topi femmina C57BL/6 wild-type (WT) di età compresa tra 7 e 9 settimane del peso di 18-24 g. Alcuni studi sono stati condotti utilizzando topi femmina del recettore della tossina Langerin-difterite (DTR) e CD301b-DTR della stessa età e peso. In ogni gruppo sono stati utilizzati da quattro a sei topi per un esperimento e i dati sono rappresentativi di tre esperimenti indipendenti. Questo lavoro è stato condotto in condizioni di Biosicurezza di Livello 3, che potrebbero essere eseguite anche in condizioni di Biosicurezza di Livello 2 secondo le linee guida istituzionali (temperatura ambiente 23 °C ± 3 °C, umidità 50% ± 10%).
1. Preparazione della Candida albicans
NOTA: Gli esperimenti in questa sezione sono stati eseguiti in una cabina di sicurezza biologica.
- Streak C. albicans ceppare SC5314 su una piastra di agar di lievito-peptone-destrosio-adenina (YPDA) utilizzando un anello di inoculazione e un ago.
- Incubare la piastra capovolta per 2 giorni a 30 °C.
NOTA: La piastra di agar YPDA con C. albicans può essere conservata a 4 °C per un massimo di 1 mese. - Isolare una singola colonia dalla piastra per l'inoculazione in 10 mL di terreno YPDA in una provetta da 50 mL utilizzando un puntale per pipetta sterile.
- Incubare a 30 °C agitando a 230-250 giri/min per ~17 ore.
- Mettere la sospensione di lievito in una cuvetta e misurare la densità ottica (OD) a 600 nm ogni 30 minuti utilizzando uno spettrofotometro UV-VIS fino a quando l'OD600 raggiunge 1,5-2,0.
NOTA: Questo passaggio può richiedere 16-18 ore. - Centrifugare la sospensione di lievito a 1000 × g per 5 min.
- Scartare il surnatante e risospendere le cellule di lievito in una quantità appropriata di soluzione salina sterile tamponata con fosfato (PBS).
- Contare le cellule di C. albicans utilizzando un emocitometro e centrifugare la sospensione a 1000 × g per 5 minuti.
- Scartare il surnatante e risospendere le cellule di C. albicans in PBS a una concentrazione di 1 × 107 cellule in 40 μl di PBS per piede.
- Per la preparazione di C. albicans (HK) ucciso termicamente, uccidere le cellule di lievito riscaldandole a 65 °C per 60 minuti utilizzando un miscelatore riscaldante dopo aver determinato il numero di cellule.
2. Infezione del piede del mouse con C. albicans
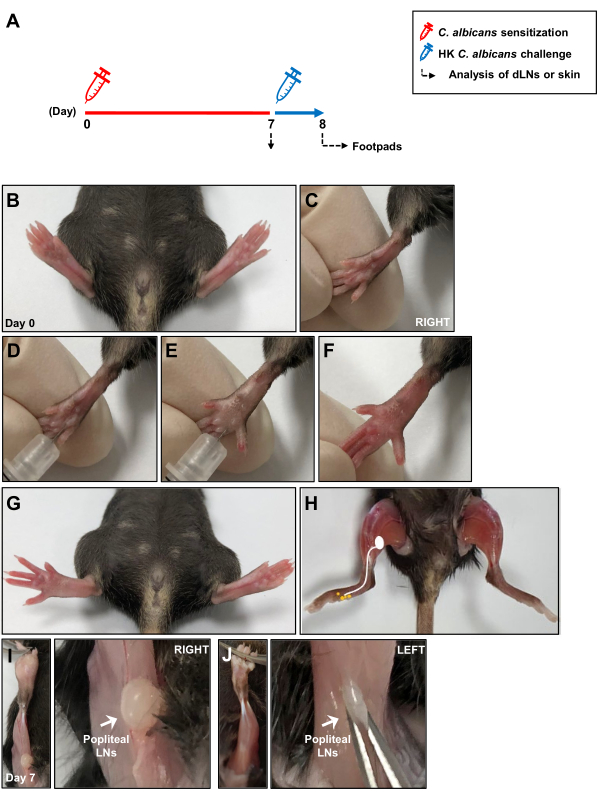
Figura 1: Diagramma schematico del modello di infezione intradermica da Candida albicans . (A) I cuscinetti posteriori dei topi sono stati iniettati per via intradermica con 1 × 107 C. albicans. Dopo 7 giorni, i cuscinetti plantari dei topi sono stati riesposti a 1 × 107 HK C. albicans mediante iniezione intradermica e la risposta di ipersensibilità di tipo ritardato è stata misurata 24 ore dopo la provocazione dell'antigene. La risposta immunitaria locale durante la sensibilizzazione di C. albicans è stata analizzata dopo 7 giorni in LN drenanti per la pelle. (B, C) Immagini dei cuscinetti dei piedi prima dell'iniezione intradermica del cuscinetto del piede con C. albicans. (D, E) Iniezione di C. albicans nel derma profondo del cuscinetto del piede destro. (F, G) Segni clinici di arrossamento e gonfiore in seguito all'iniezione del cuscinetto del piede destro. (H) Uno schizzo che mostri le vie linfatiche dal cuscinetto plantare ai LN poplitei dopo l'iniezione di C. albicans . (I) LN poplitei esposti situati dietro il ginocchio 7 giorni dopo l'iniezione di C. albicans e (J) senza iniezione. Abbreviazioni: HK = ucciso a caldo; LN = linfonodi. Clicca qui per visualizzare una versione più grande di questa figura.
- Anestetizzare i topi con isoflurano in una camera di induzione fino a quando i topi non hanno una frequenza respiratoria lenta e non mostrano risposte di ritiro ai pizzicamenti delle dita dei piedi o della coda.
NOTA: Durante l'anestesia, si consiglia un unguento per gli occhi per prevenire la secchezza oculare, soprattutto per un'anestesia che dura più di 5 minuti. - Rimuovere il tappo da un ago da 31 G e caricare la siringa da insulina da 0,3 mL con il C. albicans preparato dal passaggio 1.9 dopo aver mescolato le cellule.
- Rimuovere il topo anestetizzato dalla camera di induzione e iniettare delicatamente 40 μl di cellule di lievito (1 × 107 cellule) nel derma profondo del cuscinetto destro per la sensibilizzazione di C. albicans .
NOTA: Il volume massimo che può essere iniettato in un footpad è di 50 μl. - Estrarre lentamente l'ago della siringa dal sito di iniezione.
- Metti ogni topo da solo in una gabbia fino a quando non si è completamente ripreso dall'anestesia e poi rimettilo in sicurezza nella gabbia di casa.
- Per sviluppare una risposta antigene-specifica a C. albicans , sfidare il piede destro dei topi con l'HK C. albicans preparato tramite iniezione intradermica 7 giorni dopo la sensibilizzazione, come descritto in precedenza (1 × 107 cellule; 40 μL per piede; ripetere i passaggi 2.1-2.5).
- Raccogliere LN drenanti per la pelle 7 giorni dopo la sensibilizzazione di C. albicans o tessuti del piede lesionato 24 ore dopo la provocazione dell'antigene dopo eutanasia in una camera di CO2 .
3. Deplezione delle cellule dendritiche indotta dalla tossina difterica in vivo
NOTA: In questo studio, sia i topi Langerin-DTR che CD301b-DTR sono stati trattati con DT 1 giorno prima e dopo la sensibilizzazione intradermica a C. albicans.
- Preparare una soluzione da 10 μg/mL di DT in PBS.
- Rimuovere il tappo dall'ago di una siringa da insulina da 1 mL, miscelare il DT e riempire la siringa con il DT.
- Trattenere correttamente i topi in posizione a testa in giù.
- Disinfettare il lato ventrale dei topi con etanolo al 70%.
- Iniettare lentamente ogni topo con 100 μL di 1 μg di DT per via intraperitoneale nel quadrante inferiore sinistro dell'addome per esaurire specifici sottogruppi di cellule dendritiche.
NOTA: Fare attenzione a non danneggiare gli organi durante l'iniezione. - Attendere 5 s; Quindi, rimuovere lentamente l'ago.
4. Reazione quantitativa a catena della polimerasi in tempo reale
- Posizionare il mouse in una camera di CO2 fino a quando non si osserva alcun movimento respiratorio.
- Disinfettare il topo con etanolo al 70% e tagliare la lesione dalla pelle del piede posteriore in piccoli pezzi usando una pinza e delle forbici.
- Immergere completamente i tessuti affettati nel reagente di isolamento dell'RNA.
- Omogeneizzare i campioni utilizzando un omogeneizzatore tissutale secondo le istruzioni del produttore (2 cicli di 3 minuti a 30 Hz).
NOTA: In questo studio sono state utilizzate perle di acciaio inossidabile per la lisi dei tessuti. - Centrifugare a 10.000 × g per 5 min, 4 °C.
- Trasferire con cura il surnatante in un tubo nuovo.
- Isolare l'RNA totale dalla cute lesionata utilizzando un kit di isolamento dell'RNA totale.
- Determinare la concentrazione di RNA utilizzando uno spettrofotometro UV-Vis.
- Sintetizzare il cDNA utilizzando un kit di trascrizione inversa per la reazione a catena della polimerasi quantitativa in tempo reale (qPCR).
- Esegui la qPCR in tempo reale con il sistema PCR in tempo reale monitorando la sintesi del DNA a doppio filamento durante i cicli di PCR utilizzando un colorante fluorescente verde.
NOTA: In questo studio, i risultati sono stati normalizzati al livello di ipoxantina-guanina fosforibosiltransferasi (Hprt). Le sequenze di primer sono elencate nella Tabella 1 e il protocollo PCR è il seguente: denaturazione iniziale a 95 °C per 30 s, amplificazione per 42 cicli (95 °C per 5 s, 60 °C per 30 s).
5. Isolamento cellulare e analisi citofluorimetrica
- Dopo l'eutanasia con CO2 , sezionare i topi usando pinze e forbici, esponendo e raccogliendo con cura i LN drenanti per i piedi chiamati LN poplitei, situati dietro il ginocchio.
- Preparare sospensioni unicellulari dai LN drenanti per le zampe di ciascun topo filtrando i tessuti attraverso un colino da 70 μm dopo l'omogeneizzazione utilizzando lo stantuffo di una siringa da 3 mL.
- Lavare le celle con PBS e centrifugare a 500 × g per 5 minuti a 4 °C.
- Scartare il surnatante e lavare nuovamente le cellule con PBS.
- Centrifugare a 500 × g per 5 minuti a 4 °C.
- Scartare il surnatante e risospendere le cellule in un terreno RPMI-10 completo contenente 55 μM di β-mercaptoetanolo, 50 ng/mL di forbolo 12-miristato 13-acetato (PMA) e 500 ng/mL di ionomicina in una piastra a 24 pozzetti per la stimolazione delle cellule T.
- Dopo 1 ora, aggiungere 10 μg/mL di brefeldina A e 1000x monensin alla sospensione cellulare e alla coltura per altre 5 ore.
- Raccogliere le cellule e lavarle con un tampone di selezione cellulare attivato dalla fluorescenza (FACS).
- Centrifugare a 500 × g per 5 minuti a 4 °C ed eliminare il surnatante.
- Colorare le cellule morte con un colorante fissabile per la colorazione delle cellule morte e incubare per 30 minuti a 4 °C.
- Lavare i campioni con tampone FACS e centrifugarli a 500 × g per 5 minuti a 4 °C.
- Scartare il surnatante e colorare le cellule con anticorpi marcatori di superficie coniugati con fluorocromo e bloccante del recettore Fc per 30 minuti a 4 °C.
- Lavare i campioni con tampone FACS e centrifugarli a 500 × g per 5 minuti a 4 °C.
- Scartare il surnatante e risospendere le cellule pellettate in soluzione di fissazione e permeabilizzazione per 15-20 minuti a 4 °C per la colorazione intracellulare.
- Lavare i campioni con 1 tampone di lavaggio e centrifugarli a 500 × g per 5 minuti a 4 °C.
- Eliminare il surnatante ed eseguire la colorazione intracellulare con citochine per 30 minuti a 4 °C.
- Lavare i campioni con 1 tampone di lavaggio e centrifugare a 500 x g per 5 minuti a 4 °C.
- Risospendere le cellule nel volume appropriato (200-300 μL) di tampone FACS.
- Analizza l'espressione proteica utilizzando la citometria a flusso.
Access restricted. Please log in or start a trial to view this content.
Risultati
Qui, abbiamo dimostrato un modello di infezione intradermica di C. albicans per studiare il ruolo della risposta immunitaria cutanea Th17 mediata da DC in vivo. Dopo un'iniezione intradermica iniziale di C. albicans nel cuscinetto plantare, i LN drenanti per la pelle sono stati ingranditi (Figura 2A). Durante il periodo di sensibilizzazione, il rapporto tra le cellule T effettrici CD4+ e CD8+ è stato notevolm...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo articolo descrive un metodo di infezione intradermica da C. albicans che consente lo studio del ruolo delle DC cutanee nella risposta immunitaria Th17 in vivo. Applicando l'analisi citofluorimetrica multiparametrica con ceppi di topo indotti da DT, abbiamo scoperto che le DC dermiche CD301b+ sono un sottogruppo cruciale di DC cutanee per l'avvio dell'immunità Th17 contro l'infezione dermica profonda da C. albicans . Inoltre, i risultati hanno...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questa ricerca è stata supportata dalla borsa di ricerca della Facoltà Samjung-Dalim del Yonsei University College of Medicine (6-2019-0125), da un programma di ricerca scientifica di base attraverso la National Research Foundation of Korea finanziato dal Ministero dell'Istruzione (2019R1A6A1A03032869) e dal Ministero della Scienza e delle Tecnologie dell'Informazione e della Comunicazione (2018R1A5A2025079, 2019M3A9E8022135 e 2020R1C1C1014513) e dai Centri coreani per il controllo e la prevenzione delle malattie (KCDC, 2020-ER6714-00).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.3 mL (31 G) insulin syringe | BD | 328822 | |
| 1x Perm/Wash buffer | BD | 554723 | |
| 1 mL (30 G) syringe insulin syringe | BD | 328818 | |
| 24 well-plate | Falcon | 353047 | |
| 50 mL conical tube | Falcon | 50050 | |
| 70 μm strainer | Falcon | 352350 | |
| 70% ethanol | |||
| ABI StepOnePlus real-time PCR system | Applied Biosystems | ||
| Anesthesia chamber | Harvard Apparatus | ||
| Brefeldin A | BD | BD 555029 | |
| β-Mercaptoethanol | Gibco | 21985023 | |
| Candida albicans strain SC5314 | provided by Daniel Kaplan at Pittsburgh University | ||
| CD3 | BioLegend | 100216 | Clone 17A2 |
| CD301b-DTR mice | provided by Akiko Iwasaki at Yale University | ||
| CD4 | BioLegend | 100408 | Clone GK1.5 |
| CD44 | eBioscience | 47-0441-80 | Clone IM7 |
| CD8a | BD Biosciences | 553031 | Clone 53.6.7 |
| Centrifuge | |||
| Clicker counter | |||
| Cuvette | Kartell | KA.1938 | |
| Cytofix/Cytoperm solution | BD | 554722 | |
| Diphtheria toxin (DT) | Sigma | ||
| Dulbecco's phosphate-buffered saline (DPBS) | Welgene | LB001-02 | |
| FACS (Fluorescence-activated cell sorting) buffer | In-house | ||
| Fc receptor blocker | BD | 553142 | |
| Fetal bovine serum (FBS) | Welgene | S101-07 | |
| Forceps | Roboz | for harvesting sample | |
| Hemocytometer | Fisher Scientific | 267110 | |
| Hybrid-R total RNA kit | GeneAll Biotechnology | 305-101 | |
| hydroxyethyl piperazine ethane sulfonic acid (HEPES) | Gibco | 15630-080 | |
| IL-17A (intracellular cytokine) | BioLegend | 506912 | Clone TC11-18H10.1 |
| Ionomycin | Sigma | I0634 | |
| Isoflurane | |||
| Langerin-DTR | provided by Heung Kyu Lee at Korea Advanced Institute of Science and Technology | ||
| LIVE/DEAD Fixable Aqua Dead Cell Stain Kit | Invitrogen | L34957 | |
| Loop and Needle | SPL | 90010 | |
| Monensin | BD | BD554724 | |
| NanoDrop 2000 | Thermo Scientific | ||
| Penicillin | Gibco | 15140-122 | |
| Petri dish | SPL | 10090 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P8139 | |
| PrimeScript RT Master Mix | Takara Bio | RR360A | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scissors | Roboz | for harvesting sample | |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | |
| Sterile pipette tip | |||
| SYBR Green Premix Ex Taq II | Takara Bio | RR820A | |
| TCRβ | BioLegend | 109228 | Clone H57-597 |
| ThermoMixer C | Eppendorf | ||
| TissueLyser | QIAGEN | ||
| UV-VIS spectrophotometer | PerkinElmer | ||
| Wild-type C57BL/6 mice | Orient Bio | 7- to 9-week-old mice were used | |
| Yeast-peptone-dextrose-adenine (YPDA) medium, liquid, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose) | |||
| YPDA agar plate, sterile (1% yeast extract, 2% Bacto peptone, 2% dextrose, 2% Bacto agar) |
Riferimenti
- Nestle, F. O., Di Meglio, P., Qin, J. Z., Nickoloff, B. J. Skin immune sentinels in health and disease. Nature Reviews Immunology. 9 (10), 679-691 (2009).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta. 1758 (12), 2080-2095 (2006).
- Kabashima, K., Honda, T., Ginhoux, F., Egawa, G. The immunological anatomy of the skin. Nature Reviews Immunology. 19 (1), 19-30 (2019).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Kashem, S. W., Haniffa, M., Kaplan, D. H. Antigen-presenting cells in the skin. Annual Review of Immunology. 35, 469-499 (2017).
- Kaplan, D. H. Ontogeny and function of murine epidermal Langerhans cells. Nature Immunology. 18 (10), 1068-1075 (2017).
- Kim, T. G., et al. Skin-specific CD301b(+) dermal dendritic cells drive IL-17-mediated psoriasis-like immune response in mice. Journal of Investigative Dermatology. 138 (4), 844-853 (2018).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- O'Shea, J. J., Paul, W. E. Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science. 327 (5969), 1098-1102 (2010).
- Korn, T., Bettelli, E., Oukka, M., Kuchroo, V. K. IL-17 and Th17 cells. Annual Review of Immunology. 27, 485-517 (2009).
- Hernandez-Santos, N., Gaffen, S. L. Th17 cells in immunity to Candida albicans. Cell Host & Microbe. 11 (5), 425-435 (2012).
- Burstein, V. L., et al. IL-17-mediated immunity controls skin infection and T helper 1 response during experimental Microsporum canis dermatophytosis. Journal of Investivative Dermatology. 138 (8), 1744-1753 (2018).
- Sparber, F., et al. The skin commensal yeast Malassezia triggers a type 17 response that coordinates anti-fungal immunity and exacerbates skin inflammation. Cell Host & Microbe. 25 (3), 389-403 (2019).
- Igyarto, B. Z., et al. Skin-resident murine dendritic cell subsets promote distinct and opposing antigen-specific T helper cell responses. Immunity. 35 (2), 260-272 (2011).
- Santus, W., et al. Skin infections are eliminated by cooperation of the fibrinolytic and innate immune systems. Science Immunology. 2 (15), (2017).
- Kashem, S. W., et al. Candida albicans morphology and dendritic cell subsets determine T helper cell differentiation. Immunity. 42 (2), 356-366 (2015).
- Chen, H., Zhou, X., Ren, B., Cheng, L. The regulation of hyphae growth in Candida albicans. Virulence. 11 (1), 337-348 (2020).
- Santus, W., Mingozzi, F., Vai, M., Granucci, F., Zanoni, I. Deep dermal injection as a model of Candida albicans skin infection for histological analyses. Journal of Visualized Experiments: JoVE. (136), e57574(2018).
- Villablanca, E. J., Mora, J. R. A two-step model for Langerhans cell migration to skin-draining LN. European Journal of Immunology. 38 (11), 2975-2980 (2008).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Marcoux, D., et al. Deep cutaneous fungal infections in immunocompromised children. Journal of the American Academy of Dermatology. 61 (5), 857-864 (2009).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon